Varför har ädelstenar flera färger?
Introduktion av kristallfältteori, molekylorbitalteori och energibandteori
Färgerna på ädelstenar är rika och varierade och har en unik charm som människor alltid har älskat. Kvaliteten på ädelstenar beror till stor del på deras färg. Färgen på en ädelsten är en viktig indikator vid utvärdering av ädelstenar, och de flesta optimeringsbehandlingar för ädelstenar innebär att färgen ändras eller förbättras. Att förstå orsakerna till ädelstenarnas färg är därför en avgörande förutsättning för optimeringsbehandling av ädelstenar. Endast genom att behärska hur ädelstenar får sin färg kan man avgöra om en ädelsten kan optimeras, vilket optimeringsschema som ska antas och vilken experimentell plan som ska upprättas. Det finns fem vanliga teorier om ädelstensfärgning: klassisk mineralogiteori, kristallfältsteori, molekylär orbitalteori, energibandteori och fysiska optiska effekter. Dessa teorier utgör färgningsteorierna för vanliga naturliga ädelstenar, och följande är en kort introduktion till dessa fem färgningsteorier.
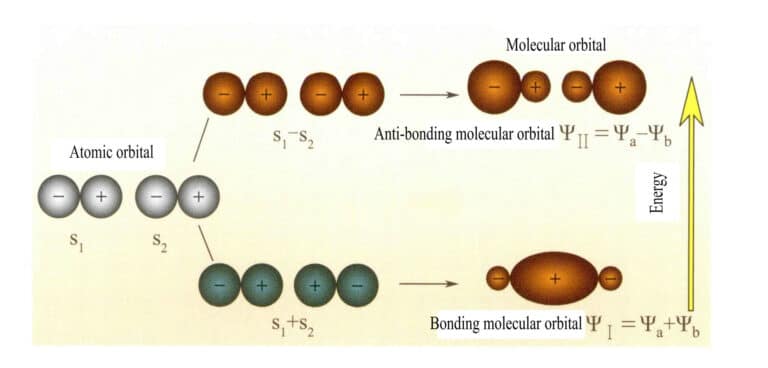
Molekylära orbitaler bildade av två s-atomorbitaler
Innehållsförteckning
Avsnitt I Kristallfältteori
Forskare på 1930-talet föreslog kristallfältsteorin för att förklara kristallers egenskaper. Kristallfältteorin är en teori som studerar de kemiska bindningarna hos övergångselement (komplex). Den förklarar de fysiska och kemiska egenskaperna hos övergångselement och lantanidelement genom att kombinera vissa synpunkter på elektrostatisk teori, kvantmekanik och gruppteori (teorin som studerar symmetrin i materien), med fokus på ligandernas inflytande på d- och f-orbitalerna hos de centrala jonerna. På 1950-talet tillämpade man kristallfältteorin på komplex och föreslog ligandfältteorin. Ligandfältsteorin är en vidareutveckling av kristallfältsteorin; den tar hänsyn till både påverkan av ligandens elektriska fält på centraljonen och fyllnadseffekten av ligandens elektroner på centraljonen, vilket gör den mer komplett än kristallfältsteorin. Det finns dock ingen väsentlig skillnad mellan de två, och de skiljer sig i allmänhet inte åt vid studier av oorganiska mineraler.
1. Grundläggande begrepp inom kristallfältsteori
Övergångsmetallernas joner befinner sig i kristallfältet av omgivande anjoner eller dipolmolekyler. Kristallfältsteori är en elektrostatisk modell som ser kristallen som en elektrostatisk interaktion mellan positiva och negativa joner, där den positivt laddade katjonen kallas centraljon och den negativt laddade anjonen kallas ligand.
Tillämpning av kristallfältsteori för att förklara färgen på ädelstensmineraler involverar huvudsakligen d-elektronerna eller f-elektronenergin hos övergångselementjoner. Till exempel har d-orbitalerna fem typer: dxy, dxz, dyz, d , och d . Dessa fem d-orbitaler har olika rumslig fördelning i det fria jontillståndet men har samma energi. De genomgår dock betydande förändringar under påverkan av ligandfältet. De fem energidegenererade d-banorna i centralatomen delas under påverkan av det negativa elektriska fältet som bildas av omgivande ligander. Vissa d-orbitaler har ökad energi, medan andra har minskad energi. På grund av splittringen av d-orbitalernas energinivåer kommer elektronerna i centralatomens d-orbitaler att omorganiseras och företrädesvis ockupera orbitalerna med lägre energi, vilket minskar systemets totala energi och gör komplexet mer stabilt.
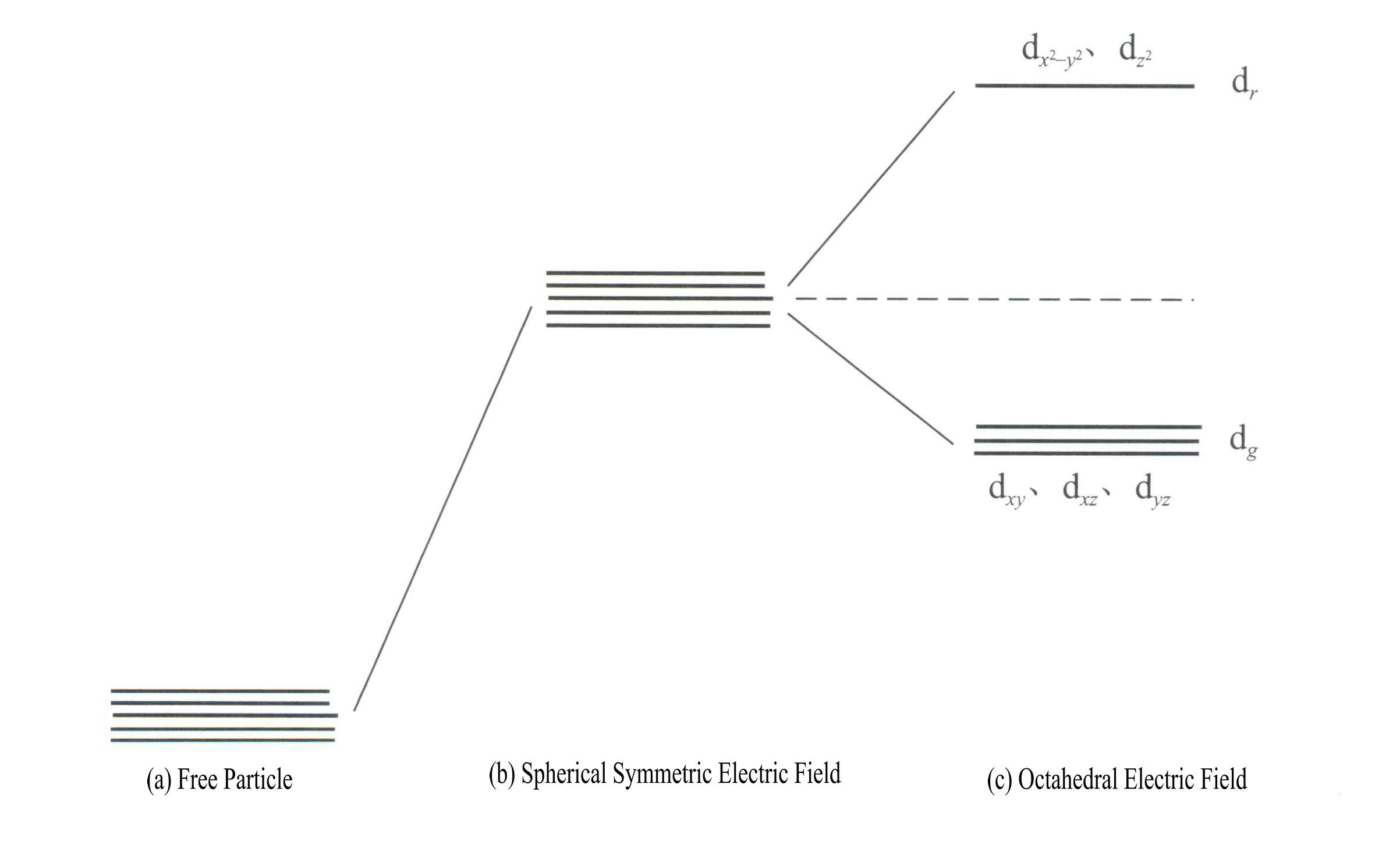
Energin i d-orbitalerna är densamma när det inte finns något elektriskt fält [Figur 3-19 (a)]; under ett sfäriskt symmetriskt elektrostatiskt fält har d-orbitalerna ökad energi men kommer inte att splittras [Figur 3-19 (b)]; när ligandfältet är oktaedralt splittras det i dr och dg. Av dessa var dr orbitaler består av d och d , med högre energi; d med lägre energig orbitaler är sammansatta av dxy, dxz, dyz.
Övergångsmetallernas joner befinner sig i kristallfältet av omgivande anjoner eller dipolmolekyler. Kristallfältsteori är en elektrostatisk modell som ser kristallen som en elektrostatisk interaktion mellan positiva och negativa joner, där den positivt laddade katjonen kallas centraljon och den negativt laddade anjonen kallas ligand.
Tillämpning av kristallfältsteori för att förklara färgen på ädelstensmineraler involverar huvudsakligen d-elektronerna eller f-elektronenergin hos övergångselementjoner. Till exempel har d-orbitalerna fem typer: dxy, dxz, dyz, d , och d . Dessa fem d-orbitaler har olika rumslig fördelning i det fria jontillståndet men har samma energi. De genomgår dock betydande förändringar under påverkan av ligandfältet. De fem energidegenererade d-banorna i centralatomen delas under påverkan av det negativa elektriska fältet som bildas av omgivande ligander. Vissa d-orbitaler har ökad energi, medan andra har minskad energi. På grund av splittringen av d-orbitalernas energinivåer kommer elektronerna i centralatomens d-orbitaler att omorganiseras och företrädesvis ockupera orbitalerna med lägre energi, vilket minskar systemets totala energi och gör komplexet mer stabilt.
Energin i d-orbitalerna är densamma när det inte finns något elektriskt fält [Figur 3-19 (a)]; under ett sfäriskt symmetriskt elektrostatiskt fält har d-orbitalerna ökad energi men kommer inte att splittras [Figur 3-19 (b)]; när ligandfältet är oktaedralt splittras det i dr och dg. Av dessa var dr orbitaler är sammansatta av dx2– y2 och dz2
, med högre energi; den lägre energin dg orbitaler är sammansatta av dxy, dxz, dyz. [Bild 3-19 (c)]
Skillnaden mellan den högsta och lägsta energinivån efter d-orbitaldelning kallas separationsenergin △ . Separationsenergierna som produceras av olika konfigurationer av ligandfält är inte desamma (Figur 3-20). Deras energiordning är:
Kvadratiskt fält > Oktaedriskt fält > Tetraedriskt fält

Även för fält med samma konfiguration kan de också skilja sig åt på grund av skillnader i ligander och centrala joner; ju större den är, desto stabilare är kristallen. Följande tre faktorer bestämmer huvudsakligen storleken på kristallens separationsenergi:
(1) Kristaller som bildas av samma övergångselement; när liganderna är desamma, ju högre laddning av den centrala jonen, desto större separationsenergi △ . Ju högre den centrala jonens positiva laddning är, desto större är attraktionen till liganderna, vilket resulterar i ett mindre avstånd mellan den centrala jonen och ligandkärnan, och ju större den repulsiva kraften hos kristallfältet som genereras av liganderna på elektronerna är, desto större är separationsenergin △ .
(2) För kristaller som bildas av olika joner med samma positiva laddning och samma ligander gäller att ju större radie den centrala jonen har, desto längre bort från kärnan befinner sig d-orbitalerna och desto större är separationsenergin △ .
(3) För kristaller som bildas av samma centraljon och olika ligander varierar separationsenergin på grund av de olika styrkorna hos ligandens kristallfält. Olika ligander har olika fältstyrkor och separationsenergin △ varierar med ligandens fältstyrka.
Separationsenergin används för att kvalitativt förklara kristallers stabilitet; det är inte nödvändigt att få fram det absoluta värdet △ , eftersom det räcker att känna till kristallens relativa värden under olika förhållanden.
Baserat på den relativa energin i de delade d-orbitalerna kan den totala energin hos övergångsmetalljoner i d-orbitalerna beräknas. Denna energi är lägre än före delningen, vilket ger ytterligare energi till kristallen, känd som kristallfältsstabiliseringsenergin, representerad av symbolen CFSE. Tabell 3-10 visar stabiliseringsenergierna för joner som innehåller dn elektroner under olika förhållanden.
Tabell 3-10 Stabiliseringsenergier för kristallfält under olika ligander (Wu Ruihua, 1994)
| dn | Svagt fält | Starkt fält | ||||
|---|---|---|---|---|---|---|
| dn | Fyrkant | Regelbunden oktaeder | Regelbunden Tetraeder | Fyrkant | Regelbunden oktaeder | Regelbunden Tetraeder |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Färgkaraktäristik hos övergångsmetalljoner
I hans färgade ädelstenar beror färgen på de flesta ädelstenar på övergångsmetalljoner, och färgen på ädelstenarna är relaterad till huruvida färgjonerna innehåller oparade elektroner i d- eller f-orbitalerna. Färgegenskaperna hos övergångsmetalljoner inkluderar huvudsakligen följande aspekter:
(1) Färgen på övergångsmetalljoner är relaterad till de elektroniska tillstånden för d orbital eller f orbital. När d-orbital- eller f-orbitalelektronerna är fyllda eller tomma kommer ädelstenen inte att uppvisa färg. Till exempel Cr6+, Ce4+, och Cu+.
(2) Olika färgjoner uppvisar olika färger i samma ädelstensmaterial. På grund av de olika separationsenergierna hos olika färgjoner kan de uppvisa olika färger även i samma material. Till exempel kan Fe2+ ger en något gråblå färg i spinell, medan Cr3+ producerar rött.
(3) Färgjoner av samma grundämne i olika valenstillstånd uppvisar ofta olika färger i samma ädelstensmaterial. Eftersom den energi som krävs för d-elektronövergångarna hos den centrala jonen är olika, är de absorberade våglängderna av ljus olika, vilket resulterar i olika färger. Till exempel kan ett castrum som innehåller Mn2+ har en mjukt rosa nyans, medan en beryll som innehåller Mn2+ är ljusröd och kallas röd beryll.
(4) Färgjoner av samma grundämne i samma valenstillstånd uppvisar ofta olika färger när de har olika konfigurationer av ligander. Som exempel kan nämnas Co2+ i spinellens tetraedriska konfiguration uppvisar en karakteristisk "diamantblå" färg, medan den i kalcitens oktaedriska konfiguration framträder i rosa. Fe2+ i den oktaedriskt koordinerade olivinen visar en karakteristisk olivgrön färg, medan den i den förvridna kubiskt koordinerade almandinen verkar djupt röd.
(5) Samma typ av färgade joner har samma valenstillstånd och koordinationsgeometri, men olika intilliggande koordinerande atomer uppvisar olika färger. Till exempel, i den tetraedriska koordinationen av Co2+, i sfalerit, Co2+ är kopplad till svavel, vilket visar grönt, medan i spinell är Co2+ är ansluten till syrgas och visar blått.
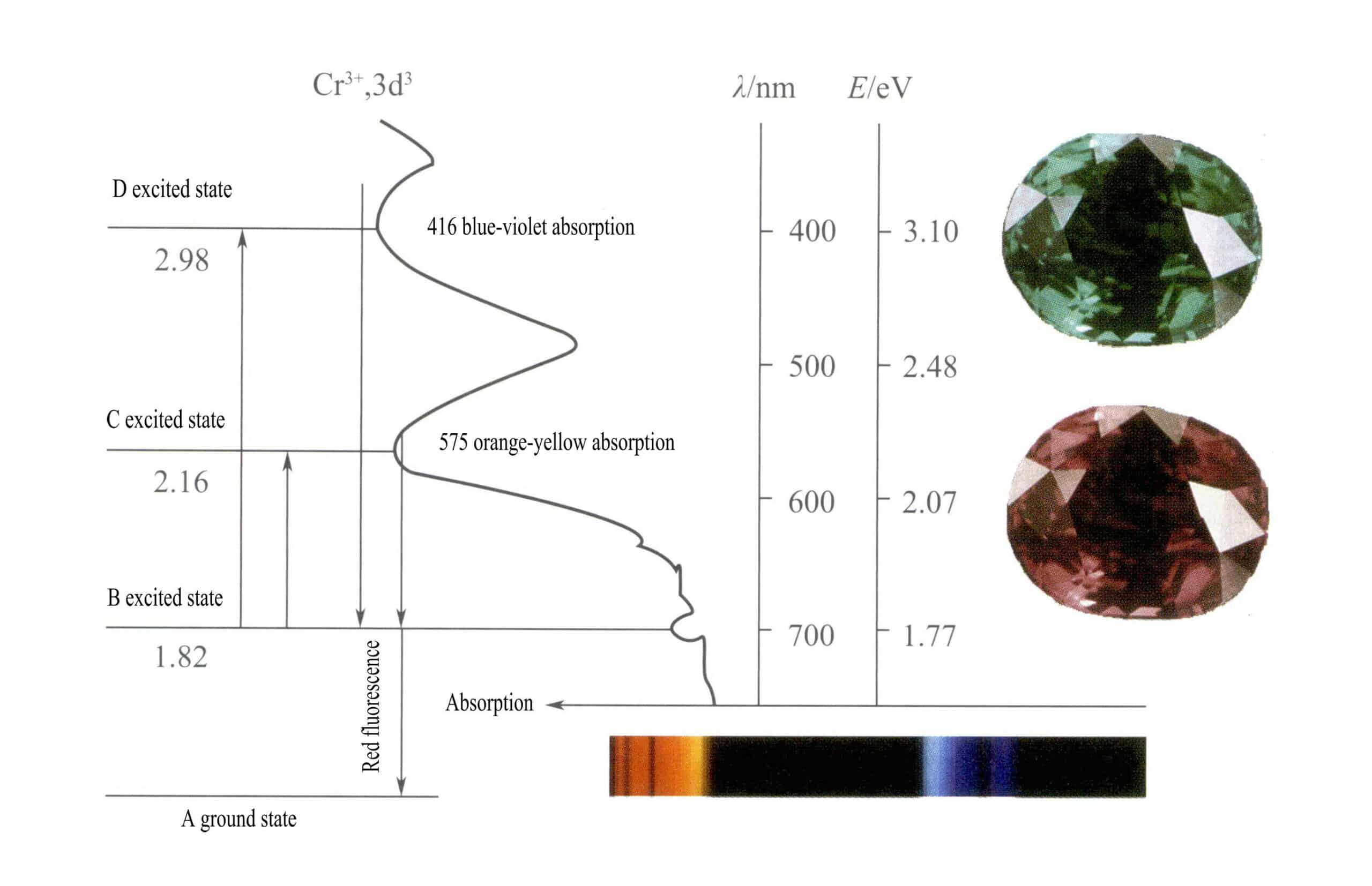
(6) Samma typ av färgade joner med samma valenstillstånd, koordinationsgeometri och angränsande atomer uppvisar olika färger i olika ädelstenar. Förvrängningen av koordinationsgeometrin som orsakas av ädelstenarnas olika kemiska sammansättningar ändrar arten av de kemiska bindningarna mellan den centrala jonen och de koordinerande liganderna, vilket ändrar övergångsenergin för d-elektronerna. Till exempel Cr3+ är röd i rubin, grön i smaragd och uppvisar varierande färger i alexandrit. Orsaken till sådana förändringar i Cr3+ är relaterad till dess egenskaper och de intilliggande koordinerande liganderna, med specifik särdragsanalys enligt följande.
① Cr3+ Kännetecken:
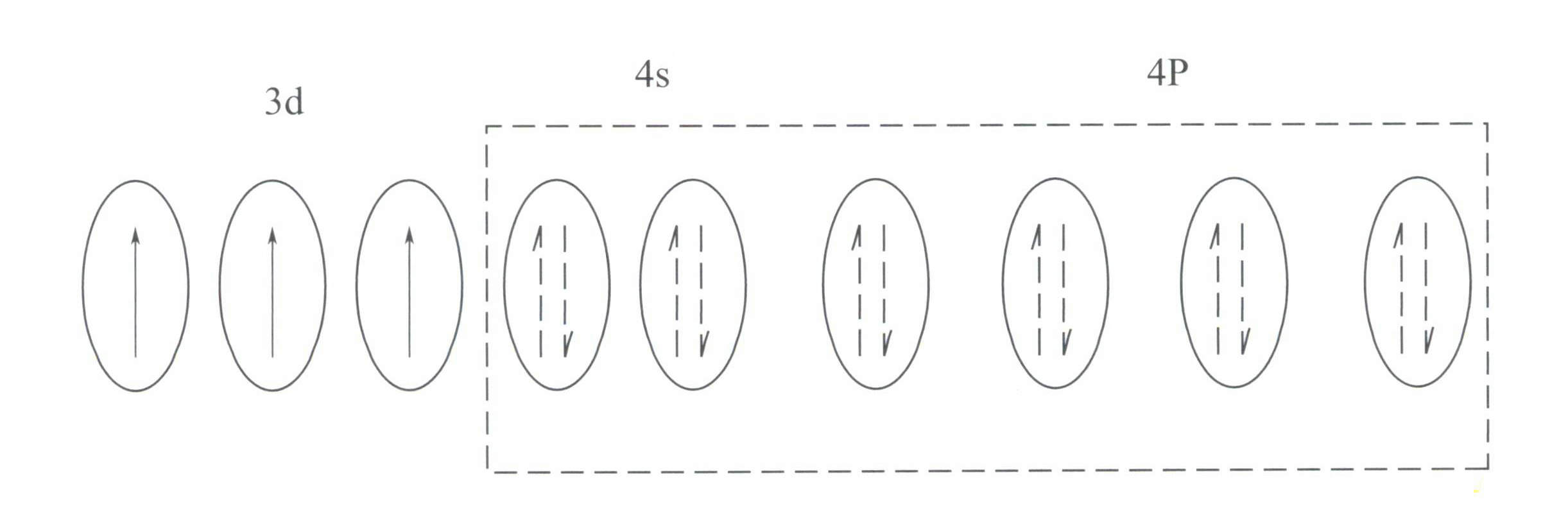
Cr3+ har en yttre elektronskalsstruktur på 3s23p63d3, med 11 elektroner i det yttre skalet, som tillhör en oregelbunden (8-18) elektronskalstruktur.
Denna struktur har en mindre avskärmande effekt på kärnan än skalstrukturen med 8 elektroner, vilket resulterar i Cr3+ har en högre effektiv positiv laddning, samtidigt som dess jonradie också är mindre, vilket utgör de grundläggande egenskaperna hos Cr3+: ett starkt positivt elektriskt fält och tomma d-orbitaler. Cr3+ kan ge sex tomma orbitaler för att rymma sex koordinerande ligander, med en rumslig konfiguration av oktaedral, tillhörande d2sp3 hybridisering (bild 3-21).
Enligt kristallfältsteorin är d-orbitalerna för Cr i ett oktaedriskt fält3+ kan delas upp i lägre energi dƐ bana och högre energi dr kretslopp. Eftersom de tre d-elektronerna i Cr3+ är alla i dƐ orbital och alla är enskilda elektroner, kan d-d-övergångar ske under synligt ljus, vilket gör att ädelstenar som innehåller Cr3+ för att visa färg.
② Färgningsmekanismen för Cr3+:
I rubin Den huvudsakliga kemiska beståndsdelen i rubin är Al2O3. När några få procent av Cr3+ ersätter Al3+ger den en ljusröd färg. I strukturen av rubin, på grund av den större radien av Cr3+ jämfört med radien för Al3+, Cr3+ kommer in i korundgittret, vilket minskar symmetrin runt aluminiumoxid.
D-orbitalerna för Cr3+ delas, och när elektroner i exciterat tillstånd återvänder från D eller C till grundtillståndet A måste de först passera genom B, varvid värme frigörs. De återvänder från B till A, åtföljda av luminescens, och avger röd fluorescens. I denna process absorberar elektronerna ljusenergi, vilket gör att rubin absorberar D violett (400 nm) och C gulgrönt (555 nm) synligt spektrum (figur 3-22) och bildar ett absorptionsband.

När vitt ljus passerar genom en rubin absorberas fotoner i spektrumet från lila till gulgrönt, medan nästan allt rött ljus och en del blått ljus passerar igenom, vilket ger rubinen en djupröd färg med en antydan till lila, känd som duvblodsröd.
Rubiner uppvisar en kortvarig B-nivåabsorption, manifesterad som röd fluorescens. Denna B-nivåabsorption som ger upphov till röd fluorescens gör rubinens färg mer levande; ju högre kromjoninnehåll, desto starkare fluorescens.
Järnjoner i ädelstenen kan undertrycka fluorescensen av B-nivåabsorption, vilket förklarar fenomenet med rubiner som verkar mörkare när de innehåller järnföroreningar.
③ Cr3+ Färgningsmekanismen i smaragder
Den huvudsakliga kemiska beståndsdelen i smaragd är Be3Al2Si6O18, Cr3+, som ersätter Al3+ i smaragdgittret och Cr3+ omges också av en oktaeder som består av sex syrejoner, där Cr3+-O-bindningens längd är också ganska lik den i rubiner. Jämfört med rubiner har smaragder dock ytterligare två joner, Be2+ och Si4+. I smaragdens struktur ökar den kovalenta bindningskaraktären mellan metalloxider, medan de joniska egenskaperna försvagas.
Små förändringar som kemiska bindningar leder till en liten minskning av Cr3+C-nivå och D-nivå, vilket resulterar i en liten förskjutning av absorptionsbandet (Figur 3-23), vilket avsevärt blockerar transmissionen av blålila (425nm) och orangegult (608nm) ljus i spektrumet, samtidigt som transmissionen av blågrönt ljus ökar, vilket ger den karakteristiska smaragdgröna färgen.

B-nivåabsorptionen av dioptas är nästan oförändrad. När impurity iron inte har någon "hämmande" effekt i smaragdkomponenten får den starka röda fluorescensen den karakteristiska smaragdgröna färgen att lysa ännu klarare.
④ Cr3+ Färgmekanismen i alexandrit:
Alexandritens färg orsakas också av Cr3+ ersätter Al3+ i förvrängd oktaedrisk koordination. På grund av den kemiska sammansättningen av alexandrit som är BeAL2O4De kemiska bindningarna mellan dess metall-syrejoner är av ett slag som ligger mellan rubin- och smaragdjonernas. Därför ligger dess absorptionsband också mellan rubin och smaragd, med ungefär lika stor transmissionssannolikhet för blåviolett och orangegult ljus, vilket gör det omöjligt att avgöra om det är rött eller blågrönt ljus som dominerar (Figur 3-24).
Därför kan alexandritens färg bara bero på energifördelningen och färgområdet för det infallande ljuset, vilket resulterar i den "färgförändrande effekten" av alexandrit, dvs. att den verkar grön i dagsljus med en hög blå ljuskomponent och röd i glödlampor med en hög röd ljuskomponent. Därför kallas alexandrit ofta för "dagens smaragd och nattens rubin".
"Färgförändringseffekten" förekommer i många typer av ädelstenar, t.ex. färgskiftande korund och färgskiftande granat. För närvarande produceras artificiellt syntetiserad färgskiftande korund med hjälp av principen om färgförändring, med användning av V3+ som färgjon för syntesen.
3. Färger på ädelstensmineral
De färger som produceras av övergångsmetallkomponenter kan härledas från den kemiska sammansättningen av ädelstensmineral. Till exempel innehåller turkos Cu2+ måste vara blå, medan Cu+ är färglös. Tabell 3-11 visar de färger som produceras av vanliga övergångsmetallkomponenter i naturliga ädelstensmineral.
Tabell 3-11 Färger som produceras av övergångsmetallkomponenter i naturliga ädelstensmineral
| Element | Färg | Vanliga mineraler |
|---|---|---|
| Cerium (Ce) | Gul | Parisit |
| Krom (Cr) | Röd, grön, orange osv. | Crocoisite, Röd Crocoisite, Uvarovite |
| Kobolt (Co) | Blå | Syntetisk spinell |
| Koppar (Cu) | Blå, Grön | Azurit, krysokolla , turkos malakit, dioptas |
| Järn (Fe) | Röd, grön, gul | Almandin, olivin, goethit |
| Mangan (Mn) | Rosa, orange | Rhodonit, spessartin |
| Nickel (Ni) | Grön | Bunsenit, Kalcedon |
Färgen på de flesta ädelstenar orsakas av de föroreningar av övergångsmetaller som de innehåller. Rubiner ser till exempel röda ut på grund av spårmängder av Cr3+. Olika faktorer påverkar färgen som orsakas av föroreningsjoner i ädelstenen. Därför kan orenheter ge olika färger i olika ädelstenar. Till exempel kan Cr3+ framträder röd i rubiner och grön i smaragder.
Samma föroreningar orsakar inte nödvändigtvis samma färg på en ädelsten. Till exempel orsakas den gröna färgen hos de flesta smaragder av Cr, medan vissa smaragders gröna färg helt eller delvis orsakas av vanadin (V).
Kristallfältsteorin kan inte bara användas för att förklara de ädelstensfärger som produceras av övergångsmetallkomponenter eller föroreningar utan också de färger som produceras av strukturella defekter (färgcentra); den specifika processen för färggenerering kan hänvisas till i kapitel 3.3 i denna bok.
Det finns också brister i förklaringen av ädelstensmineralfärger med kristallfältsteori, främst återspeglade i följande aspekter:
(1) Elektronerna i den centrala jonen d är inte helt lokaliserade i sina ursprungliga orbitaler. De kan också förekomma runt de koordinerande atomerna, vilket indikerar en kovalent interaktion mellan den centrala atomen och liganderna.
(2) Den beaktar endast den elektrostatiska joniska interaktionen mellan centralatomen och liganderna och ignorerar helt den kovalenta bindningsinteraktionen mellan centralatomen och liganderna. Inom fysikalisk forskning skiljer sig resultaten av kvantitativa beräkningar ofta avsevärt från faktiska situationer.
(3) Orsakerna till färgen på ädelstensmineral, förutom interaktionen mellan den centrala jonen och liganderna, kan också bero på de kombinerade effekterna av strukturella defekter och kristallfältet.
Avsnitt II Molekylorbitalteori
Mulliken och Hund föreslog ursprungligen molekylär orbitalteori (MO-teori). Genom många forskares kontinuerliga utforskande har den utvecklats till en mogen teori. Molekylära orbitaler (MO) kan erhållas genom linjära kombinationer av atomära orbitaler, en vanligt förekommande metod för att konstruera molekylära orbitaler. Från n atomorbitaler kan n molekylorbitaler erhållas, och de linjära kombinationskoefficienterna kan bestämmas med hjälp av variationsmetoden eller andra metoder. Molekylorbitaler som bildas av två atomorbitaler, med energinivåer som är lägre än atomorbitalernas, kallas bindningsorbitaler; de med energinivåer som är högre än atomorbitalerna kallas antibindningsorbitaler; de med energinivåer nära atomorbitalerna är i allmänhet icke-bindningsorbitaler.
Molekylorbitalteori är en teori som används för att förklara frågor som molekylär bildning, struktur och egenskaper. Den kan också förklara några av orsakerna till ädelstensfärger, som har utvecklats baserat på kristallfältteori och övergångsmetallers molekylorbitalteori. Molekylära orbitaler är en naturlig förlängning av atomära orbitaler. I en molekyl tillhör elektronerna inte längre en specifik atom utan rör sig över hela molekylområdet; därför beskrivs elektronernas rörelse i en molekyl med hjälp av molekylära orbitaler.
1. Grundläggande begrepp inom molekylorbitalteorin
Molekylorbitalteorin innebär att när atomer bildar en molekyl hör elektronerna inte längre hemma i de ursprungliga atomorbitalerna enligt kristallfältteorin, utan rör sig inom vissa molekylorbitaler. Molekylära orbitaler utgör en molekyl på samma sätt som atomära orbitaler utgör en atom. Valenselektroner anses inte längre vara lokaliserade inom enskilda atomer utan rör sig genom hela molekylen. Elektronfördelningen i molekylen kan behandlas enligt de principer som gäller för elektronfördelning i atomer (principen om minsta energi och Hunds regel).
Den linjära kombinationen av atomorbitaler i en molekyl bildar molekylorbitaler. Antalet molekylära orbitaler är lika med antalet atomära orbitaler före kombinationen. Kombinationen av atomära orbitaler till effektiva molekylära orbitaler måste följa följande tre principer:
(1) Principen om symmetrianpassning: Endast atomorbitaler med samma symmetri kan bilda molekylorbitaler.
(2) Principen om energinärhet: Endast atomorbitaler med liknande energier kan kombineras för att bilda effektiva molekylorbitaler.
(3) Maximum Overlap Principle: Vid symmetrianpassning, ju större överlappning av atomorbitaler, desto mer minskar energin hos de resulterande molekylorbitalerna och desto stabilare blir den resulterande kemiska bindningen.
Molekylorbital ψ är vågfunktionen för en enda elektron. Den kan representeras som en linjär kombination av atomorbitaler, där varje orbital motsvarar en specifik energi, som är summan av den kinetiska och potentiella energin hos elektronen som rör sig i det molekylära elektriska fältet. Två atomorbitaler, a och b, ger genom överlappande linjärkombinationer upphov till två molekylorbitaler ψI och ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
När molekylorbitaler med elektroner fylls först, kommer bindningsorbitalerna ψI fylls först. När elektroner fyller molekylära orbitaler med lika energi, enligt Hunds regel, bör de också ockupera olika molekylära orbitaler med samma spinnriktning så mycket som möjligt.
De molekylära orbitalerna ψI som erhålls genom att addera två atomorbitalfunktioner (Ekvation 3-5) kallas bindande molekylorbitaler. De molekylära orbitalerna ψII som erhålls genom att subtrahera två atomorbitalfunktioner (Ekvation 3-6) kallas antibindande molekylorbitaler. Energin i de bindande molekylorbitalerna är lägre än i de antibindande molekylorbitalerna och lägre än energin i de ursprungliga två atomorbitalerna. Precis som vid fyllning av atomorbitaler placeras elektronerna vid fyllning av molekylorbitaler först i bindningsorbitaler, och en molekylorbital kan rymma två elektroner med motsatt spinn. När elektroner fyller molekylära orbitaler med lika energi, enligt Hunds regel, bör de också uppta olika molekylära orbitaler med samma spinnriktning så mycket som möjligt. De molekylära orbitaler som bildas av två s-atomorbitaler visas i figur 3-25.

p-orbitaler och d-orbitaler kan också bilda molekylorbitaler med olika energinivåer, t.ex. kombinationen av tvåatomiga molekylorbitaler i O2 molekylerna är relativt komplexa.
I experiment uppmättes de magnetiska egenskaperna hos dessa två enskilda elektroner, vilket ger starkt stöd för molekylorbitalteorin. Till skillnad från molekyler som består av samma atomer har molekyler som består av två eller flera olika atomer mer komplexa energinivåer i molekylorbitalerna, men principen är densamma.
2. Färgegenskaper vid laddningsöverföring
Denna teori om molekylorbitaler, där hela molekylen delar elektroner, betraktas också som övergången av elektroner från en atomorbital till en annan, känd som laddningsöverföring. Laddningsöverföring kan ske i metall-metall (M-M), icke-metall-nicke-metall (L-L) och icke-metall-metall (L-M) interaktioner. Bland dem är L-L, M-L dessa två typer av bindningar ofta främst kovalenta bindningar. O2 hör till L-L-laddningsöverföring, som är en kovalent bindning.
(1) Metall-metall-laddningsöverföring (M - M-laddningsöverföring)
Denna typ av laddningsöverföring sker i allmänhet mellan vanliga övergångsmetalljoner. De flesta av färgorsakerna till färgade ädelstenar produceras av metall-metall-laddningsöverföring. M-M-laddningsöverföring omfattar huvudsakligen följande typer: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Laddningsöverföring mellan metaller delas in i två typer: laddningsöverföring mellan homonukleära atomer och laddningsöverföring mellan heteronukleära atomer.
① Laddningsöverföring mellan isoelektroniska atomer
Laddningsöverföring mellan isoelektroniska atomer sker mellan två atomer av samma övergångsmetallelement i olika oxidationstillstånd. Till exempel Fe2+ och Fe3+ genomgår laddningsöverföring under olika redoxförhållanden, absorberar energi och producerar färg. Den blå-lila färgen på iolit produceras av laddningsöverföringen av järnjoner i olika oxidationstillstånd. Fe3+ och Fe2+ är i tetraedrisk respektive oktaedrisk position, med två ligander förbundna med kanter. När synligt ljus skiner på iolit, kommer en d-elektron av Fe2+ absorberar ljus med en viss energi och övergår till Fe3+, absorberar gult ljus vid 588 nm och ger en blå-lila färg. Akvamarin, grön turmalin och andra kan också uppvisa färg på grund av laddningsöverföring mellan järnjoner.
② Laddningsöverföring mellan heteroatomer
Blå safirer är det mest typiska exemplet på den färg som produceras genom laddningsöverföring mellan två typer av övergångsmetalljoner. Koordinationspolyederna av övergångsmetalljoner är förbundna med kanter eller ytor, vilket underlättar laddningsöverföringen mellan metallerna.
Till exempel, i safirer, när järnjoner och titanjoner kommer in i de anslutna oktaederna, finns både Fe och Ti i två oxidationstillstånd:
Fe2+ + Ti4+ låg energi (3-7)
Fe3+ + Ti3+ hög energi (3-8)
Övergången från ekvation (3-7) till ekvation (3-8) kräver att en viss mängd ljusenergi absorberas, vilket resulterar i ett brett absorptionsband som sträcker sig från gult till rött. Däremot passerar det mesta blå ljuset genom ädelstenen, vilket ger den ett blått utseende.
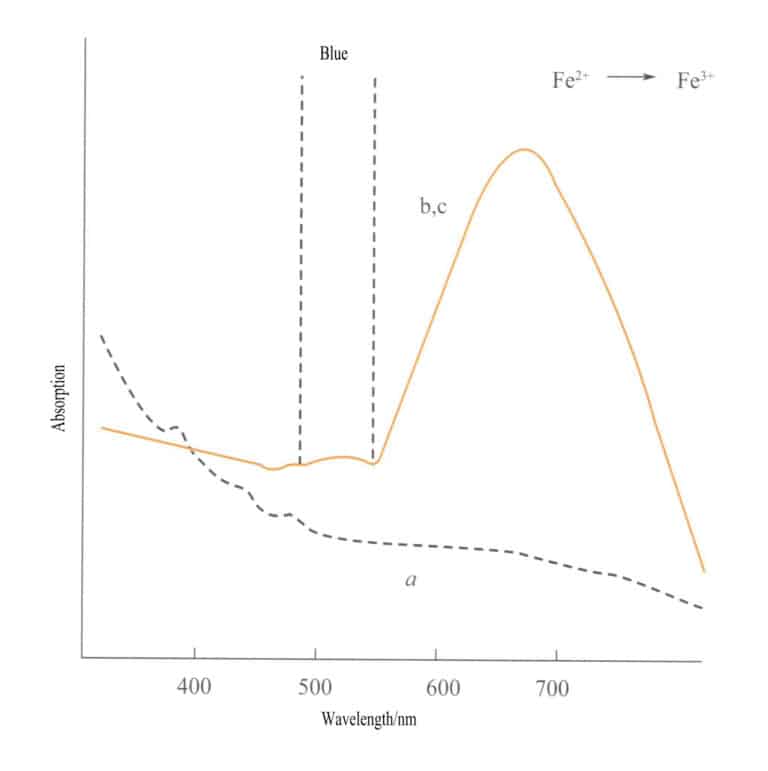
Laddningsöverföring mellan olika valenstillstånd har en stark riktning, och ädelstenar som uppvisar färg på grund av denna mekanism uppvisar ofta pleokroism. Till exempel är akvamarin färgad av Fe2+→ Fe3+ Laddningsöverföring visar färg strikt längs den optiska axelns riktning. Figur 3-26 visar att akvamarin framstår som gul i b- och c-planen. Samtidigt finns det ingen sådan överföring längs a-axelns riktning, vilket resulterar i ingen ljusabsorption och därför ingen färg längs a-axelns riktning.
(2) Laddningsöverföring från icke-metall till metall (L-M)
Denna typ av L-M-laddningsöverföring sker ofta mellan syre- och metalljoner, och vissa syreinnehållande ädelstenar färgas av laddningsöverföring från icke-metall till metall, såsom O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
I absorptionsspektrumet för enkla järnoxider (figur 3-27) förekommer två svaga absorptionsband i det infraröda området för ilmenit, hematit och lepidokrokit (elektroniska d - d-övergångar). Ett starkt absorptionsband uppträder i det kortvågiga området, producerat av O2-→Fe3+ laddningsöverföring, och detta absorptionsband bestämmer de karakteristiska färgerna för dessa föreningar: rödbrun, brun och gulbrun.
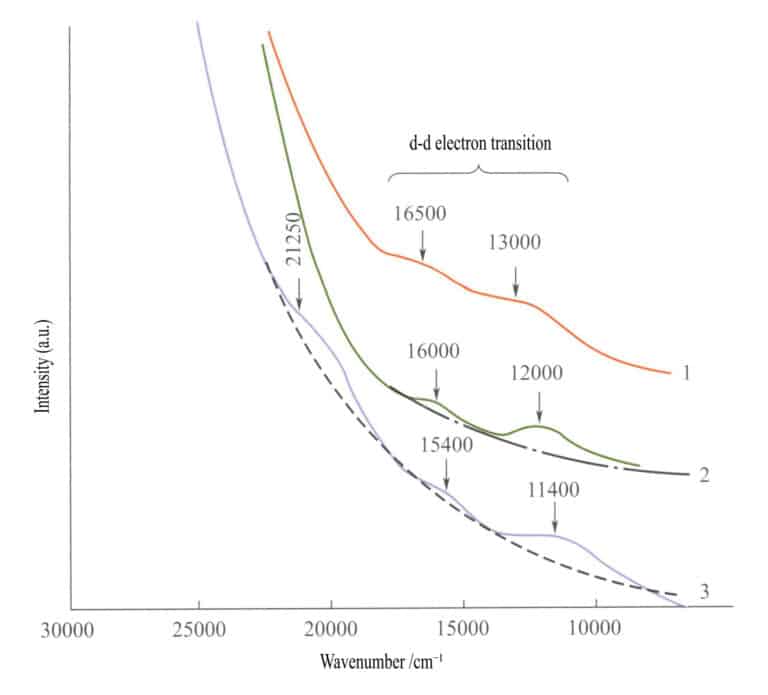
1 -Iilmenit; 2 - Hematit; 3 - Lepidokrokit
Gul beryll får sin färg från O2–→ Fe3+ Laddningsöverföring. I strukturen för gul beryl är O2–→ Fe3+ stark laddningsöverföringsabsorption kan sträcka sig från den ultravioletta änden till den blå änden av det synliga spektrumet, absorbera lila och blått, vilket resulterar i en gul färg.
Safir, som har en helt annan koordinationsmiljö än beryll, kan också producera samma spektrala absorptionsband som beryll, vilket resulterar i gult, som också är ett resultat av O2–→ Fe3+ Laddningsöverföring.
Enligt kristallfältsteorin innehåller vissa ädelstensmineraler inte oparade elektroner och kan inte producera färg. Till exempel kan de elektroniska skikten i krokoit (PbCrO4), Pb2+, Cr6+, och O2– är fulla. Men i CrO42- atomkluster är "molekylära orbitaler", som motsvarar de exciterade tillstånden under O2-→Cr6+ överföring, bildar absorptionsband och presenterar orange.
L→M Laddningsöverföring omfattar även överföring av svavel till metall, som i vanlig pyrit; detta optiska fenomen som orsakas av överföringen är lättare att förstå när det diskuteras med hjälp av bandteori.
(3) Laddningsöverföring från icke-metall till icke-metall (L-L)
Molekylär orbitalteori tyder på att den djupblå färgen på lapis lazuli beror på excitationsenerginivåerna för S3- atomgrupp.
I grafit är ringarna med sex kolatomer ordnade i lager. Längs detta lager kan elektronerna i viss utsträckning röra sig fritt, vilket resulterar i stark ljusabsorption, anisotropi och ledningsförmåga.
Vissa organiska ädelstenar, som bärnsten och pärlor, har elektroner som rör sig och exciteras genom atomgrupperna av organiska pigment i delade molekylära orbitaler, vilket orsakar absorption av synligt ljus och producerar färg. Till exempel bärnstenens "honungsgula" färg, korallens färger och vissa snäckor och färgade pärlor.
Färgmekanismerna för vanliga ädelstenar visas i tabell 3-12.
Tabell 3-12 Klassificering av färgmekanismer för vanliga ädelstenar
| Laddningsöverföring metall - metall | Fe2+ - Fe3+ /Fe3+ - Fe2+ : iolit (blå), berthierit (blå), magnetit (svart), etc. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Kyanit (blå), Safir (blå) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganit (svart), Bixbyit (svart) | |
| Laddningsöverföring från icke-metall till metall | O2- -Fe3+: Gyllengul beryll, gyllengul safir, ilmenit, hematit, lepidocrocit etc. |
| O2- - Cr6+: Krokoit (orange) | |
| O2- -V5+:Vanadinit (orange) | |
| Svavel till metall: pyrit, marcasit etc. (se halvledare med gap) | |
| Laddningsöverföring icke-metall - icke-metall | S3-: Lapis lazuli (blå) |
| Π elektronisk: grafit (svart) | |
| Färgerna hos vissa organiska ädelstenar som bärnsten och korall. |
Copywrite @ Sobling.smycken - Anpassad smyckestillverkare, OEM och ODM smyckesfabrik
Avsnitt III Energibandteori
Energibandteori är en kvantmekanisk modell för att studera ädelstensmaterial, vilket är en ytterligare förlängning och utvidgning av molekylär orbitalteori. Studien av energibandteori kan bättre förklara färgmekanismen hos vissa naturligt färgade ädelstenar.
1. Grundläggande begrepp inom energibandsteori
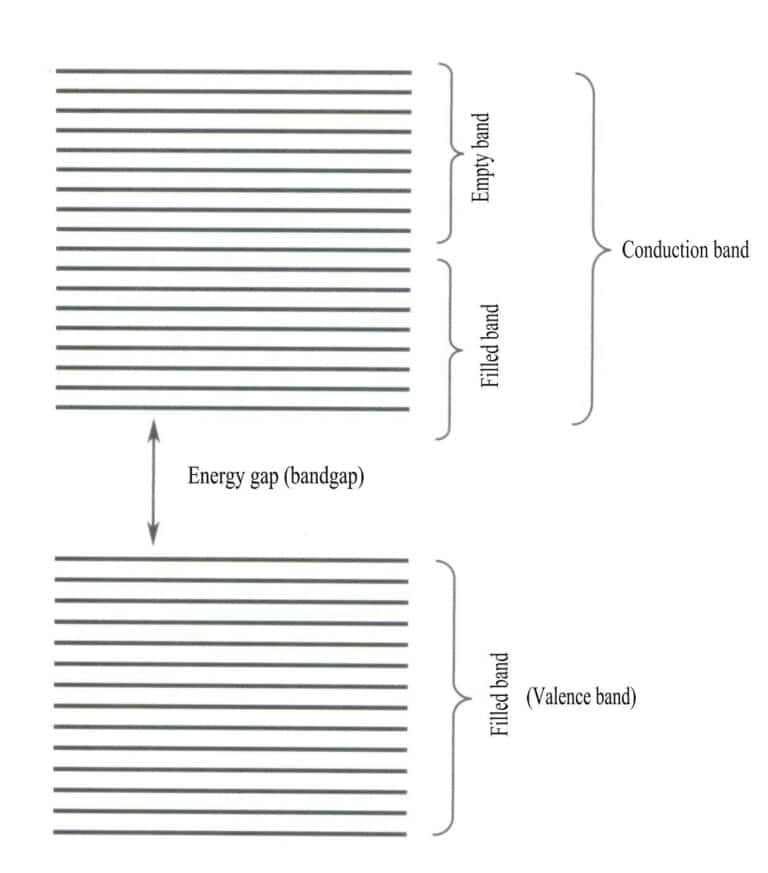
Energibandteori är en approximativ teori som används för att studera lagarna för elektronrörelse i fasta ämnen. Fasta ämnen består av atomer, vilket inkluderar atomkärnor och de yttersta elektronerna, som alla är i ständig rörelse. Bandteorin utgår från att elektronerna i fasta ämnen inte är bundna till en specifik atom utan delas av hela kristallen och rör sig inom det periodiska potentialfältet i kristallens tredimensionella utrymme. Elektronernas rörelseområde ligger inom gitterets periodiska potentialfält, vilket gör att den rumsliga fördelningen av elektronbanor kan överstiga molekylernas och nå ett maximum. Energinivåerna för enskilda elektroner breddas till energiband.
Bandteorin diskuterar huvudsakligen elektronövergångar mellan icke-lokala tillstånd, där alla valenselektroner bör tillhöra hela det fasta gitteret. Enligt bandteorin kan fasta material delas in i olika energiband baserat på om atomorbitalerna är fyllda: ett fyllt band bildas av energinivåerna i atomorbitaler som är helt upptagna av elektroner, vilket representerar ett lågenergiband; ett tomt band bildas av energinivåer som inte är helt upptagna av elektroner, vilket representerar ett högenergiband. Energiskillnaden mellan dessa två typer av band kallas "bandgap" (Figur 3-28).
När alla energiband i ett material är fyllda är det en icke-ledare; när det delvis är fyllt med elektroner är det en ledare. Gitterdefekter introducerar ytterligare energinivåer i kristallen, vilket gör att elektroner kan komma in i dessa energinivåer, vilket resulterar i villkorlig konduktivitet.
2. Karakteristika för bandgapsövergångar
Vissa ädelstensmineral innehåller grundämnen från grupp IV A i det periodiska systemet, t.ex. diamant och moissanit, som i första hand binder kovalent. Det finns också andra mineraler, t.ex. kadmiumsulfid (CdS), vars färger kan förklaras med bandteori.
Elektroner absorberar ljusenergi och rör sig mellan valens- och ledningsbanden, vilket bildar "interna bandövergångar". Sannolikheten för övergångar är nära relaterad till energidifferensen mellan valens- och ledningsbanden, som kallas bandgapsenergin (Eg) (Bild 3-29).

Figur 3-29 (a) är ett typiskt banddiagram för halvledare. Baserat på storleken på kristallens bandgapsenergi kan den delas in i tre typer: brett bandgap, smalt bandgap och medelbandgap. Ett brett bandgap har en bandgapsenergi som är större än energin för synligt ljus; när bandgapsenergin överstiger energin för synligt ljus absorberas inte synligt ljus och passerar helt igenom, vilket gör mineralet färglöst. Till exempel är bandgapsenergin för diamant Eg är cirka 5,5eV, vilket gör den färglös.
Bandgapsenergin hos material med smalt bandgap är mindre än för synligt ljus, vilket gör att allt synligt ljus absorberas, vilket resulterar i mörkgrågröna eller svarta färger. Till exempel är bandgapsenergin hos galena Eg mindre än 0,4eV, vilket ser ut att vara blygrått. När denna "narrow bandgap semiconductor" har en lämplig geometrisk form uppvisar den likriktar- och förstärkaregenskaper.
Energin i material med medelhögt bandgap ligger exakt inom det synliga ljusområdet, och ädelstensmineraler har olika färger. Deras färgsekvens visas i figur 3-29 (c) och sträcker sig från röd-gul till grön-blå till lila. Till exempel är bandgapsenergin (Eg) för kadmiumsulfid (CdS) är ca 2,5eV, vilket absorberar blått och violett ljus och ger ett gult intryck. Bandgapsenergin hos cinnober är ca 2eV, vilket gör att endast rött ljus kan passera igenom, vilket ger ett rött intryck. Bandgapsenergin för orpiment är ca 2,5eV, vilket ger ett gult intryck.
En annan kategori av naturliga ädelmineraler som förklaras av bandteorin är färgen på material med brett bandgap som innehåller föroreningar. När det gäller t.ex. en diamant med föroreningar är diamantens bandgapsenergi t.ex. ca 5,5eV, och synligt ljus absorberas inte när det passerar genom diamanten; ren diamant är färglös, men situationen förändras när den innehåller föroreningar.
(1) Färgmekanismen för gula diamanter
Kväveatomer ersätter kolatomernas positioner. Eftersom kväveatomer har en elektron mer än kolatomer bildar denna extra elektron en orenhetsenerginivå i bandgapet, den så kallade donatornerginivån, där kväveatomer fungerar som "donatorer".
Förekomsten av denna föroreningsnivå minskar bandgapets energi till 4eV[ [Figur 3-30 (a)]. Den kan vara ännu lägre, vilket gör att den kan absorbera ultraviolett ljus och en bit av 3eV violett ljus, vilket gör att diamanten ser gul ut.
Denna effekt är stark; med en kväveatom per hundratusen kolatomer kan diamanten bli djupt gul. Minskningen av bandgapet är dock fortfarande otillräcklig för att göra diamanten ledande vid rumstemperatur.
(2) Mekanism för färg i blå diamanter
Eftersom bor har en elektron mindre än kol, bildar det en "acceptornivå" i bandgapet hos diamant. Det har inga extra elektroner, men det kan acceptera elektroner från valensbandet i en diamant, vilket skapar hål i valensbandet [Figur 3-30 (b)] och bildar ett orenhetsenergiband ca 0,4eV ovanför valensbandet som kallas acceptornivån.

Acceptorens energinivå är inte enkel, utan det är en komplex struktur av orenheters energiband som kan ge blå färg. Acceptorens energinivå skapar "hål" i valensbandet, vilket gör att denna blå diamant av typen II b med "hål" kan leda elektricitet.
En boratom bland varje miljon kolatomer kan bilda blått. På grund av det högre aluminiuminnehållet i denna blå diamant och eftersom aluminium har en elektron mindre i det yttre lagret än kol, trodde man tidigare att aluminium spelade acceptorrollen. Nuvarande experiment har dock visat att det är bor och inte aluminium.
Typ II b konduktiva blå diamanter är naturligt blå och deras konduktivitet är en av skillnaderna från bestrålade blå diamanter (färgcentra). Denna egenskap används ofta för att skilja mellan de två typerna av diamanter. Gula kvävedonatordiamanter leder dock inte elektricitet, så denna metod kan inte användas för att skilja dem från bestrålade gula diamanter.
3. Ädelstensmineral färgade av bandövergångar
Energibandteorin kan förklara en del av färgbildningen hos naturliga ädelstenar. Eftersom bandgapsenergin är en inneboende egenskap hos kristallen och inte förändras på grund av yttre förhållanden, har färgen på ädelstenar god stabilitet. Kristallens ledningsförmåga kan bestämmas baserat på om energibanden i kristallen är fyllda med elektroner. Tabell 3-13 visar de typer av ädelstensfärger som kan förklaras med bandteori och deras konduktivitetsegenskaper.
Tabell 3-13 Olika typer av ädelstensfärger förklarade med bandteori och deras ledningsförmåga
| Ledare (metallfärger och metallglans) | Element | Koppar, guld, järn, silver, kvicksilver m.m. |
| Legering | Amalgam, Meteorit nickel järn | |
| Halvledare | Smal bandbredd | Ogenomskinligt grå till svart: altait, galenit |
| Ogenomskinlig metallisk färg: koboltin, markasit, pyrit, smaltit | ||
| Måttligt bandgap | Röd: cinnober, proustite, pyrargyrit | |
| Orange: Realgar | ||
| Gul: Kadmiumsulfid, realgar, svavel | ||
| Brett bandgap | Färglös: diamant, sfalerit | |
| Halvledare med brett bandgap som innehåller orenheter | Donatorförorening: Kvävedopad diamant (gul) | |
| Föroreningar i värden: Borinnehållande diamant (blå) |
Färgen på ädelstenar som orsakas av bandövergångar är relaterad till strukturen och bindningstypen vid tidpunkten för ädelstenens bildning. Det har liten relation till senare föroreningar och kristalldefekter. Storleken på ädelstenarnas bandgapsenergi är fast. Den förändras inte med egenskaperna hos ädelstensmaterialet, så konventionella optimeringsmetoder kan i allmänhet inte förbättra färgen på ädelstenar.
Avsnitt IV Fysikalisk-optiska effekter
De flesta naturliga ädelstenar kan orsaka selektiv absorption av ljus, och olika ädelstenar absorberar synligt ljus vid olika våglängder, vilket resulterar i olika färger. Förutom selektiv ljusabsorption kan den inre strukturen hos ädelstenskristaller också orsaka fysiska optiska effekter, vilket leder till olika färger i ädelstenar.
1. Ädelstensmineral relaterade till fysikaliska optiska effekter
De färger som uppstår genom fysikalisk-optiska effekter bildas på grund av ljusets dispersion, interferens, diffraktion och andra orsaker som orsakas av kristallstrukturen eller sammansättningen och inneslutningar. Detta är bara en optisk effekt som kan förklaras med fysikalisk optisk teori. Olika ädelstenar kan producera olika färger under samma optiska effekter. Förutom de vanliga spårämnena som orsakar färg är orsakerna till färger som produceras av fysiska optiska effekter främst relaterade till ädelstenarnas interna struktur och fysiska egenskaper. De typer av ädelstensmineral som orsakar färger på grund av fysikaliska optiska effekter anges i tabell 3-14.
Tabell 3-14 Typer av ädelmineral som orsakas av fysikalisk-optiska effekter
| Funktion | Optiska egenskaper och färg | Gem Minerals |
|---|---|---|
| Dispersion Spridning | Skimrande | "Eld" i ädelstenar med dispersion, t.ex. diamanter, zirkon, rutil och strontiumtitanat |
| Blå | Månsten, blå kvarts, opal | |
| Lila | Fluorit (spridning av mikrokristaller av kalcium) | |
| Röd | Rubinglas, spridning av mikrokristaller av koppar eller guld | |
| Vit | Mjölkkvarts | |
| Kattöga-effekt | kattöga akvamarin, kattöga pyroxen, etc. | |
| Stjärnljusets effekt | Olika stjärneffekter av korund och granat | |
| Lyster | Pärlornas, apofyllitens etc. lyster | |
| Gnistrande | Glitter av aventurin, obsidian etc. | |
| Interferens Diffraktion | De rena spektralfärgerna hos tunnfilm | Regnbågen av kopparkis, den missfärgade filmen i en iris-kvartsspricka |
| Interferenseffekter | Färgförändring av opal, effekten av labradorit | |
| Inkludering | Blå | Dumortierit i kvarts |
| Grön | Grön kalcedon och nickelådror i grön kalcedon, fuchsit i stjärnkvarts | |
| Orange | Hydratiserad järnoxid i eldopal och köttfärgad kalcedon | |
| Röd | Hematitflagor i ortoklas |
2. Interferens- och diffraktionseffekter
(1) Interferenseffekter
Interferensfenomen uppstår när två ljusstrålar fortplantar sig längs samma optiska väg eller i parallella riktningar. Ett vanligt interferensfenomen i ädelstenar är iridescens. I t.ex. iriserande kvarts beror interferensfärgerna på filmens tjocklek, filmens brytningsindex och det infallande ljusets beskaffenhet.
Interferensfärgerna hos pärlor bildas av den koncentriska skiktade alternerande superpositionen av två ämnen med olika brytningsindex (aragonit och nacrum), där det infallande ljuset reflekteras från ytorna mellan de alternerande skikten och det reflekterade ljuset interfererar med det infallande ljuset för att producera vackra interferensfärger.
(2) Diffraktionseffekter
Diffraktion är ett fysikaliskt fenomen som innebär att ljusvågor avviker från sin ursprungliga linjära utbredning när de stöter på hinder. Inom fysiken böjs och sprids ljusvågor i varierande grad när de passerar genom hinder som t.ex. slitsar, små hål eller skivor. Om ett hinder placeras mellan ljuskällan och observationsskärmen kommer ljusa och mörka områden att visas på observationsskärmen, och gränserna för dessa områden är inte skarpa, vilket bildar ett komplext mönster av ljus och mörker. Detta fenomen kallas diffraktion. Sådana fenomen kan uppstå när ljusvågor stöter på hinder längs sin spridningsväg. Den viktigaste faktorn för att åstadkomma diffraktion är förekomsten av periodiskt fördelade diffraktionsgitter i ädelstensmineral.
① Opal färgförändring
I opal har de vattenhaltiga kiselsfärerna samma diameter och är ordnade i en regelbunden alternerande skiktstruktur som bildar periodiskt placerade diffraktionsgaller. När ljus tränger in i opalen uppstår diffraktion som ändrar färg (Figurerna 3-31, 3-32). Färgtyperna och graden av färgförändring beror huvudsakligen på det interplanära avståndet mellan de staplade kiselsfärerna.
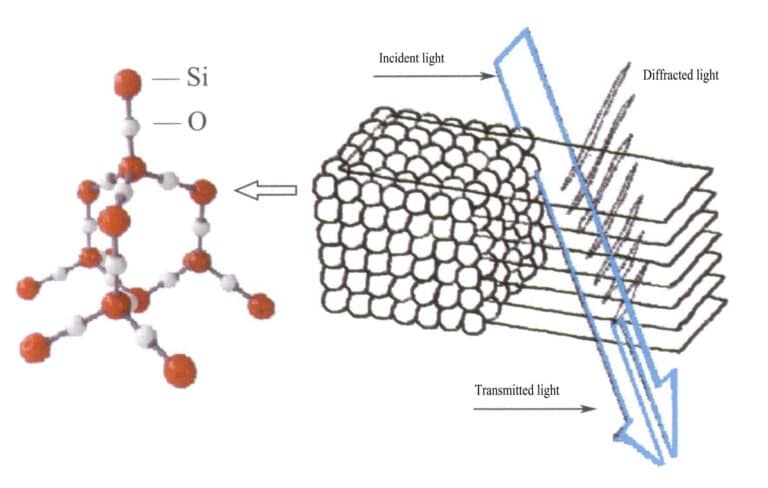

Till exempel opal med en platt kubisk struktur med centrerad yta och ett gitteravstånd på 3×10-10m visar färger som sträcker sig från grönt till rött; denna typ av opal med ett gitteravstånd på 2,5×10-10m visar färger som sträcker sig från blått till gult.
② Labradoriteffekt
Labradorit uppvisar också effekter som liknar opal (figur 3-33). Labradorit kallas också spektrolit eftersom den kan blinka i solens färgstarka ljus. Olika typer av labradorit från Finland kan uppvisa en rad olika spektralfärger, ett fenomen som kallas "labradoriteffekten". Färgförändringseffekten i labradorit beror på små smältor mellan skikten av plagioklas med olika sammansättningar. De små skillnaderna i brytningsindex mellan de olika fältspaterna orsakar interferens och diffraktion av ljus, vilket resulterar i luminescens och färgförändring. Färgerna som produceras av denna struktur är relaterade till skiktens relativa tjocklek och deras brytningsindex. Ibland uppvisar andradit från Mexiko också diffraktionsfenomen.

3. Spridning och inneslutningar
(1) Spridning
Spridning uppstår i allmänhet när den inre strukturen hos ädelstensmaterial är oregelbunden eller när komponenternas storlek överskrider gränserna för diffraktionsförhållandena. De färgeffekter som uppstår genom spridning är relaterade till ädelstensmaterialets partikelstorlek och form. När infallande ljus interagerar med oregelbundet arrangerade partiklar som är mindre än våglängden för synligt ljus, är de överförda ljusvågorna med hög energi starkare än ljusvågorna med låg energi, vilket innebär att i de flesta fall bara lila och blått kan ses. Till exempel kan SiO2 små sfärer i opal har diametrar som är mindre än våglängden för synligt ljus, och när storleken på de spridande partiklarna ligger nära våglängden för synligt ljus kan spridningsfärger också uppstå.
Till exempel orsakas lila fluorit av radioaktiv bestrålning som driver ut fluoratomer, vilket resulterar i att kalciumatomer som binder till fluoratomer kondenseras till hexagonala plattor med en storlek som kan jämföras med våglängden för synligt ljus. Interaktionen mellan kalciumplattorna och ljusvågorna ger upphov till spridning. Den absorberar vissa ljusvågor, vilket skapar en stark absorptionstopp i det gröna till röda ljusområdet, vilket gör att lila ljus kan passera igenom och ge den lila färgen.
Eftersom partiklar av samma storlek av metallelement kan ge liknande färgeffekter, och olika metallpartiklar kan ge olika färger, tillverkas vissa imitationspärlor med denna egenskap.
"Rubin"-glas framställs t.ex. genom att koppar- eller guldpartiklar tillsätts glaset, vilket ger en röd färg som liknar rubinernas. När ädelstensmaterialet innehåller inneslutningar, mikrosprickor eller bubblor som är större än våglängden för synligt ljus, interagerar ljusvågorna med dessa spridande partiklar, vilket gör att de spridda ljusvågorna rekombineras och ger ett genomskinligt mjölkigt ljus. Till exempel vissa månstensimitationer.
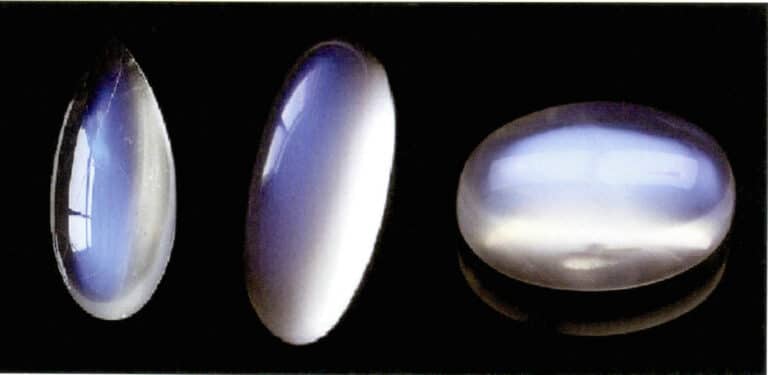
Månskenseffekten hos månsten uppkommer också genom ljusspridning (figur 3-34). Månsten är en alkalisk fältspat, en komposit som bildas av omväxlande parallella lager av kaliumrik och natriumrik fältspat. Tjockleken mellan skikten varierar normalt mellan 50 och 1000 nm, och tunnare skikt kan ge upphov till ljusspridning. Samma spridningsfärg kan också förekomma i plagioklas, känd som "labradoriteffekten".
Ett speciellt orienterat arrangemang av spridande partiklar kan ge upphov till karakteristiska optiska effekter. När de spridande partiklarna är parallellt fibrösa ger de t.ex. kattögon- eller stjärneffekter, såsom stjärnsafirer och kvartskattögon. När de spridande partiklarna är tillräckligt stora för att kunna urskiljas med blotta ögat kan de ge upphov till en "goldstone-effekt", t.ex. solsten (figur 3-35) och goldstone-glas.

(2) Inkluderingar
De färg- och optiska fenomen som uppstår vid inneslutningar är en speciell typ av spridning. Inneslutningar med färg som är inbäddade i nästan färglösa huvudkristaller kommer att presentera färgen på inneslutningarna, såsom nickelbärande bandad kalcedon och vatteninnehållande järn(II)oxid (FeO - H2O) köttfärgad kalcedon; färgen på ortoklas från Madagaskar och viss cordierit bildas av något större, men fortfarande mikroskopiska inneslutningar av hematit som skapar röda nyanser; submikroskopiska inneslutningar av järnhydroxid färgar ofta eldopal.
Diamanter uppvisar ofta olika färger på grund av förekomsten av många inneslutningar. De diamanter som färgas av inneslutningar kan vara svarta, orangeröda och brunröda. När en diamant innehåller otaliga mörka ogenomskinliga mineralinneslutningar ser den svart ut; när den undersöks med starkt genomskinligt ljus kan många mörka inneslutningar observeras och diamanten ser mörkgrå ut; en annan typ är sekundära inneslutningar som uppstår i diamantens sprickor. När sprickorna utvecklas och fylls med dessa färgade inneslutningar framstår diamanten som brunröd eller orangeröd, vilket också kallas en "oxiderad" diamant.
4. Dispersion
Fenomenet att vitt ljus sönderdelas i olika spektralfärger genom ett föremål kallas dispersion. Dispersionen hos ädelstenar avser egenskapen att ljuset sprids i olika våglängder av spektralfärger när det passerar genom de lutande planen hos transparenta ädelstenar. På grund av att de olika våglängderna i det monokromatiska ljuset som utgör vitt ljus sprids med olika hastigheter och brytningsindex i olika material kan vitt ljus under vissa förhållanden sönderdelas i olika spektralfärger. Storleken på en ädelstens dispersionsvärde bestäms av dess fysiska egenskaper; varje ädelsten har sitt inneboende dispersionsvärde, som inte förändras med ädelstenens egenskaper. Diamanternas unika charm är nära relaterad till deras höga dispersionsvärde (0,044).
De flesta diamantsimulatorer har ett högre dispersionsvärde, t.ex. zirkon med ett dispersionsvärde på 0,039 och syntetisk moissanit med ett dispersionsvärde på 0,104. En jämförelse av dispersionsvärdena för diamanter och deras vanliga ädelstensimulatorer visas i tabell 3-15.
Tabell 3-15 Jämförelse av spridningsvärden för diamanter och deras vanliga simulerande ädelstenar
| Ädelstenens namn | Dispersionsvärde |
|---|---|
| Diamant | 0.044 |
| Zirkon | 0.039 |
| Korund | 0.018 |
| Spinell | 0.020 |
| Topas | 0.014 |
| Beryl | 0.014 |
| Kristall | 0.014 |
| Syntetisk rutil | 0.280 |
| Syntetisk strontiumtitanat | 0.190 |
| Syntetisk moissanit | 0.104 |
Dispersion kallas vanligen för ädelstenarnas "eld". Diamanter har till exempel ett högt dispersionsvärde och deras eld är mycket uttalad, vilket förstärker diamanternas redan kungliga status och visar deras unika charm.
Det finns många typer av färger som produceras av fysiska optiska effekter, som alla kan förklaras med fysisk optisk teori. Med undantag för dispersion, som är en inneboende egenskap hos själva ädelstenen, orsakas andra fenomen av strukturella förändringar efter bildandet av ädelstenen och skillnaderna i mekaniska inneslutningar. Förståelsen av de olika orsakerna till ädelstenarnas färg ger en teoretisk grund för att optimera behandlingen av naturliga och syntetiska ädelstenar.