Hvorfor har edelstener flere farger?
Introduksjon av krystallfeltteori, molekylorbitalteori og energibåndteori
Fargene på edelstener er rike og varierte, og har en unik sjarm som folk alltid har elsket. Kvaliteten på edelstener avhenger i stor grad av fargen. Fargen på en edelsten er en viktig indikator i evalueringen av edelstener, og de fleste optimaliseringsbehandlinger for edelstener innebærer å endre eller forbedre fargen. Derfor er det en avgjørende forutsetning for å kunne optimalisere edelstener å forstå årsakene til fargen. Bare ved å forstå hvordan edelstener får fargen sin, kan man avgjøre om en edelsten kan optimaliseres, hvilket optimaliseringsopplegg som skal brukes, og hvilken eksperimentell plan som skal etableres. Det finnes fem vanlige teorier om farging av edelstener: klassisk mineralogiteori, krystallfeltteori, molekylær orbitalteori, energibåndteori og fysiske optiske effekter. Disse teoriene utgjør fargeleggingsteoriene for vanlige naturlige edelstener, og det følgende er en kort introduksjon til disse fem fargeleggingsteoriene.
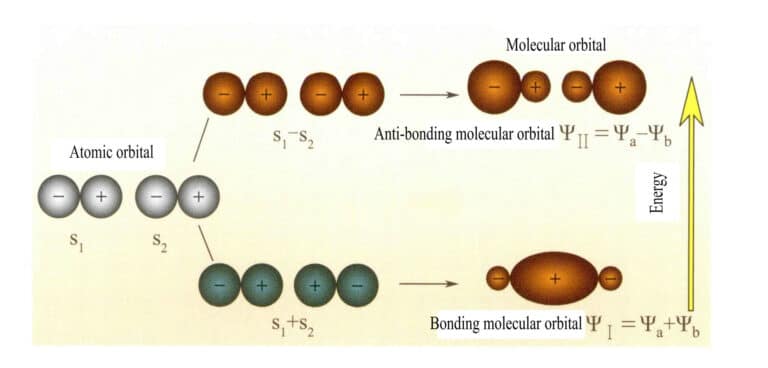
Molekylorbitaler dannet av to s-atomorbitaler
Innholdsfortegnelse
Del I Krystallfeltteori
På 1930-tallet lanserte forskere krystallfeltteorien for å forklare krystallers egenskaper. Krystallfeltteori er en teori som studerer de kjemiske bindingene til overgangselementer (komplekser). Den forklarer de fysiske og kjemiske egenskapene til overgangselementer og lantanidelementer ved å kombinere noen synspunkter fra elektrostatisk teori, kvantemekanikk og gruppeteori (teorien som studerer symmetrien i materie), med fokus på ligandenes innflytelse på d- og f-orbitalene til de sentrale ionene. På 1950-tallet anvendte man krystallfeltteori på komplekser og foreslo ligandfeltteori. Ligandfeltteori er en videreutvikling av krystallfeltteori; den tar hensyn til både påvirkningen av ligandens elektriske felt på sentralionet og fyllingseffekten av ligandens elektroner på sentralionet, noe som gjør den mer komplett enn krystallfeltteori. Det er imidlertid ingen vesentlig forskjell mellom de to teoriene, og de skilles vanligvis ikke fra hverandre i studiet av uorganiske mineraler.
1. Grunnleggende konsepter i krystallfeltteori
Ionene i overgangsmetaller befinner seg i krystallfeltet til omkringliggende anioner eller dipolmolekyler. Krystallfeltteori er en elektrostatisk modell som ser på krystallen som et elektrostatisk samspill mellom positive og negative ioner, der det positivt ladede kationet kalles det sentrale ionet, og det negativt ladede anionet kalles liganden.
Når man bruker krystallfeltteori for å forklare fargen på edelstenmineraler, involverer det hovedsakelig d-elektronene eller f-elektronenergien til overgangselementioner. For eksempel har d-orbitalene fem typer: dxy, dxz, dyz, d , og d . Disse fem d-orbitalene har ulik romlig fordeling i fri ionetilstand, men har samme energi. De gjennomgår imidlertid betydelige endringer under påvirkning av ligandfeltet. De fem energidegenererte d-orbitalene i sentralatomet splittes under påvirkning av det negative elektriske feltet som dannes av de omkringliggende ligandene. Noen d-orbitaler får økt energi, mens andre får redusert energi. På grunn av splittingen av energinivåene i d-orbitalene vil elektronene i sentralatomets d-orbitaler omorganisere seg slik at de fortrinnsvis inntar orbitalene med lavere energi, noe som reduserer systemets totale energi og gjør komplekset mer stabilt.
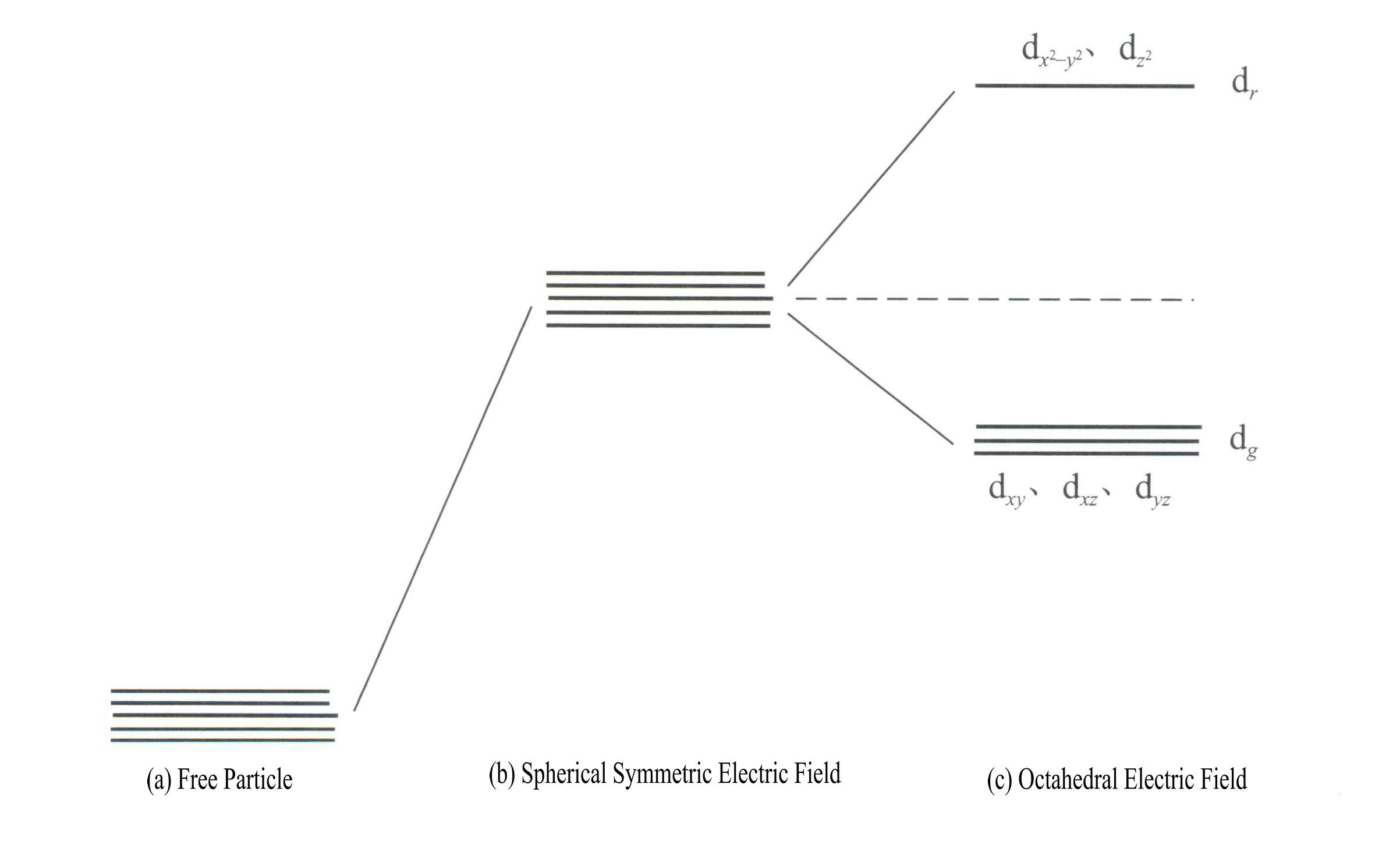
Energien til d-orbitalene er den samme når det ikke er noe elektrisk felt [Figur 3-19 (a)]; under et sfærisk symmetrisk elektrostatisk felt har d-orbitalene økt energi, men vil ikke splitte seg [Figur 3-19 (b)]; når ligandfeltet er oktaedrisk, splittes det i dr og dg. Av disse er dr orbitaler er sammensatt av d og d , med høyere energi; dg orbitaler er sammensatt av dxy, dxz, dyz.
Ionene i overgangsmetaller befinner seg i krystallfeltet til omkringliggende anioner eller dipolmolekyler. Krystallfeltteori er en elektrostatisk modell som ser på krystallen som et elektrostatisk samspill mellom positive og negative ioner, der det positivt ladede kationet kalles det sentrale ionet, og det negativt ladede anionet kalles liganden.
Når man bruker krystallfeltteori for å forklare fargen på edelstenmineraler, involverer det hovedsakelig d-elektronene eller f-elektronenergien til overgangselementioner. For eksempel har d-orbitalene fem typer: dxy, dxz, dyz, d , og d . Disse fem d-orbitalene har ulik romlig fordeling i fri ionetilstand, men har samme energi. De gjennomgår imidlertid betydelige endringer under påvirkning av ligandfeltet. De fem energidegenererte d-orbitalene i sentralatomet splittes under påvirkning av det negative elektriske feltet som dannes av de omkringliggende ligandene. Noen d-orbitaler får økt energi, mens andre får redusert energi. På grunn av splittingen av energinivåene i d-orbitalene vil elektronene i sentralatomets d-orbitaler omorganisere seg slik at de fortrinnsvis inntar orbitalene med lavere energi, noe som reduserer systemets totale energi og gjør komplekset mer stabilt.
Energien til d-orbitalene er den samme når det ikke er noe elektrisk felt [Figur 3-19 (a)]; under et sfærisk symmetrisk elektrostatisk felt har d-orbitalene økt energi, men vil ikke splitte seg [Figur 3-19 (b)]; når ligandfeltet er oktaedrisk, splittes det i dr og dg. Av disse er dr orbitaler er sammensatt av dx2– y2 og dz2
, med høyere energi; dg orbitaler er sammensatt av dxy, dxz, dyz. [Figur 3-19 (c)]
Forskjellen mellom det høyeste og det laveste energinivået etter d-orbitalsplitting kalles separasjonsenergien △ . Separasjonsenergiene som produseres av ulike konfigurasjoner av ligandfelt, er ikke de samme (Figur 3-20). Energirekkefølgen deres er
Kvadratisk felt > Oktaedrisk felt > Tetraedrisk felt

Selv for felt med samme konfigurasjon kan de også variere på grunn av forskjeller i ligander og sentrale ioner; jo større den er, desto mer stabil er krystallen. Følgende tre faktorer bestemmer hovedsakelig størrelsen på krystallseparasjonsenergien:
(1) Krystaller dannet av det samme overgangselementet; når ligandene er de samme, jo høyere ladning av sentralionet, jo større er separasjonsenergien △ . Jo høyere positiv ladning det sentrale ionet har, desto større tiltrekningskraft på ligandene, noe som resulterer i en mindre avstand mellom det sentrale ionet og ligandkjernen, og jo større frastøtende kraft krystallfeltet som ligandene genererer på elektronene har, desto større er separasjonsenergien △ .
(2) For krystaller dannet av forskjellige ioner med samme positive ladning og de samme ligandene, jo større radius det sentrale ionet har, jo lenger er d-orbitalene fra kjernen, og jo større er separasjonsenergien △ .
(3) For krystaller som dannes av samme sentrale ion og ulike ligander, varierer separasjonsenergien på grunn av de ulike styrkene i ligandenes krystallfelt. Ulike ligander har ulike feltstyrker, og separasjonsenergien △ varierer med ligandens feltstyrke.
Separasjonsenergien brukes til å forklare krystallers stabilitet kvalitativt. Det er ikke nødvendig å finne den absolutte verdien △ , da det er tilstrekkelig å kjenne krystallens relative verdier under ulike forhold.
Basert på den relative energien til de splittede d-orbitalene kan den totale energien til overgangsmetallionene i d-orbitalene beregnes. Denne energien er lavere enn før splittingen, og gir dermed ekstra energi til krystallen, kjent som krystallfeltets stabiliseringsenergi, representert ved symbolet CFSE. Tabell 3-10 viser stabiliseringsenergiene til ioner som inneholder dn elektroner under forskjellige forhold.
Tabell 3-10 Krystallfeltstabiliseringsenergier under forskjellige ligander (Wu Ruihua, 1994)
| dn | Svakt felt | Sterkt felt | ||||
|---|---|---|---|---|---|---|
| dn | Firkantet | Regulært oktaeder | Vanlig tetraeder | Firkantet | Regulært oktaeder | Vanlig tetraeder |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Fargeegenskaper for overgangsmetallioner
I hans fargede edelstener skyldes fargen på de fleste edelstener overgangsmetallioner, og fargen på edelstenene er relatert til om de fargende ionene inneholder uparede elektroner i d- eller f-orbitalene. Fargeegenskapene til overgangsmetallioner inkluderer hovedsakelig følgende aspekter:
(1) Fargen på overgangsmetallioner er relatert til de elektroniske tilstandene til d-orbitalet eller f-orbitalet. Når d-orbital- eller f-orbitalelektronene er fylt eller tomme, vil edelstenen ikke vise farge. For eksempel vil Cr6+, Ce4+, og Cu+.
(2) Ulike fargeioner viser forskjellige farger i samme edelstenemateriale. På grunn av de forskjellige separasjonsenergiene til forskjellige fargeioner, kan de presentere forskjellige farger selv i samme materiale. For eksempel kan Fe2+ gir en svakt gråblå farge i spinell, mens Cr3+ produserer rødt.
(3) Fargende ioner av samme grunnstoff i forskjellige valenstilstander viser ofte forskjellige farger i samme edelstenmateriale. Fordi energien som kreves for d-elektronovergangene til det sentrale ionet er forskjellig, er de absorberte bølgelengdene av lys forskjellige, noe som resulterer i forskjellige farger. For eksempel vil et castrum som inneholder Mn2+ har en sart rosa fargetone, mens en beryll som inneholder Mn2+ er knallrød, kjent som rød beryll.
(4) Fargelegging av ioner av samme grunnstoff i samme valenstilstand viser ofte forskjellige farger når de er i forskjellige ligandkonfigurasjoner. For eksempel har Co2+ i den tetraedriske konfigurasjonen i spinell viser en karakteristisk "diamantblå" farge, mens den i den oktaedriske konfigurasjonen i kalsitt fremstår som rosa. Fe2+ i den oktaederkoordinerte olivinen viser en karakteristisk olivengrønn farge, mens den i den forvrengte kubiskkoordinerte almandinen fremstår som dyp rød.
(5) Samme type fargede ioner har samme valenstilstand og koordinasjonsgeometri, men forskjellige tilstøtende koordinerende atomer viser forskjellige farger. For eksempel, i den tetraedriske koordinasjonen av Co2+, i sfaleritt, Co2+ er koblet til svovel og viser grønt, mens i spinell er Co2+ er koblet til oksygen, som vises i blått.
(6) Samme type fargede ioner med samme valenstilstand, koordinasjonsgeometri og tilstøtende atomer viser forskjellige farger i forskjellige edelstener. Forvrengningen av koordinasjonsgeometrien forårsaket av de forskjellige kjemiske sammensetningene av edelstenene endrer arten av de kjemiske bindingene mellom sentralionet og de koordinerende ligandene, noe som endrer overgangsenergien til d-elektronene. For eksempel kan Cr3+ fremstår rød i rubin, grønn i smaragd og viser varierende farger i aleksandritt. Årsaken til slike endringer i Cr3+ er relatert til dens egenskaper og de tilstøtende koordinerende ligandene, med spesifikk funksjonsanalyse som følger.
① Cr3+ Kjennetegn:
Cr3+ har en ytre elektronskallstruktur på 3s23p63d3, med 11 elektroner i det ytre skallet, som tilhører en uregelmessig (8-18) elektronskallstruktur.
Denne strukturen har en mindre skjermingseffekt på kjernen enn 8-elektronskallstrukturen, noe som resulterer i Cr3+ har en høyere effektiv positiv ladning, samtidig som dens ionradius også er mindre, noe som utgjør de grunnleggende egenskapene til Cr3+: et sterkt positivt elektrisk felt og tomme d-orbitaler. Cr3+ kan gi seks tomme orbitaler for å romme seks koordinerende ligander, med en romlig konfigurasjon av oktaedrisk, som tilhører d2sp3 hybridisering (figur 3-21).
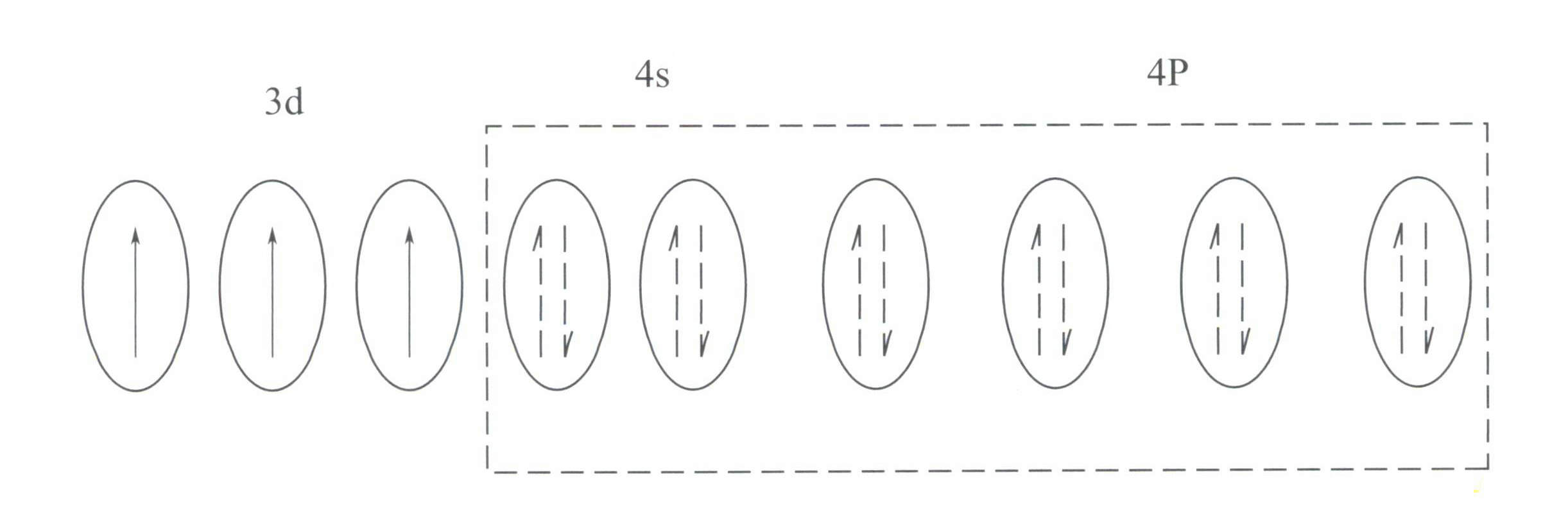
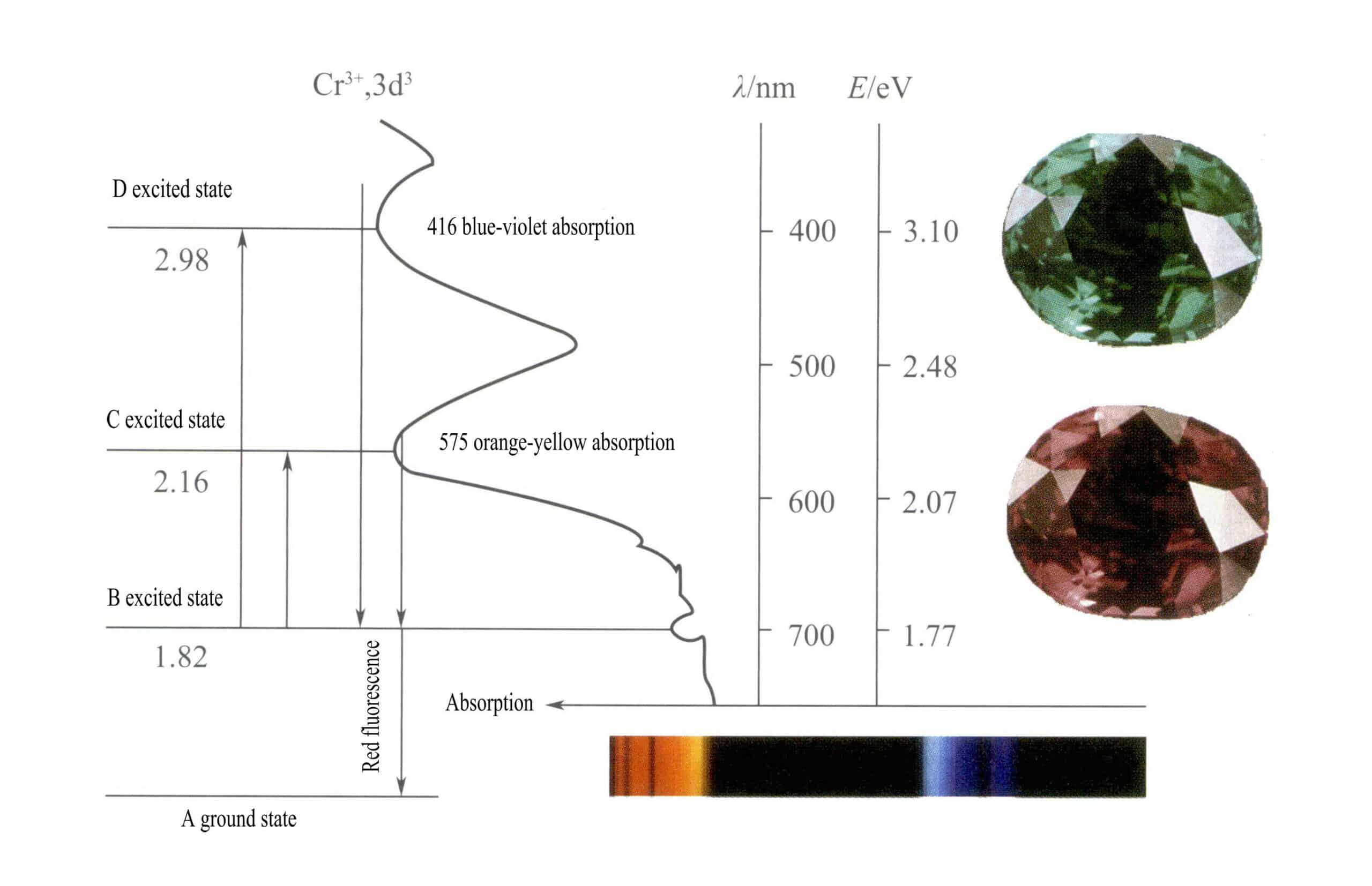
Ifølge krystallfeltteori vil d-orbitalene til Cr3+ kan splittes i lavere energi dƐ bane og høyere energi dr kretsløp. Siden de tre d-elektronene i Cr3+ er alle i dƐ orbital og alle er enkeltelektroner, kan d-d-overganger forekomme under synlig lys, noe som fører til at edelstener som inneholder Cr3+ til å vise farge.
② Fargemekanismen til Cr3+:
I rubin Den viktigste kjemiske komponenten i rubin er Al2O3. Når noen få prosent av Cr3+ erstatter Al3+gir den en lys rød farge. I strukturen av rubin, på grunn av den større radius av Cr3+ sammenlignet med radiusen til Al3+, Cr3+ kommer inn i korundgitteret, noe som reduserer symmetrien rundt aluminiumoksid.
D-orbitalene til Cr3+ Når elektronene i eksitert tilstand skal vende tilbake fra D eller C til grunntilstanden A, må de først passere gjennom B, noe som frigjør varme. De returnerer fra B til A, ledsaget av luminescens, og avgir rød fluorescens. I denne prosessen absorberer elektronene lysenergi, noe som fører til at rubin absorberer D fiolett (400 nm) og C gulgrønn (555 nm) i det synlige spekteret (figur 3-22), og danner et absorpsjonsbånd.

Når hvitt lys passerer gjennom en rubin, absorberes fotoner i spekteret fra lilla til gulgrønt, mens nesten alt rødt lys og noe blått lys slipper gjennom, noe som gir rubinen en dyp rød farge med et snev av lilla, kjent som dueblodrød.
Rubiner har en kortvarig B-nivåabsorpsjon, manifestert som rød fluorescens. Denne B-nivåabsorpsjonen som gir rød fluorescens, gjør rubinens farge mer levende; jo høyere kromioninnholdet er, desto sterkere er fluorescensen.
Jernioner i edelstenen kan undertrykke fluorescensen av B-nivåabsorpsjon, noe som forklarer fenomenet med rubiner som ser mørkere ut når de inneholder jernforurensninger.
③ Cr3+ Fargemekanismen i smaragder
Den viktigste kjemiske komponenten i smaragd er Be3Al2Si6O18, Cr3+, som erstatter Al3+ i smaragdgitteret, og Cr3+ er også omgitt av et oktaeder bestående av seks oksygenioner, der Cr3+-O-bindingslengden er også ganske lik den i rubiner. Sammenlignet med rubiner har smaragder imidlertid to flere ioner, Be2+ og Si4+. I smaragdens struktur øker den kovalente bindingen mellom metalloksider, mens de ioniske egenskapene svekkes.
Mindre endringer som kjemiske bindinger fører til en liten reduksjon i Cr3+C-nivå og D-nivå, noe som resulterer i en liten forskyvning av absorpsjonsbåndet (figur 3-23), noe som blokkerer transmisjonen av blålilla (425 nm) og oransjegult (608 nm) lys i spekteret, samtidig som det øker transmisjonen av blågrønt lys, og dermed danner den karakteristiske smaragdgrønne fargen.

B-nivåabsorpsjonen av dioptase er nesten uendret. Når urent jern ikke har noen "hemmende" effekt i smaragdkomponenten, får den sterke røde fluorescensen den karakteristiske smaragdgrønne fargen til å skinne enda klarere.
④ Cr3+ Fargemekanismen i alexandritt:
Fargen på aleksandritt er også forårsaket av Cr3+ erstatter Al3+ i forvrengt oktaedrisk koordinasjon. På grunn av den kjemiske sammensetningen av alexandritt, som er BeAL2O4På grunn av de kjemiske bindingene mellom metall-oksygenionene ligger den mellom rubin og smaragd. Derfor ligger absorpsjonsbåndene også mellom rubin og smaragd, med omtrent like stor transmisjonssannsynlighet for blåfiolett og oransjegult lys, noe som gjør det umulig å avgjøre om det er rødt eller blågrønt lys som dominerer (figur 3-24).
Derfor kan fargen på aleksandritt bare avhenge av energifordelingen og fargespekteret til det innfallende lyset, noe som resulterer i den "fargeskiftende effekten" av aleksandritt, dvs. at den ser grønn ut i dagslys med en høy blå lyskomponent og rød i glødelys med en høy rød lyskomponent. Derfor kalles aleksandritt ofte "dagens smaragd og nattens rubin".
"Fargeendringseffekten" vises i mange typer edelstener, for eksempel fargeskiftende korund og fargeskiftende granat. For tiden produseres kunstig syntetisert fargeskiftende korund ved hjelp av prinsippet om fargeendring, med V3+ som fargeion for syntese.
3. Farger på edelsteinsmineraler
Fargene som produseres av overgangsmetallkomponenter, kan utledes av den kjemiske sammensetningen av edelstenmineraler. For eksempel inneholder turkis Cu2+ må være blå, mens Cu+ er fargeløs. Tabell 3-11 viser fargene som produseres av vanlige overgangsmetallkomponenter i naturlige edelstenmineraler.
Tabell 3-11 Farger fremstilt av overgangsmetallkomponenter i naturlige edelstenmineraler
| Element | Farge | Vanlige mineraler |
|---|---|---|
| Cerium (Ce) | Gul | Parisitt |
| Krom (Cr) | Rød, grønn, oransje osv. | Krokoisitt, rød krokoisitt, uvarovitt |
| Kobolt (Co) | Blå | Syntetisk spinell |
| Kobber (Cu) | Blå, Grønn | Azuritt, krysokoll, turkis malakitt, dioptas |
| Jern (Fe) | Rød, grønn, gul | Almandin, olivin, goethitt |
| Mangan (Mn) | Rosa, oransje | Rhodonitt, spessartin |
| Nikkel (Ni) | Grønn | Bunsenitt, Kalcedon |
Fargen på de fleste edelstener skyldes urenheter i overgangsmetallene de inneholder. Rubiner ser for eksempel røde ut på grunn av spormengder av Cr3+. Ulike faktorer påvirker fargen forårsaket av urenhetsioner i edelstenen. Derfor kan urenheter gi forskjellige farger i forskjellige edelstener. For eksempel kan Cr3+ fremstår rød i rubiner og grønn i smaragder.
Det er ikke nødvendigvis de samme urenhetene som forårsaker den samme fargen på en edelsten. For eksempel er den grønne fargen på de fleste smaragder forårsaket av Cr, mens noen smaragders grønne farge helt eller delvis er forårsaket av vanadium (V).
Krystallfeltteorien kan ikke bare brukes til å forklare edelstensfargene som produseres av overgangsmetallkomponenter eller urenheter, men også fargene som produseres av strukturelle defekter (fargesentre); den spesifikke prosessen for fargegenerering kan du lese mer om i kapittel 3.3 i denne boken.
Det er også mangler i forklaringen av edelstenmineralfarger ved hjelp av krystallfeltteori, hovedsakelig reflektert i følgende aspekter:
(1) Elektronene til sentralionet d er ikke fullstendig lokalisert i sine opprinnelige orbitaler. De kan også dukke opp rundt de koordinerende atomene, noe som indikerer en kovalent interaksjon mellom sentralatomet og ligandene.
(2) Den tar bare hensyn til den elektrostatiske ioniske interaksjonen mellom sentralatomet og ligandene, og ignorerer fullstendig den kovalente bindingsinteraksjonen mellom sentralatomet og ligandene. I fysisk forskning avviker resultatene av kvantitative beregninger ofte betydelig fra faktiske situasjoner.
(3) Årsakene til fargen på edelstenmineraler, i tillegg til samspillet mellom sentralionet og ligandene, kan også skyldes den kombinerte effekten av strukturelle defekter og krystallfeltet.
Del II Molekylorbitalteori
Mulliken og Hund foreslo opprinnelig molekylorbitalteorien (MO-teorien). Gjennom kontinuerlig utforskning av mange forskere har den utviklet seg til en moden teori. Molekylorbitaler (MO) kan dannes ved lineære kombinasjoner av atomorbitaler, en vanlig metode for å konstruere molekylorbitaler. Fra n atomorbitaler kan man få n molekylorbitaler, og de lineære kombinasjonskoeffisientene kan bestemmes ved hjelp av variasjonsmetoden eller andre metoder. Molekylorbitaler dannet av to atomorbitaler, med energinivåer som er lavere enn energinivåene til atomorbitalene, kalles bindingsorbitaler; de med energinivåer som er høyere enn atomorbitalene kalles antibindingsorbitaler; de med energinivåer nær atomorbitalene kalles generelt ikke-bindende orbitaler.
Molekylorbitalteori er en teori som brukes til å forklare spørsmål som molekyldannelse, struktur og egenskaper. Den kan også forklare noen av årsakene til edelsteners farger, som er utviklet på grunnlag av krystallfeltteori og molekylorbitalteori for overgangsmetaller. Molekylorbitaler er en naturlig forlengelse av atomorbitaler. I et molekyl tilhører elektronene ikke lenger et bestemt atom, men beveger seg over hele molekylområdet, og derfor beskrives elektronenes bevegelse i et molekyl ved hjelp av molekylorbitaler.
1. Grunnleggende konsepter i molekylorbitalteori
Molekylorbitalteorien går ut på at etter at atomene har dannet et molekyl, tilhører elektronene ikke lenger de opprinnelige atomorbitalene, slik krystallfeltteorien foreslår, men beveger seg innenfor bestemte molekylorbitaler. Molekylorbitaler utgjør et molekyl på samme måte som atomorbitaler utgjør et atom. Valenselektronene er ikke lenger lokalisert innenfor de enkelte atomene, men beveger seg gjennom hele molekylet. Elektronfordelingen i molekylet kan behandles i henhold til prinsippene for elektronfordeling i atomer (prinsippet om minsteenergi og Hunds regel).
Den lineære kombinasjonen av atomorbitaler i et molekyl danner molekylorbitaler. Antallet molekylorbitaler er lik antallet atomorbitaler før kombinasjonen. Kombinasjonen av atomorbitaler til effektive molekylorbitaler må følge følgende tre prinsipper:
(1) Prinsippet om symmetritilpasning: Bare atomorbitaler med samme symmetri kan danne molekylorbitaler.
(2) Prinsippet om energinærhet: Bare atomorbitaler med lik energi kan kombineres for å danne effektive molekylorbitaler.
(3) Prinsippet om maksimal overlapping: Ved symmetrimatching vil energien til de resulterende molekylære orbitalene synke mer jo større overlappingen av atomorbitalene er, og jo mer stabil den kjemiske bindingen blir.
Molekylorbital ψ er bølgefunksjonen til et enkelt elektron. Den kan representeres som en lineær kombinasjon av atomorbitaler, der hver orbital tilsvarer en bestemt energi, som er summen av den kinetiske og potensielle energien til elektronet som beveger seg i det molekylære elektriske feltet. To atomorbitaler, a og b, produserer gjennom overlappende lineære kombinasjoner to molekylorbitaler ψI og ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Når molekylorbitaler med elektroner fylles først, vil bindingsorbitalene ψI fylles først. Når elektroner fyller molekylorbitaler med lik energi, skal de ifølge Hunds regel også fylle ulike molekylorbitaler med samme spinnretning i så stor grad som mulig.
De molekylære orbitalene ψI som oppnås ved å legge sammen to atomorbitalfunksjoner (ligning 3-5), kalles bindende molekylorbitaler. De molekylære orbitalene ψII som oppnås ved å trekke fra to atomorbitalfunksjoner (ligning 3-6), kalles antibindende molekylorbitaler. Energien til de bindende molekylorbitalene er lavere enn energien til de antibindende molekylorbitalene og lavere enn energien til de to opprinnelige atomorbitalene. Akkurat som ved fylling av atomorbitaler, blir elektronene ved fylling av molekylorbitaler først plassert i bindingsorbitaler, og en molekylorbital kan romme to elektroner med motsatt spinn. Når elektroner fyller molekylorbitaler med lik energi, bør de i henhold til Hunds regel også oppta forskjellige molekylorbitaler med samme spinnretning så mye som mulig. Molekylorbitalene som dannes av to s-atomorbitaler, er vist i figur 3-25.

p-orbitaler og d-orbitaler kan også danne molekylorbitaler med forskjellige energinivåer; for eksempel kan kombinasjonen av toatomige molekylorbitaler i O2 molekyler er relativt komplekse.
I eksperimenter ble de magnetiske egenskapene til disse to enkeltelektronene målt, noe som gir sterk støtte til teorien om molekylorbitaler. I motsetning til molekyler som består av de samme atomene, har molekyler som består av to eller flere forskjellige atomer mer komplekse energinivåer i molekylorbitalene, men prinsippet er det samme.
2. Fargeegenskaper for ladningsoverføring
Denne teorien om molekylorbitaler, der hele molekylet deler elektroner, betraktes også som overgangen av elektroner fra en atomorbital til en annen, kjent som ladningsoverføring. Ladningsoverføring kan forekomme i metall-metall- (M-M), ikke-metall-ikke-metall- (L-L) og ikke-metall-metall- (L-M) interaksjoner. Blant disse to bindingstypene er L-L og M-L ofte primært kovalente bindinger. O2 tilhører L-L-ladningsoverføring, som er en kovalent binding.
(1) Metall-metall-ladningsoverføring (M - M-ladningsoverføring)
Denne typen ladningsoverføring skjer vanligvis mellom vanlige overgangsmetallioner. De fleste av fargestoffene i fargede edelstener er produsert av metall-metall-ladningsoverføring. M-M-ladningsoverføring inkluderer hovedsakelig følgende typer: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Ladningsoverføring mellom metaller deles inn i to typer: ladningsoverføring mellom homonukleære atomer og ladningsoverføring mellom heteronukleære atomer.
① Ladningsoverføring mellom isoelektroniske atomer
Ladningsoverføring mellom isoelektroniske atomer skjer mellom to atomer av samme overgangsmetall i ulike oksidasjonstrinn. For eksempel kan Fe2+ og Fe3+ gjennomgår ladningsoverføring under forskjellige redoksforhold, absorberer energi og produserer farge. Den blålilla fargen på iolitt oppstår ved ladningsoverføring av jernioner i ulike oksidasjonsnivåer. Fe3+ og Fe2+ er i henholdsvis tetraedrisk og oktaedrisk posisjon, med to ligander forbundet med kanter. Når synlig lys skinner på iolitt, vil ett d-elektron av Fe2+ absorberer lys av en viss energi og går over til Fe3+Den absorberer gult lys ved 588 nm og gir en blå-lilla farge. Akvamarin, grønn turmalin og andre kan også vise farge på grunn av ladningsoverføring mellom jernioner.
② Ladningsoverføring mellom heteroatomer
Blå safirer er det mest typiske eksemplet på fargen som oppstår ved ladningsoverføring mellom to typer overgangsmetallioner. Koordinasjonspolyedrene av overgangsmetallioner er forbundet med kanter eller flater, noe som muliggjør ladningsoverføring mellom metallene.
I safirer, for eksempel, når jernioner og titanioner går inn i de sammenkoblede oktaedrene, eksisterer både Fe og Ti i to oksidasjonsnivåer:
Fe2+ + Ti4+ lav energi (3-7)
Fe3+ + Ti3+ høy energi (3-8)
Overgangen fra ligning (3-7) til ligning (3-8) krever at en viss mengde lysenergi absorberes, noe som resulterer i et bredt absorpsjonsbånd som spenner fra gult til rødt. Det meste av det blå lyset passerer derimot gjennom edelstenen, noe som gir den et blått utseende.
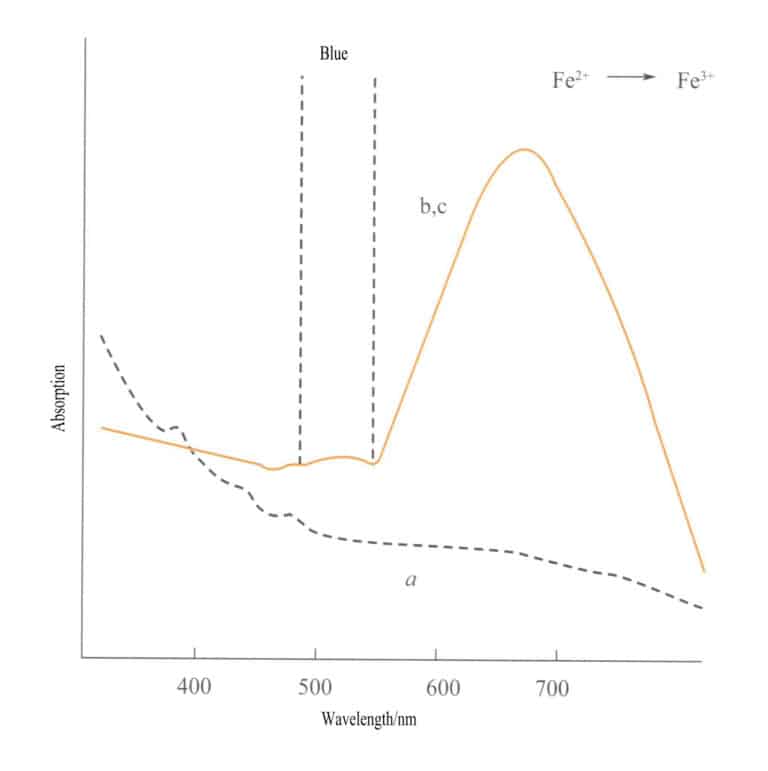
Ladningsoverføring mellom ulike valenstilstander har en sterk retningsbestemt karakter, og edelstener som har farge på grunn av denne mekanismen, viser ofte pleokroisme. For eksempel er akvamarin farget av Fe2+→ Fe3+ ladningsoverføring viser farge strengt langs den optiske akseretningen. Figur 3-26 viser at akvamarin fremstår som gul i b- og c-planene. Samtidig er det ingen slik overføring langs a-aksen, noe som resulterer i ingen lysabsorpsjon og derfor ingen farge langs a-aksen.
(2) Ladningsoverføring fra ikke-metall til metall (L-M)
Denne typen L-M-ladningsoverføring skjer ofte mellom oksygen og metallioner, og noen oksygenholdige edelstener er farget av ladningsoverføring fra ikke-metall til metall, for eksempel O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
I absorpsjonsspekteret til enkle jernoksider (figur 3-27) vises to svake absorpsjonsbånd i det infrarøde området for ilmenitt, hematitt og lepidokrocitt (d - d elektroniske overganger). Et sterkt absorpsjonsbånd opptrer i det kortbølgede området, produsert av O2-→Fe3+ ladningsoverføring, og dette absorpsjonsbåndet bestemmer de karakteristiske fargene til disse forbindelsene: rødbrun, brun og gulbrun.
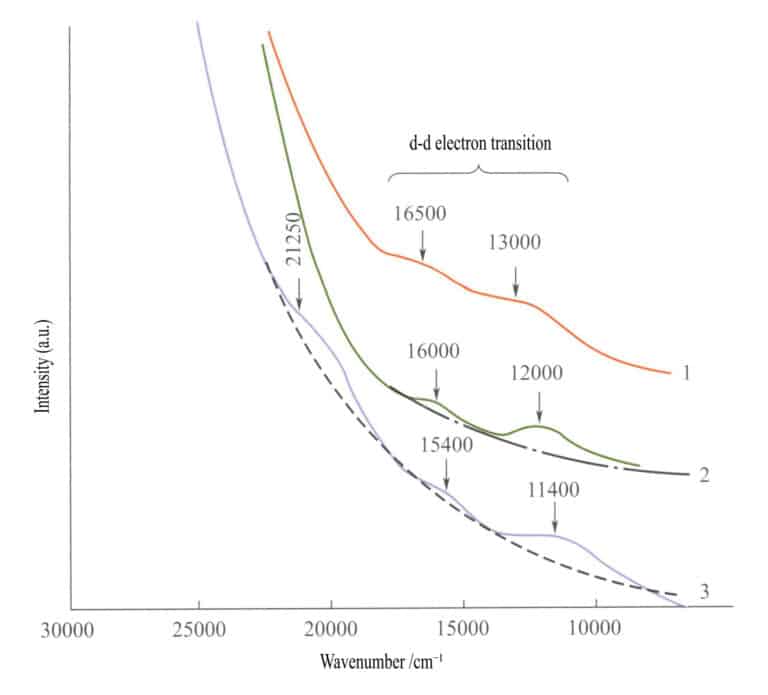
1 - Iilmenitt; 2 - Hematitt; 3 - Lepidokrokitt
Gul beryll får fargen sin fra O2–→ Fe3+ ladningsoverføring. I strukturen til gul beryll er O2–→ Fe3+ sterk ladningsoverføringsabsorpsjon kan strekke seg fra den ultrafiolette enden og inn i den blå enden av det synlige spekteret, og absorbere lilla og blått, noe som resulterer i en gul farge.
Safir, som har et helt annet koordinasjonsmiljø enn beryll, kan også produsere de samme spektrale absorpsjonsbåndene som beryll, noe som resulterer i gult, som også er et resultat av O2–→ Fe3+ ladningsoverføring.
Ifølge krystallfeltteorien inneholder noen edelsteinsmineraler ikke uparede elektroner og kan derfor ikke produsere farge. For eksempel kan de elektroniske lagene i krokoitt (PbCrO4), Pb2+, Cr6+, og O2– er fulle. Likevel, i CrO42- atomklyngen er "molekylære orbitaler", som tilsvarer de eksiterte tilstandene under O2-→Cr6+ overføring, danner absorpsjonsbånd og gir oransje farge.
L→M Ladningsoverføring omfatter også overføring av svovel til metall, som i vanlig pyritt; dette optiske fenomenet som forårsakes av overføringen, er lettere å forstå når det diskuteres ved hjelp av båndteori.
(3) Ladningsoverføring fra ikke-metall til ikke-metall (L-L)
Molekylær orbitalteori antyder at den dypblå fargen til lapis lazuli skyldes eksitasjonsenerginivåene til S3- atomgruppe.
I grafitt er ringene av seks karbonatomer ordnet i lag. Elektronene kan til en viss grad bevege seg fritt langs disse lagene, noe som resulterer i sterk lysabsorpsjon, anisotropi og ledningsevne.
Noen organiske edelstener, som rav og perler, har elektroner som beveger seg og eksiterer gjennom atomgruppene til organiske pigmenter i delte molekylorbitaler, noe som forårsaker absorpsjon av synlig lys og gir farge. For eksempel den "honninggule" fargen i rav, fargene i koraller og noen skjell og fargede perler.
Fargemekanismene til vanlige edelstener er vist i tabell 3-12.
Tabell 3-12 Klassifisering av fargemekanismer for vanlige edelstener
| Ladningsoverføring mellom metall og metall | Fe2+ - Fe3+ /Fe3+ - Fe2+ : iolitt (blå), berthieritt (blå), magnetitt (svart) osv. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Kyanitt (blå), Safir (blå) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganitt (svart), Bixbyitt (svart) | |
| Ladningsoverføring fra ikke-metall til metall | O2- -Fe3+: Gullgul beryll, gullgul safir, ilmenitt, hematitt, lepidokrocitt, etc. |
| O2- - Cr6+: Krokoitt (oransje) | |
| O2- -V5+:Vanadinitt (oransje) | |
| Svovel til metall: pyritt, marcasitt, etc. (se halvleder med gap) | |
| Ikke-metall - ikke-metallisk ladningsoverføring | S3-: Lapis lazuli (blå) |
| Π elektronisk: grafitt (svart) | |
| Fargene til noen organiske edelstener som rav og korall. |
Copywrite @ Sobling.jewelry - Tilpasset smykkeprodusent, OEM og ODM smykkefabrikk
Del III Energibåndteori
Energibåndteori er en kvantemekanisk modell for å studere edelstenematerialer, som er en videre forlengelse og utvidelse av molekylær orbitalteori. Studiet av energibåndteori kan bedre forklare fargemekanismen til noen naturlig fargede edelstener.
1. Grunnleggende begreper innen energibåndteori
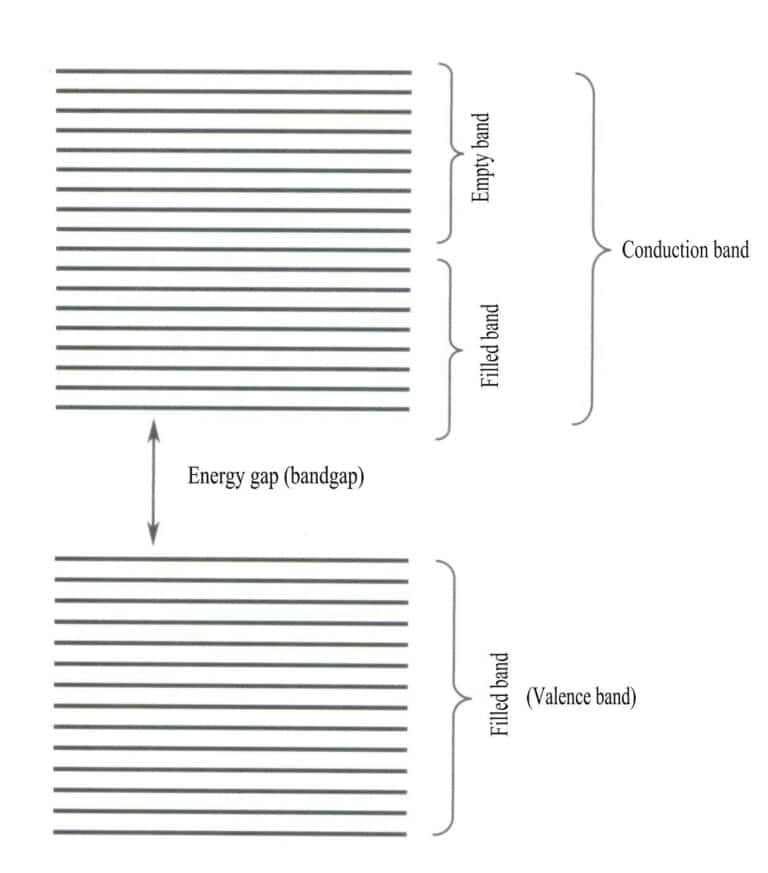
Energibåndteori er en tilnærmet teori som brukes til å studere lovene for elektronbevegelse i faste stoffer. Faste stoffer består av atomer, som inkluderer atomkjerner og de ytterste elektronene, som alle er i konstant bevegelse. Båndteorien går ut på at elektronene i faste stoffer ikke er bundet til et spesifikt atom, men er felles for hele krystallen og beveger seg innenfor det periodiske potensialfeltet i krystallens tredimensjonale rom. Elektronenes bevegelsesområde ligger innenfor gitterets periodiske potensialfelt, noe som gjør at den romlige fordelingen av elektronbaner kan være større enn for molekyler og nå et maksimum. Energinivåene til de enkelte elektronene utvides til energibånd.
Båndteori diskuterer hovedsakelig elektronoverganger mellom ikke-lokale tilstander, der alle valenselektroner skal tilhøre hele gitteret i et fast stoff. Ifølge båndteorien kan faste materialer deles inn i ulike energibånd basert på om atomorbitalene er fylt: Et fylt bånd dannes av energinivåene til atomorbitaler som er fullt besatt av elektroner, og representerer et lavenergibånd; et tomt bånd dannes av energinivåer som ikke er fullt besatt av elektroner, og representerer et høyenergibånd. Energidifferansen mellom disse to båndtypene kalles "båndgapet" (figur 3-28).
Når alle energibåndene i et materiale er fylt, er det ikke ledende; når det er delvis fylt med elektroner, er det ledende. Gitterdefekter introduserer ekstra energinivåer i krystallen, slik at elektroner kan komme inn i disse energinivåene, noe som resulterer i betinget ledningsevne.
2. Kjennetegn ved båndgap-overganger
Noen edelstenmineraler inneholder grunnstoffer fra gruppe IV A i det periodiske systemet, for eksempel diamant og moissanitt, som primært binder kovalent. Det finnes også andre mineraler, som kadmiumsulfid (CdS), hvis farger kan forklares ved hjelp av båndteori.
Elektroner absorberer lysenergi og beveger seg mellom valens- og ledningsbåndet, noe som danner "interne båndoverganger". Sannsynligheten for overganger er nært knyttet til energiforskjellen mellom valens- og ledningsbåndet, kjent som båndgapsenergien (Eg) (Figur 3-29).

Figur 3-29 (a) er et typisk bånddiagram for halvledere. Basert på størrelsen på krystallens båndgapsenergi kan den deles inn i tre typer: bredt båndgap, smalt båndgap og middels båndgap. Et bredt båndgap har en båndgapsenergi som er større enn energien til synlig lys; når båndgapsenergien overstiger energien til synlig lys, absorberes ikke synlig lys og passerer helt gjennom, noe som gjør mineralet fargeløst. For eksempel er båndgapsenergien til diamant Eg er ca. 5,5eV, noe som gjør den fargeløs.
Båndgapsenergien i materialer med smalt båndgap er mindre enn energien i synlig lys, noe som fører til at alt synlig lys absorberes og gir mørke grågrønne eller svarte farger. For eksempel er båndgapsenergien til galena Eg mindre enn 0,4 EV, som ser ut til å være blygrå. Når denne "smalbåndshalvlederen" har en passende geometrisk form, har den likerettende og forsterkende egenskaper.
Energien til materialer med middels båndgap ligger nøyaktig innenfor det synlige lysområdet, og edelstenmineraler har ulike farger. Fargesekvensen er vist i figur 3-29 (c), og spenner fra rødgult til grønnblått til lilla. For eksempel er båndgapsenergien (Eg) til kadmiumsulfid (CdS) er ca. 2,5 EV, som absorberer blått og fiolett lys og fremstår som gult. Båndgapsenergien til cinnober er ca. 2,5 EV, noe som gjør at bare rødt lys slipper gjennom, og dermed ser rødt ut. Båndgapsenergien til orpiment er ca. 2,5eV, og ser gul ut.
En annen kategori av naturlige edelstener som kan forklares ved hjelp av båndteori, er fargen på materialer med bredt båndgap som inneholder urenheter. For eksempel er båndgapsenergien til en diamant med urenheter f.eks. ca. 5,5eV, og synlig lys absorberes ikke når det passerer gjennom diamanten; ren diamant er fargeløs, men situasjonen endrer seg når den inneholder urenheter.
(1) Fargemekanismen til gule diamanter
Nitrogenatomer erstatter karbonatomene. Siden nitrogenatomer har ett elektron mer enn karbonatomer, danner dette ekstra elektronet et energinivå i båndgapet som kalles donorenerginivået, der nitrogenatomer fungerer som "donorer".
Eksistensen av dette urenhetsnivået reduserer energien i båndgapet til 4eV[ [Figur 3-30 (a)]. Den kan være enda lavere, slik at den kan absorbere ultrafiolett lys og litt av det fiolette 3V-lyset, noe som får diamanten til å se gul ut.
Denne effekten er sterk; med ett nitrogenatom for hver hundretusen karbonatomer kan diamanten bli dyp gul. Men reduksjonen i båndgapet er likevel ikke tilstrekkelig til å gjøre diamanten ledende ved romtemperatur.
(2) Mekanisme for farge i blå diamanter
Siden bor har ett elektron mindre enn karbon, danner det et "akseptornivå" i båndgapet til diamant. Det har ikke ekstra elektroner, men det kan ta imot elektroner fra valensbåndet i en diamant, noe som skaper hull i valensbåndet [Figur 3-30 (b)] og danner et urenhetsenergibånd ca. 0,4eV over valensbåndet, kjent som akseptornivået.

Akseptorenerginivået er ikke enkelt; det er en kompleks struktur av urenhetsenergibånd som kan produsere blått. Akseptorenerginivået skaper "hull" i valensbåndet, noe som gjør at denne "hullet" av type II b blå diamant kan lede strøm.
Ett boratom blant hver million karbonatomer kan danne blått. På grunn av det høyere aluminiuminnholdet i denne blå diamanten, og fordi aluminium har ett elektron mindre i det ytre laget enn karbon, trodde man tidligere at det var aluminium som spilte rollen som akseptor. Nåværende eksperimenter har likevel vist at det er bor, ikke aluminium.
Type II b konduktive blå diamanter er naturlig blå, og deres konduktivitet er en av forskjellene fra bestrålte blå diamanter (fargesentre). Denne egenskapen brukes ofte til å skille mellom de to diamanttypene. Gule nitrogendonor-diamanter leder imidlertid ikke strøm, så denne metoden kan ikke brukes til å skille dem fra bestrålte gule diamanter.
3. Edelsteinsmineraler farget av båndoverganger
Energibåndteorien kan forklare en del av fargedannelsen i naturlige edelstener. Siden båndgapsenergien er en iboende egenskap ved krystallen og ikke endres på grunn av ytre forhold, har fargen på edelstener god stabilitet. Krystallens ledningsevne kan bestemmes ut fra om energibåndene i krystallen er fylt med elektroner. Tabell 3-13 viser hvilke typer edelstensfarger som kan forklares ved hjelp av båndteori og deres ledningsevne.
Tabell 3-13 Typer edelstensfarger forklart ved hjelp av båndteori og deres ledningsevne
| Konduktorer (metallfarger og metallglans) | Element | Kobber, gull, jern, sølv, kvikksølv osv. |
| Legering | Amalgam, meteoritt nikkel jern | |
| Halvleder | Smalt båndgap | Ugjennomsiktig grå til svart: altaitt, galenitt |
| Ugjennomsiktig metallisk farge: koboltin, marcasitt, pyritt, smaltitt | ||
| Moderat båndgap | Rød: cinnober, proustit, pyrargyritt | |
| Orange: Realgar | ||
| Gul: Kadmiumsulfid, realgar, svovel | ||
| Bredt båndgap | Fargeløs: diamant, sfaleritt | |
| Halvledere med bredt båndgap som inneholder urenheter | Donorforurensning: Nitrogendopet diamant (gul) | |
| Urenheter i verten: Borholdig diamant (blå) |
Fargen på edelstener forårsaket av båndoverganger er relatert til strukturen og bindingstypen på tidspunktet for dannelsen av edelstenen. Den har liten sammenheng med senere urenheter og krystalldefekter. Størrelsen på båndgapsenergien til edelstener er fast. Den endres ikke med egenskapene til edelstenematerialet, så konvensjonelle optimaliseringsmetoder kan generelt ikke forbedre fargen på edelstener.
Del IV Fysisk-optiske effekter
De fleste naturlige edelstener kan forårsake selektiv absorpsjon av lys, og forskjellige edelstener absorberer synlig lys ved forskjellige bølgelengder, noe som resulterer i forskjellige farger. I tillegg til selektiv lysabsorpsjon kan den indre strukturen i edelstenkrystaller også forårsake fysiske optiske effekter, noe som fører til ulike farger i edelstener.
1. Edelsteinsmineraler relatert til fysiske optiske effekter
Fargene som produseres av fysisk-optiske effekter, dannes på grunn av spredning, interferens, diffraksjon og andre årsaker til lys forårsaket av krystallstrukturen eller sammensetningen og inneslutninger. Dette er bare en optisk effekt som kan forklares ved hjelp av fysisk optisk teori. Forskjellige edelstener kan produsere forskjellige farger under de samme optiske effektene. I tillegg til de vanlige sporelementene som forårsaker farge, er årsakene til farger produsert av fysiske optiske effekter hovedsakelig relatert til edelstenens indre struktur og fysiske egenskaper. Tabell 3-14 viser hvilke typer edelstenmineraler som forårsaker farger på grunn av fysisk-optiske effekter.
Tabell 3-14 Typer edelstenmineraler forårsaket av fysisk-optiske effekter
| Funksjon | Optiske egenskaper og farge | Edelsteinmineraler |
|---|---|---|
| Dispergering Spredning | Skimrende | "Ild" i spredte edelstener, som diamanter, zirkon, rutil og strontiumtitanat |
| Blå | Månestein, blå kvarts, opal | |
| Lilla | Fluoritt (spredning av mikrokrystaller av kalsium) | |
| Rød | Rubinglass, spredning av mikrokrystaller av kobber eller gull | |
| Hvit | Melkekvarts | |
| Cat's eye-effekt | katteøyeakvamarin, katteøyepyroksen osv. | |
| Stjernelys-effekt | Ulike stjerneeffekter av korund og granat | |
| Glans | Glans av perler, apofyllitt osv. | |
| Sparkle | Glitter av aventurin, obsidian osv. | |
| Interferensdiffraksjon | De rene spektralfargene til tynnfilm | Regnbuen av kobberkis, den misfargede filmen i en irisspalte av kvarts |
| Interferenseffekter | Fargeendring av opal, effekten av labradoritt | |
| Inkludering | Blå | Dumortieritt i kvarts |
| Grønn | Grønn kalcedon og nikkelårer i grønn kalcedon, fuchsitt i stjernekvarts | |
| Oransje | Hydratisert jernoksid i ildopal og kjøttfarget kalcedon | |
| Rød | Hematittflak i ortoklas |
2. Interferens- og diffraksjonseffekter
(1) Interferenseffekter
Interferensfenomener oppstår når to lysstråler forplanter seg langs samme optiske bane eller i parallelle retninger. Et vanlig interferensfenomen i edelstener er irisering. I iriserende kvarts, for eksempel, avhenger interferensfargene av filmens tykkelse, filmens brytningsindeks og arten av det innfallende lyset.
Perlenes interferensfarger dannes ved at to stoffer med ulik brytningsindeks (aragonitt og nacrum) overlapper hverandre i konsentriske lag, der det innfallende lyset reflekteres fra overflatene mellom de vekslende lagene, og det reflekterte lyset interfererer med det innfallende lyset og gir vakre interferensfarger.
(2) Diffraksjonseffekter
Diffraksjon er det fysiske fenomenet der lysbølger avviker fra sin opprinnelige rettlinjede forplantning når de støter på hindringer. I fysikken bøyes og spres lysbølger i varierende grad når de passerer gjennom hindringer som f.eks. spalter, små hull eller skiver. Hvis det plasseres en hindring mellom lyskilden og observasjonsskjermen, vil det oppstå lyse og mørke områder på observasjonsskjermen, og grensene mellom disse områdene er ikke skarpe, slik at det dannes et komplekst mønster av lys og mørke. Dette fenomenet kalles diffraksjon. Slike fenomener kan oppstå når lysbølger møter hindringer langs spredningsveien. Den viktigste faktoren for diffraksjon er tilstedeværelsen av periodisk fordelte diffraksjonsgitter i edelsteinsmineraler.
① Opal fargeendring
I opal har de vannholdige silikakulene like store diametre og er ordnet i en regelmessig vekslende lagstruktur som danner periodisk fordelte diffraksjonsgitter. Når lys kommer inn i opalen, oppstår det diffraksjon som endrer farge (figur 3-31, 3-32). Fargetypene og graden av fargeendring avhenger hovedsakelig av avstanden mellom de stablede silikakulene.

For eksempel har opal med en flatsentrert kubisk flat plate-struktur og en gitteravstand på 3×10-10m viser farger fra grønt til rødt; denne typen opal med en gitteravstand på 2,5×10-10m viser farger fra blått til gult.
② Labradorite Effect
Labradoritt har også effekter som ligner på opal (figur 3-33). Labradoritt er også kjent som spektrolitt fordi den kan blinke med solens fargerike lys. Ulike typer labradoritt fra Finland kan vise en rekke spektralfarger, et fenomen som kalles "labradoritteffekten". Fargeendringseffekten i labradoritt skyldes små mellomlagssmelter av plagioklas med ulik sammensetning. De små forskjellene i brytningsindeks mellom de ulike feltspatene fører til interferens og diffraksjon av lys, noe som resulterer i luminescens og fargeforandring. Fargene som produseres av denne strukturen, er relatert til den relative tykkelsen på lagene og brytningsindeksene deres. Av og til viser andraditt fra Mexico også diffraksjonsfenomener.

3. Spredning og inneslutninger
(1) Spredning
Spredning oppstår vanligvis når den indre strukturen i edelstenematerialer er uregelmessig, eller når størrelsen på komponentene overskrider grensene for diffraksjonsforholdene. Fargeeffektene som oppstår ved spredning, er relatert til partikkelstørrelsen og formen på edelstenematerialet. Når innfallende lys interagerer med uregelmessig ordnede partikler som er mindre enn bølgelengden til synlig lys, er de overførte høyenergiske lysbølgene sterkere enn de lavenergiske lysbølgene, noe som betyr at det i de fleste tilfeller bare er lilla og blått som kan sees. For eksempel kan SiO2 små kuler i opal har diametre som er mindre enn bølgelengden til synlig lys, og når størrelsen på de spredende partiklene er nær bølgelengden til synlig lys, kan det også oppstå spredningsfarger.
Lilla fluoritt skyldes for eksempel at radioaktiv bestråling driver ut fluoratomer, slik at kalsiumatomer som binder seg til fluoratomer, kondenserer seg til sekskantede plater med en størrelse som kan sammenlignes med bølgelengden til synlig lys. Samspillet mellom kalsiumplatene og lysbølgene fører til spredning. Det absorberer noen lysbølger, noe som skaper en sterk absorpsjonstopp i det grønne til røde lysområdet, slik at lilla lys kan passere gjennom og gi den lilla fargen.
Siden partikler av samme størrelse av metallelementer kan gi lignende fargeeffekter, og forskjellige metallpartikler kan gi forskjellige farger, produseres noen imitasjonsperler ved hjelp av denne egenskapen.
"Rubin"-glass produseres for eksempel ved å tilsette kobber- eller gullpartikler til glass, noe som gir en rød farge som ligner på rubiner. Når smykkematerialet inneholder inneslutninger, mikrosprekker eller bobler som er større enn bølgelengden til synlig lys, samvirker lysbølgene med disse partiklene, slik at de spredte lysbølgene rekombineres og gir et gjennomskinnelig melkeaktig lys. For eksempel visse månesteinsimitasjoner.
Måneskinnseffekten i månestein oppstår også ved spredning av lys (figur 3-34). Månestein er en alkalisk feltspat, en kompositt dannet av vekslende parallelle lag av kaliumrik og natriumrik feltspat. Tykkelsen mellom lagene varierer vanligvis fra 50 til 1000 nm, og tynnere lag kan gi lysspredning. Den samme fargen kan også forekomme i plagioklas, kjent som "labradoritt-effekten".
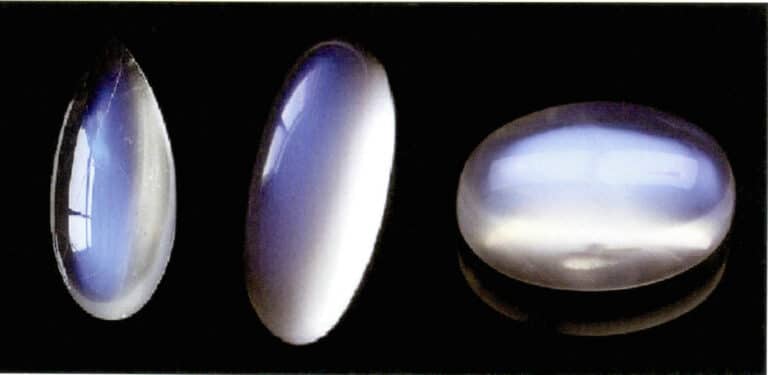
Et spesielt orientert arrangement av spredningspartikler kan gi karakteristiske optiske effekter. Når spredningspartiklene for eksempel er i parallell fiberform, gir de en katteøye- eller stjerneeffekt, slik som stjernesafirer og kvartskatteøyne. Når spredningspartiklene er store nok til at de kan skilles ut med det blotte øyet, kan de gi en "gullsteineffekt", for eksempel solstein (figur 3-35) og gullsteinsglass.

(2) Inkluderinger
Fargen og de optiske fenomenene som produseres av inneslutninger, er en spesiell type spredning. Inneslutninger med farge som er innleiret i nesten fargeløse hovedkrystaller, vil presentere fargen på inneslutningene, for eksempel nikkelholdig båndkalcedon og vannholdig jern(II)oksid (FeO - H2O) kjøttfarget kalcedon; fargen på ortoklas fra Madagaskar og noe cordieritt dannes av litt større, men likevel mikroskopiske inneslutninger av hematitt som skaper røde fargetoner; submikroskopiske inneslutninger av jernhydroksid farger ofte ildopal.
Diamanter har ofte forskjellige farger på grunn av tilstedeværelsen av mange inneslutninger. Diamanter som er farget av inneslutninger kan være svarte, oransjerøde og brunrøde. Når en diamant inneholder utallige mørke, ugjennomsiktige mineralinneslutninger, ser den svart ut; når den undersøkes med sterkt gjennomskinnelig lys, kan mange mørke inneslutninger observeres, og diamanten ser mørkegrå ut; en annen type er sekundære inneslutninger som oppstår i sprekkene i diamanten. Når sprekkene utvikler seg og fylles med disse fargede inneslutningene, fremstår diamanten som brunrød eller oransjerød, noe som også er kjent som en "oksidert" diamant.
4. Spredning
Fenomenet med å dekomponere hvitt lys i forskjellige spektralfarger gjennom et objekt kalles spredning. Spredningen av edelstener refererer til egenskapen til lys som sprer seg i forskjellige bølgelengder av spektralfarger når de passerer gjennom de skrå planene til gjennomsiktige edelstener. På grunn av de ulike bølgelengdene i det monokromatiske lyset som utgjør hvitt lys, og som forplanter seg med ulike hastigheter og brytningsindekser i ulike materialer, kan hvitt lys spaltes i ulike spektralfarger under visse forhold. Størrelsen på en edelstenes spredningsverdi bestemmes av dens fysiske egenskaper; hver edelsten har sin iboende spredningsverdi, som ikke endres med edelstenens egenskaper. Diamantenes unike sjarm er nært knyttet til deres høye spredningsverdi (0,044).
De fleste diamantsimulanter har en høyere dispersjonsverdi, for eksempel zirkon med en dispersjonsverdi på 0,039 og syntetisk moissanitt med en dispersjonsverdi på 0,104. Tabell 3-15 viser en sammenligning av spredningsverdiene til diamanter og deres vanlige simulerende edelstener.
Tabell 3-15 Sammenligning av spredningsverdiene for diamanter og deres vanlige simulerende edelstener
| Navn på edelsten | Spredningsverdi |
|---|---|
| Diamant | 0.044 |
| Zirkon | 0.039 |
| Korund | 0.018 |
| Spinell | 0.020 |
| Topas | 0.014 |
| Beryl | 0.014 |
| Krystall | 0.014 |
| Syntetisk rutil | 0.280 |
| Syntetisk strontiumtitanat | 0.190 |
| Syntetisk moissanitt | 0.104 |
Dispersjon omtales ofte som "ilden" i edelstener. Diamanter har for eksempel en høy dispersjonsverdi, og ilden deres er svært uttalt, noe som forsterker diamantenes allerede kongelige status og fremhever deres unike sjarm.
Det finnes mange typer farger som oppstår på grunn av fysisk-optiske effekter, og alle kan forklares med fysisk-optisk teori. Bortsett fra dispersjon, som er en iboende egenskap ved selve edelstenen, skyldes andre fenomener strukturelle endringer etter dannelsen av edelstenen og forskjeller i mekaniske inneslutninger. Forståelsen av de ulike årsakene til edelstenens farger gir et teoretisk grunnlag for å optimalisere behandlingen av naturlige og syntetiske edelstener.