Pourquoi les pierres précieuses ont-elles plusieurs couleurs ?
Introduction à la théorie des champs cristallins, à la théorie des orbitales moléculaires et à la théorie des bandes d'énergie
Les couleurs des pierres précieuses sont riches et variées et possèdent un charme unique que les gens ont toujours aimé. La qualité des pierres précieuses dépend en grande partie de leur couleur. La couleur d'une pierre précieuse est un indicateur important dans l'évaluation des pierres précieuses, et la plupart des traitements d'optimisation des pierres précieuses impliquent de changer ou d'améliorer leur couleur. Par conséquent, la compréhension des causes de la coloration des pierres précieuses est une condition préalable essentielle au traitement d'optimisation des pierres précieuses. Ce n'est qu'en maîtrisant la manière dont les pierres précieuses acquièrent leur couleur que l'on peut déterminer si une pierre précieuse peut être optimisée, quel schéma d'optimisation adopter et quel plan expérimental établir. Il existe cinq théories communes de la coloration des pierres précieuses : la théorie minéralogique classique, la théorie du champ cristallin, la théorie de l'orbitale moléculaire, la théorie de la bande d'énergie et les effets optiques physiques. Ces théories constituent les théories de la coloration des pierres précieuses naturelles courantes, et ce qui suit est une brève introduction à ces cinq théories de la coloration.
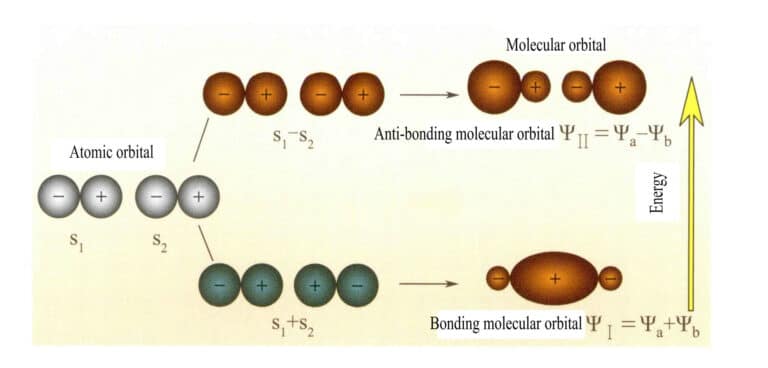
Orbitales moléculaires formées par deux orbitales atomiques s
Table des matières
Section I Théorie du champ cristallin
Dans les années 1930, des scientifiques ont proposé la théorie du champ cristallin pour expliquer les propriétés des cristaux. La théorie du champ cristallin est une théorie qui étudie les liaisons chimiques des éléments de transition (complexes). Elle explique les propriétés physiques et chimiques des éléments de transition et des lanthanides en combinant certains points de vue de la théorie électrostatique, de la mécanique quantique et de la théorie des groupes (théorie qui étudie la symétrie de la matière), en se concentrant sur l'influence des ligands sur les orbitales d et f des ions centraux. Dans les années 1950, on a appliqué la théorie du champ cristallin aux complexes et proposé la théorie du champ de ligands. La théorie du champ de ligands est une avancée de la théorie du champ cristallin ; elle prend en compte à la fois l'influence du champ électrique du ligand sur l'ion central et l'effet de remplissage des électrons du ligand sur l'ion central, ce qui la rend plus complète que la théorie du champ cristallin. Cependant, il n'y a pas de différence essentielle entre les deux, et elles ne sont généralement pas distinguées dans l'étude des minéraux inorganiques.
1. Concepts de base de la théorie des champs cristallins
Les ions des métaux de transition se trouvent dans le champ cristallin des anions ou des molécules dipolaires qui les entourent. La théorie du champ cristallin est un modèle électrostatique qui considère le cristal comme une interaction électrostatique entre des ions positifs et négatifs, où le cation chargé positivement est appelé l'ion central et l'anion chargé négativement est appelé le ligand.
L'application de la théorie du champ cristallin pour expliquer la couleur des minéraux des pierres précieuses implique principalement les électrons d ou l'énergie des électrons f des ions des éléments de transition. Par exemple, les orbitales d sont de cinq types : dxy, dxz, dyzd , d , et d . Ces cinq orbitales d ont des distributions spatiales différentes dans l'état libre de l'ion mais ont la même énergie. Cependant, elles subissent des changements significatifs sous l'influence du champ du ligand. Les cinq orbitales d dégénérées en énergie de l'atome central se divisent sous l'influence du champ électrique négatif formé par les ligands environnants. Certaines orbitales d augmentent leur énergie, tandis que d'autres la diminuent. En raison de la division des niveaux d'énergie des orbitales d, les électrons des orbitales d de l'atome central se réarrangent et occupent de préférence les orbitales de plus faible énergie, ce qui réduit l'énergie totale du système et rend le complexe plus stable.
L'énergie des orbitales d est la même en l'absence de champ électrique [figure 3-19 (a)] ; sous un champ électrostatique à symétrie sphérique, les orbitales d ont une énergie accrue mais ne se séparent pas [figure 3-19 (b)] ; lorsque le champ du ligand est octaédrique, elles se séparent en orbitales dr et dg. Parmi ceux-ci, dr sont composées d'orbitales d et d , plus énergétiques ; les orbitales dg sont composées d'orbitales dxy, dxz, dyz.
Les ions des métaux de transition se trouvent dans le champ cristallin des anions ou des molécules dipolaires qui les entourent. La théorie du champ cristallin est un modèle électrostatique qui considère le cristal comme une interaction électrostatique entre des ions positifs et négatifs, où le cation chargé positivement est appelé l'ion central et l'anion chargé négativement est appelé le ligand.
L'application de la théorie du champ cristallin pour expliquer la couleur des minéraux des pierres précieuses implique principalement les électrons d ou l'énergie des électrons f des ions des éléments de transition. Par exemple, les orbitales d sont de cinq types : dxy, dxz, dyzd , d , et d . Ces cinq orbitales d ont des distributions spatiales différentes dans l'état libre de l'ion mais ont la même énergie. Cependant, elles subissent des changements significatifs sous l'influence du champ du ligand. Les cinq orbitales d dégénérées en énergie de l'atome central se divisent sous l'influence du champ électrique négatif formé par les ligands environnants. Certaines orbitales d augmentent leur énergie, tandis que d'autres la diminuent. En raison de la division des niveaux d'énergie des orbitales d, les électrons des orbitales d de l'atome central se réarrangent et occupent de préférence les orbitales de plus faible énergie, ce qui réduit l'énergie totale du système et rend le complexe plus stable.
L'énergie des orbitales d est la même en l'absence de champ électrique [figure 3-19 (a)] ; sous un champ électrostatique à symétrie sphérique, les orbitales d ont une énergie accrue mais ne se séparent pas [figure 3-19 (b)] ; lorsque le champ du ligand est octaédrique, elles se séparent en orbitales dr et dg. Parmi ceux-ci, dr sont composées d'orbitales dx2– y2 et dz2
avec une énergie plus élevée ; le dg sont composées d'orbitales dxy, dxz, dyz. [Figure 3-19 (c)]
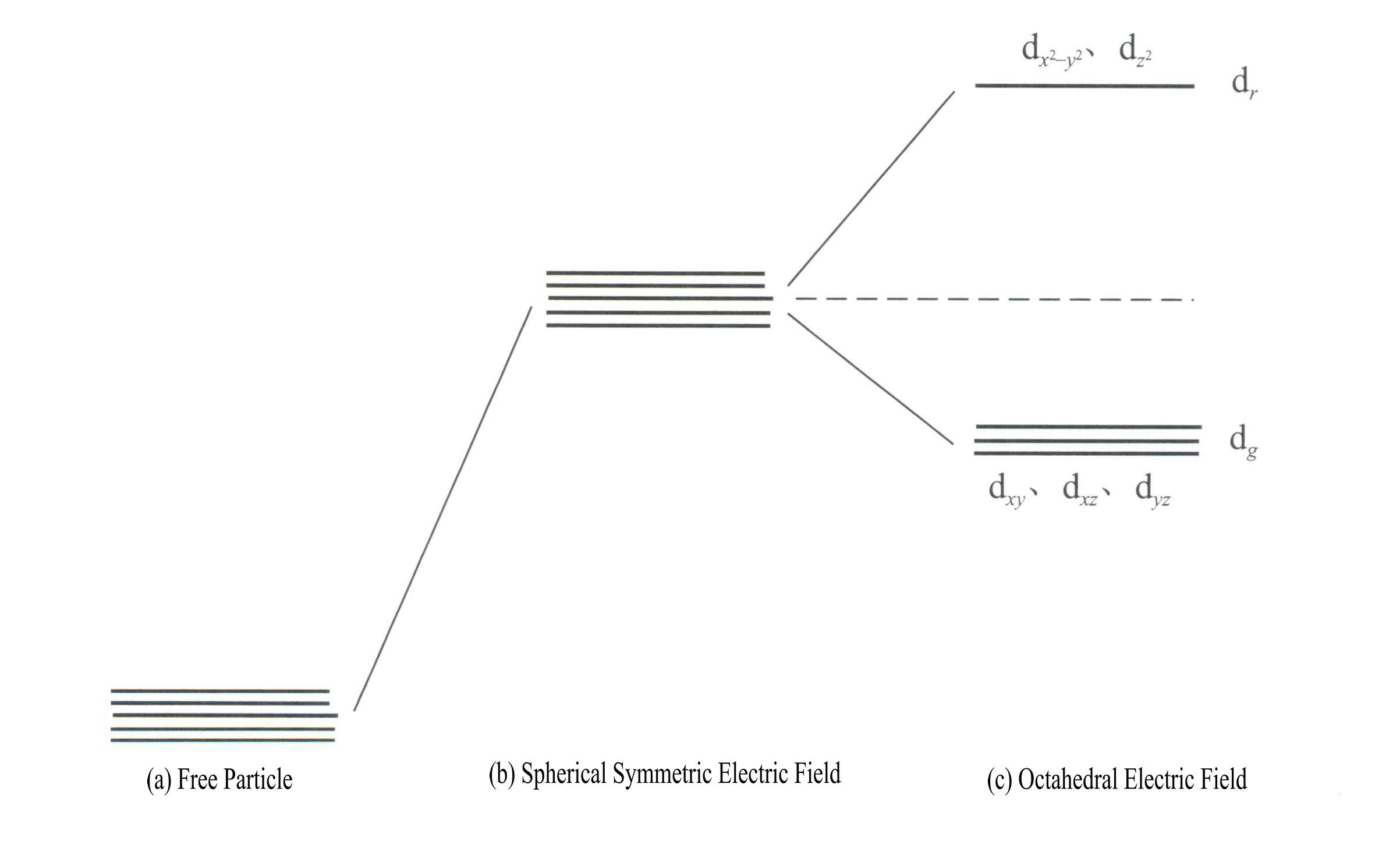
La différence entre les niveaux d'énergie les plus élevés et les plus bas après la division de l'orbitale d est appelée énergie de séparation △ . Les énergies de séparation produites par différentes configurations de champs de ligands ne sont pas les mêmes (figure 3-20). Leur ordre énergétique est le suivant :
Champ carré > Champ octaédrique > Champ tétraédrique

Même pour des champs de même configuration, ils peuvent également différer en raison des différences entre les ligands et les ions centraux ; plus elle est grande, plus le cristal est stable. Les trois facteurs suivants déterminent principalement la taille de l'énergie de séparation des cristaux :
(1) Cristaux formés par le même élément de transition ; lorsque les ligands sont les mêmes, plus la charge de l'ion central est élevée, plus l'énergie de séparation △ est importante. Plus la charge positive de l'ion central est élevée, plus l'attraction vers les ligands est importante, ce qui se traduit par une distance plus faible entre l'ion central et le noyau du ligand, et plus la force de répulsion du champ cristallin générée par les ligands sur les électrons est importante, plus l'énergie de séparation △ est élevée.
(2) Pour les cristaux formés par différents ions ayant la même charge positive et les mêmes ligands, plus le rayon de l'ion central est grand, plus les orbitales d sont éloignées du noyau et plus l'énergie de séparation △ est grande.
(3) Pour les cristaux formés par le même ion central et différents ligands, l'énergie de séparation varie en raison des différentes intensités du champ cristallin du ligand. Des ligands différents ont des champs différents, et l'énergie de séparation △ varie en fonction du champ du ligand.
L'énergie de séparation est utilisée pour expliquer qualitativement la stabilité des cristaux ; il n'est pas nécessaire d'obtenir la valeur absolue △ , car il suffit de connaître les valeurs relatives du cristal dans différentes conditions.
Sur la base de l'énergie relative des orbitales d divisées, l'énergie totale des ions de métaux de transition dans les orbitales d peut être calculée. Cette énergie est inférieure à celle qui existait avant la division, ce qui fournit une énergie supplémentaire au cristal, connue sous le nom d'énergie de stabilisation du champ cristallin, représentée par le symbole CFSE. Le tableau 3-10 énumère les énergies de stabilisation des ions contenant des orbitales dn des électrons dans différentes conditions.
Tableau 3-10 Énergies de stabilisation du champ cristallin sous différents ligands (Wu Ruihua, 1994)
| dn | Champ faible | Champ fort | ||||
|---|---|---|---|---|---|---|
| dn | Carré | Octaèdre régulier | Tétraèdre régulier | Carré | Octaèdre régulier | Tétraèdre régulier |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Caractéristiques de couleur des ions de métaux de transition
Dans ses pierres précieuses colorées, la couleur de la plupart des pierres précieuses est due à des ions de métaux de transition, et la couleur des pierres précieuses est liée au fait que les ions colorants contiennent des électrons non appariés dans les orbitales d ou f. Les caractéristiques de coloration des ions de métaux de transition comprennent principalement les aspects suivants :
(1) La coloration des ions de métaux de transition est liée aux états électroniques de l'orbitale d ou de l'orbitale f. Lorsque les électrons de l'orbitale d ou de l'orbitale f sont remplis ou vides, la pierre précieuse ne présente pas de couleur. Par exemple, Cr6+, Ce4+et Cu+.
(2) Différents ions colorants présentent des couleurs différentes dans la même pierre précieuse. En raison des différentes énergies de séparation des différents ions colorants, ceux-ci peuvent présenter des couleurs différentes même dans le même matériau. Par exemple, le Fe2+ produit une couleur légèrement gris-bleu dans le spinelle, tandis que le Cr3+ produit du rouge.
(3) Les ions colorants d'un même élément dans des états de valence différents présentent souvent des couleurs différentes dans la même pierre précieuse. L'énergie requise pour les transitions des électrons d de l'ion central étant différente, les longueurs d'onde de la lumière absorbée sont différentes, ce qui se traduit par des couleurs différentes. Par exemple, un castrum contenant du Mn2+ présente une teinte rose tendre, tandis qu'un béryl contenant du Mn2+ présente un rouge vif, connu sous le nom de béryl rouge.
(4) Les ions colorants d'un même élément dans le même état de valence présentent souvent des couleurs différentes lorsqu'ils se trouvent dans des configurations de ligands différentes. Par exemple, le Co2+ dans la configuration tétraédrique du spinelle présente une couleur "bleu diamant" caractéristique, tandis que dans la configuration octaédrique de la calcite, il apparaît en rose. Le Fe2+ dans l'olivine coordonnée par un octaèdre montre un vert olive caractéristique, tandis que dans l'almandine coordonnée par un cube déformé, il apparaît en rouge profond.
(5) Le même type d'ions colorés a le même état de valence et la même géométrie de coordination, mais différents atomes coordinateurs adjacents présentent des couleurs différentes. Par exemple, dans la coordination tétraédrique du Co2+dans la sphalérite, le Co2+ est relié au soufre et apparaît en vert, tandis que dans le spinelle, le Co2+ est connecté à l'oxygène, en bleu.
(6) Le même type d'ions colorés avec le même état de valence, la même géométrie de coordination et les mêmes atomes adjacents présentent des couleurs différentes dans des pierres précieuses différentes. La distorsion de la géométrie de coordination causée par les différentes compositions chimiques des pierres précieuses modifie la nature des liaisons chimiques entre l'ion central et les ligands de coordination, ce qui modifie l'énergie de transition des électrons d. Par exemple, Cr3+ apparaît rouge dans le rubis, vert dans l'émeraude et présente des couleurs variables dans l'alexandrite. La raison de ces changements dans la couleur du Cr3+ est liée à ses caractéristiques et aux ligands de coordination adjacents, avec une analyse des caractéristiques spécifiques comme suit.
① Cr3+ Caractéristiques :
Cr3+ a une structure d'enveloppe externe de 3s23p63d3avec 11 électrons dans l'enveloppe extérieure, appartenant à une structure d'enveloppe électronique irrégulière (8-18).
Cette structure a un effet de blindage plus faible sur le noyau que la structure à 8 électrons, ce qui donne Cr3+ ayant une charge positive effective plus élevée, tandis que son rayon ionique est également plus petit, ce qui constitue les caractéristiques de base du Cr3+: un champ électrique positif important et des orbitales d vides. Le Cr3+ peut fournir six orbitales vides pour accueillir six ligands coordinateurs, avec une configuration spatiale octaédrique, appartenant à d2sp3 l'hybridation (figure 3-21).
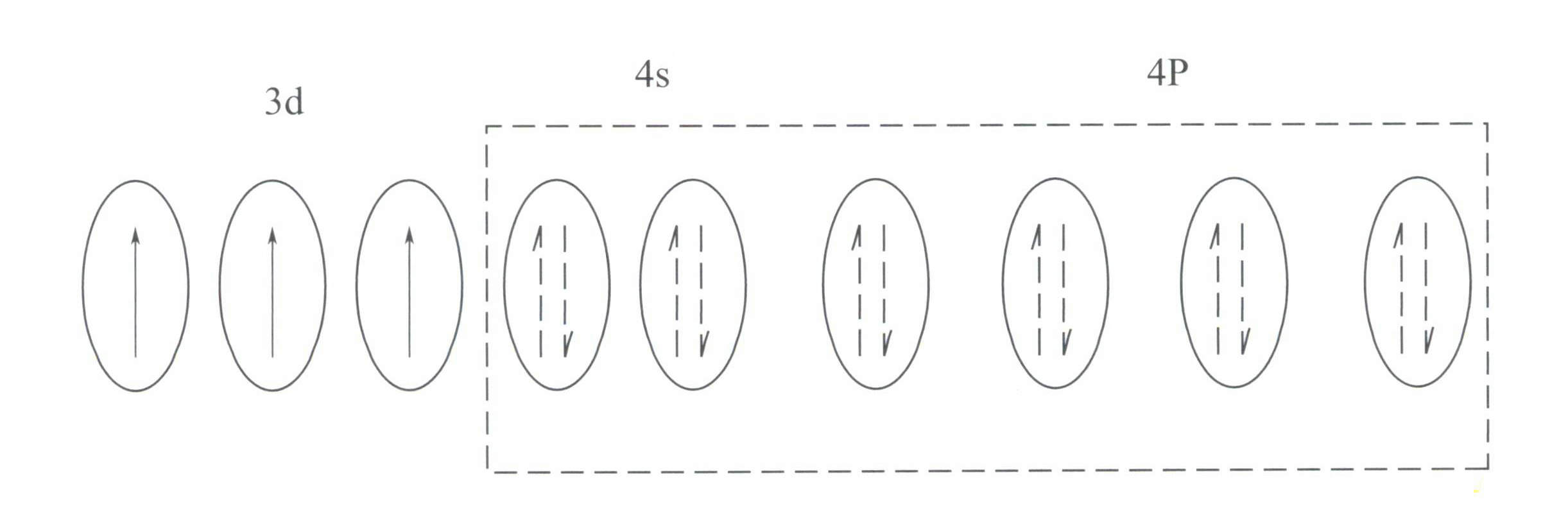
Selon la théorie du champ cristallin, dans un champ octaédrique, les orbitales d du Cr3+ peut se diviser en dƐ et l'orbite dr orbite. Étant donné que les trois électrons d du Cr3+ sont tous dans le dƐ et sont tous des électrons uniques, des transitions d-d peuvent se produire sous la lumière visible, ce qui fait que les pierres précieuses contenant du Cr3+ pour présenter de la couleur.
② Le mécanisme de coloration du Cr3+:
Dans le rubis Le principal composant chimique du rubis est l'Al2O3. Lorsque quelques pour cent de Cr3+ remplace Al3+Il produit une couleur rouge vif. Dans la structure du rubis, en raison du rayon plus grand du Cr3+ par rapport au rayon de l'Al3+, Cr3+ pénètre dans le réseau du corindon, réduisant la symétrie autour de l'oxyde d'aluminium.
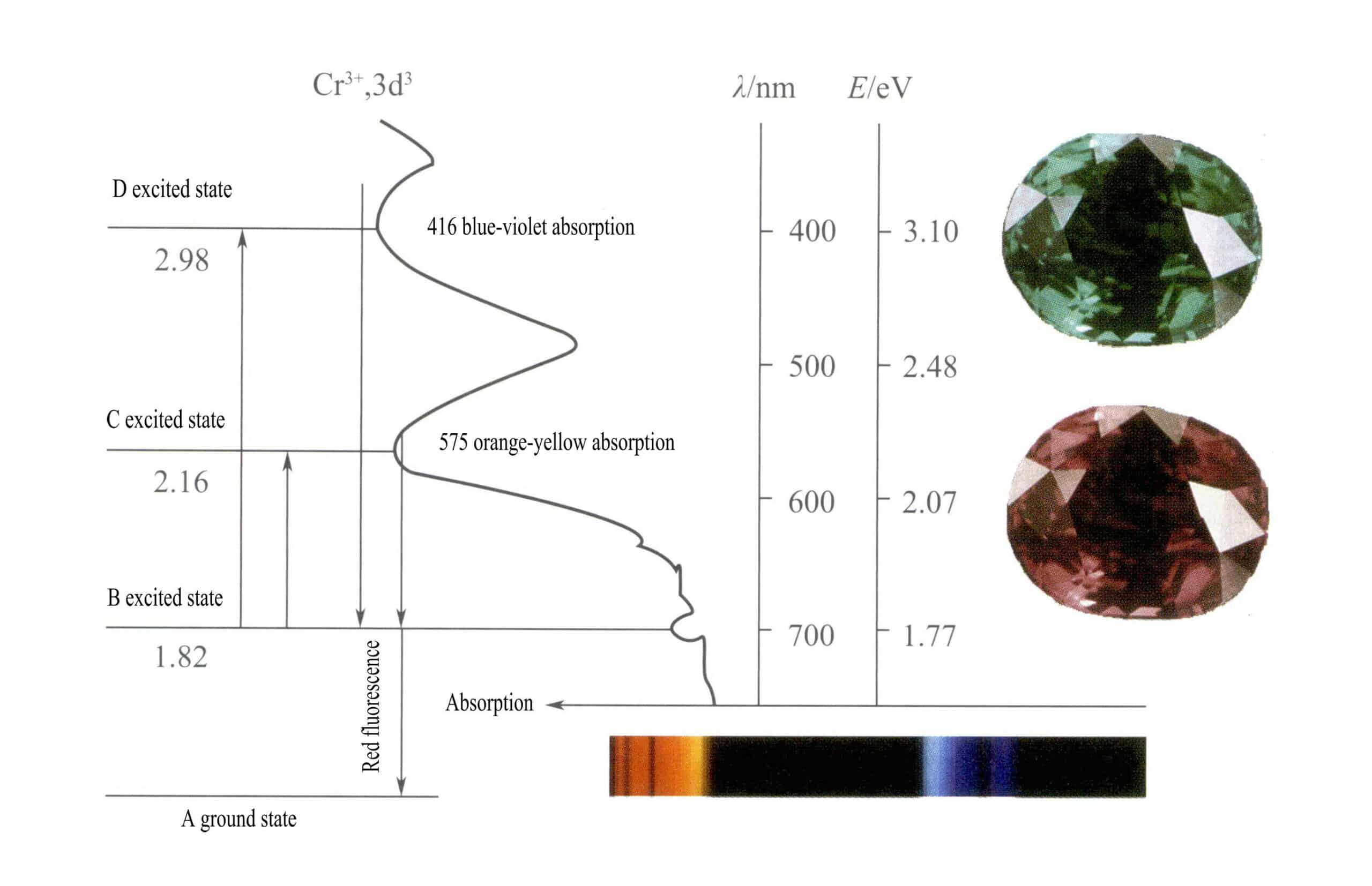
Les orbitales d du Cr3+ Les électrons de l'état excité se divisent, et lorsqu'ils retournent de D ou C à l'état fondamental A, ils doivent d'abord passer par B, ce qui libère de la chaleur. Ils retournent de B à A, accompagnés de luminescence, en émettant une fluorescence rouge. Au cours de ce processus, les électrons absorbent l'énergie lumineuse, ce qui fait que le rubis absorbe le spectre visible D violet (400 nm) et C jaune-vert (555 nm) (figure 3-22), formant ainsi une bande d'absorption.

Lorsque la lumière blanche traverse un rubis, les photons du spectre allant du violet au jaune-vert sont absorbés, tandis que la quasi-totalité de la lumière rouge et une partie de la lumière bleue passent, donnant au rubis une couleur rouge profond avec une pointe de violet, connue sous le nom de rouge sang de pigeon.
Les rubis présentent une brève absorption de niveau B, qui se manifeste par une fluorescence rouge. Cette absorption de niveau B qui produit une fluorescence rouge rend la couleur du rubis plus vive ; plus la teneur en ions chrome est élevée, plus la fluorescence est forte.
Les ions de fer présents dans la pierre précieuse peuvent supprimer la fluorescence de l'absorption de niveau B, ce qui explique le phénomène des rubis qui apparaissent plus sombres lorsqu'ils contiennent des impuretés de fer.
③ Cr3+ Le mécanisme de coloration des émeraudes
Le principal composant chimique de l'émeraude est le Be3Al2Si6O18, Cr3+qui remplace l'Al3+ dans le réseau émeraude, et Cr3+ est également entouré d'un octaèdre composé de six ions oxygène, où le Cr3+La longueur de la liaison -O est également assez similaire à celle des rubis. Cependant, par rapport aux rubis, les émeraudes possèdent deux ions supplémentaires, Be2+ et Si4+. Dans la structure des émeraudes, la nature des liaisons covalentes entre les oxydes métalliques augmente, tandis que les caractéristiques ioniques s'affaiblissent.
Des modifications mineures, telles que des liaisons chimiques, entraînent une légère diminution de la teneur en Cr3+L'énergie des niveaux C et D entraîne un léger déplacement de la bande d'absorption (figure 3-23), bloquant de manière significative la transmission de la lumière bleu-violet (425 nm) et orange-jaune (608 nm) dans le spectre, tout en augmentant la transmission de la lumière bleu-vert, formant ainsi le vert émeraude caractéristique.

L'absorption de la dioptase au niveau B est pratiquement inchangée. Lorsque le fer impur n'a pas d'effet "inhibiteur" sur le composant émeraude, la forte fluorescence rouge rend le vert émeraude caractéristique encore plus brillant.
④ Cr3+ Le mécanisme de la couleur dans l'alexandrite :
La couleur de l'alexandrite est également due au Cr3+ en remplacement de l'Al3+ en coordination octaédrique déformée. En raison de la composition chimique de l'alexandrite, BeAL2O4La nature des liaisons chimiques entre ses ions métal-oxygène se situe entre celle du rubis et celle de l'émeraude. Par conséquent, ses bandes d'absorption se situent également entre celles du rubis et de l'émeraude, les probabilités de transmission de la lumière bleu-violet et orange-jaune étant à peu près égales, il est impossible de déterminer si c'est la lumière rouge ou bleu-vert qui domine (figure 3-24).
Par conséquent, la couleur de l'alexandrite ne peut dépendre que de la distribution de l'énergie et de la gamme de couleurs de la lumière incidente, ce qui entraîne un "effet de changement de couleur" de l'alexandrite, c'est-à-dire qu'elle apparaît verte à la lumière du jour avec une forte composante de lumière bleue et rouge à la lumière incandescente avec une forte composante de lumière rouge. C'est pourquoi l'alexandrite est souvent appelée "l'émeraude du jour et le rubis de la nuit".
L'"effet de changement de couleur" apparaît dans de nombreux types de pierres précieuses, telles que le corindon et le grenat à couleur changeante. Actuellement, le corindon changeant de couleur synthétisé artificiellement est produit en utilisant le principe du changement de couleur, en employant V3+ comme ion colorant pour la synthèse.
3. Couleurs des pierres précieuses
Les couleurs produites par les composants des métaux de transition peuvent être déduites de la composition chimique des minéraux des pierres précieuses. Par exemple, la turquoise contenant du Cu2+ doit être bleu, tandis que Cu+ est incolore. Le tableau 3-11 énumère les couleurs produites par les composants de métaux de transition courants dans les minéraux des pierres précieuses naturelles.
Tableau 3-11 Couleurs produites par les composants des métaux de transition dans les pierres précieuses naturelles
| Élément | Couleur | Minéraux communs |
|---|---|---|
| Cérium (Ce) | Jaune | Parisite |
| Chrome (Cr) | Rouge, vert, orange, etc. | Crocoisite, Crocoisite rouge, Uvarovite |
| Cobalt (Co) | Bleu | Spinelle synthétique |
| Cuivre (Cu) | Bleu, vert | Azurite, chrysocolle, Turquoise, malachite, Dioptase |
| Fer (Fe) | Rouge, vert, jaune | Almandin, olivine, goethite |
| Manganèse (Mn) | Rose, orange | Rhodonite, spessartine |
| Nickel (Ni) | Vert | Bunsenite, Calcédoine |
La couleur de la plupart des pierres précieuses est due aux impuretés des métaux de transition qu'elles contiennent. Par exemple, les rubis apparaissent rouges en raison de traces de Cr3+. Divers facteurs influencent la couleur causée par les ions d'impuretés dans la pierre précieuse. Par conséquent, les impuretés peuvent produire des couleurs différentes selon les pierres précieuses. Par exemple, le Cr3+ apparaît en rouge dans les rubis et en vert dans les émeraudes.
Les mêmes impuretés ne sont pas nécessairement à l'origine de la même couleur d'une pierre précieuse. Par exemple, la couleur verte de la plupart des émeraudes est due au Cr, tandis que la couleur verte de certaines émeraudes est partiellement ou entièrement due au vanadium (V).
La théorie du champ cristallin peut non seulement être utilisée pour expliquer les couleurs des pierres précieuses produites par les composants ou les impuretés des métaux de transition, mais aussi les couleurs produites par les défauts structurels (centres de couleur) ; le processus spécifique de génération des couleurs est décrit au chapitre 3.3 du présent ouvrage.
L'explication des couleurs des minéraux des pierres précieuses par la théorie du champ cristallin présente également des lacunes, qui se reflètent principalement dans les aspects suivants :
(1) Les électrons de l'ion central d ne sont pas complètement localisés dans leurs orbitales d'origine. Ils peuvent également apparaître autour des atomes coordinateurs, ce qui indique une interaction covalente entre l'atome central et les ligands.
(2) Il ne prend en compte que l'interaction ionique électrostatique entre l'atome central et les ligands, ignorant complètement l'interaction de liaison covalente entre l'atome central et les ligands. Dans la recherche physique, les résultats des calculs quantitatifs diffèrent souvent de manière significative des situations réelles.
(3) Outre l'interaction entre l'ion central et les ligands, la couleur des minéraux des pierres précieuses peut également être due aux effets combinés des défauts structurels et du champ cristallin.
Section II Théorie de l'orbitale moléculaire
Mulliken et Hund ont initialement proposé la théorie de l'orbitale moléculaire (théorie MO). Grâce à l'exploration continue de nombreux scientifiques, elle est devenue une théorie mature. Les orbitales moléculaires (OM) peuvent être obtenues par des combinaisons linéaires d'orbitales atomiques, une méthode couramment utilisée pour construire des orbitales moléculaires. À partir de n orbitales atomiques, il est possible d'obtenir n orbitales moléculaires, et les coefficients de combinaison linéaire peuvent être déterminés à l'aide de la méthode variationnelle ou d'autres méthodes. Les orbitales moléculaires formées par deux orbitales atomiques, dont les niveaux d'énergie sont inférieurs à ceux des orbitales atomiques, sont appelées orbitales liantes ; celles dont les niveaux d'énergie sont supérieurs à ceux des orbitales atomiques sont appelées orbitales antiliantes ; celles dont les niveaux d'énergie sont proches des orbitales atomiques sont généralement des orbitales non liantes.
La théorie des orbitales moléculaires est une théorie utilisée pour expliquer des questions telles que la formation, la structure et les propriétés des molécules. Elle peut également expliquer certaines des causes de la couleur des pierres précieuses, qui ont été développées sur la base de la théorie du champ cristallin et de la théorie des orbitales moléculaires des métaux de transition. Les orbitales moléculaires sont une extension naturelle des orbitales atomiques. Dans une molécule, les électrons n'appartiennent plus à un atome spécifique mais se déplacent sur l'ensemble de la gamme moléculaire ; par conséquent, le mouvement des électrons dans une molécule est décrit à l'aide des orbitales moléculaires.
1. Concepts de base de la théorie des orbitales moléculaires
La théorie des orbitales moléculaires postule qu'une fois que les atomes ont formé une molécule, les électrons n'appartiennent plus aux orbitales atomiques d'origine, comme le propose la théorie du champ cristallin, mais se déplacent à l'intérieur de certaines orbitales moléculaires. Les orbitales moléculaires composent une molécule tout comme les orbitales atomiques composent un atome. Les électrons de valence ne sont plus considérés comme localisés dans les atomes individuels, mais se déplacent dans l'ensemble de la molécule. La distribution des électrons dans la molécule peut être traitée selon les principes de distribution des électrons dans les atomes (principe de l'énergie minimale et règle de Hund).
La combinaison linéaire des orbitales atomiques dans une molécule forme des orbitales moléculaires. Le nombre d'orbitales moléculaires est égal au nombre d'orbitales atomiques avant la combinaison. La combinaison des orbitales atomiques en orbitales moléculaires efficaces doit respecter les trois principes suivants :
(1) Principe de correspondance des symétries : Seules les orbitales atomiques présentant la même symétrie peuvent former des orbitales moléculaires.
(2) Principe de proximité énergétique : Seules les orbitales atomiques ayant des énergies similaires peuvent se combiner pour former des orbitales moléculaires efficaces.
(3) Principe du chevauchement maximal : en cas de symétrie, plus le chevauchement des orbitales atomiques est important, plus l'énergie des orbitales moléculaires qui en résultent diminue et plus la liaison chimique qui en résulte est stable.
L'orbitale moléculaire ψ est la fonction d'onde d'un électron unique. Elle peut être représentée comme une combinaison linéaire d'orbitales atomiques, chaque orbitale correspondant à une énergie spécifique, qui est la somme de l'énergie cinétique et de l'énergie potentielle de l'électron se déplaçant dans le champ électrique moléculaire. Deux orbitales atomiques, a et b, par le biais de combinaisons linéaires qui se chevauchent, produisent deux orbitales moléculaires ψI et ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Lorsque les orbitales moléculaires contenant des électrons sont remplies en premier, les orbitales de liaison ψI sont remplies en premier. Lorsque les électrons remplissent des orbitales moléculaires de même énergie, selon la règle de Hund, ils doivent également occuper, dans la mesure du possible, des orbitales moléculaires différentes ayant la même direction de spin.
Les orbitales moléculaires ψI obtenues en ajoutant deux fonctions orbitales atomiques (équation 3-5) sont appelées orbitales moléculaires de liaison. Les orbitales moléculaires ψII obtenues en soustrayant deux orbitales atomiques (équation 3-6) sont appelées orbitales moléculaires antiliantes. L'énergie des orbitales moléculaires liantes est inférieure à celle des orbitales moléculaires non liantes et inférieure aux énergies des deux orbitales atomiques d'origine. Ainsi, tout comme dans le cas du remplissage des orbitales atomiques, lors du remplissage des orbitales moléculaires, les électrons sont d'abord placés dans les orbitales de liaison, et une orbitale moléculaire peut accueillir deux électrons de spins opposés. Lorsque les électrons remplissent des orbitales moléculaires de même énergie, selon la règle de Hund, ils doivent également occuper, dans la mesure du possible, des orbitales moléculaires différentes ayant la même direction de spin. Les orbitales moléculaires formées par deux orbitales atomiques s sont illustrées dans la figure 3-25.

Les orbitales p et les orbitales d peuvent également former des orbitales moléculaires de niveaux d'énergie différents ; par exemple, la combinaison d'orbitales moléculaires diatomiques dans O2 est relativement complexe.
Des expériences ont permis de mesurer les propriétés magnétiques de ces deux électrons uniques, étayant ainsi fortement la théorie de l'orbitale moléculaire. Contrairement aux molécules composées des mêmes atomes, celles composées de deux ou plusieurs atomes différents ont des niveaux d'énergie d'orbitale moléculaire plus complexes, mais le principe est le même.
2. Caractéristiques de la coloration par transfert de charge
Cette théorie des orbitales moléculaires, où l'ensemble de la molécule partage des électrons, est également considérée comme la transition des électrons d'une orbitale atomique à une autre, connue sous le nom de transfert de charge. Le transfert de charge peut se produire dans les interactions métal-métal (M-M), non-métal-non-métal (L-L) et non-métal-métal (L-M). Parmi elles, L-L, M-L, ces deux types de liaisons sont souvent des liaisons covalentes. O2 appartient au transfert de charge L-L, qui est une liaison covalente.
(1) Transfert de charge métal-métal (transfert de charge M - M)
Ce type de transfert de charge se produit généralement entre des ions de métaux de transition communs. La plupart des causes de coloration des pierres précieuses colorées sont produites par un transfert de charge métal-métal. Le transfert de charge M-M comprend principalement les types suivants : Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Le transfert de charge entre métaux se divise en deux types : le transfert de charge entre atomes homonucléaires et le transfert de charge entre atomes hétéronucléaires.
① Transfert de charge entre atomes isoélectroniques
Le transfert de charge entre atomes isoélectroniques se produit entre deux atomes du même élément métallique de transition dans des états d'oxydation différents. Par exemple, Fe2+ et Fe3+ subissent un transfert de charge dans différentes conditions d'oxydoréduction, absorbant de l'énergie et produisant de la couleur. La couleur bleu-violet de l'iolite est produite par le transfert de charge d'ions de fer dans différents états d'oxydation. Le Fe3+ et Fe2+ sont respectivement en position tétraédrique et octaédrique, avec deux ligands reliés par des arêtes. Lorsque la lumière visible éclaire l'iolite, un électron d du Fe2+ absorbe la lumière d'une certaine énergie et se transforme en Fe3+L'aigue-marine et la tourmaline verte peuvent également présenter une couleur due au transfert de charge entre les ions de fer. L'aigue-marine, la tourmaline verte et d'autres peuvent également présenter une couleur due au transfert de charge entre les ions de fer.
② Transfert de charge entre hétéroatomes
Les saphirs bleus illustrent le plus souvent la couleur produite par le transfert de charge entre deux types d'ions de métaux de transition. Les polyèdres de coordination des ions de métaux de transition sont reliés par des arêtes ou des faces, ce qui facilite le transfert de charge entre les métaux.
Par exemple, dans les saphirs, lorsque les ions fer et les ions titane pénètrent dans les octaèdres connectés, le Fe et le Ti existent dans deux états d'oxydation :
Fe2+ + Ti4+ faible énergie (3-7)
Fe3+ + Ti3+ haute énergie (3-8)
Le passage de l'équation (3-7) à l'équation (3-8) nécessite l'absorption d'une certaine quantité d'énergie lumineuse, ce qui se traduit par une large bande d'absorption allant du jaune au rouge. En revanche, la plupart de la lumière bleue passe à travers la pierre précieuse, ce qui lui donne un aspect bleu.
Le transfert de charge entre différents états de valence a une forte directionnalité, et les pierres précieuses qui présentent une couleur due à ce mécanisme affichent souvent un pléochroïsme. Par exemple, l'aigue-marine colorée par le Fe2+→ Fe3+ Le transfert de charge fait apparaître la couleur strictement dans la direction de l'axe optique. La figure 3-26 montre que l'aigue-marine apparaît jaune dans les plans b et c. En même temps, il n'y a pas de transfert de charge dans la direction de l'axe a, ce qui signifie qu'il n'y a pas d'absorption de lumière et donc pas de couleur dans la direction de l'axe a.
(2) Transfert de charge non-métal-métal (L-M)
Ce type de transfert de charge L-M se produit souvent entre l'oxygène et les ions métalliques, et certaines pierres précieuses contenant de l'oxygène sont colorées par un transfert de charge non-métal-métal, comme l'O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
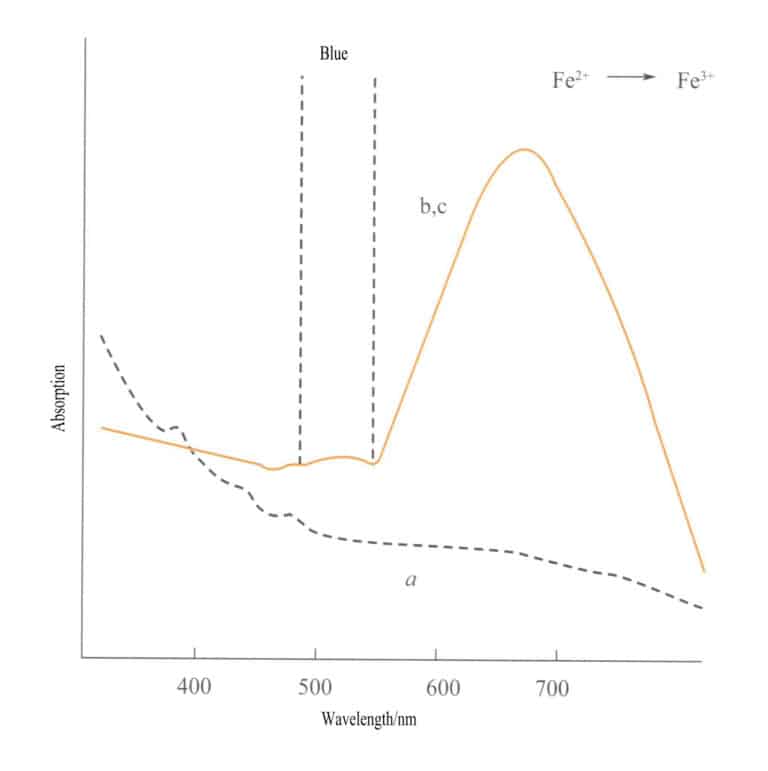
Dans le spectre d'absorption des oxydes de fer simples (figure 3-27), deux faibles bandes d'absorption apparaissent dans la région infrarouge de l'ilménite, de l'hématite et de la lépidocrocite (transitions électroniques d - d). Une bande d'absorption forte apparaît dans la gamme des ondes courtes, produite par les transitions électroniques O2-→Fe3+ Cette bande d'absorption détermine les couleurs caractéristiques de ces composés : brun-rouge, brun et brun-jaune.
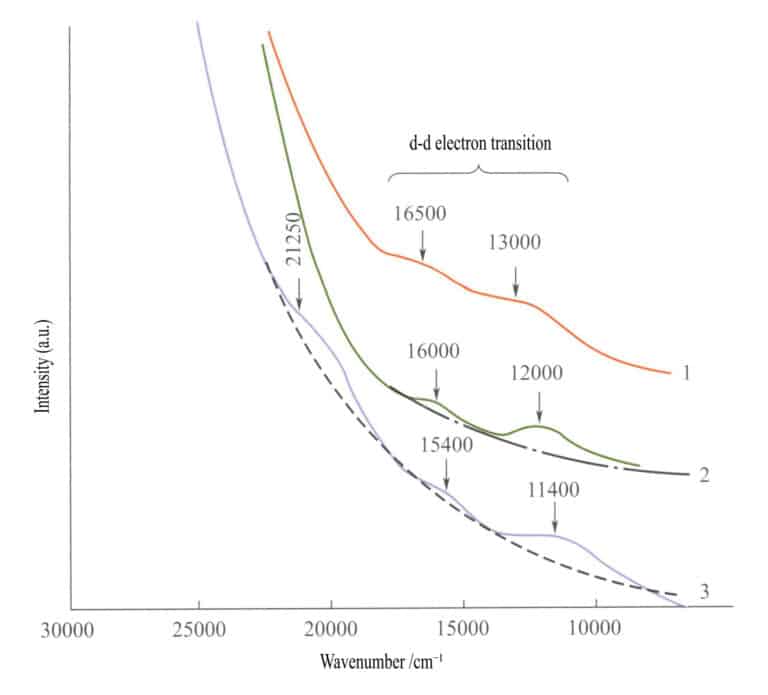
1 - Iilménite ; 2 - Hématite ; 3 - Lépidocrocite
Le béryl jaune tire sa couleur de O2–→ Fe3+ transfert de charge. Dans la structure du béryl jaune, O2–→ Fe3+ une forte absorption par transfert de charge peut s'étendre de l'extrémité ultraviolette à l'extrémité bleue du spectre visible, en absorbant le violet et le bleu, ce qui donne une couleur jaune.
Le saphir, dont l'environnement de coordination est complètement différent de celui du béryl, peut également produire les mêmes bandes spectrales d'absorption que le béryl, ce qui donne le jaune, qui est également le résultat de l'O2–→ Fe3+ transfert de charge.
Selon la théorie du champ cristallin, certains minéraux des pierres précieuses ne contiennent pas d'électrons non appariés et ne peuvent donc pas produire de couleur. Par exemple, les couches électroniques de la crocoïte (PbCrO4), Pb2+, Cr6+et O2– sont pleins. Toutefois, dans le cas du CrO42- sont des "orbitales moléculaires", qui correspondent aux états excités pendant la période d'exposition à l'O2-→Cr6+ en formant des bandes d'absorption et en présentant une couleur orange.
L→M Le transfert de charge comprend également le transfert du soufre vers le métal, comme dans la pyrite commune ; ce phénomène optique causé par le transfert est plus facile à comprendre lorsqu'il est abordé à l'aide de la théorie des bandes.
(3) Transfert de charge de non-métal à non-métal (L-L)
La théorie des orbitales moléculaires suggère que la couleur bleu foncé du lapis-lazuli est due à l'excitation des niveaux d'énergie de l'atome S3- groupe atomique.
Dans le graphite, les anneaux de six atomes de carbone sont disposés en couches. Le long de cette couche, les électrons peuvent se déplacer librement dans une certaine mesure, ce qui se traduit par une forte absorption de la lumière, une anisotropie et une conductivité.
Certaines pierres précieuses organiques, comme l'ambre et les perles, ont des électrons qui se déplacent et s'excitent à travers les groupes atomiques des pigments organiques dans des orbitales moléculaires partagées, provoquant l'absorption de la lumière visible et produisant la couleur. Par exemple, le "jaune miel" de l'ambre, les couleurs du corail, certains coquillages et certaines perles colorées.
Les mécanismes de couleur des pierres précieuses courantes sont présentés dans le tableau 3-12.
Tableau 3-12 Classification des mécanismes de couleur des pierres précieuses courantes
| Transfert de charge métal-métal | Fe2+ - Fe3+ /Fe3+ - Fe2+ : iolite (bleu), berthierite (bleu), magnétite (noir), etc. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Kyanite (bleu), Saphir (bleu) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganite (noire), Bixbyite (noire) | |
| Transfert de charge de métal à métal | O2- -Fe3+: Béryl jaune d'or, saphir jaune d'or, ilménite, hématite, lépidocrocite, etc. |
| O2- - Cr6+: Crocoite (orange) | |
| O2- -V5+:Vanadinite (orange) | |
| Du soufre au métal : pyrite, marcasite, etc. (voir semi-conducteur avec lacune) | |
| Transfert de charge non-métal - non-métal | S3-: Lapis-lazuli (bleu) |
| Π électronique : graphite (noir) | |
| Les couleurs de certaines pierres organiques comme l'ambre et le corail. |
Copywrite @ Sobling.Jewelry - Fabricant de bijoux sur mesure, usine de bijoux OEM et ODM
Section III Théorie des bandes d'énergie
La théorie des bandes d'énergie est un modèle de mécanique quantique pour l'étude des matériaux des pierres précieuses, qui est une extension et une expansion de la théorie des orbitales moléculaires. L'étude de la théorie des bandes d'énergie permet de mieux expliquer le mécanisme de la couleur de certaines pierres précieuses naturellement colorées.
1. Concepts de base de la théorie des bandes d'énergie
La théorie des bandes d'énergie est une théorie approximative utilisée pour étudier les lois du mouvement des électrons dans les solides. Les solides sont composés d'atomes, qui comprennent les noyaux atomiques et les électrons les plus externes, qui sont tous dans un état de mouvement constant. La théorie des bandes postule que les électrons dans les solides ne sont pas liés à un atome spécifique mais sont partagés par l'ensemble du cristal et se déplacent dans le champ potentiel périodique de l'espace tridimensionnel du cristal. Le champ de mouvement des électrons se situe à l'intérieur du champ potentiel périodique du réseau, ce qui permet à la distribution spatiale des orbites électroniques de dépasser celle des molécules et d'atteindre un maximum. Les niveaux d'énergie des électrons individuels sont élargis en bandes d'énergie.
La théorie des bandes traite principalement des transitions électroniques entre des états non locaux, où tous les électrons de valence doivent appartenir à l'ensemble du réseau solide. Selon la théorie des bandes, les matériaux solides peuvent être divisés en différentes bandes d'énergie selon que les orbitales atomiques sont remplies ou non : une bande remplie est formée par les niveaux d'énergie des orbitales atomiques qui sont entièrement occupées par des électrons, ce qui représente une bande de faible énergie ; une bande vide est formée par les niveaux d'énergie qui ne sont pas entièrement occupés par des électrons, ce qui représente une bande de haute énergie. La différence d'énergie entre ces deux types de bandes est appelée "bande interdite" (figure 3-28).
Lorsque toutes les bandes d'énergie d'un matériau sont remplies, il s'agit d'un non-conducteur ; lorsqu'il est partiellement rempli d'électrons, il s'agit d'un conducteur. Les défauts du réseau introduisent des niveaux d'énergie supplémentaires dans le cristal, permettant aux électrons d'entrer dans ces niveaux d'énergie, ce qui entraîne une conductivité conditionnelle.
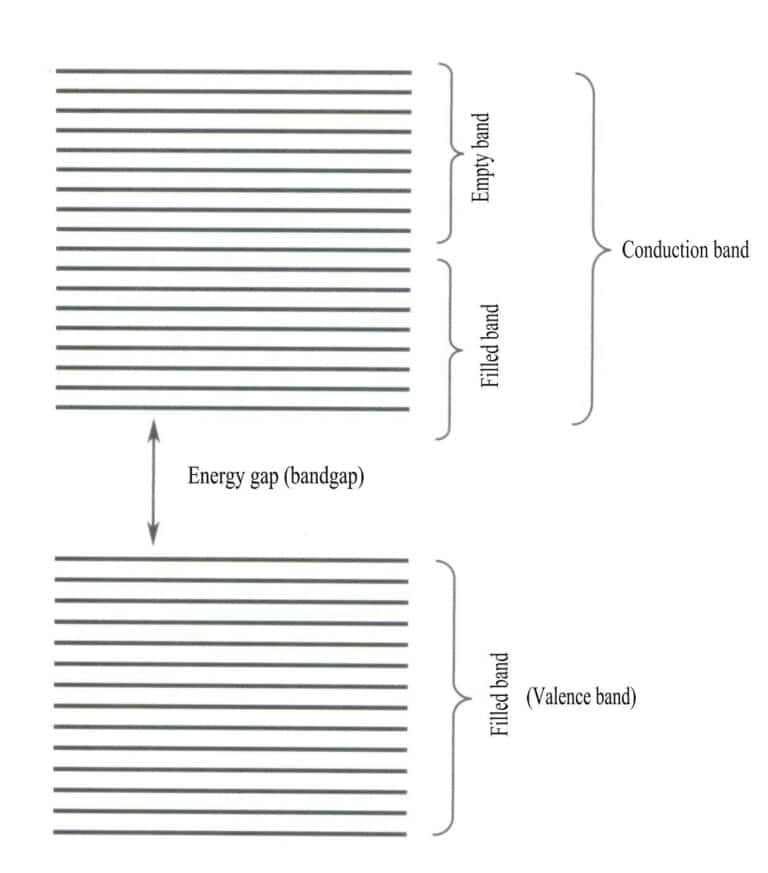
2. Caractéristiques des transitions de bande interdite
Certains minéraux des pierres précieuses contiennent des éléments du groupe IV A du tableau périodique, comme le diamant et la moissanite, qui se lient principalement de manière covalente. Il existe également d'autres minéraux, comme le sulfure de cadmium (CdS), dont les couleurs peuvent être expliquées par la théorie des bandes.
Les électrons absorbent l'énergie lumineuse et se déplacent entre les bandes de valence et de conduction, formant des "transitions de bandes internes". La probabilité des transitions est étroitement liée à la différence d'énergie entre les bandes de valence et de conduction, connue sous le nom d'énergie de la bande interdite (Eg) (figure 3-29).

La figure 3-29 (a) est un diagramme de bande typique d'un semi-conducteur. En fonction de la taille de l'énergie de la bande interdite du cristal, celui-ci peut être divisé en trois types : bande interdite large, bande interdite étroite et bande interdite moyenne. Une bande interdite large a une énergie de bande interdite supérieure à l'énergie de la lumière visible ; lorsque l'énergie de bande interdite dépasse l'énergie de la lumière visible, la lumière visible n'est pas absorbée et passe complètement à travers, ce qui rend le minéral incolore. Par exemple, l'énergie de la bande interdite du diamant Eg est d'environ 5,5eV, ce qui le rend incolore.
L'énergie de la bande interdite des matériaux à bande interdite étroite est inférieure à celle de la lumière visible, ce qui entraîne l'absorption de toute la lumière visible et donne des couleurs gris-vert ou noir foncé. Par exemple, l'énergie de la bande interdite de la galène est Eg moins de 0,4eV, qui apparaît comme un gris de plomb. Lorsque ce "semi-conducteur à bande interdite étroite" a une forme géométrique appropriée, il présente des propriétés de redressement et d'amplification.
L'énergie des matériaux à bande interdite moyenne se situe exactement dans la gamme de la lumière visible, et les minéraux gemmes présentent diverses couleurs. Leur séquence de couleurs est illustrée dans la figure 3-29 (c), allant du rouge-jaune au vert-bleu en passant par le violet. Par exemple, l'énergie de la bande interdite (Eg) du sulfure de cadmium (CdS) est d'environ 2,5eV, ce qui lui permet d'absorber la lumière bleue et violette et d'apparaître jaune. L'énergie de la bande interdite du cinabre est d'environ 2,5eV et ne laisse passer que la lumière rouge, d'où son aspect rouge. L'énergie de la bande interdite de l'orpiment est d'environ 2,5eV, ce qui lui confère une couleur jaune.
Une autre catégorie de minéraux gemmes naturels expliquée par la théorie des bandes est la couleur des matériaux à large bande interdite contenant des impuretés. Par exemple, dans le cas d'un diamant contenant des impuretés, l'énergie de la bande interdite du diamant est d'environ 5,5eV, et la lumière visible n'est pas absorbée lorsqu'elle traverse le diamant ; le diamant pur est incolore, mais la situation change lorsqu'il contient des impuretés.
(1) Le mécanisme de la couleur des diamants jaunes
Les atomes d'azote remplacent les atomes de carbone. Comme les atomes d'azote ont un électron de plus que les atomes de carbone, cet électron supplémentaire forme un niveau d'énergie d'impureté dans la bande interdite, appelé niveau d'énergie du donneur, les atomes d'azote jouant le rôle de "donneurs".
L'existence de ce niveau d'impureté réduit l'énergie de la bande interdite à 4V[ [Figure 3-30 (a)]. Elle peut être encore plus faible, ce qui lui permet d'absorber la lumière ultraviolette et un peu de lumière violette de 3eV, faisant apparaître le diamant en jaune.
Cet effet est important : un atome d'azote pour cent mille atomes de carbone peut rendre le diamant jaune foncé. Toutefois, la réduction de la bande interdite reste insuffisante pour rendre le diamant conducteur à température ambiante.
(2) Mécanisme de la couleur dans les diamants bleus
Le bore ayant un électron de moins que le carbone, il forme un "niveau accepteur" dans la bande interdite du diamant. Il n'a pas d'électrons supplémentaires, mais il peut accepter des électrons de la bande de valence d'un diamant, créant ainsi des trous dans la bande de valence [figure 3-30 (b)] et formant une bande d'énergie d'impureté d'environ 0,4eV au-dessus de la bande de valence, connue sous le nom de niveau accepteur.

Le niveau d'énergie de l'accepteur n'est pas simple ; c'est une structure complexe de bandes d'énergie d'impuretés qui peut produire du bleu. Le niveau d'énergie de l'accepteur crée des "trous" dans la bande de valence, ce qui permet à ce diamant bleu de type II b "trou" de conduire l'électricité.
Un atome de bore sur un million d'atomes de carbone peut former du bleu. En raison de la teneur plus élevée en aluminium dans ce diamant bleu et du fait que l'aluminium possède un électron de couche externe de moins que le carbone, on pensait auparavant que l'aluminium jouait le rôle d'accepteur. Cependant, les expériences actuelles ont prouvé que c'est le bore et non l'aluminium qui joue le rôle d'accepteur.
Les diamants bleus conducteurs de type II b sont naturellement bleus et leur conductivité est l'une des différences avec les diamants bleus irradiés (centres de couleur). Cette propriété est souvent utilisée pour distinguer les deux types de diamants. Cependant, les diamants donneurs d'azote jaunes ne conduisent pas l'électricité, et cette méthode ne peut donc pas être utilisée pour les différencier des diamants jaunes irradiés.
3. Pierres précieuses colorées par des transitions de bandes
La théorie des bandes d'énergie peut expliquer en partie la formation de la couleur des pierres précieuses naturelles. Étant donné que l'énergie de la bande interdite est une propriété inhérente au cristal et qu'elle ne change pas sous l'effet de conditions extérieures, la couleur des pierres précieuses présente une bonne stabilité. La conductivité du cristal peut être déterminée en fonction du remplissage des bandes d'énergie du cristal par des électrons. Le tableau 3-13 énumère les types de couleurs des pierres précieuses qui peuvent être expliquées par la théorie des bandes et leurs propriétés de conductivité.
Tableau 3-13 Types de couleurs des pierres précieuses expliquées par la théorie des bandes et leur conductivité
| Conducteurs (couleurs métalliques et lustre métallique) | Élément | Cuivre, or, fer, argent, mercure, etc. |
| Alliage | Amalgame, Météorite nickel fer | |
| Semi-conducteurs | Bande passante étroite | Gris opaque à noir : altaïte, galène |
| Couleur métallique opaque : cobaltine, marcassite, pyrite, smaltite | ||
| Bande interdite modérée | Rouge : cinabre, proustite, pyrargyrite | |
| Orange : Realgar | ||
| Jaune : Sulfure de cadmium, realgar, soufre. | ||
| Large bande interdite | Incolore : diamant, sphalérite | |
| Semi-conducteurs à large bande interdite contenant des impuretés | Impureté donneuse : Diamant dopé à l'azote (jaune) | |
| Impuretés dans l'hôte : diamant contenant du bore (bleu) |
La couleur des pierres précieuses causée par les transitions de bandes est liée à la structure et au type de liaison au moment de la formation de la pierre précieuse. Elle n'a que peu de rapport avec les impuretés et les défauts cristallins ultérieurs. La taille de l'énergie de la bande interdite des pierres précieuses est fixe. Elle ne change pas en fonction des propriétés du matériau de la pierre précieuse, de sorte que les méthodes d'optimisation conventionnelles ne peuvent généralement pas améliorer la couleur des pierres précieuses.
Section IV Effets optiques physiques
La plupart des pierres précieuses naturelles peuvent provoquer une absorption sélective de la lumière, et différentes pierres précieuses absorbent la lumière visible à différentes longueurs d'onde, ce qui donne des couleurs différentes. Outre l'absorption sélective de la lumière, la structure interne des cristaux des pierres précieuses peut également provoquer des effets optiques physiques, ce qui se traduit par des couleurs différentes dans les pierres précieuses.
1. Minéraux des pierres précieuses liés aux effets optiques physiques
Les couleurs produites par les effets optiques physiques sont formées par la dispersion, l'interférence, la diffraction et d'autres raisons de la lumière causées par la structure ou la composition du cristal et les inclusions. Il s'agit simplement d'un effet optique qui peut être expliqué par la théorie de l'optique physique. Des pierres précieuses différentes peuvent produire des couleurs différentes sous les mêmes effets optiques. Outre les oligo-éléments communs à l'origine de la couleur, les raisons des couleurs produites par des effets optiques physiques sont principalement liées à la structure interne et aux propriétés physiques des pierres précieuses. Les types de minéraux des pierres précieuses qui provoquent des couleurs dues à des effets optiques physiques sont énumérés dans le tableau 3-14.
Tableau 3-14 Types de pierres précieuses causées par des effets optiques physiques
| Fonction | Propriétés optiques et couleur | Minéraux gemmes |
|---|---|---|
| Dispersion Diffusion | Miroir | "Feu" dans les pierres précieuses en dispersion, telles que les diamants, le zircon, le rutile et le titanate de strontium. |
| Bleu | Pierre de lune, quartz bleu, opale | |
| Pourpre | Fluorite (diffusion de microcristaux de calcium) | |
| Rouge | Verre rubis, dispersion de microcristaux de cuivre ou d'or | |
| Blanc | Quartz laiteux | |
| Effet œil de chat | aigue-marine œil de chat, pyroxène œil de chat, etc. | |
| Effet de la lumière des étoiles | Différents effets d'étoile du corindon et du grenat | |
| Éclat | Éclat des perles, de l'apophyllite, etc. | |
| Étincelles | Éclat d'aventurine, d'obsidienne, etc. | |
| Interférence Diffraction | Les couleurs spectrales pures des films minces | L'arc-en-ciel de la chalcopyrite, la pellicule décolorée dans une fissure de quartz irisé |
| Effets d'interférence | Changement de couleur de l'opale, effet de la labradorite | |
| Inclusion | Bleu | Dumortierite dans du quartz |
| Vert | Calcédoine verte et veines de nickel dans la calcédoine verte, fuchsite dans le quartz étoilé | |
| Orange | Oxyde de fer hydraté dans l'opale de feu et la calcédoine de couleur chair | |
| Rouge | Flocons d'hématite dans de l'orthoclase |
2. Effets d'interférence et de diffraction
(1) Effets d'interférence
Les phénomènes d'interférence se produisent lorsque deux faisceaux de lumière se propagent le long du même chemin optique ou dans des directions parallèles. Un phénomène d'interférence courant dans les pierres précieuses est l'iridescence. Par exemple, dans le quartz irisé, les couleurs d'interférence dépendent de l'épaisseur du film, de l'indice de réfraction du film et de la nature de la lumière incidente.
Les couleurs d'interférence des perles sont formées par la superposition alternée en couches concentriques de deux substances ayant des indices de réfraction différents (aragonite et nacrum), où la lumière incidente est réfléchie par les surfaces entre les couches alternées, et la lumière réfléchie interfère avec la lumière incidente pour produire de belles couleurs d'interférence.
(2) Effets de diffraction
La diffraction désigne le phénomène physique par lequel les ondes lumineuses s'écartent de leur propagation en ligne droite lorsqu'elles rencontrent des obstacles. En physique, les ondes lumineuses subissent des degrés variables de courbure et de diffusion lorsqu'elles traversent des obstacles tels que des fentes, des petits trous ou des disques. Si un obstacle est placé entre la source lumineuse et l'écran d'observation, des zones claires et sombres apparaissent sur l'écran d'observation, et les limites de ces zones ne sont pas nettes, formant un motif complexe de lumière et d'obscurité. Ce phénomène est appelé diffraction. Ce phénomène peut se produire lorsque les ondes lumineuses rencontrent des obstacles sur leur chemin de propagation. Le facteur le plus important dans la production de la diffraction est la présence de réseaux de diffraction périodiquement espacés dans les minéraux des pierres précieuses.
① Changement de couleur de l'opale
Dans l'opale, les sphères de silice contenant de l'eau ont des diamètres égaux et sont disposées en couches alternées régulières, formant des réseaux de diffraction périodiquement espacés. Lorsque la lumière pénètre dans l'opale, la diffraction se produit et modifie la couleur (figures 3-31, 3-32). Les types de couleurs et le degré de changement de couleur dépendent principalement de l'espacement interplanaire des sphères de silice empilées.

Par exemple, l'opale avec une structure de plaque cubique à face centrée et un espacement de réseau de 3×10-10m présente des couleurs allant du vert au rouge ; ce type d'opale avec un espacement de réseau de 2,5×10-10m affiche des couleurs allant du bleu au jaune.
② Effet Labradorite
La labradorite présente également des effets similaires à ceux de l'opale (figure 3-33). La labradorite est également connue sous le nom de spectrolite parce qu'elle peut clignoter avec la lumière colorée du soleil. Différents types de labradorite de Finlande peuvent présenter une gamme de couleurs spectrales, un phénomène connu sous le nom d'"effet labradorite". L'effet de changement de couleur de la labradorite est dû à la fusion de petites couches de plagioclase de compositions différentes. Les légères différences d'indice de réfraction entre les différents feldspaths provoquent des interférences et une diffraction de la lumière, ce qui entraîne une luminescence et un changement de couleur. Les couleurs produites par cette structure sont liées à l'épaisseur relative des couches et à leurs indices de réfraction. Occasionnellement, l'andradite du Mexique présente également des phénomènes de diffraction.

3. Diffusion et inclusions
(1) Diffusion
La diffusion se produit généralement lorsque la structure interne des pierres précieuses est irrégulière ou lorsque la taille des composants dépasse les limites des conditions de diffraction. Les effets de couleur produits par la diffusion sont liés à la taille et à la forme des particules de la matière précieuse. Lorsque la lumière incidente interagit avec des particules disposées de manière irrégulière et de taille inférieure à la longueur d'onde de la lumière visible, les ondes lumineuses de haute énergie transmises sont plus fortes que les ondes lumineuses de faible énergie, ce qui signifie que dans la plupart des cas, seuls le violet et le bleu sont visibles. Par exemple, le SiO2 Les petites sphères de l'opale ont un diamètre inférieur à la longueur d'onde de la lumière visible, et lorsque la taille des particules diffusantes est proche de la longueur d'onde de la lumière visible, des couleurs diffusantes peuvent également apparaître.
Par exemple, la fluorine violette est due à une irradiation radioactive qui expulse les atomes de fluor, ce qui a pour effet de condenser les atomes de calcium liés aux atomes de fluor en plaques hexagonales d'une taille comparable à la longueur d'onde de la lumière visible. L'interaction entre les plaques de calcium et les ondes lumineuses produit une diffusion. Elle absorbe certaines ondes lumineuses, créant un pic d'absorption important dans la région de la lumière verte à rouge, ce qui permet à la lumière violette de passer à travers et de produire la couleur violette.
Étant donné que des particules d'éléments métalliques de même taille peuvent produire des effets de couleur similaires et que des particules métalliques différentes peuvent produire des couleurs différentes, certaines imitations de pierres précieuses sont fabriquées en utilisant cette propriété.
Par exemple, le verre "rubis" est produit en ajoutant des particules de cuivre ou d'or au verre, ce qui donne une couleur rouge semblable à celle des rubis. Lorsque le matériau gemme contient des inclusions, des microfissures ou des bulles plus grandes que la longueur d'onde de la lumière visible, les ondes lumineuses interagissent avec ces particules diffusantes, ce qui entraîne une recombinaison des ondes lumineuses diffusées, produisant une lumière laiteuse translucide. Par exemple, certaines imitations de pierres de lune.
L'effet de clair de lune de la pierre de lune est également produit par la diffusion de la lumière (figure 3-34). La pierre de lune est un feldspath alcalin, un composite formé par l'alternance de couches parallèles de feldspath riche en potassium et en sodium. L'épaisseur entre les couches varie généralement de 50 à 1000 nm, les couches les plus fines pouvant produire une diffusion. La même couleur de diffusion peut également se produire dans le plagioclase, connu sous le nom d'"effet labradorite".
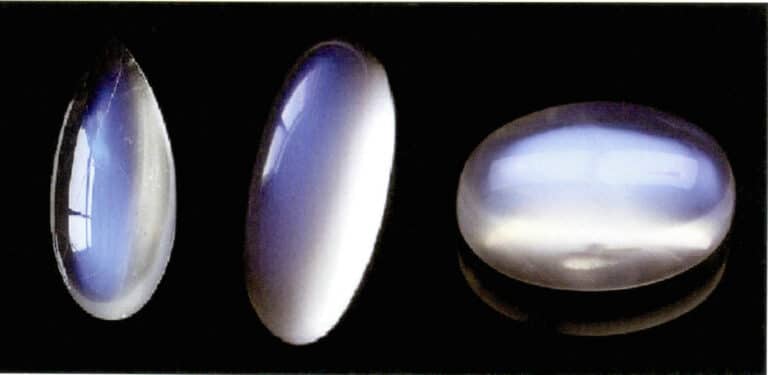
Une disposition spécialement orientée des particules diffusantes peut produire des effets optiques caractéristiques. Par exemple, lorsque les particules diffusantes se présentent sous forme de fibres parallèles, elles produisent un effet d'œil de chat ou d'étoile, comme les saphirs étoilés et les yeux de chat en quartz. Lorsque les particules diffusantes sont suffisamment grandes pour être distinguées à l'œil nu, elles peuvent produire un "effet de pierre d'or", comme la pierre de soleil (figure 3-35) et le verre de pierre d'or.

(2) Inclusions
La couleur et les phénomènes optiques produits par les inclusions constituent un type particulier de diffusion. Les inclusions colorées incluses dans des cristaux principaux presque incolores présenteront la couleur des inclusions, comme la calcédoine rubanée contenant du nickel et l'oxyde de fer(II) contenant de l'eau (FeO - H2O) ; la couleur de l'orthoclase de Madagascar et de certaines cordiérites est due à des inclusions d'hématite légèrement plus grandes, mais toujours microscopiques, qui donnent des teintes rouges ; des inclusions sub-microscopiques d'hydroxyde ferrique colorent souvent l'opale de feu.
Les diamants présentent souvent des couleurs différentes en raison de la présence de nombreuses inclusions. Les diamants colorés par des inclusions peuvent être noirs, rouge-orange et rouge-brun. Lorsqu'un diamant contient d'innombrables inclusions minérales sombres et opaques, il apparaît noir ; lorsqu'il est examiné sous une forte lumière transmise, de nombreuses inclusions sombres peuvent être observées, et le diamant apparaît gris foncé ; un autre type d'inclusions secondaires se produit dans les fissures du diamant. Lorsque les fissures se développent et sont remplies de ces inclusions colorées, le diamant apparaît brun-rouge ou rouge-orange, ce qui est également connu sous le nom de diamant "oxydé".
4. Dispersion
Le phénomène de décomposition de la lumière blanche en différentes couleurs spectrales à travers un objet est appelé dispersion. La dispersion des pierres précieuses fait référence à la propriété de la lumière de se disperser en différentes longueurs d'onde de couleurs spectrales lorsqu'elle traverse les plans inclinés des pierres précieuses transparentes. En raison des différentes longueurs d'onde de la lumière monochromatique qui composent la lumière blanche et qui se propagent à différentes vitesses et indices de réfraction dans différents matériaux, la lumière blanche peut être décomposée en différentes couleurs spectrales dans certaines conditions. La taille de la valeur de dispersion d'une pierre précieuse est déterminée par ses propriétés physiques ; chaque pierre précieuse a sa propre valeur de dispersion, qui ne change pas en fonction des propriétés de la pierre précieuse. Le charme unique des diamants est étroitement lié à leur valeur de dispersion élevée (0,044).
La plupart des simulants du diamant ont une valeur de dispersion plus élevée, comme la valeur de dispersion du zircon de 0,039 et la valeur de dispersion de la moissanite synthétique de 0,104. La comparaison des valeurs de dispersion des diamants et de leurs simulants communs est présentée dans le tableau 3-15.
Tableau 3-15 Comparaison des valeurs de dispersion des diamants et de leurs simulants communs
| Nom de la pierre précieuse | Valeur de dispersion |
|---|---|
| Diamant | 0.044 |
| Zircon | 0.039 |
| Corindon | 0.018 |
| Spinelle | 0.020 |
| Topaze | 0.014 |
| Béryl | 0.014 |
| Cristal | 0.014 |
| Rutile synthétique | 0.280 |
| Titanate de strontium synthétique | 0.190 |
| Moissanite synthétique | 0.104 |
La dispersion est communément appelée le "feu" des pierres précieuses. Par exemple, les diamants ont une valeur de dispersion élevée et leur feu est très prononcé, ce qui renforce le statut déjà royal des diamants et met en valeur leur charme unique.
Il existe de nombreux types de couleurs produites par des effets optiques physiques, qui peuvent tous être expliqués par la théorie de l'optique physique. À l'exception de la dispersion, qui est une propriété inhérente à la pierre précieuse elle-même, d'autres phénomènes sont causés par des changements structurels après la formation de la pierre précieuse et par les différences dans les inclusions mécaniques. La compréhension des différentes causes de la couleur des pierres précieuses fournit une base théorique pour optimiser le traitement des pierres précieuses naturelles et synthétiques.