De ce pietrele prețioase au mai multe culori?
Introducere în teoria câmpului cristalin, teoria orbitalului molecular și teoria benzii energetice
Culorile pietrelor prețioase sunt bogate și variate, având un farmec unic pe care oamenii l-au iubit întotdeauna. Calitatea pietrelor prețioase depinde în mare măsură de culoarea lor. Culoarea unei pietre prețioase este un indicator important în evaluarea pietrelor prețioase, iar majoritatea tratamentelor de optimizare pentru pietre prețioase implică schimbarea sau îmbunătățirea culorii acestora. Prin urmare, înțelegerea cauzelor colorării pietrelor prețioase este o condiție prealabilă esențială pentru tratamentul de optimizare a pietrelor prețioase. Numai prin înțelegerea modului în care pietrele prețioase își dobândesc culoarea se poate determina dacă o piatră prețioasă poate fi optimizată, ce schemă de optimizare să se adopte și ce plan experimental să se stabilească. Există cinci teorii comune ale colorării pietrelor prețioase: teoria mineralogiei clasice, teoria câmpului cristalin, teoria orbitalului molecular, teoria benzii energetice și efectele optice fizice. Aceste teorii constituie teoriile de colorare a pietrelor prețioase naturale comune, iar cele ce urmează reprezintă o scurtă prezentare a acestor cinci teorii de colorare.
Orbitali moleculari formați din doi orbitali atomici s
Tabla de conținut
Secțiunea I Teoria câmpului cristalin
În anii 1930, oamenii de știință au propus teoria câmpului cristalin pentru a explica proprietățile cristalelor. Teoria câmpului cristalin este o teorie care studiază legăturile chimice ale elementelor de tranziție (complexe). Aceasta explică proprietățile fizice și chimice ale elementelor de tranziție și ale elementelor lantanidice prin combinarea unor puncte de vedere din teoria electrostatică, mecanica cuantică și teoria grupurilor (teoria care studiază simetria materiei), concentrându-se asupra influenței liganzilor asupra orbitalilor d și f ai ionilor centrali. Până în anii 1950, oamenii au aplicat teoria câmpului cristalin la complecși și au propus teoria câmpului ligandului. Teoria câmpului ligand este un progres al teoriei câmpului cristalin; ea ia în considerare atât influența câmpului electric al ligandului asupra ionului central, cât și efectul de umplere al electronilor ligandului asupra ionului central, ceea ce o face mai completă decât teoria câmpului cristalin. Cu toate acestea, nu există o diferență esențială între cele două și, în general, ele nu sunt diferențiate în studiul mineralelor anorganice.
1. Concepte de bază ale teoriei câmpului cristalin
Ionii metalelor de tranziție se află în câmpul cristalin al anionilor sau moleculelor dipolare din jur. Teoria câmpului cristalin este un model electrostatic care vede cristalul ca o interacțiune electrostatică între ioni pozitivi și negativi, în care cationul încărcat pozitiv este numit ionul central, iar anionul încărcat negativ este numit ligand.
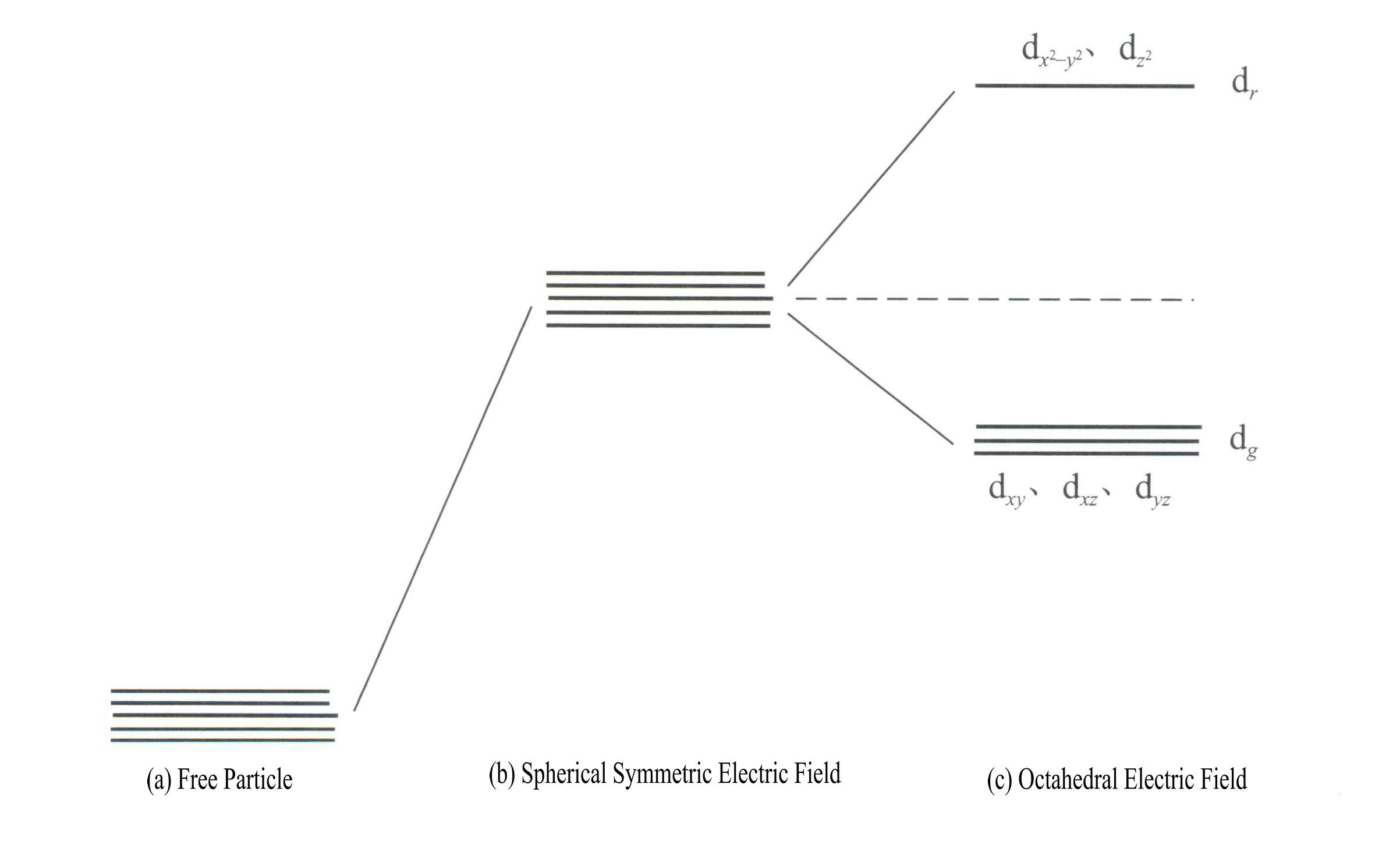
Aplicarea teoriei câmpului cristalin pentru a explica culoarea pietrelor prețioase minerale implică în principal electronii d sau energia electronilor f ai ionilor elementelor de tranziție. De exemplu, orbitalii d au cinci tipuri: dxy, dxz, dyz, d , și d . Acești cinci orbitali d au distribuții spațiale diferite în starea de ion liber, dar au aceeași energie. Cu toate acestea, ei suferă modificări semnificative sub influența câmpului ligandului. Cei cinci orbitali d degenerați energetic ai atomului central se divizează sub influența câmpului electric negativ format de liganzii din jur. Unii orbitali d au energie crescută, în timp ce alții au energie scăzută. Datorită scindării nivelurilor energetice ale orbitalilor d, electronii din orbitalii d ai atomului central se vor rearanja, ocupând preferențial orbitalii cu energie mai scăzută, reducând astfel energia totală a sistemului și făcând complexul mai stabil.
Energia orbitalilor d este aceeași atunci când nu există câmp electric [figura 3-19 (a)]; sub un câmp electrostatic cu simetrie sferică, orbitalii d au o energie crescută, dar nu se separă [figura 3-19 (b)]; atunci când câmpul ligandului este octaedral, se separă în dr și dg. Dintre acestea, dr sunt compuse din d și d , cu energie mai mare; orbitalii d cu energie mai micăg sunt compuse din orbitalii dxy, dxz, dyz.
Ionii metalelor de tranziție se află în câmpul cristalin al anionilor sau moleculelor dipolare din jur. Teoria câmpului cristalin este un model electrostatic care vede cristalul ca o interacțiune electrostatică între ioni pozitivi și negativi, în care cationul încărcat pozitiv este numit ionul central, iar anionul încărcat negativ este numit ligand.
Aplicarea teoriei câmpului cristalin pentru a explica culoarea pietrelor prețioase minerale implică în principal electronii d sau energia electronilor f ai ionilor elementelor de tranziție. De exemplu, orbitalii d au cinci tipuri: dxy, dxz, dyz, d , și d . Acești cinci orbitali d au distribuții spațiale diferite în starea de ion liber, dar au aceeași energie. Cu toate acestea, ei suferă modificări semnificative sub influența câmpului ligandului. Cei cinci orbitali d degenerați energetic ai atomului central se divizează sub influența câmpului electric negativ format de liganzii din jur. Unii orbitali d au energie crescută, în timp ce alții au energie scăzută. Datorită scindării nivelurilor energetice ale orbitalilor d, electronii din orbitalii d ai atomului central se vor rearanja, ocupând preferențial orbitalii cu energie mai scăzută, reducând astfel energia totală a sistemului și făcând complexul mai stabil.
Energia orbitalilor d este aceeași atunci când nu există câmp electric [figura 3-19 (a)]; sub un câmp electrostatic cu simetrie sferică, orbitalii d au o energie crescută, dar nu se separă [figura 3-19 (b)]; atunci când câmpul ligandului este octaedral, se separă în dr și dg. Dintre acestea, dr sunt compuse din orbitalii dx2– y2 și dz2
, cu energie mai mare; energia mai mică dg sunt compuse din orbitalii dxy, dxz, dyz. [Figura 3-19 (c)]
Diferența dintre cel mai înalt și cel mai scăzut nivel energetic după scindarea orbitalului d se numește energie de separare △ . Energiile de separare produse de diferite configurații ale câmpurilor de liganzi nu sunt aceleași (figura 3-20). Ordinea lor energetică este:
Câmpul pătrat > Câmpul octaedral > Câmpul tetraedral

Chiar și în cazul câmpurilor cu aceeași configurație, acestea pot diferi din cauza diferențelor de liganzi și ioni centrali; cu cât este mai mare, cu atât cristalul este mai stabil. Următorii trei factori determină în principal dimensiunea energiei de separare a cristalului:
(1) Cristale formate de același element de tranziție; când liganzii sunt aceiași, cu cât sarcina ionului central este mai mare, cu atât energia de separare △ este mai mare. Cu cât sarcina pozitivă a ionului central este mai mare, cu atât atracția față de liganzi este mai mare, rezultând o distanță mai mică între ionul central și nucleul ligandului și cu cât forța de repulsie a câmpului cristalin generat de liganzi asupra electronilor este mai mare, cu atât energia de separare △ este mai mare.
(2) Pentru cristalele formate din ioni diferiți cu aceeași sarcină pozitivă și aceiași liganzi, cu cât raza ionului central este mai mare, cu atât orbitalii d sunt mai departe de nucleu și cu atât energia de separare △ este mai mare.
(3) Pentru cristalele formate din același ion central și liganzi diferiți, energia de separare variază datorită intensităților diferite ale câmpului cristalin al ligandului. Liganzii diferiți au intensități diferite ale câmpului, iar energia de separare △ variază în funcție de intensitatea câmpului ligandului.
Energia de separare este utilizată pentru a explica calitativ stabilitatea cristalelor; nu este necesar să se obțină valoarea absolută △ , deoarece cunoașterea valorilor relative ale cristalului în diferite condiții este suficientă.
Pe baza energiei relative a orbitalilor d divizați, se poate calcula energia totală a ionilor metalului de tranziție în orbitalii d. Această energie este mai mică decât înainte de scindare, oferind astfel o energie suplimentară cristalului, cunoscută sub numele de energie de stabilizare a câmpului cristalin, reprezentată prin simbolul CFSE. Tabelul 3-10 enumeră energiile de stabilizare ale ionilor care conțin dn electroni în condiții diferite.
Tabelul 3-10 Energiile de stabilizare a câmpului cristalin sub diferiți liganzi (Wu Ruihua, 1994)
| dn | Câmp slab | Câmp puternic | ||||
|---|---|---|---|---|---|---|
| dn | Pătrat | Octaedru regulat | Tetraedru regulat | Pătrat | Octaedru regulat | Tetraedru regulat |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Caracteristicile de culoare ale ionilor metalelor de tranziție
În cazul pietrelor sale prețioase colorate, culoarea majorității pietrelor prețioase se datorează ionilor metalelor de tranziție, iar culoarea pietrelor prețioase este legată de faptul dacă ionii coloranți conțin electroni neîmperecheați în orbitalii d sau f. Caracteristicile de colorare ale ionilor metalelor de tranziție includ în principal următoarele aspecte:
(1) Colorarea ionilor metalelor de tranziție este legată de stările electronice ale orbitalului d sau orbitalului f. Atunci când electronii orbitalului d sau ai orbitalului f sunt plini sau goi, piatra prețioasă nu va prezenta culoare. De exemplu, Cr6+, Ce4+, și Cu+.
(2) Diferiți ioni coloranți prezintă culori diferite în același material de piatră prețioasă. Datorită energiilor de separare diferite ale diferiților ioni coloranți, aceștia pot prezenta culori diferite chiar și în același material. De exemplu, Fe2+ produce o culoare ușor gri-albastru în spinel, în timp ce Cr3+ produce roșu.
(3) Ionii coloranți ai aceluiași element în stări de valență diferite prezintă adesea culori diferite în același material de piatră prețioasă. Deoarece energia necesară pentru tranzițiile electronilor d ai ionului central este diferită, lungimile de undă absorbite ale luminii sunt diferite, rezultând culori diferite. De exemplu, un castru care conține Mn2+ prezintă o nuanță roz moale, în timp ce un beriliu care conține Mn2+ prezintă roșu aprins, cunoscut sub numele de beriliu roșu.
(4) Ionii coloranți ai aceluiași element în aceeași stare de valență prezintă adesea culori diferite atunci când au configurații diferite ale liganzilor. De exemplu, Co2+ în configurația tetraedrică a spinelului prezintă o culoare caracteristică "albastru diamant", în timp ce în configurația octaedrică a calcitului, acesta apare roz. Fe2+ în olivina coordonată octaedral prezintă un verde măsliniu caracteristic, în timp ce în almandina coordonată cubic distorsionat, acesta apare roșu închis.
(5) Același tip de ioni colorați au aceeași stare de valență și aceeași geometrie de coordonare, dar diferiți atomi de coordonare adiacenți prezintă culori diferite. De exemplu, în coordonarea tetraedrică a Co2+, în defalerit, Co2+ este conectat la sulf, prezentându-se în verde, în timp ce în spinel, Co2+ este conectat la oxigen, fiind albastru.
(6) Același tip de ioni colorați cu aceeași stare de valență, geometrie de coordonare și atomi adiacenți prezintă culori diferite în pietre prețioase diferite. Distorsiunea geometriei de coordonare cauzată de compozițiile chimice diferite ale pietrelor prețioase modifică natura legăturilor chimice dintre ionul central și liganzii coordonatori, modificând energia de tranziție a electronilor d. De exemplu, Cr3+ apare roșu în rubin, verde în smarald și prezintă culori variabile în alexandrit. Motivul pentru astfel de schimbări în Cr3+ este legată de caracteristicile sale și de liganzii coordonatori adiacenți, cu analiza caracteristicilor specifice după cum urmează.
① Cr3+ Caracteristici:
Cr3+ are o structură externă a învelișului electronic de 3s23p63d3, cu 11 electroni în învelișul exterior, aparținând unei structuri neregulate (8-18) a învelișului electronic.
Această structură are un efect de ecranare mai mic asupra nucleului decât structura de înveliș cu 8 electroni, rezultând Cr3+ având o sarcină pozitivă efectivă mai mare, în timp ce raza sa ionică este, de asemenea, mai mică, ceea ce formează caracteristicile de bază ale Cr3+: un câmp electric puternic pozitiv și orbitali d goi. Cr3+ poate oferi șase orbitali goi pentru a găzdui șase liganzi coordonatori, cu o configurație spațială octaedrică, aparținând lui d2sp3 hibridizare (figura 3-21).
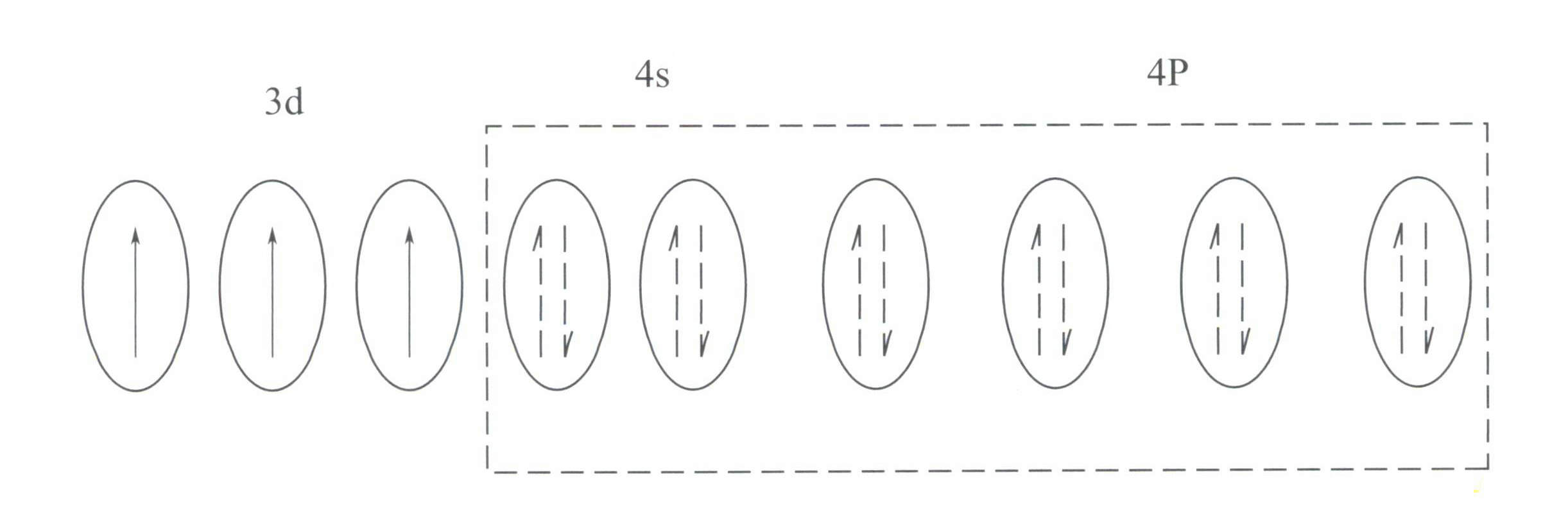
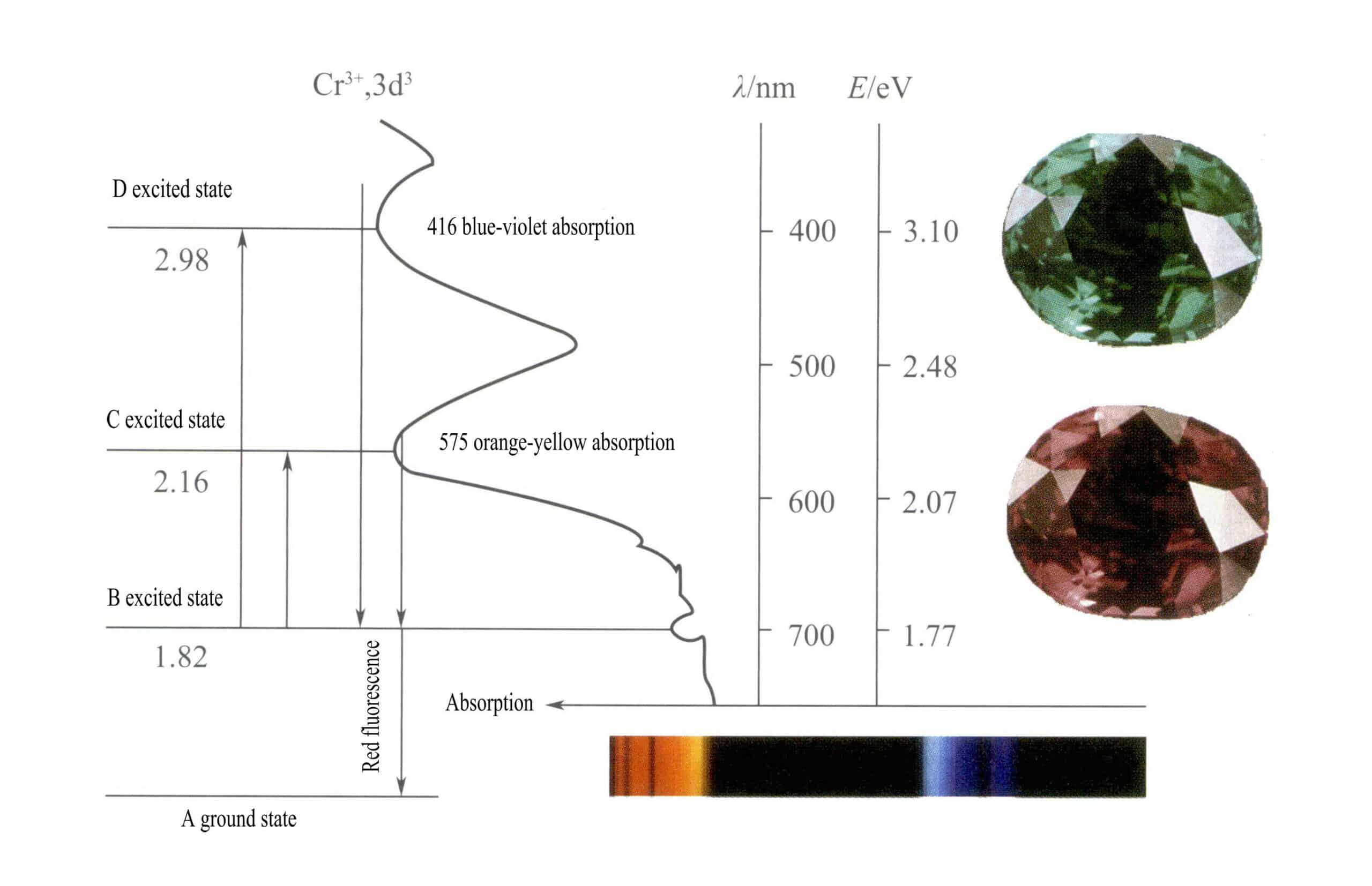
Conform teoriei câmpului cristalin, într-un câmp octaedric, orbitalii d ai Cr3+ se poate diviza în energie mai mică dƐ și orbita de energie mai mare dr orbită. Deoarece cei trei electroni d ai Cr3+ sunt toate în dƐ și sunt toți electroni simpli, tranzițiile d-d pot apărea în lumina vizibilă, făcând ca pietrele prețioase care conțin Cr3+ să prezinte culoare.
② Mecanismul de colorare a Cr3+:
În rubin Principala componentă chimică a rubinului este Al2O3. Atunci când câteva procente de Cr3+ îl înlocuiește pe Al3+, produce o culoare roșu aprins. În structura rubinului, datorită razei mai mari a Cr3+ comparativ cu raza de Al3+, Cr3+ intră în rețeaua corindonului, reducând simetria în jurul oxidului de aluminiu.
Orbitalii d ai Cr3+ se despart, iar când electronii din starea excitată se întorc din D sau C în starea fundamentală A, trebuie să treacă mai întâi prin B, eliberând căldură. Ei se întorc din B în A, însoțiți de luminescență, emițând fluorescență roșie. În acest proces, electronii absorb energia luminoasă, făcând ca rubinul să absoarbă spectrul vizibil D violet (400 nm) și C galben-verde (555 nm) (figura 3-22), formând o bandă de absorbție.

Atunci când lumina albă trece printr-un rubin, fotonii din spectrul de la violet la galben-verde sunt absorbiți, în timp ce aproape toată lumina roșie și o parte din lumina albastră trec, dând rubinului o culoare roșu intens cu o nuanță de violet, cunoscută sub numele de roșu sânge de porumbel.
Rubinele prezintă o scurtă absorbție de nivel B, manifestată ca fluorescență roșie. Această absorbție de nivel B care produce fluorescența roșie face culoarea rubinului mai vie; cu cât conținutul de ioni de crom este mai mare, cu atât fluorescența este mai puternică.
Ionii de fier din piatra prețioasă pot suprima fluorescența absorbției de nivel B, explicând fenomenul în care rubinele par mai întunecate atunci când conțin impurități de fier.
③ Cr3+ Mecanismul de colorare în smaralde
Principala componentă chimică a smaraldului este Be3Al2Si6O18, Cr3+, care înlocuiește Al3+ în rețeaua de smarald, iar Cr3+ este, de asemenea, înconjurat de un octaedru compus din șase ioni de oxigen, în care ionii de Cr3+Lungimea legăturii -O este, de asemenea, destul de similară cu cea din rubine. Cu toate acestea, comparativ cu rubinele, smaraldele au cu doi ioni mai mult, Be2+ și Si4+. În structura smaralde, natura legăturilor covalente dintre oxizii metalici crește, în timp ce caracteristicile ionice slăbesc.
Modificările minore, cum ar fi legăturile chimice, conduc la o ușoară scădere a Cr3+energia nivelului C și a nivelului D, rezultând o ușoară deplasare a benzii de absorbție (figura 3-23), blocând în mod semnificativ transmisia luminii albastru-violet (425nm) și portocaliu-galben (608nm) din spectru, crescând în același timp transmisia luminii albastru-verde, formând astfel verdele smarald caracteristic.

Absorbția de nivel B a dioptazei este aproape neschimbată. Atunci când impuritatea fier nu are niciun efect "inhibitor" în componenta smarald, fluorescența roșie puternică face ca verdele smarald caracteristic să strălucească și mai puternic.
④ Cr3+ Mecanismul culorii în alexandrit:
Culoarea alexandritului este cauzată și de Cr3+ înlocuirea Al3+ în coordonare octaedrică distorsionată. Datorită faptului că compoziția chimică a alexandritului este BeAL2O4, natura legăturilor chimice dintre ionii săi metal-oxigen se situează între cea a rubinului și cea a smaraldului. Prin urmare, benzile sale de absorbție se situează, de asemenea, între cele ale rubinului și ale smaraldului, probabilitățile de transmisie ale luminii albastru-violet și portocaliu-galben fiind aproximativ egale, ceea ce face imposibilă determinarea faptului dacă lumina roșie sau albastru-verde este dominantă (figura 3-24).
Prin urmare, culoarea alexandritului nu poate depinde decât de distribuția energiei și de gama de culori a luminii incidente, rezultând astfel "efectul de schimbare a culorii" alexandritului, și anume apariția culorii verzi în lumina zilei cu o componentă ridicată de lumină albastră și a culorii roșii în lumina incandescentă cu o componentă ridicată de lumină roșie. De aceea, alexandritul este adesea numit "smaraldul zilei și rubinul nopții".
"Efectul de schimbare a culorii" apare în multe tipuri de pietre prețioase, cum ar fi corindonul care își schimbă culoarea și granatul care își schimbă culoarea. În prezent, corindonul cu schimbare de culoare sintetizat artificial este produs utilizând principiul schimbării culorii, folosind V3+ ca ion colorant pentru sinteză.
3. Culorile mineralelor prețioase
Culorile produse de componentele metalelor de tranziție pot fi deduse din compoziția chimică a pietrelor prețioase. De exemplu, turcoazul care conține Cu2+ trebuie să fie albastru, în timp ce Cu+ este incolor. Tabelul 3-11 enumeră culorile produse de componentele comune ale metalelor de tranziție din pietrele prețioase naturale.
Tabelul 3-11 Culori produse de componentele metalelor de tranziție în mineralele gemelor naturale
| Element | Culoare | Minerale comune |
|---|---|---|
| Ceriu (Ce) | Galben | Parisită |
| Crom (Cr) | Roșu, verde, portocaliu, etc. | Crocoisită, Crocoisită roșie, Uvarovită |
| Cobalt (Co) | Albastru | Spinel sintetic |
| Cupru (Cu) | Albastru, verde | Azurit, crizocolă , turcoaz malachit, dioptază |
| Fier (Fe) | Roșu, verde, galben | Almandină, olivină, goethit |
| Mangan (Mn) | Roz, portocaliu | Rodonit, spessartină |
| Nichel (Ni) | Verde | Bunsenit, Calcedonie |
Culoarea majorității pietrelor prețioase este cauzată de impuritățile metalelor de tranziție pe care le conțin. De exemplu, rubinele au un aspect roșu din cauza urmelor de Cr3+. Diverși factori influențează culoarea cauzată de ionii de impuritate din piatra prețioasă. Prin urmare, impuritățile pot produce culori diferite în pietre prețioase diferite. De exemplu, Cr3+ apare roșu în rubine și verde în smaralde.
Aceleași impurități nu pot cauza neapărat aceeași culoare a unei pietre prețioase. De exemplu, culoarea verde a celor mai multe smaralde este cauzată de Cr, în timp ce culoarea verde a unor smaralde este parțial sau în întregime cauzată de vanadiu (V).
Teoria câmpului cristalin poate fi utilizată nu numai pentru a explica culorile pietrelor prețioase produse de componentele sau impuritățile metalelor de tranziție, ci și culorile produse de defectele structurale (centrele de culoare); procesul specific de generare a culorilor poate fi menționat în capitolul 3.3 din această carte.
Există, de asemenea, deficiențe în explicarea culorilor minerale ale pietrelor prețioase prin teoria câmpului cristalin, reflectate în principal în următoarele aspecte:
(1) Electronii ionului central d nu sunt complet localizați în orbitalii lor originali. Ei pot apărea și în jurul atomilor coordonatori, indicând o interacțiune covalentă între atomul central și liganzi.
(2) Acesta ia în considerare numai interacțiunea ionică electrostatică dintre atomul central și liganzi, ignorând complet interacțiunea de legătură covalentă dintre atomul central și liganzi. În cercetarea fizică, rezultatele calculelor cantitative diferă adesea semnificativ de situațiile reale.
(3) Motivele culorii mineralelor prețioase, pe lângă interacțiunea dintre ionul central și liganzi, se pot datora și efectelor combinate ale defectelor structurale și câmpului cristalin.
Secțiunea II Teoria orbitalului molecular
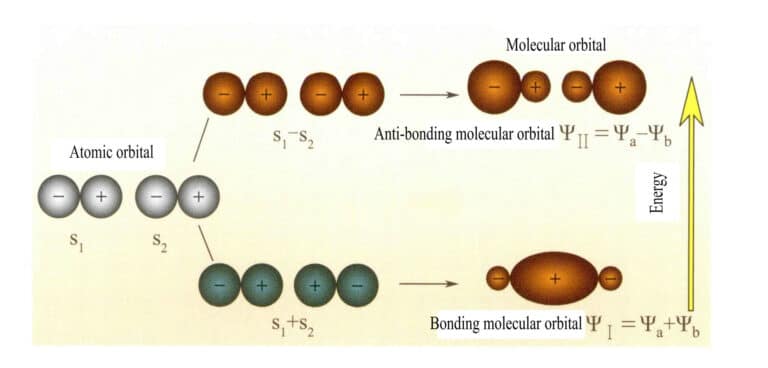
Mulliken și Hund au propus inițial teoria orbitalului molecular (teoria MO). Prin explorarea continuă a multor oameni de știință, aceasta a devenit o teorie matură. Orbitalele moleculare (MO) pot fi obținute prin combinații liniare de orbitale atomice, o metodă frecvent utilizată pentru construirea orbitalelor moleculare. Din n orbitali atomici se pot obține n orbitali moleculari, iar coeficienții combinației liniare pot fi determinați utilizând metoda variațională sau alte metode. Orbitalele moleculare formate din doi orbitali atomici, cu niveluri de energie mai mici decât cele ale orbitalilor atomici, se numesc orbitali de legătură; cele cu niveluri de energie mai mari decât cele ale orbitalilor atomici se numesc orbitali de antilegătură; cele cu niveluri de energie apropiate de cele ale orbitalilor atomici sunt, în general, orbitali de nelegătură.
Teoria orbitalului molecular este o teorie utilizată pentru a explica aspecte precum formarea, structura și proprietățile moleculare. De asemenea, poate explica unele dintre cauzele culorilor pietrelor prețioase, care au fost dezvoltate pe baza teoriei câmpului cristalin și a teoriei orbitalului molecular al metalelor de tranziție. Orbitalii moleculari sunt o extensie naturală a orbitalilor atomici. Într-o moleculă, electronii nu mai aparțin unui anumit atom, ci se deplasează în întreaga gamă moleculară; prin urmare, mișcarea electronilor într-o moleculă este descrisă cu ajutorul orbitalilor moleculari.
1. Concepte de bază ale teoriei orbitalului molecular
Teoria orbitalilor moleculari presupune că, după ce atomii formează o moleculă, electronii nu mai aparțin orbitalilor atomici originali, așa cum propune teoria câmpului cristalin, ci se deplasează în cadrul anumitor orbitali moleculari. Orbitalele moleculare alcătuiesc o moleculă la fel cum orbitalele atomice alcătuiesc un atom. Electronii de valență nu mai sunt considerați localizați în atomi individuali, ci se deplasează în întreaga moleculă. Distribuția electronilor în moleculă poate fi tratată în conformitate cu principiile de distribuție a electronilor în atomi (principiul energiei minime și regula lui Hund).
Combinația liniară a orbitalilor atomici într-o moleculă formează orbitalii moleculari. Numărul orbitalilor moleculari este egal cu numărul orbitalilor atomici înainte de combinare. Combinarea orbitalilor atomici în orbitali moleculari efectivi trebuie să respecte următoarele trei principii:
(1) Principiul potrivirii simetriei: Numai orbitalii atomici cu aceeași simetrie pot forma orbitalii moleculari.
(2) Principiul proximității energetice: Numai orbitalii atomici cu energii similare se pot combina pentru a forma orbitalii moleculari efectivi.
(3) Principiul suprapunerii maxime: În condiții de compatibilitate a simetriei, cu cât este mai mare suprapunerea orbitalilor atomici, cu atât scade energia orbitalilor moleculari rezultați și cu atât este mai stabilă legătura chimică rezultată.
Orbitalul molecular ψ este funcția de undă a unui singur electron. Acesta poate fi reprezentat ca o combinație liniară de orbitali atomici, fiecare orbital corespunzând unei energii specifice, care este suma energiei cinetice și potențiale a electronului care se deplasează în câmpul electric molecular. Doi orbitali atomici, a și b, prin combinații liniare suprapuse, produc doi orbitali moleculari ψI și ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Atunci când orbitalii moleculari cu electroni sunt ocupați primii, orbitalii de legătură ψI sunt ocupate primele. Atunci când electronii ocupă orbite moleculare cu energie egală, conform regulii lui Hund, aceștia ar trebui să ocupe, pe cât posibil, și orbite moleculare diferite cu aceeași direcție de spin.
Orbitalii moleculari ψI obținute prin adăugarea a două funcții orbitale atomice (ecuația 3-5) se numesc orbitali moleculari de legătură. Orbitalele moleculare ψII obținute prin scăderea a două funcții orbitale atomice (ecuația 3-6) se numesc orbitali moleculari antilegători. Energia orbitalilor moleculari de legătură este mai mică decât cea a orbitalilor moleculari antilegători și mai mică decât energiile celor doi orbitali atomici originali. Astfel, la fel ca în cazul umplerii orbitalilor atomici, atunci când se umplu orbitalii moleculari, electronii sunt mai întâi plasați în orbitalii de legătură, iar un orbital molecular poate găzdui doi electroni cu spini opuși. Atunci când electronii ocupă orbitali moleculari cu energie egală, în conformitate cu regula lui Hund, aceștia ar trebui să ocupe, pe cât posibil, și orbitali moleculari diferiți cu aceeași direcție de spin. Orbitalele moleculare formate din doi orbitali atomici s sunt prezentate în figura 3-25.

Orbitalii p și orbitalii d pot forma, de asemenea, orbitali moleculari cu niveluri energetice diferite; de exemplu, combinația orbitalilor moleculari diatomici în O2 moleculelor este relativ complexă.
În cadrul experimentelor, au fost măsurate proprietățile magnetice ale acestor doi electroni individuali, ceea ce a oferit un sprijin puternic pentru teoria orbitalului molecular. Spre deosebire de moleculele compuse din aceiași atomi, cele compuse din doi sau mai mulți atomi diferiți au niveluri energetice ale orbitalului molecular mai complexe, dar principiul este același.
2. Caracteristici de colorare prin transfer de sarcină
Această teorie a orbitalilor moleculari, în care întreaga moleculă împarte electronii, este, de asemenea, considerată ca tranziția electronilor de la un orbital atomic la altul, cunoscută sub numele de transfer de sarcină. Transferul de sarcină poate avea loc în interacțiunile metal-metal (M-M), nemetal-non-metal (L-L) și nemetal-metal (L-M). Dintre acestea, L-L, M-L aceste două tipuri de legături sunt adesea în primul rând legături covalente. O2 aparține transferului de sarcină L-L, care este o legătură covalentă.
(1) Transferul de sarcină metal-metal (transfer de sarcină M - M)
Acest tip de transfer de sarcină are loc, în general, între ionii metalelor de tranziție comune. Majoritatea cauzelor de colorare a pietrelor prețioase colorate sunt produse de transferul de sarcină metal-metal. Transferul de sarcină M-M include în principal următoarele tipuri: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Transferul de sarcină între metale este împărțit în două tipuri: transferul de sarcină între atomi homonucleari și transferul de sarcină între atomi heteronucleari.
① Transfer de sarcină între atomi izoelectronici
Transferul de sarcină între atomi izoelectronici are loc între doi atomi ai aceluiași element metalic de tranziție în stări de oxidare diferite. De exemplu, Fe2+ și Fe3+ suferă un transfer de sarcină în diferite condiții redox, absorbind energie și producând culoare. Culoarea albastru-violet a iolitului este produsă de transferul de sarcină al ionilor de fier în diferite stări de oxidare. Fe3+ și Fe2+ sunt în poziții tetraedrice și, respectiv, octaedrice, cu doi liganzi conectați prin muchii. Când lumina vizibilă strălucește pe iolit, un electron d al Fe2+ absoarbe lumina de o anumită energie și trece la Fe3+, absorbind lumina galbenă la 588nm și producând o culoare albastru-violet. Acvamarina, turmalina verde și altele pot prezenta, de asemenea, culoare datorită transferului de sarcină între ionii de fier.
② Transfer de sarcină între heteroatomi
Safirele albastre reprezintă cel mai tipic exemplu de culoare produsă prin transferul de sarcină între două tipuri de ioni de metale de tranziție. Poliedrele de coordonare ale ionilor metalici de tranziție sunt conectate prin muchii sau fețe, facilitând transferul de sarcină între metale.
De exemplu, în safire, atunci când ionii de fier și ionii de titan intră în octaedrele conectate, atât Fe, cât și Ti există în două stări de oxidare:
Fe2+ + Ti4+ energie scăzută (3-7)
Fe3+ + Ti3+ energie ridicată (3-8)
Tranziția de la ecuația (3-7) la ecuația (3-8) necesită absorbția unei anumite cantități de energie luminoasă, rezultând o bandă largă de absorbție care variază de la galben la roșu. În schimb, cea mai mare parte a luminii albastre trece prin piatra prețioasă, oferindu-i un aspect albastru.
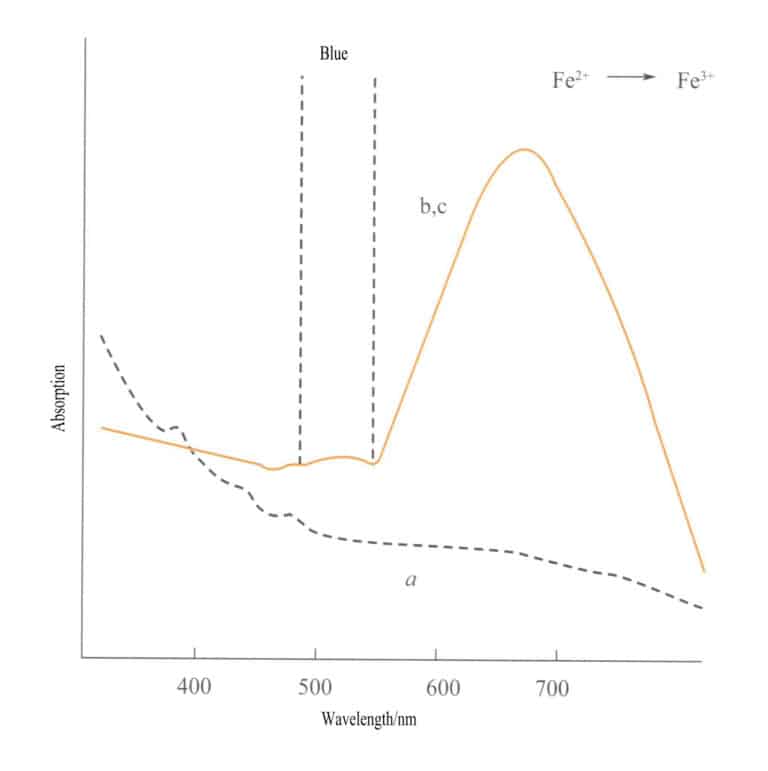
Transferul de sarcină între diferite stări de valență are o direcționalitate puternică, iar pietrele prețioase care prezintă culoare datorită acestui mecanism prezintă adesea pleocroism. De exemplu, acvamarinul colorat de Fe2+→ Fe3+ transferul de sarcină arată culoarea strict de-a lungul direcției axei optice. Figura 3-26 arată că acvamarinul apare galben în planurile b și c. În același timp, nu există un astfel de transfer de-a lungul direcției axei a, ceea ce duce la lipsa absorbției luminii și, prin urmare, la lipsa culorii de-a lungul direcției axei a.
(2) Transfer de sarcină de la nemetal la metal (L-M)
Acest tip de transfer de sarcină L-M are loc adesea între oxigen și ionii metalici, iar unele pietre prețioase care conțin oxigen sunt colorate prin transferul de sarcină de la nemetal la metal, cum ar fi O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
În spectrul de absorbție al oxizilor de fier simpli (figura 3-27), apar două benzi de absorbție slabe în regiunea infraroșie la ilmenit, hematit și lepidocrocit ( tranziții electronice d - d). O bandă de absorbție puternică apare în domeniul undelor scurte, produsă de O2-→Fe3+ transfer de sarcină, iar această bandă de absorbție determină culorile caracteristice ale acestor compuși: brun-roșcat, maro și galben-maroniu.
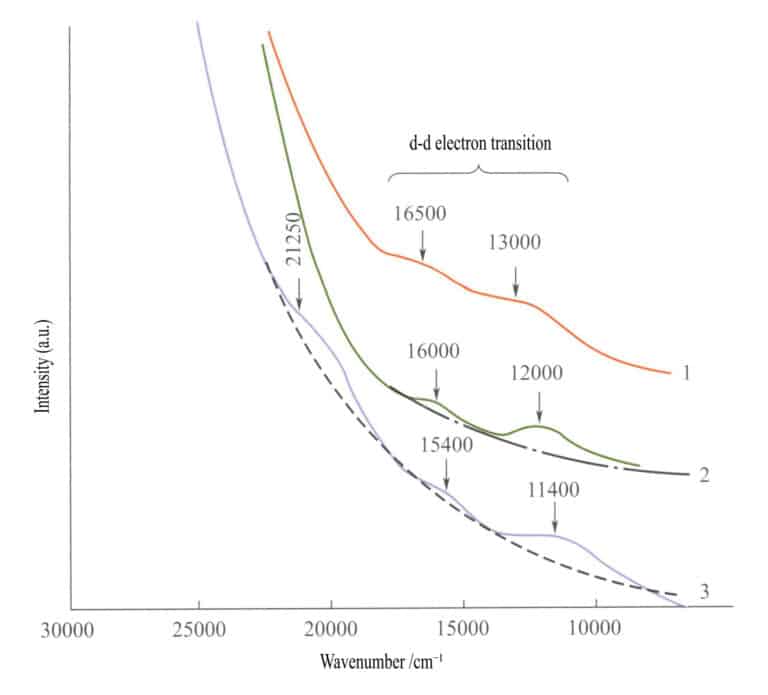
1 - Iilmenit; 2 - Hematit; 3 - Lepidocrocite
Culoarea beriliului galben provine din O2–→ Fe3+ transfer de sarcină. În structura beriliului galben, O2–→ Fe3+ absorbția puternică a transferului de sarcină se poate extinde de la capătul ultraviolet până la capătul albastru al spectrului vizibil, absorbind violet și albastru, rezultând o culoare galbenă.
Safirul, care are un mediu de coordonare complet diferit de beriliu, poate produce, de asemenea, aceleași benzi spectrale de absorbție ca beriliul, rezultând galben, care este, de asemenea, un rezultat al O2–→ Fe3+ transfer de sarcină.
Conform teoriei câmpului cristalin, unele minerale prețioase nu conțin electroni nepereche și nu pot produce culoare. De exemplu, straturile electronice ale crocoitei (PbCrO4), Pb2+, Cr6+, și O2– sunt pline. Totuși, în CrO42- sunt "orbitali moleculari", care corespund stărilor excitate în timpul O2-→Cr6+ transfer, formând benzi de absorbție și prezentând culoarea portocalie.
L→M Transferul de sarcină include, de asemenea, transferul de sulf la metal, ca în pirita obișnuită; acest fenomen optic cauzat de transfer este mai ușor de înțeles atunci când este discutat folosind teoria benzilor.
(3) Transfer de sarcină de la nemetal la nemetal (L-L)
Teoria orbitală moleculară sugerează că culoarea albastru închis a lapis lazuli se datorează nivelurilor energetice de excitație ale S3- grup atomic.
În grafit, inelele de șase atomi de carbon sunt dispuse în straturi. De-a lungul acestui strat, electronii se pot deplasa într-o anumită măsură liber, rezultând o absorbție puternică a luminii, anizotropie și conductivitate.
Unele pietre prețioase organice, cum ar fi chihlimbarul și perlele, au electroni care se mișcă și se excită prin grupele atomice ale pigmenților organici în orbite moleculare comune, provocând absorbția luminii vizibile și producând culoare. De exemplu, "galbenul de miere" al chihlimbarului, culorile coralului și unele scoici și perle colorate.
Mecanismele de culoare ale pietrelor prețioase comune sunt prezentate în tabelul 3-12.
Tabelul 3-12 Clasificarea mecanismelor de culoare ale pietrelor prețioase comune
| Transfer de sarcină metal - metal | Fe2+ - Fe3+ /Fe3+ - Fe2+ : iolit (albastru), berthierit (albastru), magnetit (negru) etc. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Kyanite (albastru), Safir (albastru) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganit (negru), Bixbyit (negru) | |
| Transfer de sarcină de la un metal la altul | O2- -Fe3+: Beril galben auriu, safir galben auriu, ilmenit, hematit, lepidocrocite , etc. |
| O2- - Cr6+: Crocoit (portocaliu) | |
| O2- -V5+:Vanadinit (portocaliu) | |
| Transformarea sulfului în metal: pirita, marcasita etc. (a se vedea semiconductor cu gol) | |
| Transfer de sarcină non-metal - non-metal | S3-: Lapis lazuli (albastru) |
| Π electronic: grafit (negru) | |
| Culorile unor pietre prețioase organice, cum ar fi chihlimbarul și coralul. |
Copywrite @ Sobling.Jewelry - Producător de bijuterii personalizate, fabrică de bijuterii OEM și ODM
Secțiunea III Teoria benzilor energetice
Teoria benzii energetice este un model mecanic cuantic pentru studierea materialelor din pietre prețioase, care este o extensie și o extindere a teoriei orbitalului molecular. Studiul teoriei benzilor energetice poate explica mai bine mecanismul de culoare al unor pietre prețioase colorate natural.
1. Concepte de bază ale teoriei benzilor energetice
Teoria benzilor energetice este o teorie aproximativă utilizată pentru a studia legile mișcării electronilor în solide. Solidele sunt compuse din atomi, care includ nucleele atomice și electronii cei mai exteriori, toți fiind într-o stare constantă de mișcare. Teoria benzilor presupune că electronii din solide nu sunt legați de un anumit atom, ci sunt partajați de întregul cristal și se mișcă în câmpul potențial periodic al spațiului tridimensional al cristalului. Intervalul de mișcare al electronilor se încadrează în câmpul de potențial periodic al rețelei, ceea ce permite ca distribuția spațială a orbitelor electronilor să o depășească pe cea a moleculelor, atingând un maxim. Nivelurile de energie ale electronilor individuali sunt extinse în benzi de energie.
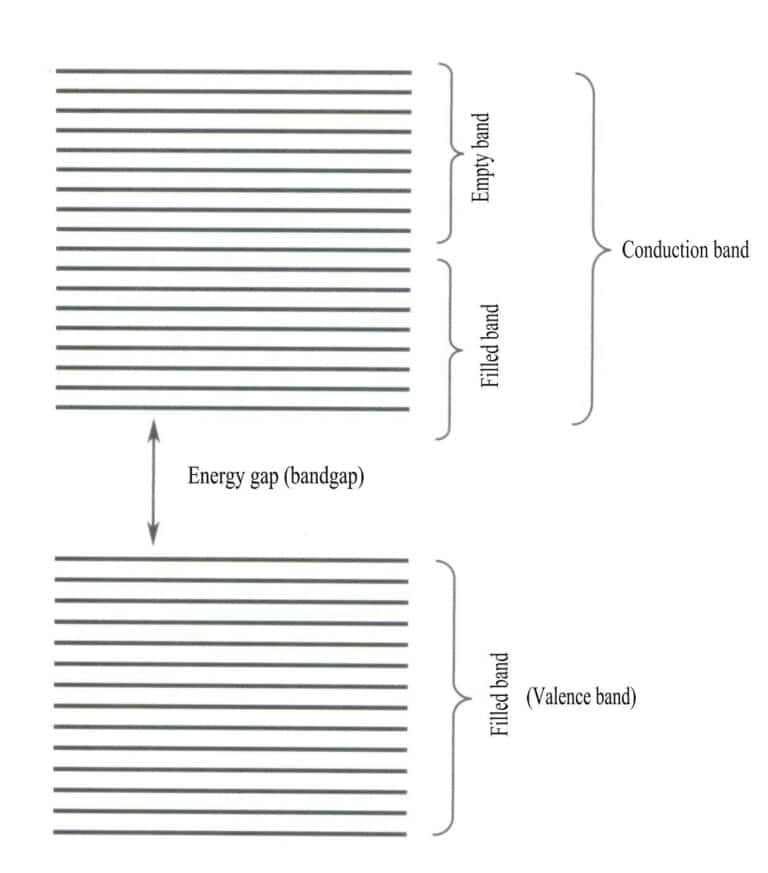
Teoria benzilor discută în principal tranzițiile electronice între stările nelocale, în care toți electronii de valență ar trebui să aparțină întregii rețele solide. Conform teoriei benzilor, materialele solide pot fi împărțite în benzi energetice diferite, în funcție de umplerea sau nu a orbitalilor atomici: o bandă plină este formată din nivelurile energetice ale orbitalilor atomici care sunt complet ocupați de electroni, reprezentând o bandă cu energie scăzută; o bandă goală este formată din nivelurile energetice care nu sunt complet ocupate de electroni, reprezentând o bandă cu energie ridicată. Diferența de energie dintre aceste două tipuri de benzi se numește "gol de bandă" (figura 3-28).
Atunci când toate benzile energetice ale unui material sunt umplute, acesta este un neconductor; atunci când este parțial umplut cu electroni, acesta este un conductor. Defectele rețelei introduc niveluri de energie suplimentare în cristal, permițând electronilor să intre în aceste niveluri de energie, rezultând o conductivitate condiționată.
2. Caracteristicile tranzițiilor de bandă interzisă
Unele pietre prețioase minerale conțin elemente din grupa IV A a tabelului periodic, cum ar fi diamantul și moissanitul, care se leagă în principal covalent. Există și alte minerale, cum ar fi sulfura de cadmiu (CdS), ale căror culori pot fi explicate prin teoria benzilor.
Electronii absorb energia luminii și se deplasează între benzile de valență și de conducție, formând "tranziții interne de bandă". Probabilitatea tranzițiilor este strâns legată de diferența de energie dintre benzile de valență și de conducție, cunoscută sub numele de energia benzii interzise (Eg) (Figura 3-29).

Figura 3-29 (a) este o diagramă de bandă tipică a unui semiconductor. Pe baza mărimii energiei benzii libere a cristalului, acesta poate fi împărțit în trei tipuri: bandă liberă largă, bandă liberă îngustă și bandă liberă medie. O bandă interzisă largă are o energie a benzii interzise mai mare decât energia luminii vizibile; atunci când energia benzii interzise depășește energia luminii vizibile, lumina vizibilă nu este absorbită și trece complet prin ea, făcând mineralul incolor. De exemplu, energia fantei de bandă a diamantului Eg este de aproximativ 5,5eV, ceea ce îl face incolor.
Energia de bandă interzisă a materialelor cu bandă interzisă îngustă este mai mică decât cea a luminii vizibile, ceea ce face ca toată lumina vizibilă să fie absorbită, rezultând culori gri-verde sau negre. De exemplu, energia bandgap a galenei este Eg mai mică de 0,4eV, care pare a fi gri plumb. Atunci când acest "semiconductor cu interval de bandă îngustă" se află într-o formă geometrică adecvată, el prezintă proprietăți de redresare și amplificare.
Energia materialelor cu bandă interzisă medie se află exact în intervalul luminii vizibile, iar mineralele prețioase prezintă diverse culori. Secvența lor de culori este prezentată în figura 3-29 (c), variind de la roșu-galben la verde-albastru și violet. De exemplu, energia bandgap (Eg) a sulfurii de cadmiu (CdS) este de aproximativ 2,5eV, care absoarbe lumina albastră și violet, părând galbenă. Energia bandgap a cinabrului este de aproximativ 2eV, permițând doar trecerea luminii roșii, care apare astfel roșie. Energia bandgap a orpimentului este de aproximativ 2,5eV, apărând galben.
O altă categorie de minerale prețioase naturale explicată prin teoria benzilor este culoarea materialelor cu bandgap larg care conțin impurități. De exemplu, în cazul unui diamant cu impurități, energia bandgap a diamantului este de aproximativ 5,5eV, iar lumina vizibilă nu este absorbită atunci când trece prin diamant; diamantul pur este incolor, dar situația se schimbă atunci când conține impurități.
(1) Mecanismul de culoare al diamantelor galbene
Atomii de azot înlocuiesc poziția atomilor de carbon. Deoarece atomii de azot au un electron în plus față de atomii de carbon, acest electron suplimentar formează un nivel de energie impur în intervalul de bandă, cunoscut sub numele de nivel de energie donator, atomii de azot acționând ca "donatori".
Existența acestui nivel de impuritate reduce energia benzii interzise la 4eV[ [Figura 3-30 (a)]. Aceasta poate fi chiar mai mică, permițându-i să absoarbă lumina ultravioletă și un pic de lumină violetă de 3eV, făcând diamantul să pară galben.
Acest efect este puternic; având un atom de azot la fiecare sută de mii de atomi de carbon, diamantul poate deveni galben intens. Cu toate acestea, reducerea intervalului de bandă este încă insuficientă pentru a face diamantul conductiv la temperatura camerei.
(2) Mecanismul culorii în diamantele albastre
Deoarece borul are cu un electron mai puțin decât carbonul, acesta formează un "nivel acceptor" în banda interzisă a diamantului. Borul nu are electroni suplimentari, dar poate accepta electroni din banda de valență a diamantului, creând găuri în banda de valență [figura 3-30 (b)] și formând o bandă energetică de impuritate cu aproximativ 0,4eV deasupra benzii de valență, cunoscută sub numele de nivel acceptor.

Nivelul de energie al acceptorului nu este simplu; este o structură complexă de benzi de energie ale impurităților care pot produce albastru. Nivelul de energie al acceptorului creează "găuri" în banda de valență, ceea ce permite acestui diamant albastru de tip II b cu "găuri" să conducă electricitatea.
Un atom de bor la fiecare milion de atomi de carbon poate forma albastrul. Datorită conținutului mai mare de aluminiu din acest diamant albastru și a faptului că aluminiul are cu un electron mai puțin în stratul exterior decât carbonul, se credea anterior că aluminiul joacă rolul de acceptor. Totuși, experimentele actuale au demonstrat că este vorba de bor, nu de aluminiu.
Diamantele albastre conductive de tip II b sunt albastre în mod natural, iar conductivitatea lor este una dintre diferențele față de diamantele albastre iradiate (centre de culoare). Această proprietate este adesea utilizată pentru a distinge între cele două tipuri de diamante. Cu toate acestea, diamantele galbene donatoare de azot nu conduc electricitatea, astfel încât această metodă nu poate fi utilizată pentru a le diferenția de diamantele galbene iradiate.
3. Minerale prețioase colorate prin tranziții de bandă
Teoria benzii energetice poate explica o parte din formarea culorii pietrelor prețioase naturale. Deoarece banda de energie este o proprietate inerentă a cristalului și nu se modifică din cauza condițiilor externe, culoarea pietrelor prețioase are o bună stabilitate. Conductivitatea cristalului poate fi determinată pe baza faptului dacă benzile de energie din cristal sunt umplute cu electroni. Tabelul 3-13 enumeră tipurile de culori ale pietrelor prețioase care pot fi explicate prin teoria benzilor și proprietățile lor de conductivitate.
Tabelul 3-13 Tipuri de culori ale pietrelor prețioase explicate prin teoria benzilor și conductivitatea lor
| Conductori (culori metalice și luciu metalic) | Element | Cupru, aur, fier, argint, mercur etc. |
| Aliaj | Amalgam, Meteorit nichel fier | |
| Semiconductor | Band Gap îngust | Gri opac până la negru: altait, galenă |
| Culoare metalică opacă: cobaltină, marcasită, pirita, smaltită | ||
| Band gap moderat | Roșu: cinabru, proustită, pirarit | |
| Portocaliu: Realgar | ||
| Galben: Sulfură de cadmiu, realgar, sulf | ||
| Bandgap larg | Incolor: diamant, sphalerit | |
| Semiconductori cu bandgap larg care conțin impurități | Impuritate donatoare: Diamant dopat cu azot (galben) | |
| Impurități în gazdă: diamant cu conținut de bor (albastru) |
Culoarea pietrelor prețioase cauzată de tranzițiile de bandă este legată de structura și tipul de legătură la momentul formării pietrei prețioase. Ea are o legătură redusă cu impuritățile și defectele cristaline ulterioare. Dimensiunea benzii de energie a pietrelor prețioase este fixă. Aceasta nu se modifică în funcție de proprietățile materialului pietrelor prețioase, astfel încât metodele convenționale de optimizare nu pot îmbunătăți, în general, culoarea pietrelor prețioase.
Secțiunea IV Efecte fizico-optice
Majoritatea pietrelor prețioase naturale pot provoca absorbția selectivă a luminii, iar diferite pietre prețioase absorb lumina vizibilă la diferite lungimi de undă, rezultând culori diferite. În plus față de absorbția selectivă a luminii, structura internă a cristalelor pietrelor prețioase poate provoca, de asemenea, efecte optice fizice, ceea ce duce la obținerea de culori diferite în pietre prețioase.
1. Mineralele pietrelor prețioase legate de efectele optice fizice
Culorile produse de efectele optice fizice se formează datorită dispersiei, interferenței, difracției și altor motive ale luminii cauzate de structura sau compoziția cristalului și de incluziuni. Acesta este doar un efect optic care poate fi explicat prin teoria optică fizică. Pietre prețioase diferite pot produce culori diferite sub aceleași efecte optice. În plus față de oligoelementele comune care provoacă culoarea, motivele culorilor produse de efectele optice fizice sunt legate în principal de structura internă și de proprietățile fizice ale pietrelor prețioase. Tipurile de minerale ale pietrelor prețioase care produc culori datorită efectelor optice fizice sunt enumerate în tabelul 3-14.
Tabelul 3-14 Tipuri de minerale prețioase cauzate de efecte optice fizice
| Funcția | Proprietăți optice și culoare | Minerale prețioase |
|---|---|---|
| Dispersia Dispersia | Strălucitoare | "Foc" în pietrele prețioase cu dispersie, cum ar fi diamantele, zirconiul, rutilul și titanatul de stronțiu |
| Albastru | Piatră de lună, cuarț albastru, opal | |
| Violet | Fluorit (împrăștiere de microcristale de calciu) | |
| Roșu | Sticlă de rubin, cu microcristale de cupru sau aur dispersate | |
| Alb | Cuarț lăptos | |
| Efect de ochi de pisică | acvamarin ochi de pisică, piroxen ochi de pisică etc. | |
| Efectul luminii stelelor | Diverse efecte stelare ale corindonului și granatului | |
| Lustru | Luciu de perle, apofilită etc. | |
| Scânteie | Strălucire de aventurină, obsidian, etc. | |
| Interferență Difracție | Culorile spectrale pure ale filmului subțire | Curcubeul calcopiritei, pelicula decolorată dintr-o fisură de cuarț iris |
| Efecte de interferență | Schimbarea de culoare a opalului, efectul labradoritei | |
| Incluziune | Albastru | Dumortierit în cuarț |
| Verde | Calcedonie verde și vene de nichel în calcedonie verde, fuchsite în cuarț stelat | |
| Portocaliu | Oxid de fier hidratat în opal de foc și calcedonie de culoarea cărnii | |
| Roșu | Fulgi de hematită în orthoclase |
2. Efecte de interferență și difracție
(1) Efecte de interferență
Fenomenele de interferență apar atunci când două fascicule de lumină se propagă de-a lungul aceleiași căi optice sau în direcții paralele. Un fenomen de interferență comun în pietrele prețioase este iridescența. De exemplu, în cazul cuarțului irizat, culorile de interferență depind de grosimea filmului, de indicele de refracție al filmului și de natura luminii incidente.
Culorile interferențiale ale perlelor sunt formate prin suprapunerea în straturi concentrice alternante a două substanțe cu indici de refracție diferiți (aragonit și nacrum), unde lumina incidentă este reflectată de suprafețele dintre straturile alternante, iar lumina reflectată interferează cu lumina incidentă pentru a produce frumoase culori interferențiale.
(2) Efecte de difracție
Difracția se referă la fenomenul fizic prin care undele luminoase deviază de la propagarea lor inițială în linie dreaptă atunci când întâlnesc obstacole. În fizică, undele luminoase suferă diferite grade de îndoire și împrăștiere atunci când trec prin obstacole precum fante, găuri mici sau discuri. Dacă între sursa de lumină și ecranul de observare se află un obstacol, pe ecranul de observare vor apărea regiuni luminoase și întunecate, iar limitele acestor regiuni nu sunt clare, formând un model complex de lumină și întuneric. Acest fenomen se numește difracție. Astfel de fenomene pot apărea ori de câte ori undele luminoase întâlnesc obstacole de-a lungul căii lor de propagare. Cel mai important factor în producerea difracției este prezența rețelelor de difracție periodic distanțate în pietrele prețioase minerale.
① Schimbarea culorii Opal
În opal, sferele de silice care conțin apă au diametre egale și sunt dispuse într-o structură stratificată alternantă regulată, formând rețele de difracție distanțate periodic. Atunci când lumina pătrunde în opal, are loc difracția, schimbând culoarea (figurile 3-31, 3-32). Tipurile de culori și gradul de schimbare a culorii depind în principal de distanța interplanară dintre sferele de silice suprapuse.
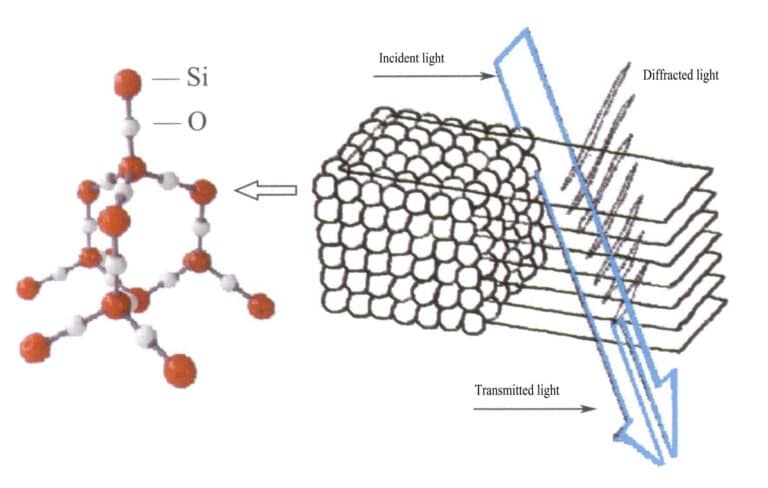

De exemplu, opalul cu o structură cubică plană cu fața centrată și o distanțare a rețelei de 3×10-10m prezintă culori care variază de la verde la roșu; acest tip de opal cu o distanțare a rețelei de 2,5×10-10m afișează culori care variază de la albastru la galben.
② Efect de labradorit
Labradorita prezintă, de asemenea, efecte similare opalului (Figura 3-33). Labradoritul este cunoscut și sub numele de spectrolite, deoarece poate străluci în lumina colorată a soarelui. Diferite tipuri de labradorit din Finlanda pot afișa o gamă de culori spectrale, un fenomen cunoscut sub numele de "efectul labradoritului". Efectul de schimbare a culorii labradoritei se datorează unor mici topituri interstrat de plagioclase cu compoziții diferite. Micile diferențe în indicele de refracție dintre diferitele feldspați provoacă interferența și difracția luminii, rezultând luminescența și schimbarea culorii. Culorile produse de această structură sunt legate de grosimea relativă a straturilor și de indicii lor de refracție. Ocazional, andradita din Mexic prezintă, de asemenea, fenomene de difracție.

3. Dispersia și incluziunile
(1) Răspândirea
În general, împrăștierea apare atunci când structura internă a materialelor prețioase este neregulată sau când dimensiunea componentelor depășește limitele condițiilor de difracție. Efectele de culoare produse de împrăștiere sunt legate de dimensiunea și forma particulelor din materialul gemei. Atunci când lumina incidentă interacționează cu particule dispuse neregulat, mai mici decât lungimea de undă a luminii vizibile, undele luminoase cu energie înaltă transmise sunt mai puternice decât undele luminoase cu energie joasă, ceea ce înseamnă că, în majoritatea cazurilor, se pot vedea doar violet și albastru. De exemplu, particulele SiO2 sferele mici din opal au diametre mai mici decât lungimea de undă a luminii vizibile, iar atunci când dimensiunea particulelor de împrăștiere este apropiată de lungimea de undă a luminii vizibile, pot apărea și culori de împrăștiere.
De exemplu, fluoritul purpuriu este cauzat de iradierea radioactivă care expulzează atomii de fluor, rezultând că atomii de calciu care se leagă de atomii de fluor se condensează în plăci hexagonale de o dimensiune comparabilă cu lungimea de undă a luminii vizibile. Interacțiunea dintre plăcile de calciu și undele luminoase produce împrăștierea. Aceasta absoarbe unele unde luminoase, creând un vârf puternic de absorbție în regiunea luminii verzi-roșii, permițând luminii violet să treacă și să producă culoarea violet.
Deoarece particulele de aceeași dimensiune ale elementelor metalice pot produce efecte cromatice similare, iar particulele metalice diferite pot produce culori diferite, unele imitații de pietre prețioase sunt fabricate folosind această proprietate.
De exemplu, sticla "rubin" este produsă prin adăugarea de particule de cupru sau aur în sticlă, rezultând o culoare roșie similară cu cea a rubinelor. Atunci când materialul gemei conține incluziuni, microfisuri sau bule mai mari decât lungimea de undă a luminii vizibile, undele luminoase interacționează cu aceste particule împrăștiate, determinând recombinarea undelor luminoase împrăștiate, producând o lumină lăptoasă translucidă. De exemplu, anumite imitații de piatră de lună.
Efectul de clar de lună al pietrei de lună este, de asemenea, produs de împrăștierea luminii (Figura 3-34). Piatra lunii este un feldspat alcalin, un compus format din straturi paralele alternante de feldspat bogat în potasiu și bogat în sodiu. Grosimea între straturi variază de obicei între 50~1000nm, cu straturi mai subțiri capabile să producă împrăștiere. Aceeași culoare de împrăștiere poate apărea și în plagioclase, cunoscută sub numele de "efectul labradorit".
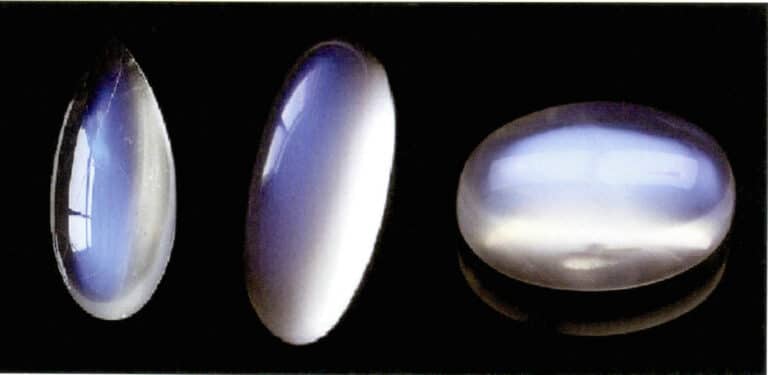
Un aranjament special orientat al particulelor de împrăștiere poate produce efecte optice caracteristice. De exemplu, atunci când particulele de dispersie sunt sub formă fibroasă paralelă, acestea produc un efect de ochi de pisică sau de stea, cum ar fi safirele stea și ochii de pisică din cuarț. Atunci când particulele de împrăștiere sunt suficient de mari pentru a putea fi distinse cu ochiul liber, ele pot produce un "efect de piatră aurie", cum ar fi piatra soarelui (figura 3-35) și sticla de piatră aurie.

(2) Includeri
Culoarea și fenomenele optice produse de incluziuni sunt un tip special de împrăștiere. Incluziunile cu culoare încorporate în cristale principale aproape incolore vor prezenta culoarea incluziunilor, cum ar fi calcedonia în bandă cu conținut de nichel și oxidul de fier(II) cu conținut de apă (FeO - H2O) calcedonie de culoarea cărnii; culoarea ortoclaselor din Madagascar și a unor cordierite este formată din incluziuni puțin mai mari, dar totuși microscopice, de hematită, care creează nuanțe roșii; incluziunile submicroscopice de hidroxid feric colorează adesea opalul de foc.
Diamantele prezintă adesea culori diferite datorită prezenței a numeroase incluziuni. Diamantele colorate de incluziuni pot fi negre, roșu-portocaliu și roșu-maroniu. Atunci când un diamant conține nenumărate incluziuni minerale opace întunecate, acesta apare negru; atunci când este examinat cu lumină puternică transmisă, se pot observa multe incluziuni întunecate, iar diamantul apare gri închis; un alt tip sunt incluziunile secundare care apar în fisurile diamantului. Atunci când fisurile se dezvoltă și sunt umplute cu aceste incluziuni colorate, diamantul apare roșu-maroniu sau roșu-portocaliu, fiind cunoscut și sub denumirea de diamant "oxidat".
4. Dispersia
Fenomenul de descompunere a luminii albe în diferite culori spectrale prin intermediul unui obiect se numește dispersie. Dispersia pietrelor prețioase se referă la proprietatea luminii de a se dispersa în diferite lungimi de undă ale culorilor spectrale atunci când trece prin planurile înclinate ale pietrelor prețioase transparente. Datorită faptului că diferitele lungimi de undă ale luminii monocromatice care alcătuiesc lumina albă se propagă la viteze și indici de refracție diferiți în materiale diferite, lumina albă se poate descompune în diferite culori spectrale în anumite condiții. Dimensiunea valorii de dispersie a unei pietre prețioase este determinată de proprietățile sale fizice; fiecare piatră prețioasă are valoarea sa de dispersie inerentă, care nu se modifică în funcție de proprietățile pietrei prețioase. Farmecul unic al diamantelor este strâns legat de valoarea lor ridicată de dispersie (0,044).
Majoritatea simulanților de diamante au o valoare de dispersie mai mare, cum ar fi valoarea de dispersie a zirconului de 0,039 și valoarea de dispersie a moissanitei sintetice de 0,104. Tabelul 3-15 prezintă o comparație a valorilor dispersiei diamantelor și a pietrelor lor prețioase simulante comune.
Tabelul 3-15 Comparație între valorile de dispersie ale diamantelor și ale pietrelor lor prețioase simulante comune
| Numele pietrei prețioase | Valoarea dispersiei |
|---|---|
| Diamant | 0.044 |
| Zircon | 0.039 |
| Corindon | 0.018 |
| Spinel | 0.020 |
| Topaz | 0.014 |
| Beryl | 0.014 |
| Cristal | 0.014 |
| Rutil sintetic | 0.280 |
| Titanat de stronțiu sintetic | 0.190 |
| Moissanit sintetic | 0.104 |
Dispersia este denumită în mod obișnuit "focul" pietrelor prețioase. De exemplu, diamantele au o valoare de dispersie ridicată, iar focul lor este foarte pronunțat, sporind statutul deja regal al diamantelor și punând în valoare farmecul lor unic.
Există mai multe tipuri de culori produse prin efecte optice fizice, toate acestea putând fi explicate prin teoria optică fizică. Cu excepția dispersiei, care este o proprietate inerentă a pietrei prețioase în sine, alte fenomene sunt cauzate de modificările structurale după formarea pietrei prețioase și de diferențele dintre incluziunile mecanice. Înțelegerea diferitelor cauze ale culorilor pietrelor prețioase oferă o bază teoretică pentru optimizarea tratamentului pietrelor prețioase naturale și sintetice.