Perché le gemme hanno più colori?
Introduzione alla teoria del campo cristallino, alla teoria degli orbitali molecolari e alla teoria delle bande energetiche.
I colori delle gemme sono ricchi e variegati e possiedono un fascino unico che le persone hanno sempre amato. La qualità delle gemme dipende in gran parte dal loro colore. Il colore di una pietra preziosa è un indicatore importante nella valutazione delle gemme e la maggior parte dei trattamenti di ottimizzazione delle gemme prevede la modifica o il miglioramento del loro colore. Pertanto, la comprensione delle cause della colorazione delle gemme è un prerequisito fondamentale per i trattamenti di ottimizzazione delle gemme. Solo conoscendo il modo in cui le gemme acquisiscono il loro colore si può determinare se una gemma può essere ottimizzata, quale schema di ottimizzazione adottare e quale piano sperimentale stabilire. Esistono cinque teorie comuni sulla colorazione delle gemme: la teoria mineralogica classica, la teoria del campo cristallino, la teoria degli orbitali molecolari, la teoria delle bande energetiche e gli effetti ottici fisici. Queste teorie costituiscono le teorie della colorazione delle gemme naturali più comuni e quella che segue è una breve introduzione a queste cinque teorie della colorazione.
Orbitali molecolari formati da due orbitali atomici s
Indice dei contenuti
Sezione I Teoria del campo cristallino
Negli anni '30 gli scienziati proposero la teoria del campo cristallino per spiegare le proprietà dei cristalli. La teoria del campo cristallino è una teoria che studia i legami chimici degli elementi di transizione (complessi). Spiega le proprietà fisiche e chimiche degli elementi di transizione e dei lantanidi combinando alcuni punti di vista della teoria elettrostatica, della meccanica quantistica e della teoria dei gruppi (la teoria che studia la simmetria della materia), concentrandosi sull'influenza dei ligandi sugli orbitali d e f degli ioni centrali. Negli anni Cinquanta si applicò la teoria dei campi cristallini ai complessi e si propose la teoria dei campi di ligandi. La teoria del campo del ligando è un progresso della teoria del campo cristallino; considera sia l'influenza del campo elettrico del ligando sullo ione centrale sia l'effetto di riempimento degli elettroni del ligando sullo ione centrale, rendendola più completa della teoria del campo cristallino. Tuttavia, non c'è una differenza essenziale tra le due e generalmente non vengono distinte nello studio dei minerali inorganici.
1. Concetti di base della teoria dei campi cristallini
Gli ioni dei metalli di transizione si trovano nel campo cristallino di anioni o molecole di dipolo circostanti. La teoria del campo cristallino è un modello elettrostatico che vede il cristallo come un'interazione elettrostatica tra ioni positivi e negativi, dove il catione con carica positiva è chiamato ione centrale e l'anione con carica negativa è chiamato ligando.
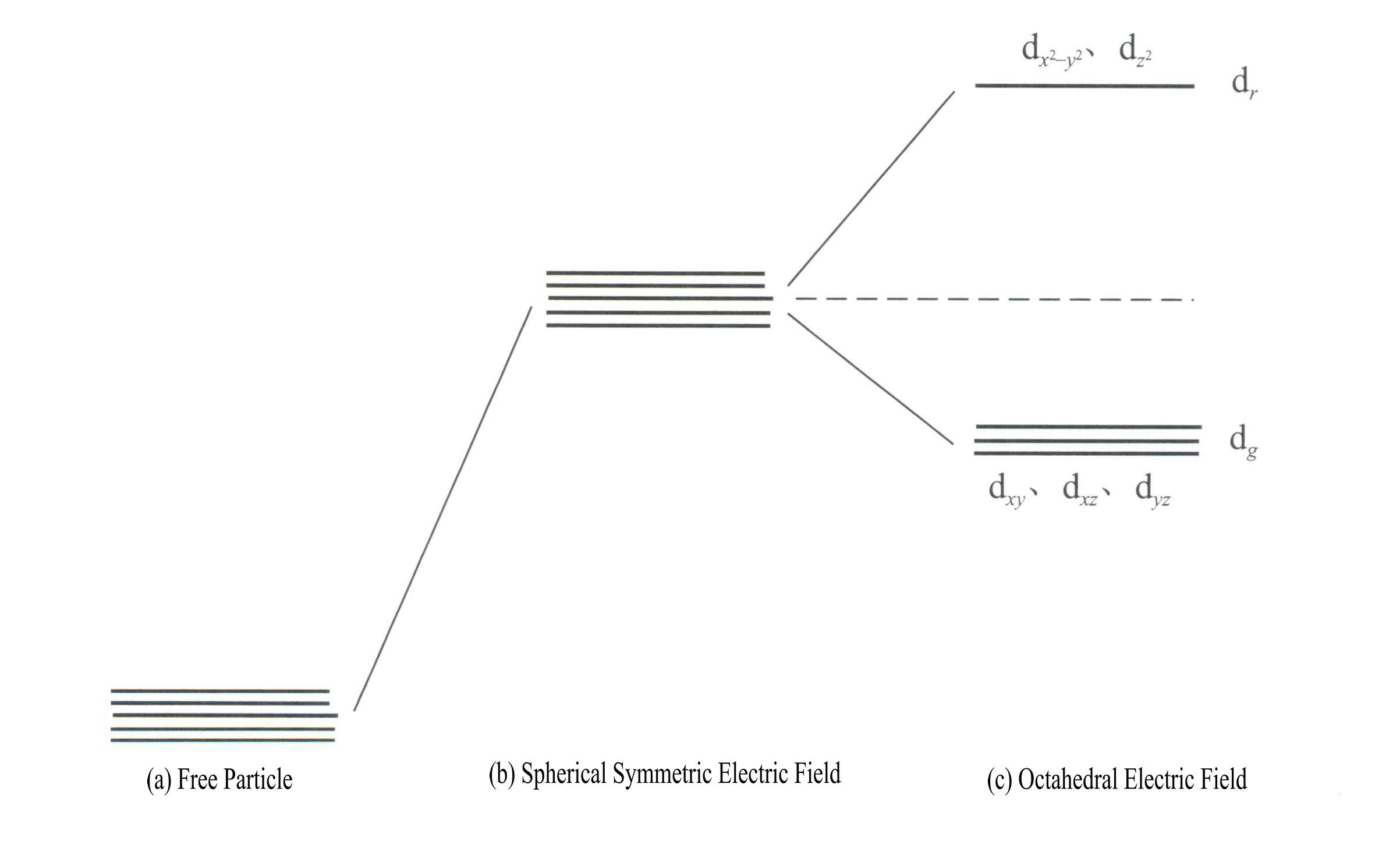
L'applicazione della teoria del campo cristallino per spiegare il colore dei minerali delle gemme coinvolge principalmente gli elettroni d o l'energia degli elettroni f degli ioni degli elementi di transizione. Ad esempio, gli orbitali d sono di cinque tipi: dxy, dxz, dyz, d , e d . Questi cinque orbitali d hanno distribuzioni spaziali diverse nello stato libero dello ione, ma hanno la stessa energia. Tuttavia, subiscono cambiamenti significativi sotto l'influenza del campo del legante. I cinque orbitali d degenerati energeticamente dell'atomo centrale si dividono sotto l'influenza del campo elettrico negativo formato dai ligandi circostanti. Alcuni orbitali d hanno un'energia maggiore, mentre altri hanno un'energia minore. A causa della scissione dei livelli energetici degli orbitali d, gli elettroni negli orbitali d dell'atomo centrale si riorganizzeranno, occupando preferenzialmente gli orbitali a più bassa energia, riducendo così l'energia totale del sistema e rendendo il complesso più stabile.
L'energia degli orbitali d è la stessa in assenza di campo elettrico [Figura 3-19 (a)]; in presenza di un campo elettrostatico a simmetria sferica, gli orbitali d hanno un'energia maggiore ma non si dividono [Figura 3-19 (b)]; quando il campo del legante è ottaedrico, si dividono in dr e dg. Di questi, dr sono composti da orbitali d e d , a più alta energia; gli orbitali d, a più bassa energia, sono composti da orbitali dg sono composti da orbitali dxy, dxz, dyz.
Gli ioni dei metalli di transizione si trovano nel campo cristallino di anioni o molecole di dipolo circostanti. La teoria del campo cristallino è un modello elettrostatico che vede il cristallo come un'interazione elettrostatica tra ioni positivi e negativi, dove il catione con carica positiva è chiamato ione centrale e l'anione con carica negativa è chiamato ligando.
L'applicazione della teoria del campo cristallino per spiegare il colore dei minerali delle gemme coinvolge principalmente gli elettroni d o l'energia degli elettroni f degli ioni degli elementi di transizione. Ad esempio, gli orbitali d sono di cinque tipi: dxy, dxz, dyz, d , e d . Questi cinque orbitali d hanno distribuzioni spaziali diverse nello stato libero dello ione, ma hanno la stessa energia. Tuttavia, subiscono cambiamenti significativi sotto l'influenza del campo del legante. I cinque orbitali d degenerati energeticamente dell'atomo centrale si dividono sotto l'influenza del campo elettrico negativo formato dai ligandi circostanti. Alcuni orbitali d hanno un'energia maggiore, mentre altri hanno un'energia minore. A causa della scissione dei livelli energetici degli orbitali d, gli elettroni negli orbitali d dell'atomo centrale si riorganizzeranno, occupando preferenzialmente gli orbitali a più bassa energia, riducendo così l'energia totale del sistema e rendendo il complesso più stabile.
L'energia degli orbitali d è la stessa in assenza di campo elettrico [Figura 3-19 (a)]; in presenza di un campo elettrostatico a simmetria sferica, gli orbitali d hanno un'energia maggiore ma non si dividono [Figura 3-19 (b)]; quando il campo del legante è ottaedrico, si dividono in dr e dg. Di questi, dr sono composti da orbitali dx2– y2 e dz2
con un'energia più elevata; il dg sono composti da orbitali dxy, dxz, dyz. [Figura 3-19 (c)]
La differenza tra i livelli energetici più alti e più bassi dopo la scissione degli orbitali d è chiamata energia di separazione △ . Le energie di separazione prodotte da diverse configurazioni di campi di ligandi non sono uguali (Figura 3-20). Il loro ordine energetico è:
Campo quadrato > Campo ottaedrico > Campo tetraedrico

Anche per campi della stessa configurazione, possono differire a causa delle differenze nei ligandi e negli ioni centrali; più è grande, più il cristallo è stabile. I tre fattori seguenti determinano principalmente la dimensione dell'energia di separazione del cristallo:
(1) Cristalli formati dallo stesso elemento di transizione; quando i ligandi sono gli stessi, maggiore è la carica dello ione centrale, maggiore è l'energia di separazione △ . Maggiore è la carica positiva dello ione centrale, maggiore è l'attrazione verso i ligandi, con conseguente minore distanza tra lo ione centrale e il nucleo del ligando, e maggiore è la forza repulsiva del campo cristallino generato dai ligandi sugli elettroni, maggiore è l'energia di separazione △ .
(2) Per i cristalli formati da ioni diversi con la stessa carica positiva e gli stessi leganti, più grande è il raggio dello ione centrale, più lontani sono gli orbitali d dal nucleo e maggiore è l'energia di separazione △ .
(3) Per i cristalli formati dallo stesso ione centrale e da diversi leganti, l'energia di separazione varia a causa della diversa intensità del campo cristallino del legante. Diversi ligandi hanno diverse intensità di campo e l'energia di separazione △ varia con l'intensità di campo del ligando.
L'energia di separazione viene utilizzata per spiegare qualitativamente la stabilità dei cristalli; non è necessario ottenere il valore assoluto △ , poiché è sufficiente conoscere i valori relativi del cristallo in diverse condizioni.
In base all'energia relativa degli orbitali d divisi, è possibile calcolare l'energia totale degli ioni del metallo di transizione negli orbitali d. Questa energia è inferiore a quella precedente alla scissione e fornisce quindi energia aggiuntiva al cristallo, nota come energia di stabilizzazione del campo cristallino, rappresentata dal simbolo CFSE. La Tabella 3-10 elenca le energie di stabilizzazione degli ioni contenenti orbitali dn elettroni in condizioni diverse.
Tabella 3-10 Energie di stabilizzazione del campo cristallino con diversi ligandi (Wu Ruihua, 1994)
| dn | Campo debole | Campo forte | ||||
|---|---|---|---|---|---|---|
| dn | Quadrato | Ottaedro regolare | Tetraedro regolare | Quadrato | Ottaedro regolare | Tetraedro regolare |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Caratteristiche cromatiche degli ioni dei metalli di transizione
Nelle sue gemme colorate, il colore della maggior parte delle gemme è dovuto agli ioni dei metalli di transizione e il colore delle gemme è legato al fatto che gli ioni coloranti contengano elettroni non appaiati negli orbitali d o f. Le caratteristiche di colorazione degli ioni dei metalli di transizione includono principalmente i seguenti aspetti:
(1) La colorazione degli ioni dei metalli di transizione è correlata agli stati elettronici dell'orbitale d o dell'orbitale f. Quando gli elettroni degli orbitali d o f sono pieni o vuoti, la gemma non mostra colore. Ad esempio, Cr6+, Ce4+e Cu+.
(2) Diversi ioni coloranti presentano colori diversi nello stesso materiale gemmologico. A causa delle diverse energie di separazione dei vari ioni coloranti, essi possono presentare colori diversi anche nello stesso materiale. Ad esempio, il Fe2+ produce un colore leggermente grigio-blu nello spinello, mentre il Cr3+ produce il rosso.
(3) Gli ioni coloranti dello stesso elemento in diversi stati di valenza spesso presentano colori diversi nello stesso materiale gemmologico. Poiché l'energia richiesta per le transizioni degli elettroni d dello ione centrale è diversa, le lunghezze d'onda della luce assorbita sono diverse, con conseguenti colori diversi. Ad esempio, un castone contenente Mn2+ presenta una tonalità rosa tenue, mentre un berillo contenente Mn2+ presenta un colore rosso vivo, noto come berillo rosso.
(4) Gli ioni coloranti di uno stesso elemento nello stesso stato di valenza spesso mostrano colori diversi quando si trovano in configurazioni diverse di ligandi. Ad esempio, il Co2+ nella configurazione tetraedrica dello spinello mostra un caratteristico colore "blu diamante", mentre nella configurazione ottaedrica della calcite appare di colore rosa. Fe2+ nell'olivina a coordinazione ottaedrica mostra un caratteristico verde oliva, mentre nell'almandina a coordinazione cubica distorta appare rosso intenso.
(5) Lo stesso tipo di ioni colorati ha lo stesso stato di valenza e la stessa geometria di coordinazione, ma i diversi atomi di coordinazione adiacenti presentano colori diversi. Ad esempio, nella coordinazione tetraedrica del Co2+nella sfalerite, Co2+ è collegato allo zolfo, mostrando il colore verde, mentre nello spinello il Co2+ è collegato all'ossigeno, in colore blu.
(6) Lo stesso tipo di ioni colorati con lo stesso stato di valenza, la stessa geometria di coordinazione e gli stessi atomi adiacenti presentano colori diversi in gemme diverse. La distorsione della geometria di coordinazione causata dalle diverse composizioni chimiche delle gemme modifica la natura dei legami chimici tra lo ione centrale e i ligandi di coordinazione, alterando l'energia di transizione degli elettroni d. Ad esempio, il Cr3+ appare rosso nel rubino, verde nello smeraldo e mostra colori variabili nell'alessandrite. La ragione di questi cambiamenti nel Cr3+ è legato alle sue caratteristiche e ai ligandi coordinanti adiacenti, con analisi specifiche delle caratteristiche come segue.
① Cr3+ Caratteristiche:
Cr3+ ha una struttura del guscio elettronico esterno di 3s23p63d3, con 11 elettroni nel guscio esterno, appartenente a una struttura a guscio irregolare (8-18).
Questa struttura ha un effetto schermante sul nucleo minore rispetto alla struttura a guscio a 8 elettroni, con il risultato che Cr3+ che ha una carica positiva effettiva più elevata, mentre il suo raggio ionico è anche più piccolo, il che costituisce le caratteristiche di base del Cr3+: un forte campo elettrico positivo e orbitali d vuoti. Cr3+ può fornire sei orbitali vuoti per ospitare sei ligandi coordinanti, con una configurazione spaziale ottaedrica, appartenenti a d2sp3 ibridazione (Figura 3-21).
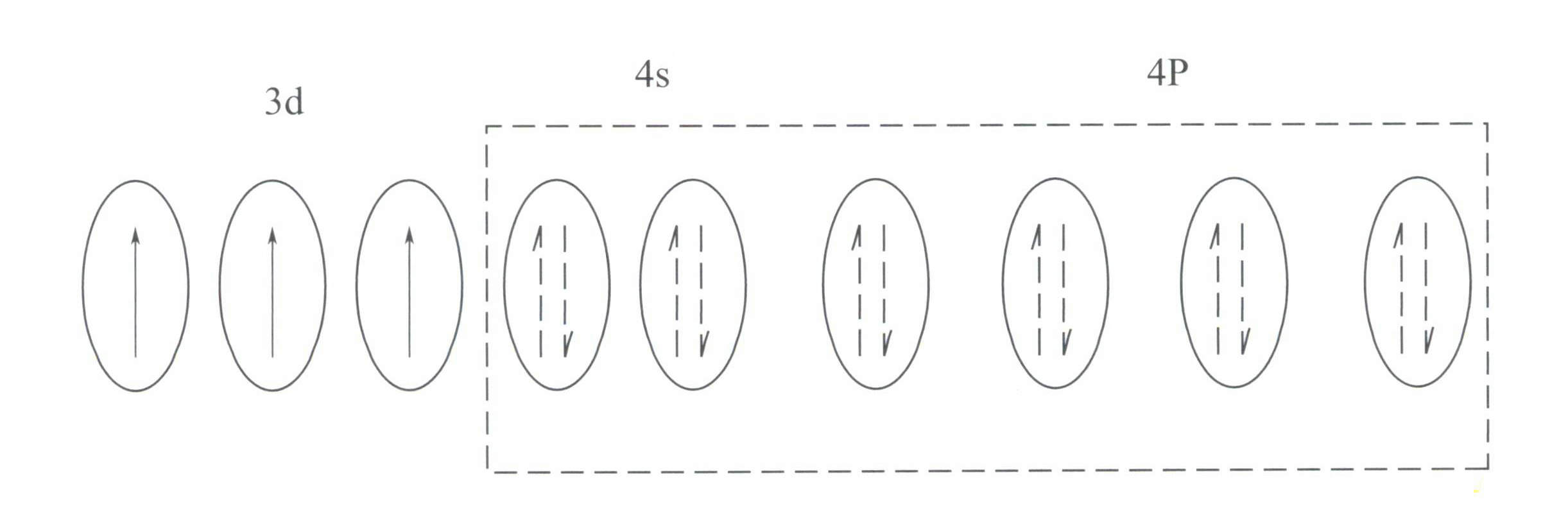
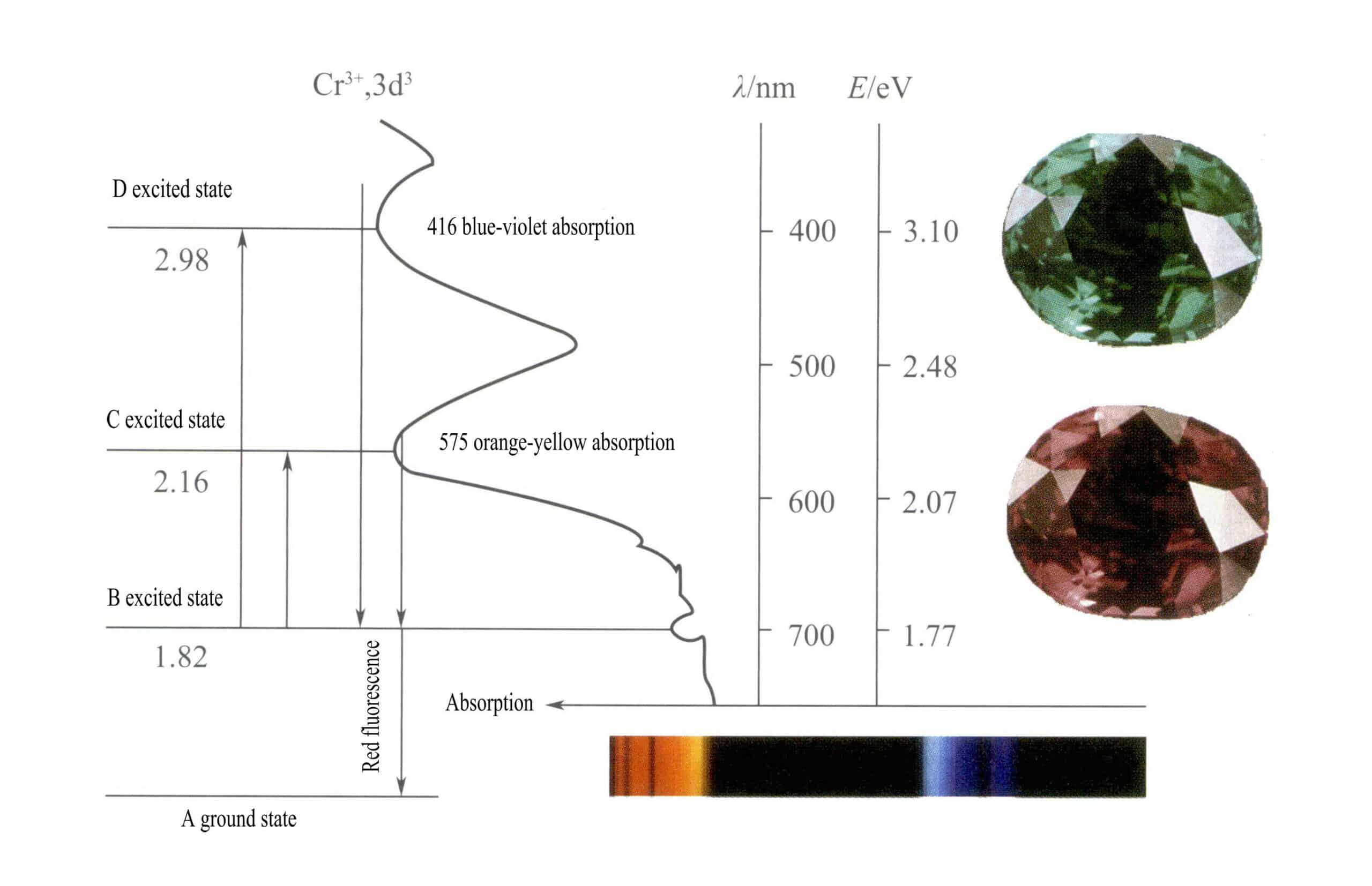
Secondo la teoria del campo cristallino, in un campo ottaedrico, gli orbitali d del Cr3+ può dividersi in energia inferiore dƐ e l'orbita a più alta energia dr orbita. Poiché i tre elettroni d di Cr3+ sono tutti nella zona dƐ e sono tutti elettroni singoli, le transizioni d-d possono avvenire sotto la luce visibile, facendo sì che le gemme contenenti Cr3+ per esibire il colore.
② Il meccanismo di colorazione del Cr3+:
Nel rubino Il principale componente chimico del rubino è Al2O3. Quando qualche percentuale di Cr3+ sostituisce Al3+produce un colore rosso brillante. Nella struttura del rubino, a causa del raggio maggiore del Cr3+ rispetto al raggio di Al3+, Cr3+ entra nel reticolo del corindone, riducendo la simmetria intorno all'ossido di alluminio.
Gli orbitali d del Cr3+ Quando gli elettroni dello stato eccitato tornano da D o C allo stato fondamentale A, devono prima passare attraverso B, rilasciando calore. Tornano da B ad A, accompagnati dalla luminescenza, emettendo fluorescenza rossa. In questo processo, gli elettroni assorbono energia luminosa, facendo sì che il rubino assorba lo spettro visibile D violetto (400 nm) e C giallo-verde (555 nm) (Figura 3-22), formando una banda di assorbimento.

Quando la luce bianca attraversa un rubino, i fotoni dello spettro dal viola al giallo-verde vengono assorbiti, mentre quasi tutta la luce rossa e una parte della luce blu passano attraverso, dando al rubino un colore rosso intenso con una punta di viola, noto come rosso sangue di piccione.
I rubini presentano un breve assorbimento di livello B, che si manifesta come fluorescenza rossa. Questo assorbimento di livello B che produce la fluorescenza rossa rende il colore del rubino più vivido; maggiore è il contenuto di ioni cromo, più forte è la fluorescenza.
Gli ioni di ferro presenti nella gemma possono sopprimere la fluorescenza dell'assorbimento di livello B, spiegando il fenomeno dei rubini che appaiono più scuri quando contengono impurità di ferro.
③ Cr3+ Il meccanismo di colorazione degli smeraldi
Il principale componente chimico dello smeraldo è il Be3Al2Si6O18, Cr3+che sostituisce Al3+ nel reticolo di smeraldo, e Cr3+ è anche circondato da un ottaedro composto da sei ioni ossigeno, dove il Cr3+Anche la lunghezza del legame -O è molto simile a quella dei rubini. Tuttavia, rispetto ai rubini, gli smeraldi hanno due ioni in più, Be2+ e Si4+. Nella struttura degli smeraldi, la natura del legame covalente tra gli ossidi metallici aumenta, mentre le caratteristiche ioniche si indeboliscono.
Cambiamenti minori, come i legami chimici, portano a una leggera diminuzione della concentrazione di Cr3+L'energia del livello C e del livello D determina un leggero spostamento della banda di assorbimento (Figura 3-23), bloccando in modo significativo la trasmissione della luce blu-viola (425 nm) e giallo-arancio (608 nm) nello spettro, mentre aumenta la trasmissione della luce blu-verde, formando così il caratteristico verde smeraldo.

L'assorbimento del livello B della diottasi è quasi invariato. Quando l'impurità del ferro non ha alcun effetto "inibitorio" nel componente smeraldo, la forte fluorescenza rossa fa brillare ancora di più il caratteristico verde smeraldo.
④ Cr3+ Il meccanismo del colore nell'alessandrite:
Il colore dell'alessandrite è causato anche dal Cr3+ sostituendo Al3+ in coordinazione ottaedrica distorta. A causa della composizione chimica dell'alessandrite, che è BeAL2O4La natura dei legami chimici tra i suoi ioni metallo-ossigeno è intermedia tra quella del rubino e quella dello smeraldo. Pertanto, anche le sue bande di assorbimento si collocano tra quelle del rubino e dello smeraldo, con le probabilità di trasmissione della luce blu-viola e giallo-arancione che sono approssimativamente uguali, rendendo impossibile determinare se la luce rossa o blu-verde sia dominante (Figura 3-24).
Pertanto, il colore dell'alessandrite può dipendere solo dalla distribuzione dell'energia e dalla gamma di colori della luce incidente, dando luogo all'"effetto di cambiamento di colore" dell'alessandrite, ossia apparire verde alla luce del giorno con un'alta componente di luce blu e rosso alla luce incandescente con un'alta componente di luce rossa. Per questo motivo, l'alessandrite viene spesso definita "lo smeraldo del giorno e il rubino della notte".
L'effetto "cambio di colore" si manifesta in molti tipi di gemme, come il corindone cangiante e il granato cangiante. Attualmente, il corindone cangiante sintetizzato artificialmente viene prodotto utilizzando il principio del cambiamento di colore, impiegando V3+ come ione colorante per la sintesi.
3. I colori dei minerali delle gemme
I colori prodotti dai componenti dei metalli di transizione possono essere dedotti dalla composizione chimica dei minerali delle gemme. Ad esempio, il turchese contenente Cu2+ deve essere blu, mentre Cu+ è incolore. La Tabella 3-11 elenca i colori prodotti dai comuni componenti dei metalli di transizione presenti nei minerali delle gemme naturali.
Tabella 3-11 Colori prodotti dai componenti dei metalli di transizione nei minerali delle gemme naturali
| Elemento | Colore | Minerali comuni |
|---|---|---|
| Cerio (Ce) | Giallo | Parisite |
| Cromo (Cr) | Rosso, verde, arancione, ecc. | Crocoisite, Crocoisite rossa, Uvarovite |
| Cobalto (Co) | Blu | Spinello sintetico |
| Rame (Cu) | Blu, verde | Azurite, crisocolla, malachite turchese, diottasio |
| Ferro (Fe) | Rosso, verde, giallo | Almandino, olivina, goethite |
| Manganese (Mn) | Rosa, arancione | Rodonite, spessartina |
| Nichel (Ni) | Verde | Bunsenite, Calcedonio |
Il colore della maggior parte delle gemme è causato dalle impurità dei metalli di transizione che contengono. Ad esempio, i rubini appaiono rossi a causa di tracce di Cr3+. Vari fattori influenzano il colore causato dagli ioni di impurità presenti nella gemma. Pertanto, le impurità possono produrre colori diversi in gemme diverse. Ad esempio, il Cr3+ appare rosso nei rubini e verde negli smeraldi.
Non è detto che le stesse impurità causino lo stesso colore di una gemma. Ad esempio, il colore verde della maggior parte degli smeraldi è causato dal Cr, mentre il colore verde di alcuni smeraldi è parzialmente o interamente causato dal vanadio (V).
La teoria del campo cristallino può essere utilizzata non solo per spiegare i colori delle gemme prodotti dai componenti o dalle impurità dei metalli di transizione, ma anche i colori prodotti dai difetti strutturali (centri di colore); il processo specifico di generazione del colore è riportato nel capitolo 3.3 di questo libro.
La spiegazione dei colori dei minerali delle gemme attraverso la teoria del campo cristallino presenta anche delle lacune, che si riflettono principalmente nei seguenti aspetti:
(1) Gli elettroni dello ione centrale d non sono completamente localizzati nei loro orbitali originali. Possono comparire anche intorno agli atomi coordinanti, indicando un'interazione covalente tra l'atomo centrale e i leganti.
(2) Considera solo l'interazione elettrostatica ionica tra l'atomo centrale e i ligandi, ignorando completamente l'interazione di legame covalente tra l'atomo centrale e i ligandi. Nella ricerca fisica, i risultati dei calcoli quantitativi spesso differiscono in modo significativo dalle situazioni reali.
(3) Le ragioni del colore dei minerali gemmari, oltre all'interazione tra lo ione centrale e i ligandi, possono essere dovute anche agli effetti combinati dei difetti strutturali e del campo cristallino.
Sezione II Teoria degli orbitali molecolari
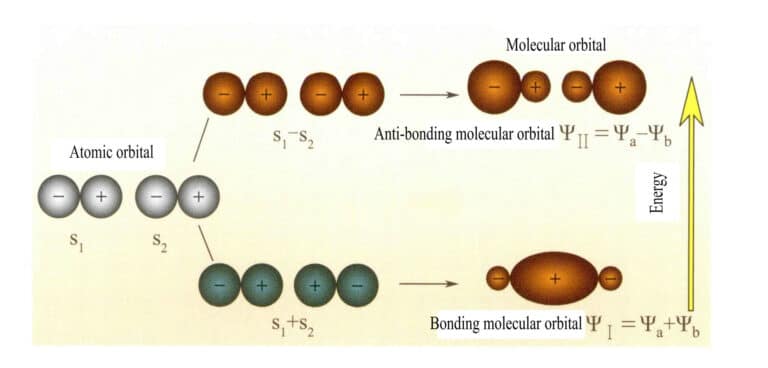
Mulliken e Hund proposero inizialmente la teoria degli orbitali molecolari (teoria MO). Grazie alla continua esplorazione di molti scienziati, si è sviluppata in una teoria matura. Gli orbitali molecolari (MO) possono essere ottenuti da combinazioni lineari di orbitali atomici, un metodo comunemente usato per costruire gli orbitali molecolari. Da n orbitali atomici si possono ottenere n orbitali molecolari e i coefficienti della combinazione lineare possono essere determinati con il metodo variazionale o con altri metodi. Gli orbitali molecolari formati da due orbitali atomici, con livelli energetici inferiori a quelli degli orbitali atomici, sono detti orbitali di legame; quelli con livelli energetici superiori agli orbitali atomici sono detti orbitali di antilegame; quelli con livelli energetici vicini agli orbitali atomici sono generalmente orbitali di non legame.
La teoria degli orbitali molecolari è una teoria utilizzata per spiegare questioni quali la formazione, la struttura e le proprietà delle molecole. Può anche spiegare alcune delle cause dei colori delle gemme, che sono stati sviluppati sulla base della teoria del campo cristallino e della teoria degli orbitali molecolari dei metalli di transizione. Gli orbitali molecolari sono un'estensione naturale degli orbitali atomici. In una molecola, gli elettroni non appartengono più a un atomo specifico, ma si muovono nell'intera gamma molecolare; pertanto, il movimento degli elettroni in una molecola viene descritto utilizzando gli orbitali molecolari.
1. Concetti di base della teoria degli orbitali molecolari
La teoria degli orbitali molecolari sostiene che, dopo che gli atomi formano una molecola, gli elettroni non appartengono più agli orbitali atomici originali, come proposto dalla teoria del campo cristallino, ma si muovono all'interno di determinati orbitali molecolari. Gli orbitali molecolari compongono una molecola proprio come gli orbitali atomici compongono un atomo. Gli elettroni di valenza non sono più considerati localizzati all'interno dei singoli atomi, ma si muovono nell'intera molecola. La distribuzione degli elettroni nella molecola può essere trattata secondo i principi della distribuzione degli elettroni negli atomi (principio di minima energia e regola di Hund).
La combinazione lineare degli orbitali atomici in una molecola forma gli orbitali molecolari. Il numero di orbitali molecolari è uguale al numero di orbitali atomici prima della combinazione. La combinazione degli orbitali atomici in orbitali molecolari effettivi deve rispettare i tre principi seguenti:
(1) Principio di corrispondenza della simmetria: Solo gli orbitali atomici con la stessa simmetria possono formare orbitali molecolari.
(2) Principio di prossimità energetica: Solo orbitali atomici con energie simili possono combinarsi per formare orbitali molecolari effettivi.
(3) Principio della massima sovrapposizione: in caso di corrispondenza di simmetria, maggiore è la sovrapposizione degli orbitali atomici, più diminuisce l'energia degli orbitali molecolari risultanti e più stabile è il legame chimico risultante.
L'orbitale molecolare ψ è la funzione d'onda di un singolo elettrone. Può essere rappresentato come una combinazione lineare di orbitali atomici, con ogni orbitale corrispondente a un'energia specifica, che è la somma dell'energia cinetica e potenziale dell'elettrone che si muove nel campo elettrico molecolare. Due orbitali atomici, a e b, attraverso combinazioni lineari sovrapposte, producono due orbitali molecolari ψI e ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Quando gli orbitali molecolari con elettroni vengono riempiti per primi, gli orbitali di legame ψI sono riempiti per primi. Quando gli elettroni riempiono orbitali molecolari di uguale energia, secondo la regola di Hund, devono occupare il più possibile anche orbitali molecolari diversi con la stessa direzione di spin.
Gli orbitali molecolari ψI ottenuti sommando due orbitali atomici (Equazione 3-5) sono chiamati orbitali molecolari di legame. Gli orbitali molecolari ψII ottenuti dalla sottrazione di due orbitali atomici (Equazione 3-6) sono chiamati orbitali molecolari antileganti. L'energia degli orbitali molecolari di legame è inferiore a quella degli orbitali molecolari di antilegame e inferiore alle energie dei due orbitali atomici originali. Pertanto, proprio come nel caso del riempimento degli orbitali atomici, quando si riempiono gli orbitali molecolari, gli elettroni vengono prima collocati negli orbitali di legame e un orbitale molecolare può ospitare due elettroni con spin opposti. Quando gli elettroni riempiono orbitali molecolari di uguale energia, secondo la regola di Hund, dovrebbero occupare anche orbitali molecolari diversi con la stessa direzione di spin, per quanto possibile. Gli orbitali molecolari formati da due orbitali atomici s sono illustrati nella Figura 3-25.

Gli orbitali p e gli orbitali d possono anche formare orbitali molecolari di livelli energetici diversi; ad esempio, la combinazione di orbitali molecolari biatomici in O2 molecole è relativamente complesso.
Negli esperimenti sono state misurate le proprietà magnetiche di questi due singoli elettroni, fornendo un forte sostegno alla teoria degli orbitali molecolari. A differenza delle molecole composte dagli stessi atomi, quelle composte da due o più atomi diversi hanno livelli di energia degli orbitali molecolari più complessi, ma il principio è lo stesso.
2. Caratteristiche della colorazione a trasferimento di carica
Questa teoria degli orbitali molecolari, in cui l'intera molecola condivide gli elettroni, è anche considerata come il passaggio di elettroni da un orbitale atomico a un altro, noto come trasferimento di carica. Il trasferimento di carica può avvenire nelle interazioni metallo-metallo (M-M), non metallo-non metallo (L-L) e non metallo-metallo (L-M). Tra questi, L-L, M-L, questi due tipi di legame sono spesso principalmente legami covalenti. O2 appartiene al trasferimento di carica L-L, che è un legame covalente.
(1) Trasferimento di carica metallo-metallo (trasferimento di carica M - M)
Questo tipo di trasferimento di carica avviene generalmente tra ioni di metalli di transizione comuni. La maggior parte delle cause di colorazione delle gemme colorate sono prodotte dal trasferimento di carica metallo-metallo. Il trasferimento di carica M-M comprende principalmente i seguenti tipi: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+Mn2+ - Mn4+/Mn3+ - Mn3+ . Il trasferimento di carica tra metalli si divide in due tipi: trasferimento di carica tra atomi omonucleari e trasferimento di carica tra atomi eteronucleari.
① Trasferimento di carica tra atomi isoelettronici
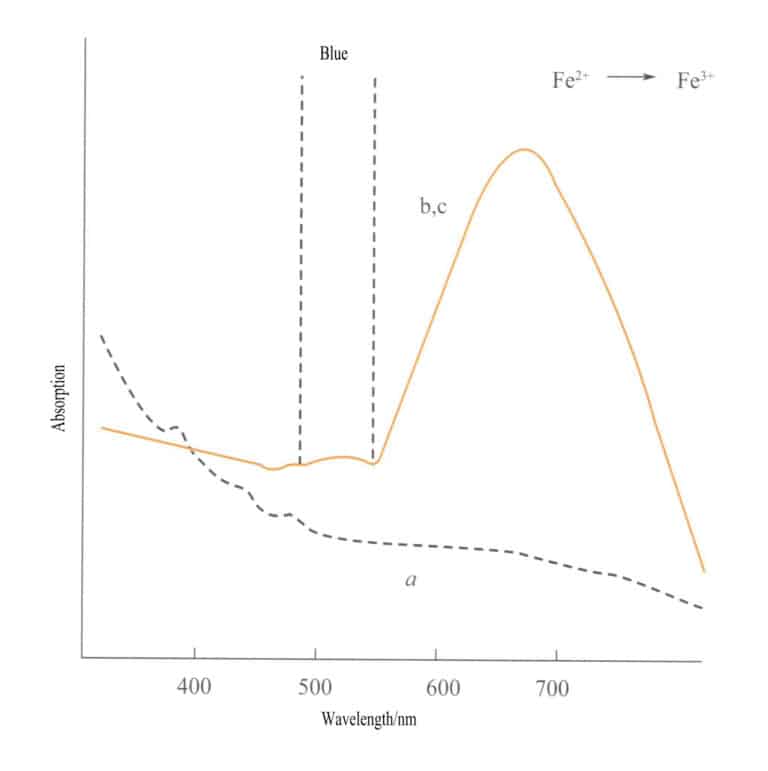
Il trasferimento di carica tra atomi isoelettronici avviene tra due atomi dello stesso elemento metallico di transizione in stati di ossidazione diversi. Ad esempio, Fe2+ e Fe3+ subiscono un trasferimento di carica in diverse condizioni redox, assorbendo energia e producendo colore. Il colore blu-viola della iolite è prodotto dal trasferimento di carica degli ioni di ferro in diversi stati di ossidazione. Fe3+ e Fe2+ si trovano rispettivamente in posizione tetraedrica e ottaedrica, con due ligandi collegati da bordi. Quando la luce visibile illumina la iolite, un elettrone d del Fe2+ assorbe la luce di una certa energia e transita a Fe3+assorbendo la luce gialla a 588 nm e producendo un colore blu-viola. Anche l'acquamarina, la tormalina verde e altre possono presentare un colore dovuto al trasferimento di carica tra ioni di ferro.
② Trasferimento di carica tra eteroatomi
Gli zaffiri blu sono il tipico esempio di colore prodotto dal trasferimento di carica tra due tipi di ioni di metalli di transizione. I poliedri di coordinazione degli ioni dei metalli di transizione sono collegati da spigoli o facce che facilitano il trasferimento di carica tra i metalli.
Ad esempio, negli zaffiri, quando gli ioni di ferro e di titanio entrano negli ottaedri collegati, sia il Fe che il Ti esistono in due stati di ossidazione:
Fe2+ + Ti4+ bassa energia (3-7)
Fe3+ + Ti3+ alta energia (3-8)
La transizione dall'equazione (3-7) all'equazione (3-8) richiede l'assorbimento di una certa quantità di energia luminosa, che si traduce in un'ampia banda di assorbimento che va dal giallo al rosso. Al contrario, la maggior parte della luce blu passa attraverso la gemma, conferendole un aspetto blu.
Il trasferimento di carica tra diversi stati di valenza ha una forte direzionalità e le gemme che presentano colori dovuti a questo meccanismo spesso mostrano pleocroismo. Ad esempio, l'acquamarina colorata da Fe2+→ Fe3+ Il trasferimento di carica mostra il colore rigorosamente lungo la direzione dell'asse ottico. La Figura 3-26 mostra come l'acquamarina appaia gialla nei piani b e c. Allo stesso tempo, non vi è alcun trasferimento di carica lungo la direzione dell'asse a, con conseguente assenza di assorbimento della luce e, quindi, di colore lungo la direzione dell'asse a.
(2) Trasferimento di carica da non metallo a metallo (L-M)
Questo tipo di trasferimento di carica L-M si verifica spesso tra l'ossigeno e gli ioni metallici, e alcune gemme contenenti ossigeno sono colorate dal trasferimento di carica da non metallo a metallo, come l'O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
Nello spettro di assorbimento degli ossidi di ferro semplici (Figura 3-27), due deboli bande di assorbimento appaiono nella regione dell'infrarosso di ilmenite, ematite e lepidocrocite (transizioni elettroniche d - d). Una forte banda di assorbimento appare nella gamma delle onde corte, prodotta dall'O2-→Fe3+ Questa banda di assorbimento determina i colori caratteristici di questi composti: marrone-rossastro, marrone e giallo-marrone.
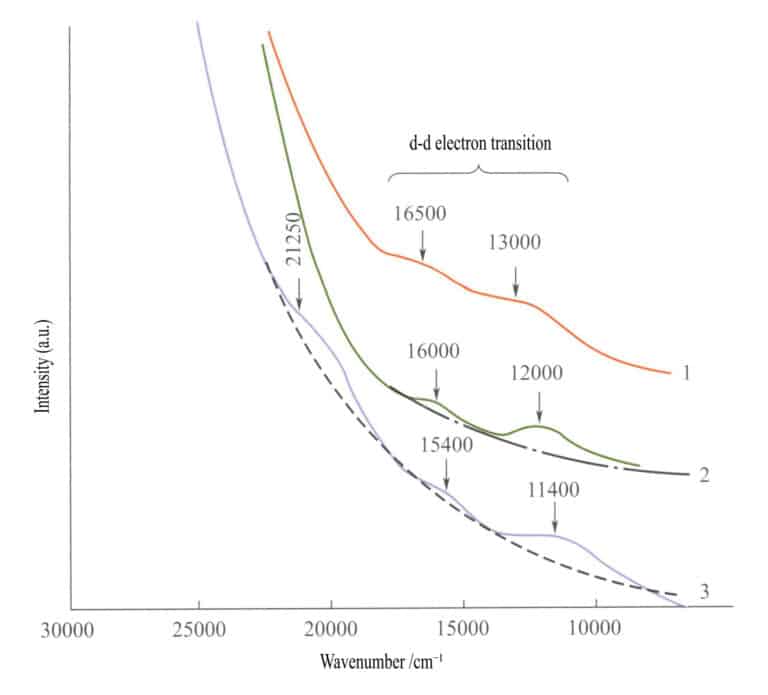
1 -Iilmenite; 2 - Ematite; 3 - Lepidocrocite
Il berillo giallo trae il suo colore da O2–→ Fe3+ trasferimento di carica. Nella struttura del berillo giallo, O2–→ Fe3+ Il forte assorbimento per trasferimento di carica può estendersi dall'ultravioletto al blu dello spettro visibile, assorbendo il viola e il blu e dando luogo a un colore giallo.
Anche lo zaffiro, che ha un ambiente di coordinazione completamente diverso da quello del berillo, può produrre le stesse bande di assorbimento spettrale del berillo, dando luogo al giallo, che è anche il risultato dell'O2–→ Fe3+ trasferimento di carica.
Secondo la teoria del campo cristallino, alcuni minerali gemmari non contengono elettroni spaiati e non possono produrre colore. Ad esempio, gli strati elettronici della crocoite (PbCrO4), Pb2+, Cr6+, e O2– sono pieni. Tuttavia, nel caso del CrO42- atomici sono "orbitali molecolari", che corrispondono agli stati eccitati durante la fase di O2-→Cr6+ trasferisce, formando bande di assorbimento e presentandosi di colore arancione.
L→M Il trasferimento di carica include anche il trasferimento di zolfo al metallo, come nella comune pirite; questo fenomeno ottico causato dal trasferimento è più facile da comprendere se discusso utilizzando la teoria delle bande.
(3) Trasferimento di carica da non metallo a non metallo (L-L)
La teoria degli orbitali molecolari suggerisce che il colore blu intenso del lapislazzuli sia dovuto ai livelli energetici di eccitazione del S3- gruppo atomico.
Nella grafite, gli anelli di sei atomi di carbonio sono disposti a strati. Lungo questo strato, gli elettroni possono muoversi in una certa misura liberamente, con conseguente forte assorbimento della luce, anisotropia e conduttività.
Alcune gemme organiche, come l'ambra e le perle, hanno elettroni che si muovono ed eccitano attraverso i gruppi atomici dei pigmenti organici in orbitali molecolari condivisi, causando l'assorbimento della luce visibile e producendo il colore. Ad esempio, il "giallo miele" dell'ambra, i colori del corallo, alcune conchiglie e perle colorate.
I meccanismi di colore delle gemme più comuni sono illustrati nella Tabella 3-12.
Tabella 3-12 Classificazione dei meccanismi di colore delle gemme comuni
| Trasferimento di carica metallo-metallo | Fe2+ - Fe3+ /Fe3+ - Fe2+ : iolite (blu), berthierite (blu), magnetite (nera), ecc. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Kyanite (blu), Zaffiro (blu) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganite (nera), Bixbyite (nera) | |
| Trasferimento di carica da non metallo a metallo | O2- -Fe3+: Berillo giallo oro, zaffiro giallo oro, ilmenite, ematite, lepidocrocite, ecc. |
| O2- - Cr6+: Crocoite (arancione) | |
| O2- -V5+Vanadinite (arancione) | |
| Da zolfo a metallo: pirite, marcasite, ecc. (vedi semiconduttore con gap) | |
| Trasferimento di carica non metallico - non metallico | S3-: Lapislazzuli (blu) |
| Π elettronico: grafite (nero) | |
| I colori di alcune gemme organiche come l'ambra e il corallo. |
Copywrite @ Sobling.Jewelry - Produttore di gioielli personalizzati, fabbrica di gioielli OEM e ODM
Sezione III Teoria delle bande energetiche
La teoria delle bande energetiche è un modello meccanico quantistico per lo studio dei materiali delle gemme, che rappresenta un'ulteriore estensione ed espansione della teoria degli orbitali molecolari. Lo studio della teoria delle bande di energia può spiegare meglio il meccanismo di colorazione di alcune gemme di colore naturale.
1. Concetti di base della teoria delle bande energetiche
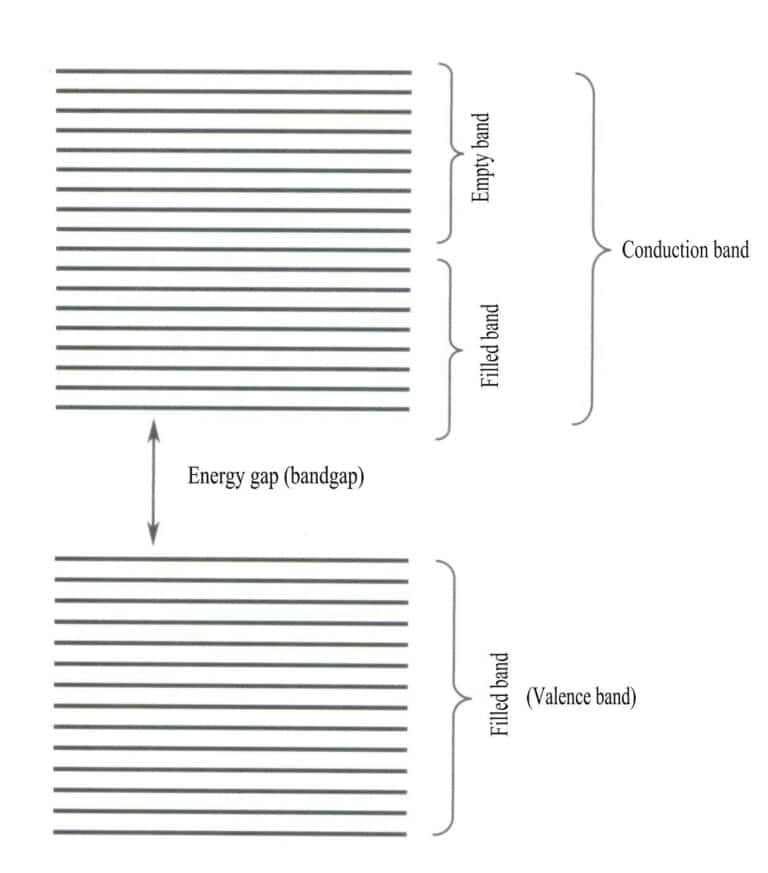
La teoria delle bande energetiche è una teoria approssimativa utilizzata per studiare le leggi del moto degli elettroni nei solidi. I solidi sono composti da atomi, che comprendono i nuclei atomici e gli elettroni più esterni, tutti in costante movimento. La teoria delle bande sostiene che gli elettroni nei solidi non sono legati a un atomo specifico, ma sono condivisi dall'intero cristallo e si muovono all'interno del campo di potenziale periodico dello spazio tridimensionale del cristallo. Il campo di movimento degli elettroni si trova all'interno del campo di potenziale periodico del reticolo, consentendo alla distribuzione spaziale degli orbitali degli elettroni di superare quella delle molecole, raggiungendo un massimo. I livelli energetici dei singoli elettroni si allargano in bande energetiche.
La teoria delle bande tratta principalmente le transizioni di elettroni tra stati non locali, in cui tutti gli elettroni di valenza dovrebbero appartenere all'intero reticolo solido. Secondo la teoria delle bande, i materiali solidi possono essere suddivisi in diverse bande energetiche in base al riempimento o meno degli orbitali atomici: una banda piena è formata dai livelli energetici degli orbitali atomici completamente occupati dagli elettroni, che rappresentano una banda a bassa energia; una banda vuota è formata dai livelli energetici non completamente occupati dagli elettroni, che rappresentano una banda ad alta energia. La differenza di energia tra questi due tipi di bande è chiamata "band gap" (Figura 3-28).
Quando tutte le bande energetiche di un materiale sono riempite, è un non-conduttore; quando è parzialmente riempito di elettroni, è un conduttore. I difetti del reticolo introducono ulteriori livelli energetici nel cristallo, consentendo agli elettroni di entrare in questi livelli energetici, con conseguente conduttività condizionale.
2. Caratteristiche delle transizioni di band-gap
Alcuni minerali delle gemme contengono elementi del gruppo IV A della tavola periodica, come il diamante e la moissanite, che si legano principalmente in modo covalente. Esistono anche altri minerali, come il solfuro di cadmio (CdS), i cui colori possono essere spiegati dalla teoria delle bande.
Gli elettroni assorbono l'energia della luce e si muovono tra le bande di valenza e di conduzione, formando "transizioni di banda interne". La probabilità delle transizioni è strettamente correlata alla differenza di energia tra le bande di valenza e di conduzione, nota come energia di band gap (Eg) (Figura 3-29).

La Figura 3-29 (a) rappresenta un tipico diagramma a bande dei semiconduttori. In base alle dimensioni dell'energia di band gap, il cristallo può essere suddiviso in tre tipi: wide band gap, narrow band gap e medium band gap. Una banda larga ha un'energia di band gap superiore all'energia della luce visibile; quando l'energia di band gap supera l'energia della luce visibile, la luce visibile non viene assorbita e passa completamente, rendendo il minerale incolore. Ad esempio, l'energia di band gap del diamante Eg è di circa 5,5eV, il che lo rende incolore.
L'energia di bandgap dei materiali a bandgap stretto è inferiore a quella della luce visibile, per cui tutta la luce visibile viene assorbita, dando luogo a colori grigio-verde scuro o nero. Ad esempio, l'energia di bandgap della galena è Eg inferiore a 0,4eV, che sembra essere grigio piombo. Quando questo "semiconduttore a banda stretta" ha una forma geometrica appropriata, presenta proprietà di raddrizzamento e amplificazione.
L'energia dei materiali a bandgap medio si trova esattamente nell'intervallo della luce visibile e i minerali gemmari presentano vari colori. La loro sequenza di colori è mostrata nella Figura 3-29 (c), e va dal rosso-giallo al verde-blu al viola. Ad esempio, l'energia di bandgap (Eg) del solfuro di cadmio (CdS) è di circa 2,5eV, che assorbe la luce blu e viola, apparendo giallo. L'energia di bandgap del cinabro è di circa 2eV e lascia passare solo la luce rossa, apparendo quindi rosso. L'energia di bandgap dell'orpimento è di circa 2,5eV e appare giallo.
Un'altra categoria di minerali gemmati naturali spiegata dalla teoria delle bande è il colore dei materiali ad ampio bandgap contenenti impurità. Ad esempio, nel caso di un diamante con impurità, l'energia di bandgap del diamante è di circa 5,5eV e la luce visibile non viene assorbita quando passa attraverso il diamante; il diamante puro è incolore, ma la situazione cambia quando contiene impurità.
(1) Il meccanismo del colore dei diamanti gialli
Gli atomi di azoto sostituiscono le posizioni degli atomi di carbonio. Poiché gli atomi di azoto hanno un elettrone in più rispetto agli atomi di carbonio, questo elettrone extra forma un livello energetico di impurità nel bandgap, noto come livello energetico donatore, con gli atomi di azoto che fungono da "donatori".
L'esistenza di questo livello di impurità riduce l'energia del band gap a 4eV[ [Figura 3-30 (a)]. Può essere ancora più bassa, consentendo di assorbire la luce ultravioletta e un po' di luce violetta a 3eV, facendo apparire il diamante giallo.
L'effetto è forte: un atomo di azoto ogni centomila atomi di carbonio può rendere il diamante di colore giallo intenso. Tuttavia, la riduzione del band gap è ancora insufficiente per rendere il diamante conduttivo a temperatura ambiente.
(2) Meccanismo del colore nei diamanti blu
Poiché il boro ha un elettrone in meno rispetto al carbonio, forma un "livello accettore" nel band gap del diamante. Non ha elettroni in più, ma può accettare elettroni dalla banda di valenza del diamante, creando buchi nella banda di valenza [Figura 3-30 (b)] e formando una banda energetica di impurità di circa 0,4eV sopra la banda di valenza, nota come livello accettore.

Il livello energetico dell'accettore non è semplice; è una struttura complessa di bande energetiche di impurità che possono produrre il blu. Il livello energetico dell'accettore crea dei "buchi" nella banda di valenza, che permettono al diamante blu di tipo II b di condurre l'elettricità.
Un atomo di boro ogni milione di atomi di carbonio può formare il blu. A causa del maggiore contenuto di alluminio in questo diamante blu e del fatto che l'alluminio ha un elettrone dello strato esterno in meno rispetto al carbonio, in passato si pensava che l'alluminio svolgesse il ruolo di accettore. Tuttavia, gli esperimenti attuali hanno dimostrato che è il boro, non l'alluminio.
I diamanti blu conduttivi di tipo II b sono naturalmente blu e la loro conduttività è una delle differenze rispetto ai diamanti blu irradiati (centri di colore). Questa proprietà viene spesso utilizzata per distinguere i due tipi di diamanti. Tuttavia, i diamanti gialli donatori di azoto non conducono elettricità, quindi questo metodo non può essere utilizzato per distinguerli dai diamanti gialli irradiati.
3. Minerali di pietra preziosa colorati da transizioni di banda
La teoria delle bande energetiche può spiegare parte della formazione del colore delle gemme naturali. Poiché l'energia della banda è una proprietà intrinseca del cristallo e non cambia a causa di condizioni esterne, il colore delle gemme ha una buona stabilità. La conduttività del cristallo può essere determinata in base al fatto che le bande energetiche del cristallo sono piene di elettroni. La Tabella 3-13 elenca i tipi di colori delle gemme che possono essere spiegati dalla teoria delle bande e le loro proprietà di conducibilità.
Tabella 3-13 Tipi di colori delle gemme spiegati dalla teoria delle bande e dalla loro conduttività
| Conduttori (colori metallici e lucentezza metallica) | Elemento | Rame, oro, ferro, argento, mercurio, ecc. |
| Lega | Amalgama, ferro di nichel meteoritico | |
| Semiconduttori | Banda passante stretta | Da grigio opaco a nero: altaite, galena |
| Colore metallico opaco: cobalto, marcasite, pirite, smaltite | ||
| Banda passante moderata | Rosso: cinabro, proustite, pirargirite | |
| Arancione: Realgar | ||
| Giallo: Solfuro di cadmio, realgar, zolfo | ||
| Ampio bandgap | Incolore: diamante, sfalerite | |
| Semiconduttori a banda larga contenenti impurità | Impurità del donatore: Diamante drogato con azoto (giallo) | |
| Impurità nell'ospite: diamante contenente boro (blu) |
Il colore delle gemme causato dalle transizioni di banda è legato alla struttura e al tipo di legame al momento della formazione della gemma. Ha poca relazione con le impurità e i difetti cristallini successivi. La dimensione dell'energia di band gap delle gemme è fissa. Non cambia con le proprietà del materiale della gemma, quindi i metodi di ottimizzazione convenzionali non possono generalmente migliorare il colore delle gemme.
Sezione IV Effetti ottici fisici
La maggior parte delle gemme naturali può provocare un assorbimento selettivo della luce e le diverse gemme assorbono la luce visibile a diverse lunghezze d'onda, dando origine a colori diversi. Oltre all'assorbimento selettivo della luce, anche la struttura interna dei cristalli delle gemme può causare effetti ottici fisici, che portano a colori diversi nelle gemme.
1. Minerali delle gemme in relazione agli effetti ottici fisici
I colori prodotti dagli effetti ottici fisici si formano a causa della dispersione, dell'interferenza, della diffrazione e di altri motivi della luce causati dalla struttura o dalla composizione del cristallo e dalle inclusioni. Si tratta semplicemente di un effetto ottico che può essere spiegato dalla teoria ottica fisica. Gemme diverse possono produrre colori diversi a parità di effetti ottici. Oltre ai comuni oligoelementi che causano il colore, le ragioni dei colori prodotti dagli effetti ottici fisici sono principalmente legate alla struttura interna e alle proprietà fisiche delle gemme. I tipi di minerali delle gemme che causano colori dovuti a effetti ottici fisici sono elencati nella Tabella 3-14.
Tabella 3-14 Tipi di minerali delle gemme causati da effetti fisici ottici
| Funzione | Proprietà ottiche e colore | Minerali delle gemme |
|---|---|---|
| Dispersione Dispersione | Scintillante | "Fuoco" nelle gemme in dispersione, come diamanti, zircone, rutilo e titanato di stronzio |
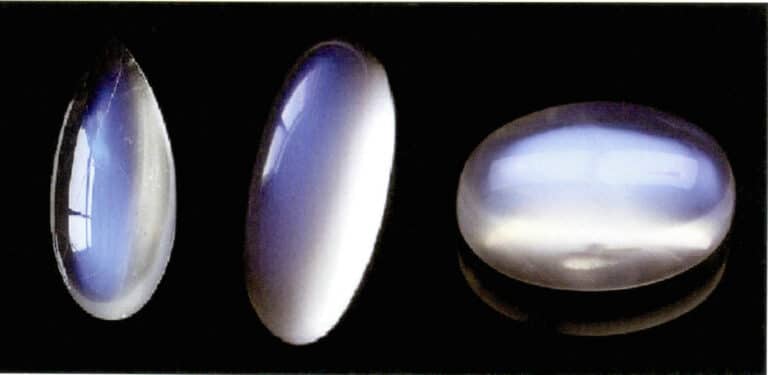
| Blu | Pietra di luna, quarzo blu, opale | |
| Viola | Fluorite (diffusione di microcristalli di calcio) | |
| Rosso | Vetro rubino, diffusione di microcristalli di rame o oro | |
| Bianco | Quarzo lattiginoso | |
| Effetto occhio di gatto | acquamarina occhio di gatto, pirosseno occhio di gatto, ecc. | |
| Effetto luce stellare | Vari effetti stellari di corindone e granato | |
| Lustro | Lucentezza di perle, apofillite, ecc. | |
| Scintillio | Scintillio di avventurina, ossidiana, ecc. | |
| Diffrazione per interferenza | I colori spettrali puri del film sottile | L'arcobaleno della calcopirite, la pellicola decolorata in una fessura di quarzo irideo |
| Effetti di interferenza | Cambiamento di colore dell'opale, l'effetto della labradorite | |
| Inclusione | Blu | Dumortierite in quarzo |
| Verde | Calcedonio verde e vene di nichel in calcedonio verde, fucsite in quarzo stellato | |
| Arancione | Ossido di ferro idrato in opale di fuoco e calcedonio color carne | |
| Rosso | Scaglie di ematite in ortoclasio |
2. Effetti di interferenza e diffrazione
(1) Effetti dell'interferenza
I fenomeni di interferenza si verificano quando due fasci di luce si propagano lungo lo stesso percorso ottico o in direzioni parallele. Un fenomeno di interferenza comune nelle gemme è l'iridescenza. Ad esempio, nel quarzo iridescente, i colori di interferenza dipendono dallo spessore della pellicola, dal suo indice di rifrazione e dalla natura della luce incidente.
I colori di interferenza delle perle sono formati dalla sovrapposizione concentrica a strati di due sostanze con indici di rifrazione diversi (aragonite e nacrum), dove la luce incidente viene riflessa dalle superfici tra gli strati alternati e la luce riflessa interferisce con la luce incidente producendo splendidi colori di interferenza.
(2) Effetti di diffrazione
La diffrazione si riferisce al fenomeno fisico per cui le onde luminose deviano dalla loro propagazione rettilinea originale quando incontrano ostacoli. In fisica, le onde luminose subiscono vari gradi di flessione e dispersione quando attraversano ostacoli come fenditure, piccoli fori o dischi. Se tra la sorgente luminosa e lo schermo di osservazione si frappone un ostacolo, sullo schermo di osservazione appariranno regioni chiare e scure, i cui confini non sono netti, formando un complesso disegno di luci e ombre. Questo fenomeno è chiamato diffrazione. Questi fenomeni si verificano ogni volta che le onde luminose incontrano ostacoli lungo il loro percorso di propagazione. Il fattore più importante nella produzione della diffrazione è la presenza di reticoli di diffrazione a spaziatura periodica nei minerali delle gemme.
① Cambiamento di colore dell'opale
Nell'opale, le sfere di silice contenenti acqua hanno diametri uguali e sono disposte in una struttura stratificata regolare e alternata, formando reticoli di diffrazione periodicamente distanziati. Quando la luce entra nell'opale, si verifica una diffrazione che cambia il colore (Figure 3-31, 3-32). I tipi di colori e il grado di variazione del colore dipendono principalmente dalla spaziatura interplanare delle sfere di silice impilate.
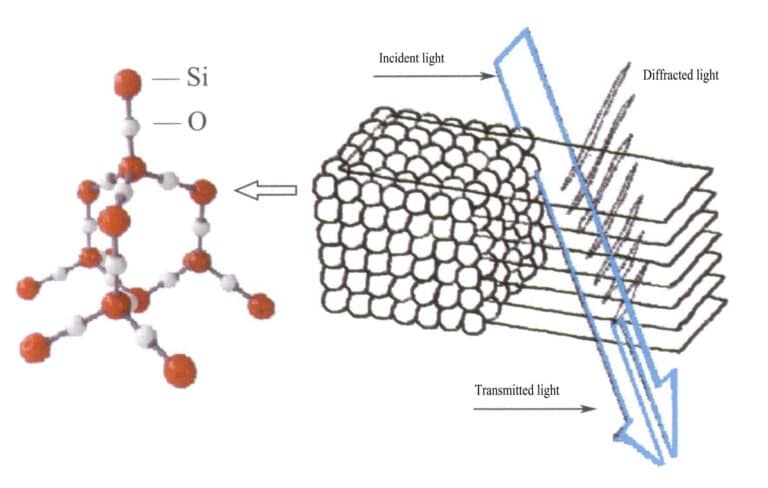

Ad esempio, l'opale con una struttura cubica a facce centrate a piastra piana e una spaziatura reticolare di 3×10-10m mostra colori che vanno dal verde al rosso; questo tipo di opale con una spaziatura reticolare di 2,5×10-10m mostra colori che vanno dal blu al giallo.
② Effetto Labradorite
La labradorite presenta anche effetti simili all'opale (Figura 3-33). La labradorite è nota anche come spettrolite perché può lampeggiare con la luce colorata del sole. Diversi tipi di labradorite provenienti dalla Finlandia possono mostrare una gamma di colori spettrali, un fenomeno noto come "effetto labradorite". L'effetto di cambiamento di colore nella labradorite è dovuto a piccole fusioni interstrato di plagioclasio con composizioni diverse. Le lievi differenze nell'indice di rifrazione tra i diversi feldspati causano l'interferenza e la diffrazione della luce, dando luogo alla luminescenza e al cambiamento di colore. I colori prodotti da questa struttura sono legati allo spessore relativo degli strati e ai loro indici di rifrazione. Occasionalmente, anche l'andradite proveniente dal Messico presenta fenomeni di diffrazione.

3. Diffusione e inclusioni
(1) Diffusione
La diffusione si verifica generalmente quando la struttura interna dei materiali gemmologici è irregolare o quando le dimensioni dei componenti superano i limiti delle condizioni di diffrazione. Gli effetti cromatici prodotti dalla diffusione sono legati alle dimensioni e alla forma delle particelle del materiale gemmologico. Quando la luce incidente interagisce con particelle disposte in modo irregolare e di dimensioni inferiori alla lunghezza d'onda della luce visibile, le onde luminose ad alta energia trasmesse sono più forti di quelle a bassa energia, per cui nella maggior parte dei casi sono visibili solo il viola e il blu. Ad esempio, il SiO2 Le piccole sfere presenti nell'opale hanno diametri inferiori alla lunghezza d'onda della luce visibile e, quando le dimensioni delle particelle diffondenti si avvicinano alla lunghezza d'onda della luce visibile, si può verificare anche la diffusione dei colori.
Ad esempio, la fluorite viola è causata da un'irradiazione radioattiva che espelle gli atomi di fluoro, con il risultato che gli atomi di calcio che si legano agli atomi di fluoro si condensano in placche esagonali di dimensioni paragonabili alla lunghezza d'onda della luce visibile. L'interazione tra le placche di calcio e le onde luminose produce una dispersione. Assorbe alcune onde luminose, creando un forte picco di assorbimento nella regione della luce verde-rossa, consentendo il passaggio della luce viola e producendo il colore viola.
Poiché le particelle di elementi metallici della stessa dimensione possono produrre effetti cromatici simili e le particelle di metalli diversi possono produrre colori diversi, alcune imitazioni di gemme sono prodotte utilizzando questa proprietà.
Ad esempio, il vetro "rubino" viene prodotto aggiungendo particelle di rame o oro al vetro, ottenendo un colore rosso simile a quello dei rubini. Quando il materiale della gemma contiene inclusioni, microfessure o bolle più grandi della lunghezza d'onda della luce visibile, le onde luminose interagiscono con queste particelle che si disperdono, facendo sì che le onde luminose disperse si ricombinino, producendo una luce lattiginosa traslucida. Ad esempio, alcune imitazioni di pietra di luna.
Anche l'effetto lunare della pietra di luna è prodotto dalla dispersione della luce (Figura 3-34). La pietra di luna è un feldspato alcalino, un composito formato da strati paralleli alternati di feldspato ricco di potassio e ricco di sodio. Lo spessore interstrato varia tipicamente da 50 a 1000 nm, con strati più sottili in grado di produrre scattering. Lo stesso colore di diffusione può verificarsi anche nel plagioclasio, noto come "effetto labradorite".
Una disposizione appositamente orientata delle particelle diffondenti può produrre effetti ottici caratteristici. Ad esempio, quando le particelle diffondenti sono in forma di fibre parallele, producono un effetto "occhio di gatto" o "stella", come gli zaffiri stellati e gli occhi di gatto di quarzo. Quando le particelle diffondenti sono abbastanza grandi da poter essere distinte a occhio nudo, possono produrre un "effetto goldstone", come la pietra del sole (Figura 3-35) e il vetro goldstone.

(2) Inclusioni
Il colore e i fenomeni ottici prodotti dalle inclusioni sono un tipo speciale di diffusione. Le inclusioni colorate incorporate in cristalli principali quasi incolori presenteranno il colore delle inclusioni, come il calcedonio a bande contenente nichel e l'ossido di ferro(II) contenente acqua (FeO - H2O) calcedonio color carne; il colore dell'ortoclasio del Madagascar e di alcune cordieriti è formato da inclusioni leggermente più grandi, ma sempre microscopiche, di ematite che creano sfumature rosse; inclusioni sub-microscopiche di idrossido ferrico spesso colorano l'opale di fuoco.
I diamanti presentano spesso colori diversi a causa della presenza di numerose inclusioni. I diamanti colorati dalle inclusioni possono essere neri, rosso-arancio e rosso-bruno. Quando un diamante contiene innumerevoli inclusioni minerali scure e opache, appare nero; se esaminato con una forte luce trasmessa, si possono osservare molte inclusioni scure e il diamante appare grigio scuro; un altro tipo di inclusioni è quello delle inclusioni secondarie che si verificano nelle crepe del diamante. Quando le crepe si sviluppano e si riempiono di queste inclusioni colorate, il diamante appare di colore rosso-bruno o rosso-arancio, noto anche come diamante "ossidato".
4. Dispersione
Il fenomeno della scomposizione della luce bianca in vari colori spettrali attraverso un oggetto è chiamato dispersione. La dispersione delle gemme si riferisce alla proprietà della luce di disperdersi in diverse lunghezze d'onda di colori spettrali quando passa attraverso i piani inclinati delle gemme trasparenti. A causa delle diverse lunghezze d'onda della luce monocromatica che compongono la luce bianca e che si propagano a velocità e indici di rifrazione diversi in materiali diversi, la luce bianca può essere scomposta in vari colori spettrali in determinate condizioni. La dimensione del valore di dispersione di una gemma è determinata dalle sue proprietà fisiche; ogni gemma ha il suo valore di dispersione intrinseco, che non cambia con le proprietà della gemma. Il fascino unico dei diamanti è strettamente legato al loro elevato valore di dispersione (0,044).
La maggior parte dei simulanti del diamante ha un valore di dispersione più alto, come il valore di dispersione dello zircone di 0,039 e il valore di dispersione della moissanite sintetica di 0,104. La tabella 3-15 mostra il confronto tra i valori di dispersione dei diamanti e dei loro comuni simulanti.
Tabella 3-15 Confronto tra i valori di dispersione dei diamanti e dei loro comuni simulanti
| Nome della pietra preziosa | Valore di dispersione |
|---|---|
| Diamante | 0.044 |
| Zircone | 0.039 |
| Corindone | 0.018 |
| Spinello | 0.020 |
| Topazio | 0.014 |
| Beryl | 0.014 |
| Cristallo | 0.014 |
| Rutilo sintetico | 0.280 |
| Titanato di stronzio sintetico | 0.190 |
| Moissanite sintetica | 0.104 |
La dispersione è comunemente definita il "fuoco" delle gemme. Ad esempio, i diamanti hanno un alto valore di dispersione e il loro fuoco è molto pronunciato, esaltando lo status già regale dei diamanti e mostrando il loro fascino unico.
Esistono molti tipi di colori prodotti da effetti ottici fisici, tutti spiegabili con la teoria ottica fisica. Ad eccezione della dispersione, che è una proprietà intrinseca della gemma stessa, altri fenomeni sono causati da cambiamenti strutturali successivi alla formazione della gemma e dalle differenze nelle inclusioni meccaniche. La comprensione delle varie cause dei colori delle gemme fornisce una base teorica per ottimizzare il trattamento delle gemme naturali e sintetiche.