لماذا تتعدد ألوان الأحجار الكريمة؟
مقدمة نظرية الحقل البلوري ونظرية المدار الجزيئي ونظرية نطاق الطاقة
إن ألوان الأحجار الكريمة غنية ومتنوعة، وتمتلك سحرًا فريدًا لطالما أحبها الناس. تعتمد جودة الأحجار الكريمة إلى حد كبير على لونها. ويُعد لون الأحجار الكريمة مؤشراً مهماً في تقييم الأحجار الكريمة، وتتضمن معظم علاجات تحسين الأحجار الكريمة تغيير لونها أو تحسينه. لذلك، يُعد فهم أسباب تلوين الأحجار الكريمة شرطاً أساسياً حاسماً في معالجة تحسين الأحجار الكريمة. ولا يمكن للمرء تحديد ما إذا كان يمكن تحسين لون الأحجار الكريمة أو لا يمكن تحسين لونها إلا من خلال إتقان كيفية اكتساب الأحجار الكريمة للونها، ومخطط التحسين الذي يجب اعتماده، والخطة التجريبية التي يجب وضعها. هناك خمس نظريات شائعة لتلوين الأحجار الكريمة: نظرية علم المعادن الكلاسيكية، ونظرية المجال البلوري، ونظرية المدار الجزيئي، ونظرية نطاق الطاقة، والتأثيرات البصرية الفيزيائية. وتشكّل هذه النظريات نظريات تلوين الأحجار الكريمة الطبيعية الشائعة، وفيما يلي مقدمة موجزة لنظريات التلوين الخمس هذه.
المدارات الجزيئية المكونة من مدارين ذريين s
جدول المحتويات
القسم الأول نظرية الحقل البلوري
اقترح العلماء في ثلاثينيات القرن العشرين نظرية المجال البلوري لتفسير خصائص البلورات. نظرية الحقل البلوري هي نظرية تدرس الروابط الكيميائية للعناصر الانتقالية (المعقدات). وتفسر الخواص الفيزيائية والكيميائية للعناصر الانتقالية وعناصر اللانثانيد من خلال الجمع بين بعض وجهات نظر النظرية الكهروستاتيكية وميكانيكا الكم ونظرية المجموعة (النظرية التي تدرس تناظر المادة)، مع التركيز على تأثير الروابط على مدارات الأيونات المركزية d و f. وبحلول الخمسينيات من القرن العشرين، طبق الناس نظرية المجال البلوري على المعقدات واقترحوا نظرية مجال الرابطة. تُعد نظرية مجال الرابطة تطويرًا لنظرية المجال البلوري؛ فهي تأخذ في الاعتبار تأثير المجال الكهربي للرابطة على الأيون المركزي وتأثير ملء إلكترونات الرابطة على الأيون المركزي، مما يجعلها أكثر اكتمالًا من نظرية المجال البلوري. ومع ذلك، لا يوجد فرق جوهري بين الاثنين، ولا يتم التمييز بينهما بشكل عام في دراسة المعادن غير العضوية.
1. المفاهيم الأساسية لنظرية الحقل البلوري
توجد أيونات الفلزات الانتقالية في المجال البلوري للأنيونات أو الجزيئات ثنائية القطب المحيطة بها. نظرية الحقل البلوري هي نموذج كهروستاتيكي ينظر إلى البلورة على أنها تفاعل كهروستاتيكي بين الأيونات الموجبة والسالبة، حيث يسمى الكاتيون الموجب الشحنة بالأيون المركزي، ويسمى الأنيون السالب الشحنة بالليجند.
يتضمن تطبيق نظرية المجال البلوري لتفسير لون معادن الأحجار الكريمة بشكل أساسي إلكترونات d أو طاقة إلكترونات f لأيونات العناصر الانتقالية. على سبيل المثال، تحتوي المدارات d على خمسة أنواع: dس ص, dxz, dيازو d و d و d. هذه المدارات d الخمسة لها توزيعات مكانية مختلفة في حالة الأيون الحر ولكن لها نفس الطاقة. ومع ذلك، فإنها تخضع لتغيرات كبيرة تحت تأثير مجال الرابطة. تنقسم مدارات d الخمسة المتحللة الطاقة للذرة المركزية تحت تأثير المجال الكهربائي السالب الذي تشكله الروابط المحيطة. تزداد طاقة بعض المدارات d، بينما تنخفض طاقة البعض الآخر. وبسبب انقسام مستويات طاقة المدارات d، يُعاد ترتيب الإلكترونات الموجودة في مدارات d للذرة المركزية، فتشغل المدارات ذات الطاقة الأقل طاقة بشكل تفضيلي، ومن ثَمَّ تقلل الطاقة الكلية للنظام وتجعل المركب أكثر استقرارًا.
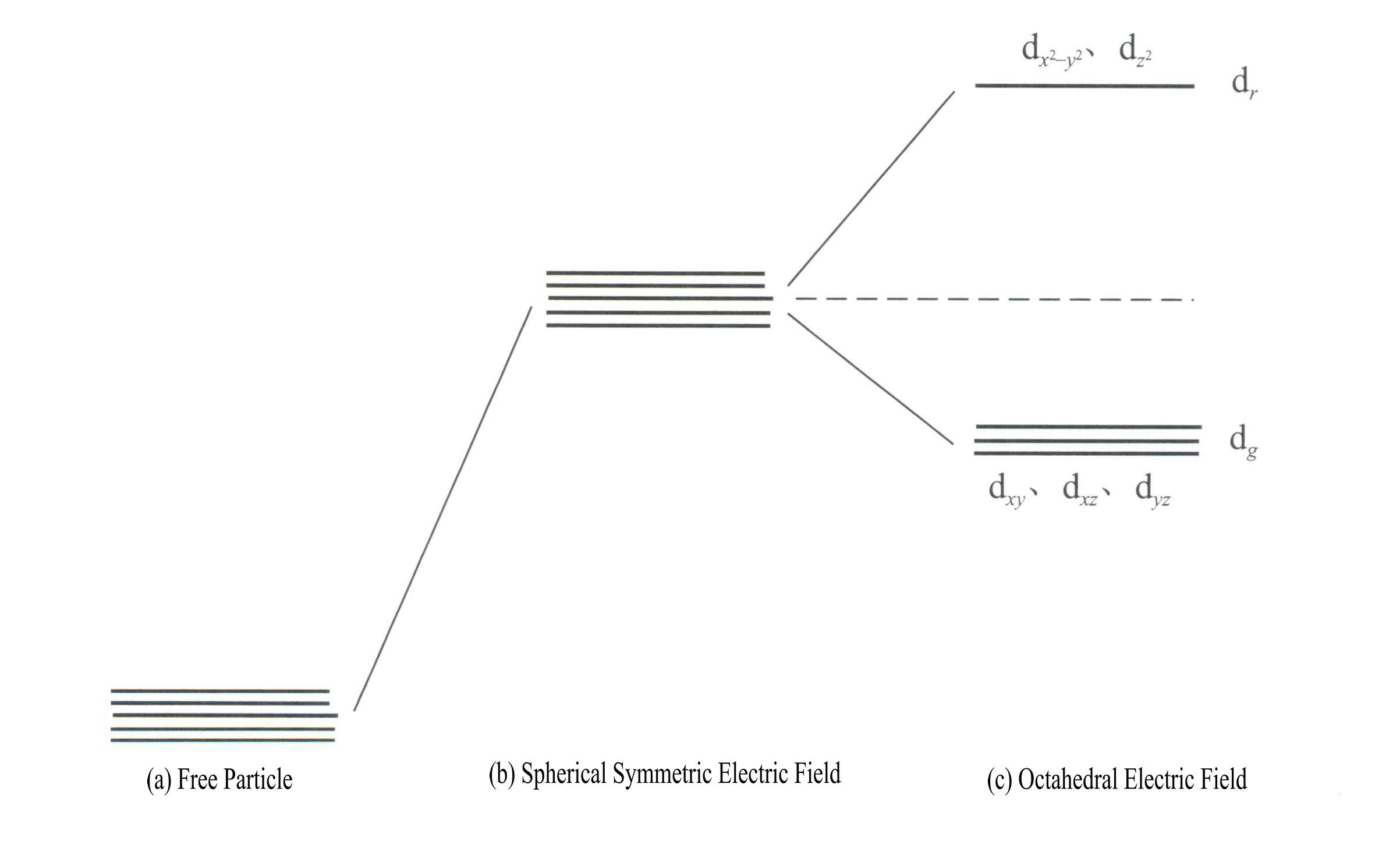
تكون طاقة المدارات d هي نفسها عندما لا يكون هناك مجال كهربائي [الشكل 3-19 (أ)]؛ وفي ظل مجال كهروستاتيكي متماثل كرويًّا، تزداد طاقة المدارات d ولكنها لا تنقسم [الشكل 3-19 (ب)]؛ وعندما يكون مجال الرابطة ثماني الأوجه تنقسم إلى dr و دg. من بين هؤلاء، دr تتكوَّن المدارات من مداري d وd، ذوي الطاقة الأعلى؛ حيث إن المدار d الأقل طاقةg من مدارات dس ص, dxz, dياز.
توجد أيونات الفلزات الانتقالية في المجال البلوري للأنيونات أو الجزيئات ثنائية القطب المحيطة بها. نظرية الحقل البلوري هي نموذج كهروستاتيكي ينظر إلى البلورة على أنها تفاعل كهروستاتيكي بين الأيونات الموجبة والسالبة، حيث يسمى الكاتيون الموجب الشحنة بالأيون المركزي، ويسمى الأنيون السالب الشحنة بالليجند.
يتضمن تطبيق نظرية المجال البلوري لتفسير لون معادن الأحجار الكريمة بشكل أساسي إلكترونات d أو طاقة إلكترونات f لأيونات العناصر الانتقالية. على سبيل المثال، تحتوي المدارات d على خمسة أنواع: dس ص, dxz, dيازو d و d و d. هذه المدارات d الخمسة لها توزيعات مكانية مختلفة في حالة الأيون الحر ولكن لها نفس الطاقة. ومع ذلك، فإنها تخضع لتغيرات كبيرة تحت تأثير مجال الرابطة. تنقسم مدارات d الخمسة المتحللة الطاقة للذرة المركزية تحت تأثير المجال الكهربائي السالب الذي تشكله الروابط المحيطة. تزداد طاقة بعض المدارات d، بينما تنخفض طاقة البعض الآخر. وبسبب انقسام مستويات طاقة المدارات d، يُعاد ترتيب الإلكترونات الموجودة في مدارات d للذرة المركزية، فتشغل المدارات ذات الطاقة الأقل طاقة بشكل تفضيلي، ومن ثَمَّ تقلل الطاقة الكلية للنظام وتجعل المركب أكثر استقرارًا.
تكون طاقة المدارات d هي نفسها عندما لا يكون هناك مجال كهربائي [الشكل 3-19 (أ)]؛ وفي ظل مجال كهروستاتيكي متماثل كرويًّا، تزداد طاقة المدارات d ولكنها لا تنقسم [الشكل 3-19 (ب)]؛ وعندما يكون مجال الرابطة ثماني الأوجه تنقسم إلى dr و دg. من بين هؤلاء، دr من مدارات dx2– y2 و دz2
ذات الطاقة الأعلى؛ حيث إن الطاقة المنخفضة دg من مدارات dس ص, dxz, dياز. [الشكل 3-19 (ج)]
يُطلق على الفرق بين أعلى وأدنى مستويات الطاقة بعد انقسام المدار d طاقة الفصل △ . طاقات الفصل الناتجة عن تكوينات مختلفة من حقول الرابطة ليست متماثلة (الشكل 3-20). ترتيب طاقتهم هو:
حقل مربع الشكل > حقل ثماني الأوجه > حقل رباعي الأوجه

حتى بالنسبة للحقول ذات التكوين الواحد، قد تختلف أيضًا بسبب الاختلافات في الروابط والأيونات المركزية؛ فكلما كانت أكبر، كانت البلورة أكثر استقرارًا. تحدد العوامل الثلاثة التالية بشكل أساسي حجم طاقة فصل البلورة:
(1) البلورات المتكونة من نفس العنصر الانتقالي؛ عندما تكون الروابط متماثلة، كلما زادت شحنة الأيون المركزي، زادت طاقة الفصل △ . وكلما زادت الشحنة الموجبة للأيون المركزي، كلما زادت الشحنة الموجبة للأيون المركزي، كلما زادت قوة الجذب للروابط، مما يؤدي إلى مسافة أصغر بين الأيون المركزي ونواة الرابطة، وكلما زادت قوة التنافر للمجال البلوري المتولدة من الروابط على الإلكترونات، كلما زادت طاقة الفصل △ .
(2) بالنسبة للبلورات المتكونة من أيونات مختلفة لها نفس الشحنة الموجبة ونفس الروابط، كلما كان نصف قطر الأيون المركزي أكبر، كلما كانت المدارات d أبعد عن النواة، وزادت طاقة الفصل △ .
(3) بالنسبة للبلورات المكوّنة من نفس الأيون المركزي وروابط مختلفة، تختلف طاقة الفصل بسبب اختلاف قوة المجال البلوري للرابطة. فالروابط المختلفة لها قوة مجال مختلفة، وتختلف طاقة الفصل △ باختلاف قوة مجال الرابطة.
تُستخدم طاقة الفصل لتفسير ثبات البلورات نوعيًا، وليس من الضروري الحصول على القيمة المطلقة △، حيث إن معرفة القيم النسبية للبلورة في ظل ظروف مختلفة كافية.
واستنادًا إلى الطاقة النسبية للمدارات d المنقسمة، يمكن حساب الطاقة الكلية لأيونات الفلزات الانتقالية في المدارات d. وتكون هذه الطاقة أقل مما كانت عليه قبل الانشقاق، ومن ثَمَّ توفر طاقة إضافية للبلورة، تُعرَف باسم طاقة استقرار المجال البلوري، ويمثِّلها الرمز CFSE. يسرد الجدول 3-10 طاقات استقرار الأيونات التي تحتوي على dn الإلكترونات في ظروف مختلفة.
الجدول 3-10 طاقات استقرار الحقل البلوري في ظل الروابط المختلفة (وو رويوا، 1994)
| dn | المجال الضعيف | حقل قوي | ||||
|---|---|---|---|---|---|---|
| dn | المربع | ثماني السطوح المنتظم | رباعي السطوح المنتظم | المربع | ثماني السطوح المنتظم | رباعي السطوح المنتظم |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. الخصائص اللونية لأيونات الفلزات الانتقالية
في أحجاره الكريمة الملونة، ويرجع لون معظم الأحجار الكريمة إلى أيونات الفلزات الانتقالية، ويرتبط لون الأحجار الكريمة بما إذا كانت الأيونات الملونة تحتوي على إلكترونات غير متزاوجة في المدارات d أو f. تشمل خصائص تلوين أيونات الفلزات الانتقالية بشكل أساسي الجوانب التالية:
(1) يرتبط تلوين أيونات الفلزات الانتقالية بالحالات الإلكترونية للمدار d أو المدار f. عندما تكون إلكترونات المدار d أو f المدارية ممتلئة أو فارغة، لن يظهر على الحجر الكريم لون. على سبيل المثال، Cr6+سي، ج4+و Cu+.
(2) تُظهر أيونات التلوين المختلفة ألوانًا مختلفة في نفس مادة الأحجار الكريمة. ونظرًا لاختلاف طاقات الفصل بين أيونات التلوين المختلفة، يمكن أن تظهر ألوانًا مختلفة حتى في نفس المادة. على سبيل المثال، الحديد2+ لونًا أزرق مائل للرمادي قليلًا في الإسبنيل، بينما يُنتج Cr3+ تنتج اللون الأحمر.
(3) غالبًا ما تُظهر الأيونات الملونة لنفس العنصر في حالات تكافؤ مختلفة ألوانًا مختلفة في نفس مادة الأحجار الكريمة. نظرًا لاختلاف الطاقة اللازمة لانتقالات الإلكترونات الثنائية للأيون المركزي، تختلف الأطوال الموجية الممتصة للضوء، مما يؤدي إلى اختلاف الألوان. على سبيل المثال، الزهر الذي يحتوي على المنغنيز2+ لونًا ورديًا ناعمًا، في حين أن البريل الذي يحتوي على المنغنيز2+ يقدم اللون الأحمر الفاتح، والمعروف باسم البريل الأحمر.
(4) غالبًا ما تُظهر الأيونات الملونة لنفس العنصر في نفس حالة التكافؤ ألوانًا مختلفة عندما تكون في تكوينات مختلفة من الروابط. على سبيل المثال، Co2+ في التكوين رباعي الأوجه في الإسبنيل لون "أزرق ماسي" مميز، بينما في التكوين ثماني الأوجه في الكالسيت يظهر باللون الوردي. الحديد2+ في الزبرجد الزيتون الثماني الأوجه المتناسق ثماني الأوجه يظهر باللون الأخضر الزيتوني المميز، بينما يظهر في الألمندين المكعب المشوه المتناسق المكعب باللون الأحمر الداكن.
(5) نفس النوع من الأيونات الملونة لها نفس حالة التكافؤ والهندسة التنسيقية، ولكن الذرات المتجاورة المختلفة المتناسقة تظهر ألوانًا مختلفة. على سبيل المثال، في التنسيق رباعي الأوجه ل Co2+في السفاليريت، Co2+ متصلة بالكبريت، وتظهر باللون الأخضر، بينما في الإسبنيل، فإن Co2+ متصل بالأكسجين، ويظهر باللون الأزرق.
(6) يُظهر نفس النوع من الأيونات الملونة التي لها نفس حالة التكافؤ والهندسة التنسيقية والذرات المتجاورة ألوانًا مختلفة في الأحجار الكريمة المختلفة. إن تشويه الهندسة التناسقية الناجم عن التركيبات الكيميائية المختلفة للأحجار الكريمة يغير طبيعة الروابط الكيميائية بين الأيون المركزي والرباطات المنسقة، مما يغير الطاقة الانتقالية للإلكترونات d. على سبيل المثال، Cr3+ يظهر باللون الأحمر في الياقوت، والأخضر في الزمرد، ويظهر بألوان متغيرة في الكسندريت. سبب هذه التغيُّرات في Cr3+ يرتبط بخصائصه والرباطات التنسيقية المجاورة، مع تحليل خاصية محددة على النحو التالي.
① كر3+ الخصائص:
كر3+ له بنية غلاف إلكتروني خارجي من 3s23p63d3مع وجود 11 إلكترونًا في الغلاف الخارجي، تنتمي إلى بنية غلاف إلكتروني غير منتظمة (8-18).
هذه البنية لها تأثير تدريع أقل على النواة من بنية الغلاف المكونة من 8 إلكترونات، مما يؤدي إلى Cr3+ بشحنة موجبة فعالة أعلى، في حين أن نصف قطرها الأيوني أصغر أيضًا، وهو ما يشكل الخصائص الأساسية ل Cr3+:: مجال كهربي موجب قوي ومدارات d فارغة. Cr3+ يمكن أن توفر ستة مدارات فارغة لاستيعاب ستة روابط منسقة، بتوزيع مكاني ثماني الأوجه ينتمي إلى d2sp3 التهجين (الشكل 3-21).
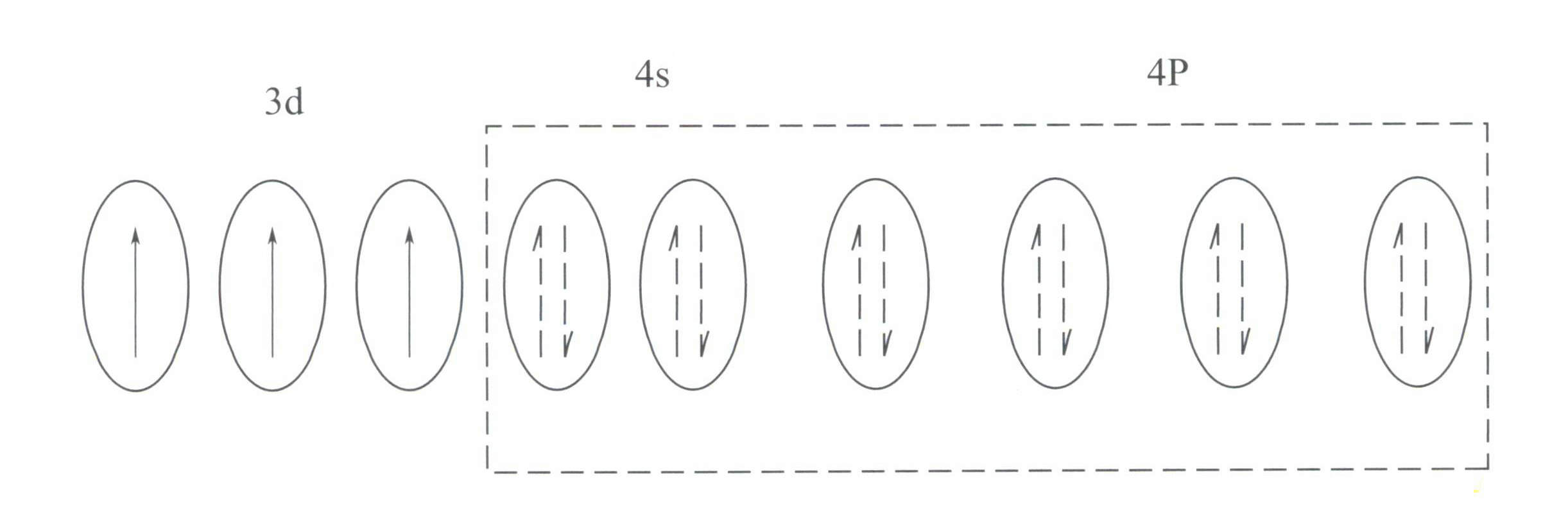
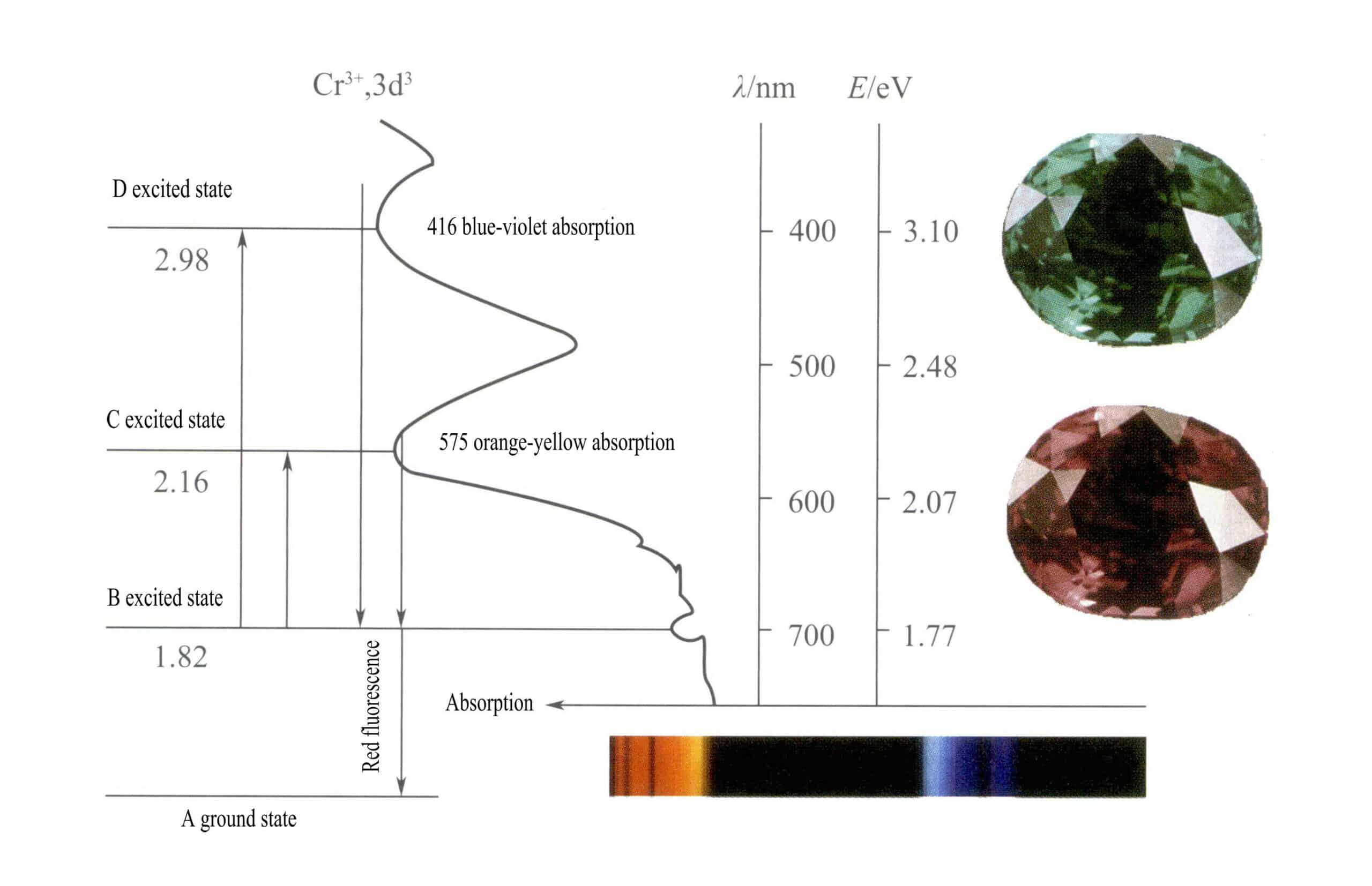
وفقًا لنظرية المجال البلوري، في المجال الثماني الأوجه، فإن المدارات d ل Cr3+ يمكن أن تنقسم إلى طاقة أقل دƐ المدار والطاقة الأعلى دr المدار. بما أن إلكترونات d الثلاثة لـ Cr3+ كلها في دƐ وجميعها إلكترونات أحادية المدار، ويمكن أن تحدث انتقالات d-d تحت الضوء المرئي، مما يتسبب في أن الأحجار الكريمة التي تحتوي على Cr3+ لإظهار اللون.
② آلية تلوين Cr3+:
في الياقوت المكون الكيميائي الرئيسي في الياقوت هو Al2O3. عندما تكون نسبة قليلة من Cr3+ يحل محل آل3+، ينتج عنه لون أحمر فاتح. في بنية الياقوت، بسبب نصف القطر الأكبر من Cr3+ مقارنةً بنصف قطر Al3+، كر3+ يدخل في شبكة الكوراندوم، مما يقلل من التماثل حول أكسيد الألومنيوم.
المدارات d ل Cr3+ الانقسام، وعندما تعود إلكترونات الحالة المثارة من D أو C إلى الحالة الأرضية A، يجب أن تمر أولًا عبر B، فتطلق الحرارة. ثم تعود من B إلى A، مصحوبة بتلألؤ ضوئي ينبعث منه تألق أحمر. في هذه العملية، تمتص الإلكترونات الطاقة الضوئية، مما يجعل الياقوت يمتص الطيف المرئي D البنفسجي (400 نانومتر) و C الأصفر والأخضر (555 نانومتر) (الشكل 3-22)، مكونًا نطاق امتصاص.

عندما يمر الضوء الأبيض من خلال الياقوت، يتم امتصاص فوتونات الطيف من اللون الأرجواني إلى الأصفر والأخضر، بينما يمر كل الضوء الأحمر تقريباً وبعض الضوء الأزرق، مما يعطي الياقوت لوناً أحمر غامقاً مع لمحة من اللون الأرجواني، المعروف باسم أحمر دم الحمام.
يُظهر الياقوت امتصاصاً وجيزاً على مستوى B، يتجلى في شكل تألق أحمر. هذا الامتصاص على مستوى B الذي ينتج عنه تألق أحمر يجعل لون الياقوت أكثر حيوية؛ وكلما زاد محتوى أيون الكروم كلما كان التألق أقوى.
يمكن لأيونات الحديد في الأحجار الكريمة أن تكبح تألق الامتصاص من المستوى B، مما يفسر ظاهرة ظهور الياقوت بشكل أغمق عند احتوائه على شوائب الحديد.
③ Cr3+ آلية التلوين في الزمرد
المكون الكيميائي الرئيسي للزمرد هو Be3آل2سي6O18، كر3+الذي يحل محل Al3+ في الشبكة الزمردية، و Cr3+ محاط أيضًا بثمانية أوجه مكونة من ستة أيونات أكسجين، حيث يكون Cr3+-O مماثل تمامًا لطول الرابطة في الياقوت. ومع ذلك، بالمقارنة مع الياقوت، يحتوي الزمرد على أيونين إضافيين، Be2+ وسي4+. في بنية الزمرد، تزداد طبيعة الرابطة التساهمية بين أكاسيد الفلزات، بينما تضعف الخصائص الأيونية.
تؤدي التغييرات الطفيفة مثل الروابط الكيميائية إلى انخفاض طفيف في Cr3+طاقة المستوى C والمستوى D، مما يؤدي إلى انزياح طفيف في نطاق الامتصاص (الشكل 3-23)، مما يحجب بشكل كبير انتقال الضوء الأزرق الأرجواني (425 نانومتر) والبرتقالي الأصفر (608 نانومتر) في الطيف، بينما يزيد من انتقال الضوء الأزرق والأخضر، وبالتالي تكوين الضوء الأخضر الزمردي المميز.

لا يتغير امتصاص المستوى B من الديوبتاز تقريبًا. عندما لا يكون للحديد الشائب أي تأثير "مثبط" في المكون الزمردي، فإن التألق الأحمر القوي يجعل اللون الأخضر الزمردي المميز أكثر إشراقًا.
④ كر3+ آلية اللون في الكسندريت:
يحدث لون الكسندريت أيضًا بسبب الكروم3+ استبدال آل3+ في تناسق ثماني الأوجه مشوه. نظرًا لأن التركيب الكيميائي للإلكسندريت هو BeAL2O4، فإن طبيعة الروابط الكيميائية بين أيونات الأكسجين الفلزية الخاصة به تقع بين طبيعة الياقوت والزمرد. ولذلك، فإن نطاقات امتصاصه تقع أيضاً بين نطاقات الياقوت والزمرد، مع تساوي احتمالات انتقال الضوء الأزرق البنفسجي والبرتقالي الأصفر تقريباً، مما يجعل من المستحيل تحديد ما إذا كان الضوء الأحمر أو الأزرق والأخضر هو السائد (الشكل 3-24).
ولذلك، لا يمكن أن يعتمد لون الكسندريت إلا على توزيع الطاقة ونطاق ألوان الضوء الساقط، مما يؤدي إلى "التأثير المتغير اللون" للكسندريت، أي الظهور باللون الأخضر في ضوء النهار مع ارتفاع مكون الضوء الأزرق والأحمر في الضوء المتوهج مع ارتفاع مكون الضوء الأحمر. ولذلك، غالباً ما يُطلق على الكسندريت اسم "زمرد النهار وياقوت الليل".
يظهر "تأثير تغير اللون" في العديد من أنواع الأحجار الكريمة، مثل الياقوت المتغير اللون والعقيق المتغير اللون. وفي الوقت الحالي، يتم إنتاج الياقوت المتغيّر اللون المصطنع باستخدام مبدأ تغيّر اللون، باستخدام الياقوت المتغيّر اللون V3+ كأيون تلوين للتركيب.
3. ألوان معادن الأحجار الكريمة
يمكن الاستدلال على الألوان الناتجة عن مكونات الفلزات الانتقالية من التركيب الكيميائي لمعادن الأحجار الكريمة. على سبيل المثال، الفيروز الذي يحتوي على النحاس2+ يجب أن يكون أزرق، بينما النحاس+ عديم اللون. يسرد الجدول 3-11 الألوان الناتجة عن مكونات الفلزات الانتقالية الشائعة في معادن الأحجار الكريمة الطبيعية.
الجدول 3-11 الألوان الناتجة عن مكونات الفلزات الانتقالية في معادن الأحجار الكريمة الطبيعية
| العنصر | اللون | المعادن الشائعة |
|---|---|---|
| السيريوم (Ce) | أصفر | باريزيت |
| الكروم (Cr) | أحمر، أخضر، أخضر، برتقالي، إلخ. | كروكيسيت، كروكيسيت أحمر، يوفاروفيت |
| الكوبالت (Co) | أزرق | الإسبنيل الاصطناعي |
| النحاس (النحاس) | أزرق، أخضر | أزوريت، كريسوكولا، كريسوكولا، مالاكيت تركواز، ديوبتاز |
| الحديد (Fe) | أحمر، أخضر، أصفر | ألمندين، أوليفين، غويثيت |
| المنجنيز (Mn) | وردي، برتقالي | رودونيت، سبيسارتين |
| النيكل (ني) | أخضر | البونسونيت، العقيق الأبيض |
ينتج لون معظم الأحجار الكريمة عن الشوائب المعدنية الانتقالية التي تحتويها. على سبيل المثال، تظهر أحجار الياقوت باللون الأحمر بسبب الكميات الضئيلة من الكروم3+. تؤثر عوامل مختلفة على اللون الناتج عن أيونات الشوائب في الأحجار الكريمة. لذلك، قد تنتج الشوائب ألواناً مختلفة في الأحجار الكريمة المختلفة. على سبيل المثال، الكروم3+ يظهر باللون الأحمر في الياقوت الأحمر والأخضر في الزمرد.
قد لا تتسبب نفس الشوائب بالضرورة في نفس لون الحجر الكريم. على سبيل المثال، ينتج اللون الأخضر لمعظم الزمردات عن الكروم (Cr)، في حين أن اللون الأخضر لبعض الزمردات ناتج جزئياً أو كلياً عن الفاناديوم (V).
يمكن استخدام نظرية المجال البلوري ليس فقط لتفسير ألوان الأحجار الكريمة التي تنتجها المكونات أو الشوائب المعدنية الانتقالية، بل أيضًا الألوان التي تنتجها العيوب البنائية (مراكز الألوان)؛ ويمكن الرجوع إلى العملية المحددة لتوليد الألوان في الفصل 3.3 من هذا الكتاب.
كما أن هناك أوجه قصور في تفسير ألوان معادن الأحجار الكريمة من خلال نظرية المجال البلوري، والتي تنعكس بشكل أساسي في الجوانب التالية
(1) إلكترونات الأيون المركزي d ليست متمركزة بالكامل في مداراتها الأصلية. ويمكن أن تظهر أيضًا حول الذرات المنسقة، مما يشير إلى وجود تفاعل تساهمي بين الذرة المركزية والروابط.
(2) لا تأخذ في الاعتبار سوى التفاعل الأيوني الكهروستاتيكي بين الذرة المركزية والروابط، متجاهلةً تمامًا تفاعل الرابطة التساهمية بين الذرة المركزية والروابط. في الأبحاث الفيزيائية، غالبًا ما تختلف نتائج الحسابات الكمية اختلافًا كبيرًا عن المواقف الفعلية.
(3) قد ترجع أسباب لون معادن الأحجار الكريمة، بالإضافة إلى التفاعل بين الأيون المركزي والرباطات، إلى التأثيرات المشتركة للعيوب الهيكلية والمجال البلوري.
القسم الثاني نظرية المدار الجزيئي
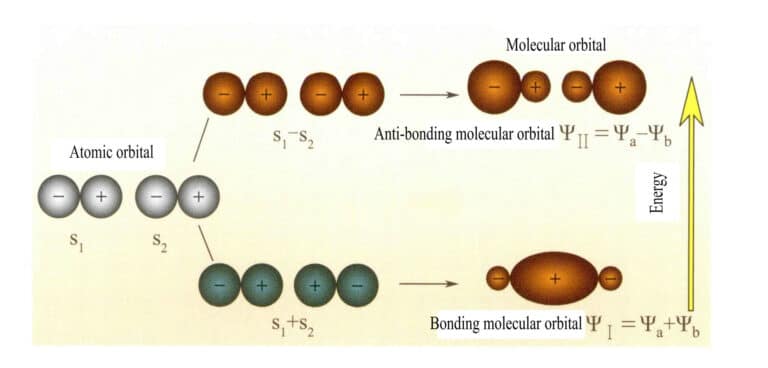
اقترح موليكن وهوند في البداية نظرية المدار الجزيئي (نظرية المدار الجزيئي). ومن خلال الاستكشاف المستمر للعديد من العلماء، تطورت النظرية لتصبح نظرية ناضجة. يمكن الحصول على المدارات الجزيئية (MOs) عن طريق التوليفات الخطية للمدارات الذرية، وهي طريقة شائعة الاستخدام لبناء المدارات الجزيئية. من n مدارًا ذريًّا، يمكن الحصول على n مدارًا جزيئيًّا، ويمكن تحديد معاملات التركيب الخطي باستخدام طريقة التباين أو طرق أخرى. تُسمَّى المدارات الجزيئية المكوَّنة من مدارين ذريين، بمستويات طاقة أقل من مستويات طاقة المدارات الذرية، مدارات الترابط، وتُسمَّى المدارات ذات مستويات الطاقة الأعلى من المدارات الذرية مدارات مضادة للترابط، أما المدارات ذات مستويات الطاقة القريبة من المدارات الذرية فهي عمومًا مدارات غير مترابطة.
نظرية المدار الجزيئي هي نظرية تُستخدم لتفسير مسائل مثل تكوين الجزيئات وبنيتها وخصائصها. ويمكنها أيضًا تفسير بعض أسباب ألوان الأحجار الكريمة، والتي تم تطويرها استنادًا إلى نظرية المجال البلوري ونظرية المدارات الجزيئية للفلزات الانتقالية. المدارات الجزيئية هي امتداد طبيعي للمدارات الذرية. في الجزيء، لم تعد الإلكترونات في الجزيء تنتمي إلى ذرة محددة بل تتحرك عبر النطاق الجزيئي بأكمله؛ ولذلك، توصف حركة الإلكترونات في الجزيء باستخدام المدارات الجزيئية.
1. المفاهيم الأساسية لنظرية المدارات الجزيئية
وتفترض نظرية المدارات الجزيئية أنه بعد تكوين الذرات للجزيء، لا تعود الإلكترونات تنتمي إلى المدارات الذرية الأصلية كما تقترح نظرية المجال البلوري ولكنها تتحرك داخل مدارات جزيئية معينة. تُكوِّن المدارات الجزيئية الجزيئية الجزيء تمامًا كما تُكوِّن المدارات الذرية الذرة. لم تعد إلكترونات التكافؤ تعتبر متمركزة داخل ذرات منفردة ولكنها تتحرك في جميع أنحاء الجزيء بأكمله. يمكن التعامل مع توزيع الإلكترونات في الجزيء وفقًا لمبادئ توزيع الإلكترونات في الذرات (مبدأ الحد الأدنى للطاقة وقاعدة هوند).
يُكوِّن الاتحاد الخطي للمدارات الذرية في الجزيء مدارات جزيئية. عدد المدارات الجزيئية يساوي عدد المدارات الذرية قبل الاتحاد. يجب أن يلتزم اتحاد المدارات الذرية في مدارات جزيئية فعالة بالمبادئ الثلاثة الآتية:
(1) مبدأ مطابقة التماثل: يمكن للمدارات الذرية التي لها نفس التماثل فقط تكوين مدارات جزيئية.
(2) مبدأ تقارب الطاقة: يمكن للمدارات الذرية ذات الطاقات المتشابهة فقط أن تتحد لتكوين مدارات جزيئية فعالة.
(3) مبدأ التداخل الأقصى: في ظل مبدأ التماثل، كلما زاد تداخل المدارات الذرية، كلما انخفضت طاقة المدارات الجزيئية الناتجة وزادت ثبات الرابطة الكيميائية الناتجة.
المدار الجزيئي ψ هو الدالة الموجية لإلكترون واحد. يمكن تمثيله كتركيبة خطية من المدارات الذرية، حيث يناظر كل مدار طاقة محددة، وهي مجموع الطاقة الحركية والمحتملة للإلكترون المتحرك في المجال الكهربائي الجزيئي. وينتج مداران ذريان، أ و ب، من خلال تركيبات خطية متداخلة، مدارين جزيئيين ψI و ψثانياً :
ψI=ψa + ψb (3-5)
ψثانياً = ψa - ψb (3-6)
عندما تمتلئ المدارات الجزيئية بالإلكترونات أولًا، فإن مدارات الترابط ψI تمتلئ أولًا. عندما تملأ الإلكترونات المدارات الجزيئية ذات الطاقة المتساوية، وفقًا لقاعدة هوند، يجب أن تشغل الإلكترونات أيضًا مدارات جزيئية مختلفة بنفس اتجاه الدوران قدر الإمكان.
المدارات الجزيئية ψI التي تم الحصول عليها من خلال جمع دالتين مداريتين ذريتين (المعادلة 3-5) تسمى المدارات الجزيئية المترابطة. المدارات الجزيئية ψثانياً التي نحصل عليها بطرح دالتين مداريتين ذريتين (المعادلة 3-6) تُسمَّى المدارات الجزيئية المضادة للترابط. طاقة المدارات الجزيئية المترابطة أقل من طاقة المدارات الجزيئية المضادة للترابط وأقل من طاقات المدارين الذريين الأصليين. وبالتالي، كما هو الحال في حالة ملء المدارات الذرية، عند ملء المدارات الجزيئية، توضع الإلكترونات أولًا في مدارات الترابط، ويمكن للمدار الجزيئي أن يستوعب إلكترونين بدوارين متعاكسين. عندما تملأ الإلكترونات المدارات الجزيئية ذات الطاقة المتساوية، وفقًا لقاعدة Hund، يجب أن تشغل إلكترونات أيضًا مدارات جزيئية مختلفة بنفس اتجاه الدوران قدر الإمكان. يوضِّح الشكل 3-25 المدارات الجزيئية المكوَّنة من مدارين ذريين s.

p والمدارات d يمكن أن تُكوِّن أيضًا مدارات جزيئية بمستويات طاقة مختلفة؛ على سبيل المثال، يمكن أن يُكوِّن اتحاد المدارات الجزيئية الثنائية الذرة في O2 الجزيئات معقدة نسبيًا.
في التجارب، تم قياس الخصائص المغناطيسية لهذين الإلكترونين المنفردين، مما يوفر دعمًا قويًا لنظرية المدار الجزيئي. وخلافًا للجزيئات المكونة من نفس الذرات، فإن الجزيئات المكونة من ذرتين مختلفتين أو أكثر لها مستويات طاقة مدارية جزيئية أكثر تعقيدًا، لكن المبدأ واحد.
2. خصائص تلوين نقل الشحنة
وتعتبر نظرية المدارات الجزيئية هذه، حيث يتشارك الجزيء بأكمله الإلكترونات، انتقال الإلكترونات من مدار ذري إلى آخر، وهو ما يُعرف بانتقال الشحنة. يمكن أن يحدث انتقال الشحنة في تفاعلات فلز-فلز (M-M)، وغير فلز-غير فلز (L-L)، وغير فلز-فلز (L-M). من بينها، L-L، M-L، وهذان النوعان من الروابط غالبًا ما يكونان في المقام الأول روابط تساهمية. O2 ينتمي إلى انتقال الشحنة L-L، وهي رابطة تساهمية.
(1) نقل الشحنة من المعدن إلى المعدن (نقل الشحنة M - M)
يحدث هذا النوع من انتقال الشحنة بشكل عام بين أيونات الفلزات الانتقالية الشائعة. وتنتج معظم أسباب تلوين الأحجار الكريمة الملونة عن طريق انتقال الشحنة بين الفلزات والمعادن. يشمل انتقال الشحنة M-M بشكل أساسي الأنواع التالية: الحديد2+ - في3+/في3+ - في2+تي3+ - تي4+ / تي4+- T3+ في2+ - T4+/في3+ - T3+من2+ - من4+/من3+ - من3+ . ينقسم انتقال الشحنة بين الفلزات إلى نوعين: انتقال الشحنة بين الذرات المتجانسة النووية، وانتقال الشحنة بين الذرات غير المتجانسة النووية.
① انتقال الشحنة بين الذرات المتساوية الإلكترونيات
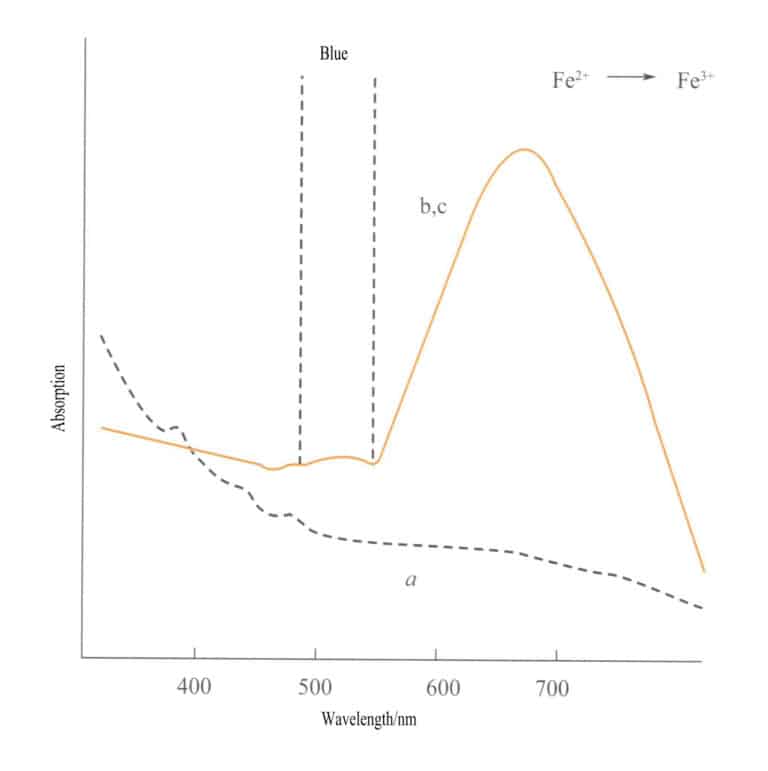
يحدث انتقال الشحنة بين ذرات متساوية الإلكترونيات بين ذرتين من نفس العنصر الفلزي الانتقالي في حالات أكسدة مختلفة. على سبيل المثال، الحديد2+ والحديد3+ تخضع لانتقال الشحنة في ظل ظروف الأكسدة والاختزال المختلفة، وتمتص الطاقة وتنتج اللون. وينتج اللون الأزرق الأرجواني من الإيوليت عن طريق انتقال شحنة أيونات الحديد في حالات الأكسدة المختلفة. الحديد3+ والحديد2+ في موضع رباعي الأوجه وثماني الأوجه على التوالي، مع وجود رباطين متصلين بحواف. عندما يضيء الضوء المرئي على الإيوليت، فإن إلكترونًا واحدًا من إلكترون d من Fe2+ يمتص ضوءًا ذا طاقة معينة ويتحول إلى Fe3+يمتصّ الضوء الأصفر عند 588 نانومتر وينتج لوناً أزرق-أرجواني. كما يمكن أن يُظهر الزبرجد والتورمالين الأخضر وغيرهما لوناً بسبب انتقال الشحنة بين أيونات الحديد.
② انتقال الشحنة بين الذرات المتغايرة
ويمثل الياقوت الأزرق عادةً اللون الناتج عن انتقال الشحنة بين نوعين من أيونات الفلزات الانتقالية. وترتبط الأيونات المتعددة الوجوه التنسيقية لأيونات الفلزات الانتقالية بحواف أو وجوه، مما يسهل انتقال الشحنة بين الفلزات.
على سبيل المثال، في الياقوت الأزرق، عندما تدخل أيونات الحديد وأيونات التيتانيوم في الثماني الأوجه المتصلة، يوجد كل من الحديد والتيتانيوم في حالتي أكسدة:
في2+ + تي4+ طاقة منخفضة (3-7)
في3+ + تي3+ طاقة عالية (3-8)
يتطلّب الانتقال من المعادلة (3-7) إلى المعادلة (3-8) امتصاص كمية معينة من الطاقة الضوئية، مما ينتج عنه نطاق امتصاص واسع يتراوح بين الأصفر والأحمر. وفي المقابل، يمر معظم الضوء الأزرق عبر الحجر الكريم، مما يمنحه مظهراً أزرق.
فانتقال الشحنة بين حالات التكافؤ المختلفة له اتجاهية قوية، وغالبًا ما تُظهر الأحجار الكريمة التي تُظهر لونًا بسبب هذه الآلية تعدد الألوان. على سبيل المثال، الزبرجد الملون بواسطة Fe2+→ الحديد3+ يُظهر انتقال الشحنة اللون بدقة على طول اتجاه المحور البصري. يوضح الشكل 3-26 أن الزبرجد يظهر باللون الأصفر في المستويين b و c. وفي الوقت نفسه، لا يوجد مثل هذا الانتقال على طول اتجاه المحور الضوئي، مما يؤدي إلى عدم وجود امتصاص للضوء، وبالتالي لا يوجد لون على طول اتجاه المحور الضوئي.
(2) انتقال الشحنة من معدن إلى معدن (L-M)
غالبًا ما يحدث هذا النوع من انتقال الشحنة L-M بين الأكسجين وأيونات الفلزات، وبعض الأحجار الكريمة المحتوية على الأكسجين ملونة بانتقال الشحنة من غير معدن إلى معدن، مثل O2–→ الحديد3+, O2- →كر6+, O2-→من6+، س → ف5+.
في طيف الامتصاص لأكاسيد الحديد البسيطة (الشكل 3-27)، يظهر نطاقان ضعيفان للامتصاص في منطقة الأشعة تحت الحمراء للإلمينيت والهيماتيت واللبيدوكروسيت (الانتقالات الإلكترونية d - d). يظهر نطاق امتصاص قوي في نطاق الموجات القصيرة، ينتج عن O2-→فول الصوديوم3+ انتقال الشحنة، ويحدد نطاق الامتصاص هذا الألوان المميزة لهذه المركبات: البني المحمر والبني والأصفر المائل إلى البني.
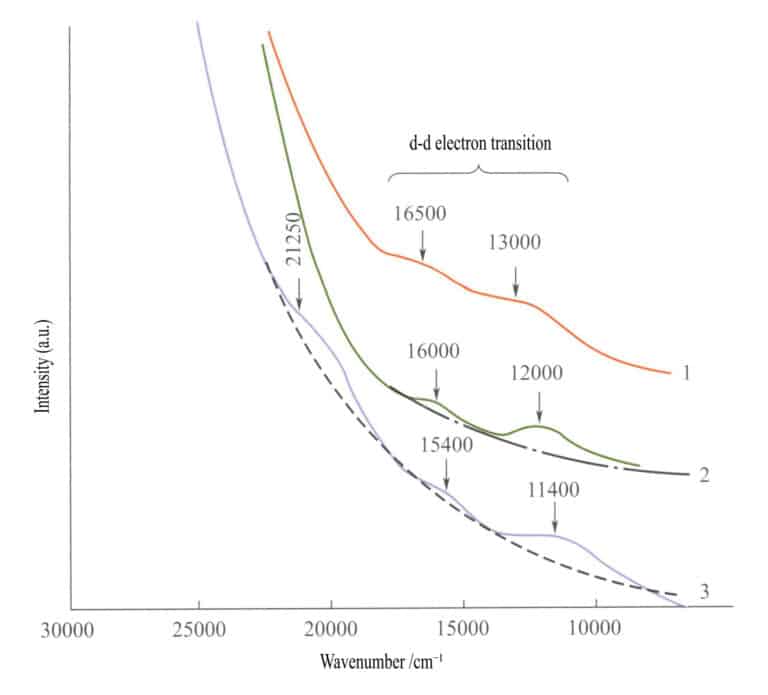
1 - إيلمينيت؛ 2 - هيماتيت؛ 3 - ليبيدوكروسيت
يكتسب البريل الأصفر لونه من O2–→ الحديد3+ انتقال الشحنة. في بنية البريل الأصفر، O2–→ الحديد3+ يمكن أن يمتد الامتصاص القوي لانتقال الشحنة من الطرف فوق البنفسجي إلى الطرف الأزرق من الطيف المرئي، حيث يمتص اللون الأرجواني والأزرق، مما ينتج عنه لون أصفر.
يمكن أن ينتج الياقوت، الذي له بيئة تنسيقية مختلفة تمامًا عن البريل، نفس نطاقات الامتصاص الطيفي التي ينتجها البريل، مما يؤدي إلى اللون الأصفر، وهو أيضًا نتيجة للأكسيد الأصفر2–→ الحديد3+ نقل الشحنة.
ووفقًا لنظرية المجال البلوري، لا تحتوي بعض معادن الأحجار الكريمة على إلكترونات غير متزاوجة ولا يمكنها إنتاج اللون. على سبيل المثال، الطبقات الإلكترونية من الكروكيت (PbCrO4)، Pb2+، كر6+و O2– ممتلئة. ومع ذلك، في CrO42- العنقود الذري هي "المدارات الجزيئية"، والتي تتوافق مع الحالات المثارة أثناء O2-→Cr6+ الانتقال، وتشكيل نطاقات امتصاص وتقديم اللون البرتقالي.
L →M يشمل انتقال الشحنة أيضًا انتقال الكبريت إلى المعدن، كما هو الحال في البيريت الشائع؛ ويسهل فهم هذه الظاهرة البصرية الناجمة عن الانتقال عند مناقشتها باستخدام نظرية النطاق.
(3) انتقال الشحنة من غير المعدن إلى غير المعدن (L-L)
تشير النظرية المدارية الجزيئية إلى أن اللون الأزرق الغامق لللازورد يرجع إلى مستويات طاقة الإثارة في S3- المجموعة الذرية.
في الجرافيت، يتم ترتيب الحلقات المكونة من ست ذرات كربون في طبقات. على طول هذه الطبقات، يمكن للإلكترونات أن تتحرك بحرية إلى حد ما، مما يؤدي إلى امتصاص قوي للضوء وتباين الخواص والتوصيلية.
تحتوي بعض الأحجار الكريمة العضوية، مثل الكهرمان واللؤلؤ، على إلكترونات تتحرك وتثير عبر المجموعات الذرية للأصباغ العضوية في مدارات جزيئية مشتركة، مما يتسبب في امتصاص الضوء المرئي وإنتاج اللون. على سبيل المثال، "اللون الأصفر العسلي" للكهرمان وألوان المرجان وبعض الأصداف واللآلئ الملونة.
وترد آليات ألوان الأحجار الكريمة الشائعة في الجدول 3-12.
الجدول 3-12 تصنيف آليات ألوان الأحجار الكريمة الشائعة
| نقل الشحنة من معدن إلى معدن | في2+ - في3+ /في3+ - في2+ :: إيوليت (أزرق)، برثيت (أزرق)، مغنتيت (أسود)، إلخ. |
| في2+ -Ti4+/في3+ - تي3+ : الكيانيت (أزرق)، الياقوت (أزرق) | |
| من2+-من4+/من3+-من3+: مانغانيت (أسود)، بيكسبيت (أسود) | |
| نقل الشحنة من معدن إلى معدن غير معدني | O2- -في3+: البريل الأصفر الذهبي، والياقوت الأصفر الذهبي، والإلمنيت، والهيماتيت، واللبيدوكروسيت، إلخ. |
| O2- - كر6+: كروكويت (برتقالي) | |
| O2- -V5+:الفانادينيت (برتقالي) | |
| الكبريت إلى معدن: البيريت والمركاسيت وغيرهما (انظر أشباه الموصلات ذات الفجوة) | |
| نقل الشحنات غير المعدنية - غير المعدنية | S3-: اللازورد (أزرق) |
| и إلكتروني: جرافيت (أسود) | |
| ألوان بعض الأحجار الكريمة العضوية مثل الكهرمان والمرجان. |
نسخ الكتابة على مجوهرات سوبلينج - مصنع مجوهرات حسب الطلب، مصنع مجوهرات OEM و ODM
القسم الثالث نظرية نطاق الطاقة
نظرية حزام الطاقة هي نموذج ميكانيكي كمي لدراسة مواد الأحجار الكريمة، وهي امتداد وتوسع إضافي لنظرية المدارات الجزيئية. يمكن لدراسة نظرية حزام الطاقة أن تفسر بشكل أفضل آلية ألوان بعض الأحجار الكريمة الملونة بشكل طبيعي.
1. المفاهيم الأساسية لنظرية نطاق الطاقة
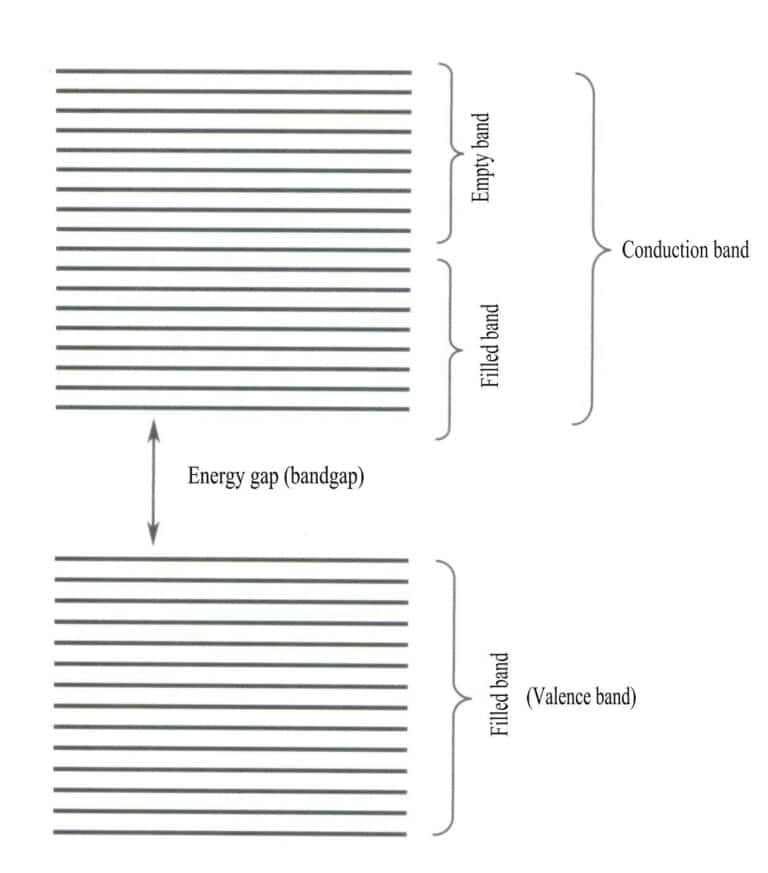
نظرية نطاق الطاقة هي نظرية تقريبية تُستخدم لدراسة قوانين حركة الإلكترونات في المواد الصلبة. تتكون المواد الصلبة من ذرات تشمل النوى الذرية والإلكترونات الخارجية، وجميعها في حالة حركة ثابتة. وتفترض نظرية النطاق أن الإلكترونات في المواد الصلبة ليست مرتبطة بذرة معينة، بل تتشاركها البلورة بأكملها وتتحرك ضمن مجال الجهد الدوري للفضاء الثلاثي الأبعاد للبلورة. ويقع نطاق حركة الإلكترونات ضمن مجال الجهد الدوري للشبكة، مما يسمح للتوزيع المكاني لمدارات الإلكترونات بتجاوز نطاق حركة الجزيئات ليصل إلى الحد الأقصى. وتتسع مستويات طاقة الإلكترونات المنفردة إلى نطاقات طاقة.
تناقش نظرية النطاق بشكل أساسي انتقالات الإلكترونات بين الحالات غير المحلية، حيث يجب أن تنتمي جميع إلكترونات التكافؤ إلى الشبكة الصلبة بأكملها. ووفقًا لنظرية النطاق، يمكن تقسيم المواد الصلبة إلى نطاقات طاقة مختلفة بناءً على ما إذا كانت المدارات الذرية ممتلئة أم لا: يتشكل النطاق الممتلئ من مستويات طاقة المدارات الذرية المشغولة بالكامل بالإلكترونات، وهو ما يمثل نطاقًا منخفض الطاقة؛ ويتكون النطاق الفارغ من مستويات طاقة غير مشغولة بالكامل بالإلكترونات، وهو ما يمثل نطاقًا عالي الطاقة. ويسمى فرق الطاقة بين هذين النوعين من النطاقات "فجوة النطاق" (الشكل 3-28).
عندما تكون جميع نطاقات الطاقة في المادة ممتلئة بالإلكترونات، تكون المادة غير موصلة؛ وعندما تكون ممتلئة جزئيًا بالإلكترونات، تكون موصلة. تُدخل العيوب الشبكية مستويات طاقة إضافية في البلورة، مما يسمح للإلكترونات بالدخول إلى مستويات الطاقة هذه، مما يؤدي إلى توصيلية مشروطة.
2. خصائص انتقالات فجوة النطاق
تحتوي بعض معادن الأحجار الكريمة على عناصر من المجموعة الرابعة أ من الجدول الدوري، مثل الماس والمويسانيت، والتي ترتبط بشكل أساسي تساهمياً. وهناك أيضًا معادن أخرى، مثل كبريتيد الكادميوم (CdS)، والتي يمكن تفسير ألوانها من خلال نظرية النطاق.
تمتص الإلكترونات الطاقة الضوئية وتتحرك بين نطاقات التكافؤ والتوصيل مشكّلةً "انتقالات النطاق الداخلي". وترتبط احتمالية حدوث الانتقالات ارتباطًا وثيقًا بفرق الطاقة بين نطاقي التكافؤ والتوصيل، والمعروف باسم طاقة فجوة النطاق (Eg) (الشكل 3-29).

الشكل 3-29 (أ) هو مخطط نطاق نموذجي لأشباه الموصلات. واستناداً إلى حجم طاقة فجوة نطاق البلورة، يمكن تقسيمها إلى ثلاثة أنواع: فجوة نطاق واسعة، وفجوة نطاق ضيقة، وفجوة نطاق متوسطة. تحتوي فجوة الحزمة العريضة على طاقة فجوة نطاق واسعة أكبر من طاقة الضوء المرئي؛ عندما تتجاوز طاقة فجوة الحزمة طاقة الضوء المرئي، لا يتم امتصاص الضوء المرئي ويمر عبرها بالكامل، مما يجعل المعدن عديم اللون. على سبيل المثال، طاقة فجوة النطاق للماس Eg حوالي 5.5eV، مما يجعله عديم اللون.
تكون طاقة فجوة الحزمة للمواد ذات فجوة الحزمة الضيقة أقل من طاقة الضوء المرئي، مما يؤدي إلى امتصاص كل الضوء المرئي، وينتج عنه ألوان رمادية مائلة إلى الأخضر الداكن أو الأسود. على سبيل المثال، طاقة فجوة نطاق الجالينا هي Eg أقل من 0.4eV، والتي تبدو رمادية رصاصية. عندما تكون "أشباه الموصلات ذات فجوة الحزمة الضيقة" هذه في شكل هندسي مناسب، فإنها تُظهر خصائص التقويم والتضخيم.
تقع طاقة المواد ذات فجوة الحزمة المتوسطة ضمن نطاق الضوء المرئي تماماً، وتظهر المعادن الأحجار الكريمة بألوان مختلفة. ويرد تسلسل ألوانها في الشكل 3-29 (ج)، وتتراوح بين الأحمر والأصفر والأخضر والأزرق والأرجواني. على سبيل المثال، طاقة فجوة النطاق (Eg) من كبريتيد الكادميوم (CdS) حوالي 2.5eV، الذي يمتص الضوء الأزرق والبنفسجي، فيظهر باللون الأصفر. وتبلغ طاقة فجوة نطاق السينابار حوالي 2eV، وهو ما يسمح بمرور الضوء الأحمر فقط، ومن ثم يظهر باللون الأحمر. وتبلغ طاقة فجوة نطاق الأوربيمنت حوالي 2.5eV، فيظهر باللون الأصفر.
هناك فئة أخرى من معادن الأحجار الكريمة الطبيعية التي تفسرها نظرية النطاق، وهي لون المواد ذات فجوة النطاق الواسعة التي تحتوي على شوائب. على سبيل المثال، في حالة الماس الذي يحتوي على شوائب، تكون طاقة فجوة النطاق للماس 5.5eV تقريبًا، ولا يتم امتصاص الضوء المرئي عند مروره عبر الماس؛ فالماس النقي عديم اللون، ولكن الوضع يتغير عندما يحتوي على شوائب.
(1) آلية لون الألماس الأصفر
تحل ذرات النيتروجين محل مواضع ذرات الكربون. ونظرًا لأن ذرات النيتروجين تحتوي على إلكترون واحد أكثر من ذرات الكربون، فإن هذا الإلكترون الإضافي يشكل مستوى طاقة شوائب في فجوة النطاق، يُعرف باسم مستوى الطاقة المانحة، حيث تعمل ذرات النيتروجين "كمانحات".
يقلل وجود مستوى النجاسة هذا من طاقة فجوة النطاق إلى 4eV[ [الشكل 3-30 (أ)]. ويمكن أن تكون أقل من ذلك، مما يسمح لها بامتصاص الضوء فوق البنفسجي وقليلاً من الضوء البنفسجي 3eV، مما يجعل الماس يبدو أصفر اللون.
هذا التأثير قوي؛ فوجود ذرة نيتروجين واحدة لكل مائة ألف ذرة كربون يمكن أن يجعل الماس أصفر غامقًا. ومع ذلك، فإن تقليل فجوة النطاق لا يزال غير كافٍ لجعل الماس موصلاً في درجة حرارة الغرفة.
(2) آلية اللون في الماس الأزرق
وبما أن البورون يحتوي على إلكترون أقل من الكربون بإلكترون واحد، فإنه يشكل "مستوى مستقبِل" في فجوة نطاق الماس. وهو لا يحتوي على إلكترونات إضافية، ولكنه يمكن أن يقبل إلكترونات من نطاق تكافؤ الماس، مما يخلق ثقوباً في نطاق التكافؤ [الشكل 3-30 (ب)] ويشكل نطاق طاقة شوائب أعلى من نطاق التكافؤ بحوالي 0.4eV فوق نطاق التكافؤ المعروف باسم المستوى المستقبِل.

مستوى الطاقة المستقبِل ليس بسيطاً؛ فهو عبارة عن بنية معقدة من نطاقات طاقة الشوائب التي يمكن أن تنتج اللون الأزرق. وينشئ مستوى الطاقة المستقبِل "ثقوبًا" في نطاق التكافؤ، مما يسمح لهذا النوع "الثقب" من النوع الثاني ب من الماس الأزرق "الثقب" بتوصيل الكهرباء.
يمكن أن تشكل ذرة بورون واحدة من بين كل مليون ذرة كربون اللون الأزرق. ونظرًا لارتفاع محتوى الألومنيوم في هذا الماس الأزرق ولأن الألومنيوم يحتوي على إلكترون طبقة خارجية أقل من الكربون بإلكترون واحد، كان يُعتقد سابقًا أن الألومنيوم يؤدي دور المستقبِل. ومع ذلك، أثبتت التجارب الحالية أنه البورون وليس الألومنيوم.
يكون الألماس الأزرق الموصّل من النوع الثاني ب أزرق طبيعياً، وتُعتبر خاصية التوصيل أحد الاختلافات عن الألماس الأزرق المشعّ (مراكز الألوان). وغالباً ما تُستخدم هذه الخاصية للتمييز بين نوعي الألماس. غير أن الألماس الأصفر النيتروجيني المانح للنيتروجين لا يوصل الكهرباء، لذلك لا يمكن استخدام هذه الطريقة للتمييز بينه وبين الألماس الأصفر المشعع.
3. معادن الأحجار الكريمة الملونة بواسطة انتقالات النطاقات
يمكن لنظرية نطاق الطاقة تفسير جزء من تكوين لون الأحجار الكريمة الطبيعية. نظرًا لأن طاقة فجوة النطاق هي خاصية متأصلة في البلورة ولا تتغير بسبب الظروف الخارجية، فإن لون الأحجار الكريمة يتمتع بثبات جيد. ويمكن تحديد توصيلية البلورة بناءً على ما إذا كانت نطاقات الطاقة في البلورة ممتلئة بالإلكترونات. يسرد الجدول 3-13 أنواع ألوان الأحجار الكريمة التي يمكن تفسيرها بنظرية النطاقات وخصائص توصيلها.
الجدول 3-13 أنواع ألوان الأحجار الكريمة الموضحة حسب نظرية النطاق وتوصيلها
| الموصلات (الألوان المعدنية واللمعان المعدني) | العنصر | النحاس، والذهب، والحديد، والفضة، والزئبق، إلخ. |
| سبيكة | الملغم، حديد النيكل والنيكل النيزكي | |
| أشباه الموصلات | فجوة النطاق الضيق | رمادي معتم إلى أسود: ألتايت، جالينا |
| لون معدني معتم: الكوبالتين، الماركاسيت، البيريت، السمالتيت | ||
| فجوة نطاق معتدلة | الأحمر: الزنجفر، والبروستيت، والبيرجريت | |
| برتقالي ريلجار | ||
| الأصفر كبريتيد الكادميوم، الريالغار، الكبريت | ||
| فجوة نطاق واسع | عديم اللون: ألماس، سفاليريت | |
| أشباه الموصلات ذات فجوة النطاق العريضة المحتوية على الشوائب | الشوائب المانحة: ماس مطعّم بالنيتروجين (أصفر) | |
| الشوائب في المضيف: الماس المحتوي على البورون (الأزرق) |
ويرتبط لون الأحجار الكريمة الناتج عن انتقالات النطاقات بالبنية ونوع الترابط في وقت تكوين الأحجار الكريمة. وليس له علاقة تذكر بالشوائب والعيوب البلورية اللاحقة. إن حجم طاقة فجوة النطاق للأحجار الكريمة ثابت. وهو لا يتغير مع خصائص مادة الأحجار الكريمة، لذلك لا يمكن لطرق التحسين التقليدية عموماً تحسين لون الأحجار الكريمة.
القسم الرابع التأثيرات البصرية الفيزيائية
يمكن لمعظم الأحجار الكريمة الطبيعية أن تسبب امتصاصاً انتقائياً للضوء، وتمتص الأحجار الكريمة المختلفة الضوء المرئي بأطوال موجية مختلفة، مما يؤدي إلى ألوان مختلفة. وبالإضافة إلى الامتصاص الانتقائي للضوء، يمكن أن يسبب التركيب الداخلي لبلورات الأحجار الكريمة تأثيرات بصرية فيزيائية، مما يؤدي إلى اختلاف الألوان في الأحجار الكريمة.
1. معادن الأحجار الكريمة المتعلقة بالتأثيرات البصرية الفيزيائية
تتشكل الألوان الناتجة عن التأثيرات الضوئية الفيزيائية بسبب التشتت والتداخل والحيود وغيرها من أسباب الضوء الناتجة عن التركيب أو التركيب البلوري والشوائب. هذا مجرد تأثير بصري يمكن تفسيره من خلال النظرية البصرية الفيزيائية. يمكن أن تنتج الأحجار الكريمة المختلفة ألواناً مختلفة تحت نفس التأثيرات البصرية. بالإضافة إلى العناصر النزرة الشائعة التي تسبب الألوان، ترتبط أسباب الألوان الناتجة عن التأثيرات البصرية الفيزيائية بشكل أساسي بالبنية الداخلية للأحجار الكريمة وخصائصها الفيزيائية. وترد في الجدول 3-14 أنواع معادن الأحجار الكريمة التي تسبب الألوان الناتجة عن التأثيرات البصرية الفيزيائية.
الجدول 3-14 أنواع معادن الأحجار الكريمة الناجمة عن التأثيرات البصرية الفيزيائية
| الوظيفة | الخواص البصرية واللون | معادن الأحجار الكريمة |
|---|---|---|
| التشتت التشتت | متلألئ | "النار" في الأحجار الكريمة المشتتة، مثل الماس والزركون والروتيل والروتيل وتيتانات السترونتيوم |
| أزرق | حجر القمر، كوارتز أزرق، أوبال | |
| أرجواني | الفلوريت (تشتت البلورات الدقيقة من الكالسيوم) | |
| أحمر | زجاج ياقوتي، نثر بلورات دقيقة من النحاس أو الذهب | |
| أبيض | كوارتز حليبي | |
| تأثير عين القطة | زبرجد عين القط، بيروكسين عين القط، إلخ. | |
| تأثير ضوء النجوم | تأثيرات نجمية مختلفة من الياقوت والعقيق | |
| اللمعان | بريق اللؤلؤ والأبوفيليت، إلخ. | |
| سباركل | بريق الأفينتورين والسبج وغيرها. | |
| حيود التداخل | الألوان الطيفية النقية للأغشية الرقيقة | قوس قزح من الكالكوبيرايت، الغشاء المتغير اللون في شق الكوارتز القزحي |
| تأثيرات التداخل | تغير لون العقيق، تأثير اللابرادوريت المتغير اللون | |
| الدمج | أزرق | دومورتيريت في الكوارتز |
| أخضر | العقيق الأخضر وعروق النيكل في العقيق الأخضر، والفوشيت في الكوارتز النجمي | |
| برتقالي | أكسيد الحديد المائي في الأوبال الناري والعقيق بلون اللحم | |
| أحمر | رقائق الهيماتيت في الأورثوكلاز |
2. تأثيرات التداخل والحيود
(1) تأثيرات التداخل
تحدث ظاهرة التداخل عندما تنتشر حزمتان من الضوء على طول المسار البصري نفسه أو في اتجاهين متوازيين. وظاهرة التداخل الشائعة في الأحجار الكريمة هي التقزح اللوني. على سبيل المثال، في الكوارتز المتقزح اللون، تعتمد ألوان التداخل في الكوارتز المتقزح على سماكة الفيلم ومعامل انكسار الفيلم وطبيعة الضوء الساقط.
تتشكل ألوان اللؤلؤ المتداخلة من تراكب الطبقات المتداخلة متحدة المركز لمادتين لهما معاملات انكسار مختلفة (الأراجونيت والنيكروم)، حيث ينعكس الضوء الساقط من الأسطح بين الطبقات المتبادلة، ويتداخل الضوء المنعكس مع الضوء الساقط لإنتاج ألوان تداخل جميلة.
(2) تأثيرات الحيود
يشير مصطلح الحيود إلى الظاهرة الفيزيائية التي تنحرف فيها الموجات الضوئية عن انتشارها الأصلي في خط مستقيم عند مواجهة عوائق. في الفيزياء، تخضع الموجات الضوئية لدرجات متفاوتة من الانحناء والتشتت عند مرورها عبر عوائق مثل الشقوق أو الثقوب الصغيرة أو الأقراص. إذا وُضع عائق بين مصدر الضوء وشاشة الرصد، فستظهر مناطق مضيئة ومظلمة على شاشة الرصد، ولا تكون حدود هذه المناطق حادة، مما يشكل نمطًا معقدًا من الضوء والظلام. وتسمى هذه الظاهرة بالحيود. يمكن أن تحدث هذه الظاهرة عندما تواجه موجات الضوء عوائق على طول مسار انتشارها. والعامل الأكثر أهمية في إنتاج الحيود هو وجود حواجز شبكية متباعدة دورياً في معادن الأحجار الكريمة.
① تغيير لون الأوبال
في الأوبال، تكون كرات السيليكا المحتوية على الماء ذات أقطار متساوية ومرتبة في بنية منتظمة متناوبة الطبقات، مما يشكل حواجز شبكية متباعدة بشكل دوري. عندما يدخل الضوء إلى الأوبال، يحدث حيود الضوء، مما يؤدي إلى تغيير اللون (الشكلان 3-31، 3-32). وتعتمد أنواع الألوان ودرجة تغير اللون بشكل أساسي على التباعد بين كرات السيليكا المكدسة بين الطبقات.
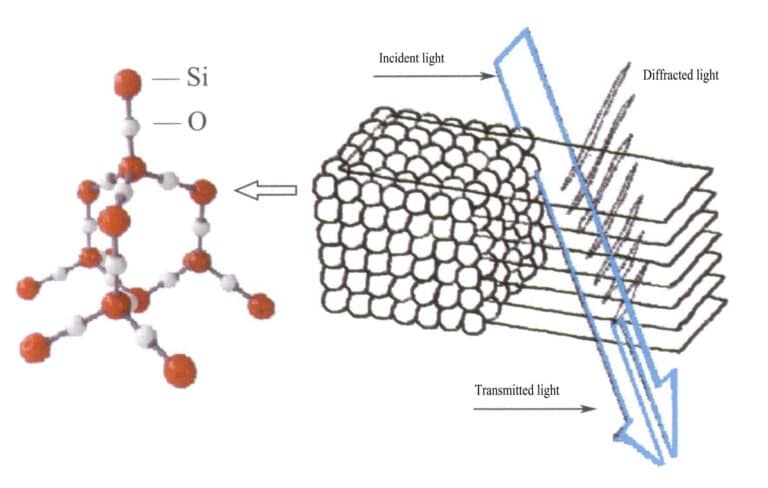

على سبيل المثال، الأوبال ذو بنية صفيحة مسطحة مكعبة متمركزة الوجه ومسافة شبكية 3×10-10م يُظهر ألوانًا تتراوح بين الأخضر والأحمر؛ هذا النوع من الأوبال ذو التباعد الشبكي 2.5×10-10م يُظهر ألواناً تتراوح بين الأزرق والأصفر.
② تأثير اللابرادوريت
ويُظهر اللابرادوريت أيضاً تأثيرات مشابهة للأوبال (الشكل 3-33). ويُعرف اللابرادوريت أيضًا باسم اللابرادوريت الطيفي لأنه يمكن أن يومض بضوء الشمس الملون. ويمكن أن تعرض أنواع مختلفة من اللابرادوريت من فنلندا مجموعة من الألوان الطيفية، وهي ظاهرة تعرف باسم "تأثير اللابرادوريت". ويرجع تأثير تغير اللون في اللابرادوريت إلى ذوبان طبقات صغيرة بينية من البلاجيوكلاز بتركيبات مختلفة. تتسبب الاختلافات الطفيفة في معامل الانكسار بين الفلسبارات المختلفة في حدوث تداخل وانحراف للضوء، مما يؤدي إلى حدوث تلألؤ وتغير في اللون. وترتبط الألوان الناتجة عن هذا التركيب بالسمك النسبي للطبقات ومعاملات انكسارها. وفي بعض الأحيان، يُظهر الأندرادايت من المكسيك أيضًا ظاهرة الانعراج.

3. التشتت والشوائب
(1) التشتت
يحدث التشتت بشكل عام عندما تكون البنية الداخلية لمواد الأحجار الكريمة غير منتظمة أو عندما يتجاوز حجم المكونات حدود ظروف الحيود. وترتبط التأثيرات اللونية الناتجة عن التشتت بحجم الجسيمات وشكل مادة الأحجار الكريمة. عندما يتفاعل الضوء الساقط مع جسيمات غير منتظمة الترتيب أصغر من الطول الموجي للضوء المرئي، تكون موجات الضوء عالية الطاقة المنقولة أقوى من موجات الضوء منخفضة الطاقة، مما يعني أنه في معظم الحالات، يمكن رؤية اللون الأرجواني والأزرق فقط. على سبيل المثال، فإن SiO2 الكرات الصغيرة في الأوبال لها أقطار أصغر من الطول الموجي للضوء المرئي، وعندما يكون حجم الجسيمات المشتتة قريبًا من الطول الموجي للضوء المرئي، يمكن أن يحدث أيضًا تشتت الألوان.
على سبيل المثال، يحدث الفلوريت الأرجواني بسبب الإشعاع الإشعاعي الذي يطرد ذرات الفلور مما يؤدي إلى تكثف ذرات الكالسيوم التي ترتبط بذرات الفلور في صفائح سداسية الشكل بحجم مماثل للطول الموجي للضوء المرئي. ويؤدي التفاعل بين صفائح الكالسيوم وموجات الضوء إلى حدوث تشتت. وتمتص بعض الموجات الضوئية، مما يخلق ذروة امتصاص قوية في منطقة الضوء الأخضر إلى الأحمر، مما يسمح بمرور الضوء الأرجواني وإنتاج اللون الأرجواني.
نظرًا لأن الجسيمات من نفس حجم العناصر المعدنية يمكن أن تنتج تأثيرات لونية متشابهة، ويمكن أن تنتج الجسيمات المعدنية المختلفة ألوانًا مختلفة، يتم تصنيع بعض الأحجار الكريمة المقلدة باستخدام هذه الخاصية.
على سبيل المثال، يتم إنتاج زجاج "الياقوت" عن طريق إضافة جزيئات النحاس أو الذهب إلى الزجاج، مما ينتج عنه لون أحمر مشابه للون الياقوت. عندما تحتوي مادة الأحجار الكريمة على شوائب أو شقوق دقيقة أو فقاعات أكبر من الطول الموجي للضوء المرئي، تتفاعل موجات الضوء مع هذه الجسيمات المشتتة، مما يؤدي إلى إعادة تجميع موجات الضوء المشتتة، مما ينتج عنه ضوء حليبي شفاف. على سبيل المثال، بعض مقلدات حجر القمر
وينتج تأثير ضوء القمر لحجر القمر أيضًا عن طريق تشتت الضوء (الشكل 3-34). حجر القمر عبارة عن فلسبار قلوي، وهو مركب يتكون من طبقات متوازية متناوبة من الفلسبار الغني بالبوتاسيوم والفلسبار الغني بالصوديوم. وتتراوح سماكة الطبقات البينية عادةً بين 50 و1000 نانومتر، مع وجود طبقات أرق قادرة على إنتاج التشتت. يمكن أن يحدث نفس لون التشتت أيضاً في البلاجيوكلاز، والمعروف باسم "تأثير اللابرادوريت".
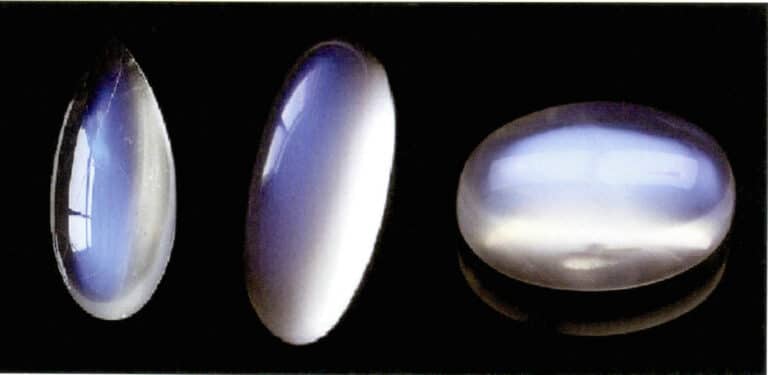
يمكن أن ينتج عن الترتيب الموجه خصيصًا لجسيمات التشتت تأثيرات بصرية مميزة. على سبيل المثال، عندما تكون جسيمات التشتت في شكل ليفي متوازي، فإنها تنتج تأثيرات عين القطة أو تأثيرات نجمية، مثل الياقوت النجمي وعيون القطط الكوارتز. وعندما تكون جسيمات التشتت كبيرة بما يكفي لتمييزها بالعين المجردة، فإنها يمكن أن تنتج "تأثير الحجر الذهبي"، مثل حجر الشمس (الشكل 3-35) وزجاج الحجر الذهبي.

(2) التضمينات
الظواهر اللونية والبصرية الناتجة عن الشوائب هي نوع خاص من التشتت. وتظهر الشوائب ذات اللون المضمنة في بلورات رئيسية عديمة اللون تقريبًا لون الشوائب، مثل العقيق النطاقي الحامل للنيكل وأكسيد الحديد (II) المحتوي على الماء (FeO - H2O) العقيق ذو اللون اللحمي؛ يتكون لون الأورثوكلاز من مدغشقر وبعض الكورديريت من شوائب أكبر قليلاً، ولكنها لا تزال مجهرية من الهيماتيت التي تخلق درجات حمراء؛ وغالباً ما تلون الشوائب دون المجهرية من هيدروكسيد الحديديك الأوبال الناري.
غالباً ما يظهر الألماس بألوان مختلفة بسبب وجود العديد من الشوائب. يمكن أن يكون لون الألماس الملون بالشوائب أسود وبرتقالي-أحمر وبني-أحمر. عندما يحتوي الألماس على عدد لا يحصى من الشوائب المعدنية المعتمة الداكنة، يظهر الألماس باللون الأسود؛ وعند فحصه بضوء نافذ قوي، يمكن ملاحظة العديد من الشوائب الداكنة، فيظهر الألماس باللون الرمادي الداكن؛ وهناك نوع آخر من الشوائب الثانوية التي تحدث في شقوق الألماس. وعندما تتطور الشقوق وتمتلئ بهذه الشوائب الملونة، يظهر الألماس بلون بني-أحمر أو برتقالي-أحمر، وهو ما يُعرف أيضاً بالألماس "المؤكسد".
4. التشتت
تسمى ظاهرة تحلل الضوء الأبيض إلى ألوان طيفية مختلفة من خلال جسم ما بالتشتت. يشير تشتت الأحجار الكريمة إلى خاصية تشتت الضوء إلى أطوال موجية مختلفة من الألوان الطيفية عند مروره عبر المستويات المائلة للأحجار الكريمة الشفافة. ونظراً لاختلاف الأطوال الموجية للضوء الأحادي اللون الذي يكوّن الضوء الأبيض الذي ينتشر بسرعات مختلفة ومعاملات انكسار مختلفة في مواد مختلفة، يمكن أن يتحلل الضوء الأبيض إلى ألوان طيفية مختلفة في ظروف معينة. يتم تحديد حجم قيمة التشتت للأحجار الكريمة وفقاً لخصائصها الفيزيائية؛ فلكل حجر كريم قيمة تشتت متأصلة فيه، وهي لا تتغير مع خصائص الحجر الكريم. يرتبط سحر الألماس الفريد من نوعه ارتباطاً وثيقاً بقيمة التشتت العالية (0.044).
وتتسم معظم الأحجار المماثلة للماس بقيمة تشتت أعلى، مثل قيمة تشتت الزركون البالغة 0.039 وقيمة تشتت المويسانيت الاصطناعي البالغة 0.104. وترد في الجدول 3-15 مقارنة بين قيم التشتت للماس والأحجار الكريمة الشبيهة الشائعة في الماس.
الجدول 3-15 مقارنة بين قيم تشتت الألماس والأحجار الكريمة المشابهة له الشائعة
| اسم الحجر الكريم | قيمة التشتت |
|---|---|
| الماس | 0.044 |
| زركون | 0.039 |
| اكسيد الالمونيوم | 0.018 |
| الإسبنيل | 0.020 |
| توباز | 0.014 |
| بيريل | 0.014 |
| الكريستال | 0.014 |
| الروتيل الاصطناعي | 0.280 |
| تيتانات السترونتيوم الاصطناعية | 0.190 |
| مويسانيت صناعي | 0.104 |
يُشار إلى التشتت عادةً باسم "نار" الأحجار الكريمة. على سبيل المثال، يتمتع الألماس بقيمة تشتت عالية، وناره واضحة جداً، مما يعزز من المكانة الملكية التي يتمتع بها الألماس أصلاً ويبرز سحره الفريد.
هناك العديد من أنواع الألوان الناتجة عن التأثيرات البصرية الفيزيائية، والتي يمكن تفسيرها جميعاً من خلال النظرية البصرية الفيزيائية. وباستثناء التشتت الذي يعد خاصية متأصلة في الأحجار الكريمة نفسها، فإن الظواهر الأخرى تنتج عن التغيرات الهيكلية بعد تكوين الحجر الكريم والاختلافات في الشوائب الميكانيكية. يوفر فهم الأسباب المختلفة لألوان الأحجار الكريمة أساساً نظرياً لتحسين معالجة الأحجار الكريمة الطبيعية والاصطناعية.