Почему драгоценные камни имеют несколько цветов?
Введение в теорию кристаллического поля, теорию молекулярных орбиталей и теорию энергетических полос
Цвета драгоценных камней богаты и разнообразны, они обладают неповторимым очарованием, которое всегда нравилось людям. Качество драгоценных камней во многом зависит от их цвета. Цвет камня - важный показатель при оценке драгоценных камней, и большинство оптимизационных процедур с драгоценными камнями связаны с изменением или улучшением их цвета. Поэтому понимание причин окраски драгоценных камней - важнейшее условие их оптимизации. Только зная, как драгоценные камни приобретают свой цвет, можно определить, можно ли оптимизировать драгоценный камень, какую схему оптимизации принять и какой экспериментальный план разработать. Существует пять общих теорий окраски драгоценных камней: классическая теория минералогии, теория кристаллического поля, теория молекулярных орбиталей, теория энергетических полос и физические оптические эффекты. Эти теории составляют теории окраски распространенных природных драгоценных камней, и ниже приводится краткое введение в эти пять теорий окраски.
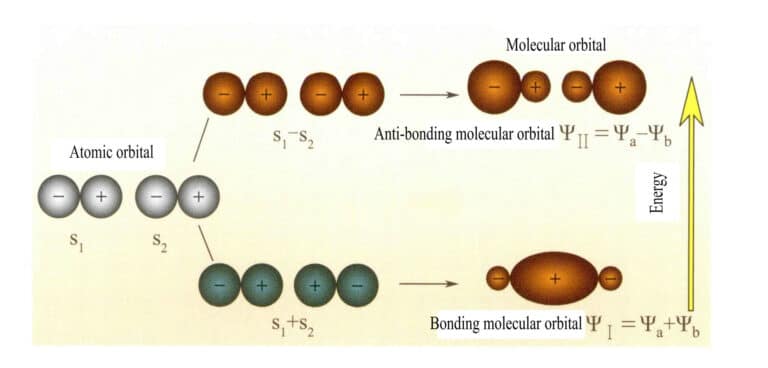
Молекулярные орбитали, образованные двумя s-атомными орбиталями
Оглавление
Раздел I Теория кристаллического поля
Ученые 1930-х годов предложили теорию кристаллического поля для объяснения свойств кристаллов. Теория кристаллического поля - это теория, изучающая химические связи переходных элементов (комплексов). Она объясняет физические и химические свойства переходных элементов и лантаноидов, объединяя некоторые точки зрения электростатической теории, квантовой механики и теории групп (теории, изучающей симметрию материи), уделяя особое внимание влиянию лигандов на d- и f-орбитали центральных ионов. К 1950-м годам люди применили теорию кристаллического поля к комплексам и предложили теорию лигандного поля. Теория поля лигандов является развитием теории кристаллического поля; она учитывает как влияние электрического поля лиганда на центральный ион, так и эффект заполнения центрального иона электронами лиганда, что делает ее более полной, чем теория кристаллического поля. Однако существенной разницы между ними нет, и при изучении неорганических минералов их обычно не различают.
1. Основные понятия теории кристаллического поля
Ионы переходных металлов находятся в кристаллическом поле окружающих их анионов или дипольных молекул. Теория кристаллического поля - это электростатическая модель, которая рассматривает кристалл как электростатическое взаимодействие между положительными и отрицательными ионами, где положительно заряженный катион называется центральным ионом, а отрицательно заряженный анион - лигандом.
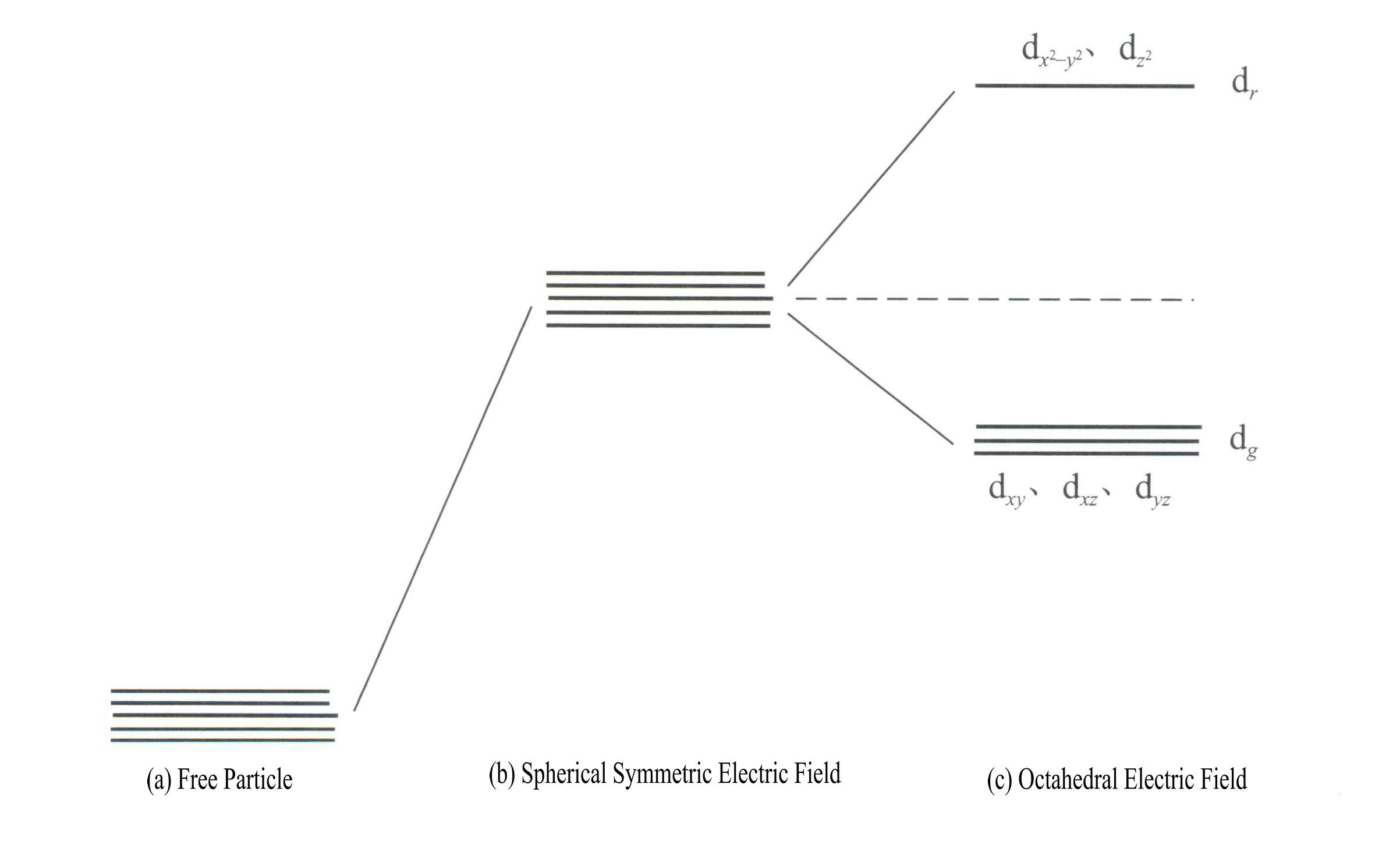
Применение теории кристаллического поля для объяснения цвета минералов драгоценных камней в основном связано с энергией d-электронов или f-электронов ионов переходных элементов. Например, d-орбитали имеют пять типов: dxy, dxz, dyz, d , и d . Эти пять d-орбиталей имеют различное пространственное распределение в свободном ионном состоянии, но обладают одинаковой энергией. Однако под действием поля лиганда они претерпевают значительные изменения. Пять энергетически вырожденных d-орбиталей центрального атома расщепляются под воздействием отрицательного электрического поля, создаваемого окружающими лигандами. Некоторые d-орбитали имеют повышенную энергию, а другие - пониженную. В результате расщепления энергетических уровней d-орбиталей электроны на d-орбиталях центрального атома перестраиваются, занимая преимущественно орбитали с более низкой энергией, что снижает общую энергию системы и делает комплекс более стабильным.
Энергия d-орбиталей одинакова при отсутствии электрического поля [Рисунок 3-19 (a)]; в сферически симметричном электростатическом поле d-орбитали имеют повышенную энергию, но не расщепляются [Рисунок 3-19 (b)]; когда поле лиганда октаэдрическое, он расщепляется на dr и гg. Из них гr орбитали состоят из d и d , с большей энергией; орбитали с меньшей энергией dg орбитали состоят из dxy, dxz, dyz.
Ионы переходных металлов находятся в кристаллическом поле окружающих их анионов или дипольных молекул. Теория кристаллического поля - это электростатическая модель, которая рассматривает кристалл как электростатическое взаимодействие между положительными и отрицательными ионами, где положительно заряженный катион называется центральным ионом, а отрицательно заряженный анион - лигандом.
Применение теории кристаллического поля для объяснения цвета минералов драгоценных камней в основном связано с энергией d-электронов или f-электронов ионов переходных элементов. Например, d-орбитали имеют пять типов: dxy, dxz, dyz, d , и d . Эти пять d-орбиталей имеют различное пространственное распределение в свободном ионном состоянии, но обладают одинаковой энергией. Однако под действием поля лиганда они претерпевают значительные изменения. Пять энергетически вырожденных d-орбиталей центрального атома расщепляются под воздействием отрицательного электрического поля, создаваемого окружающими лигандами. Некоторые d-орбитали имеют повышенную энергию, а другие - пониженную. В результате расщепления энергетических уровней d-орбиталей электроны на d-орбиталях центрального атома перестраиваются, занимая преимущественно орбитали с более низкой энергией, что снижает общую энергию системы и делает комплекс более стабильным.
Энергия d-орбиталей одинакова при отсутствии электрического поля [Рисунок 3-19 (a)]; в сферически симметричном электростатическом поле d-орбитали имеют повышенную энергию, но не расщепляются [Рисунок 3-19 (b)]; когда поле лиганда октаэдрическое, он расщепляется на dr и гg. Из них гr орбитали состоят из dx2– y2 и гz2
с большей энергией; с меньшей энергией dg орбитали состоят из dxy, dxz, dyz. [Рисунок 3-19 (c)].
Разница между самым высоким и самым низким энергетическими уровнями после расщепления d-орбитали называется энергией разделения △ . Энергии разделения при различных конфигурациях лигандных полей не одинаковы (рис. 3-20). Их энергетический порядок таков:
Квадратное поле > Октаэдрическое поле > Тетраэдрическое поле

Даже для полей одинаковой конфигурации они могут отличаться из-за различий в лигандах и центральных ионах; чем она больше, тем стабильнее кристалл. Следующие три фактора в основном определяют величину энергии разделения кристаллов:
(1) Кристаллы, образованные одним и тем же переходным элементом; когда лиганды одинаковы, чем выше заряд центрального иона, тем больше энергия разделения △ . Чем выше положительный заряд центрального иона, тем сильнее притяжение к лигандам, что приводит к уменьшению расстояния между центральным ионом и ядром лиганда, и тем больше отталкивающая сила кристаллического поля, создаваемая лигандами на электронах, тем больше энергия разделения △ .
(2) Для кристаллов, образованных различными ионами с одинаковым положительным зарядом и одинаковыми лигандами, чем больше радиус центрального иона, тем дальше d-орбитали находятся от ядра и тем больше энергия разделения △ .
(3) Для кристаллов, образованных одним и тем же центральным ионом и разными лигандами, энергия разделения меняется из-за разной напряженности кристаллического поля лиганда. Разные лиганды имеют разные напряженности поля, и энергия разделения △ меняется в зависимости от напряженности поля лиганда.
Энергия разделения используется для качественного объяснения устойчивости кристаллов; при этом не обязательно получать абсолютное значение △, достаточно знать относительные значения для кристаллов в различных условиях.
На основе относительной энергии расщепленных d-орбиталей можно рассчитать общую энергию ионов переходных металлов на d-орбиталях. Эта энергия ниже, чем до расщепления, что обеспечивает дополнительную энергию кристалла, известную как энергия стабилизации кристаллического поля, обозначаемая символом CFSE. В таблице 3-10 приведены энергии стабилизации ионов, содержащих dn электронов при различных условиях.
Таблица 3-10 Энергии стабилизации кристаллического поля под действием различных лигандов (Wu Ruihua, 1994)
| dn | Слабое поле | Сильное поле | ||||
|---|---|---|---|---|---|---|
| dn | Квадрат | Правильный октаэдр | Регулярный тетраэдр | Квадрат | Правильный октаэдр | Регулярный тетраэдр |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Цветовые характеристики ионов переходных металлов
В цветных драгоценных камнях цвет большинства драгоценных камней обусловлен ионами переходных металлов, и цвет драгоценных камней зависит от того, содержат ли окрашивающие ионы неспаренные электроны на d- или f-орбиталях. Характеристики окраски ионов переходных металлов в основном включают следующие аспекты:
(1) Окраска ионов переходных металлов связана с электронными состояниями d- или f-орбиталей. Когда электроны d- или f-орбиталей заполнены или пусты, драгоценный камень не будет иметь цвета. Например, Cr6+, Ce4+, и Cu+.
(2) Различные красящие ионы проявляют разные цвета в одном и том же материале драгоценного камня. Благодаря разным энергиям разделения различных красящих ионов они могут проявлять разные цвета даже в одном и том же материале. Например, Fe2+ придает шпинели слегка серовато-голубой цвет, в то время как Cr3+ производит красный цвет.
(3) Окраска ионов одного и того же элемента в разных валентных состояниях часто имеет разные цвета в одном и том же материале драгоценного камня. Поскольку энергия, необходимая для перехода d-электронов центрального иона, различна, то и поглощаемые длины волн света различны, что приводит к разным цветам. Например, каструль, содержащий Mn2+ имеет нежно-розовый оттенок, а берилл, содержащий Mn2+ представляет ярко-красный, известный как красный берилл.
(4) Окраска ионов одного и того же элемента в одном и том же валентном состоянии часто имеет разные цвета при различных конфигурациях лигандов. Например, Co2+ в тетраэдрической конфигурации шпинели имеет характерный "алмазно-голубой" цвет, а в октаэдрической конфигурации кальцита - розовый. Fe2+ в октаэдрически координированном оливине имеет характерный оливково-зеленый цвет, а в искаженном кубически координированном альмандине - темно-красный.
(5) Окрашенные ионы одного типа имеют одинаковое валентное состояние и координационную геометрию, но разные соседние координирующие атомы проявляют разные цвета. Например, в тетраэдрической координации Co2+в сфалерите, Co2+ соединяется с серой и окрашивается в зеленый цвет, в то время как в шпинели Co2+ соединен с кислородом, отображается синим цветом.
(6) Окрашенные ионы одного типа с одинаковым валентным состоянием, координационной геометрией и соседними атомами проявляют разные цвета в разных драгоценных камнях. Искажение координационной геометрии, вызванное различным химическим составом драгоценных камней, изменяет природу химических связей между центральным ионом и координирующими лигандами, изменяя энергию перехода d-электронов. Например, Cr3+ В рубине он кажется красным, в изумруде - зеленым, а в александрите имеет переменную окраску. Причина таких изменений в Cr3+ связано с его характеристиками и соседними координирующими лигандами, при этом анализ особенностей выглядит следующим образом.
① Cr3+ Характеристики:
Cr3+ имеет структуру внешней электронной оболочки 3s23p63d3С 11 электронами во внешней оболочке, принадлежащими к нерегулярной (8-18) структуре электронных оболочек.
Эта структура оказывает меньшее экранирующее действие на ядро, чем структура с 8-электронной оболочкой, в результате чего Cr3+ имеет больший эффективный положительный заряд, а его ионный радиус также меньше, что формирует основные характеристики Cr3+: сильное положительное электрическое поле и пустые d-орбитали. Cr3+ может предоставить шесть пустых орбиталей для размещения шести координирующих лигандов, с пространственной конфигурацией октаэдра, принадлежащей к d2sp3 гибридизации (Рисунок 3-21).
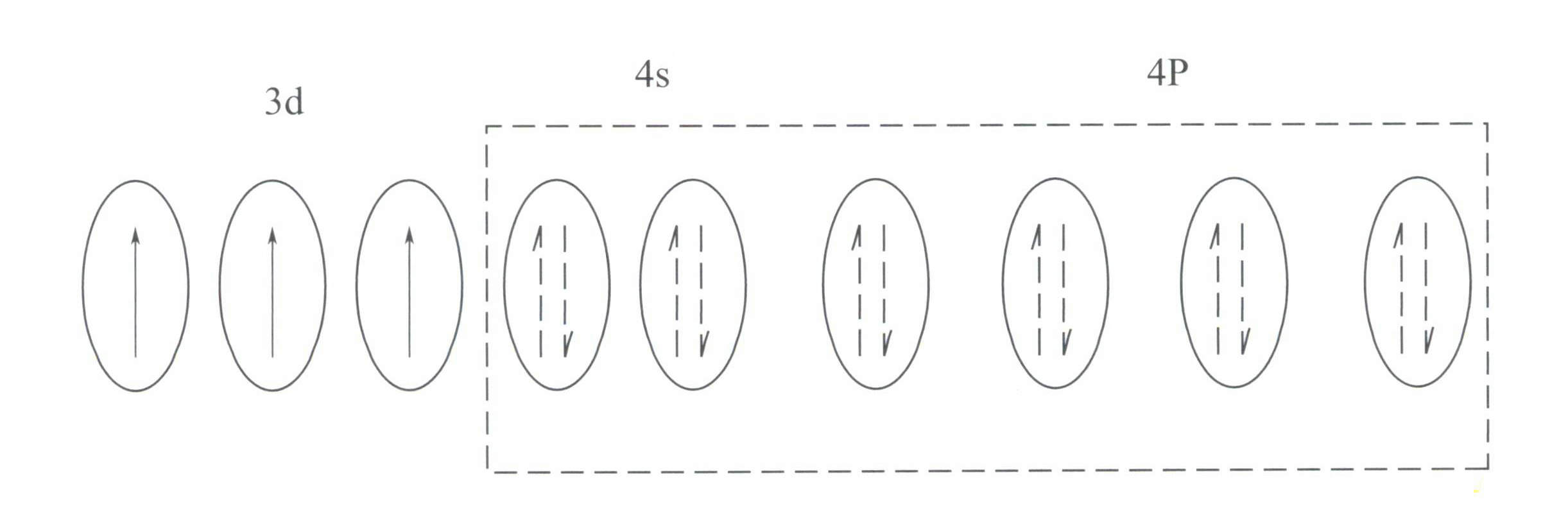
Согласно теории кристаллического поля, в октаэдрическом поле d-орбитали Cr3+ может расщепляться на более низкоэнергетические dƐ орбита и более высокая энергия dr орбита. Поскольку три d-электрона Cr3+ все они находятся в dƐ орбитали и все они являются одноэлектронными, d-d переходы могут происходить под действием видимого света, в результате чего драгоценные камни, содержащие Cr3+ проявлять цвет.
② Механизм окрашивания Cr3+:
В рубине Основным химическим компонентом рубина является Al2O3. Когда несколько процентов Cr3+ заменяет Эла3+, он дает ярко-красный цвет. В структуре рубина из-за большего радиуса Cr3+ по сравнению с радиусом Al3+, Cr3+ входит в решетку корунда, снижая симметрию вокруг оксида алюминия.
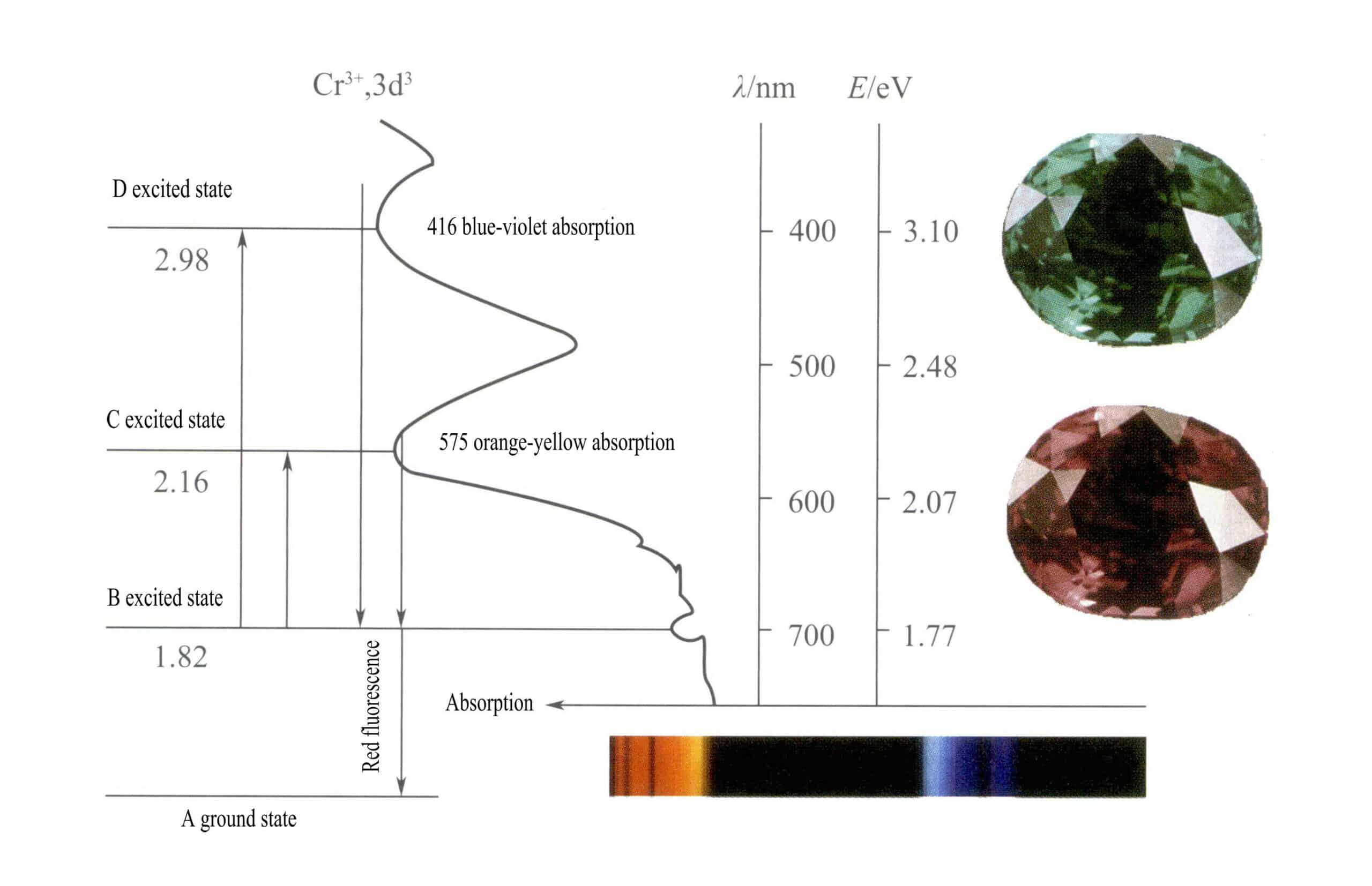
d-орбитали Cr3+ расщепляются, и когда электроны возбужденного состояния возвращаются из D или C в основное состояние A, они должны сначала пройти через B, выделяя тепло. Они возвращаются из B в A, сопровождаемые люминесценцией, испуская красную флуоресценцию. В этом процессе электроны поглощают световую энергию, в результате чего рубин поглощает D фиолетового (400 нм) и C желто-зеленого (555 нм) видимого спектра (рис. 3-22), образуя полосу поглощения.

Когда белый свет проходит через рубин, фотоны в спектре от фиолетового до желто-зеленого поглощаются, в то время как почти весь красный свет и немного синего проходят, придавая рубину глубокий красный цвет с оттенком фиолетового, известный как "голубиная кровь".
Рубины демонстрируют кратковременное поглощение на уровне B, проявляющееся в виде красной флуоресценции. Это поглощение на уровне B, которое приводит к красной флуоресценции, делает цвет рубина более ярким; чем выше содержание ионов хрома, тем сильнее флуоресценция.
Ионы железа в драгоценном камне могут подавлять флуоресценцию B-уровня поглощения, что объясняет феномен рубинов, кажущихся более темными при наличии примесей железа.
③ Cr3+ Механизм окрашивания в изумрудах
Основным химическим компонентом изумруда является Be3Эл2Si6O18, Cr3+, который заменяет Al3+ в изумрудной решетке, и Cr3+ также окружен октаэдром, состоящим из шести ионов кислорода, где Cr3+Длина связи -O также довольно близка к таковой в рубинах. Однако, по сравнению с рубинами, в изумрудах на два иона больше, Be2+ и Si4+. В структуре изумрудов усиливается характер ковалентной связи между оксидами металлов, а ионные характеристики ослабевают.
Такие незначительные изменения, как химические связи, приводят к небольшому уменьшению Cr3+Энергия уровней C и D приводит к небольшому сдвигу полосы поглощения (рис. 3-23), значительно блокируя пропускание сине-фиолетового (425 нм) и оранжево-желтого (608 нм) света в спектре, и одновременно увеличивая пропускание сине-зеленого света, формируя характерный изумрудно-зеленый цвет.

Поглощение диоптаза на уровне B практически не изменяется. Когда примесное железо не оказывает "ингибирующего" действия на изумрудный компонент, сильная красная флуоресценция заставляет характерный изумрудно-зеленый цвет сиять еще ярче.
④ Cr3+ Механизм окраски в александрите:
Цвет александрита также обусловлен содержанием Cr3+ заменяя Al3+ в искаженной октаэдрической координации. Благодаря тому, что химический состав александрита - BeAL2O4По характеру химических связей между ионами металла и кислорода он находится между рубином и изумрудом. Поэтому его полосы поглощения также лежат между полосами рубина и изумруда, при этом вероятности пропускания сине-фиолетового и оранжево-желтого света примерно равны, что не позволяет определить, какой свет преобладает - красный или сине-зеленый (рис. 3-24).
Поэтому цвет александрита может зависеть только от распределения энергии и цветовой гаммы падающего света, что приводит к "эффекту изменения цвета" александрита, то есть к тому, что при дневном свете он кажется зеленым с высокой синей составляющей света, а при свете ламп накаливания - красным с высокой красной составляющей света. Поэтому александрит часто называют "дневным изумрудом и ночным рубином".
Эффект изменения цвета" проявляется во многих видах драгоценных камней, таких как меняющий цвет корунд и меняющий цвет гранат. В настоящее время искусственно синтезированный корунд, меняющий цвет, производится по принципу изменения цвета с использованием V3+ в качестве красящего иона для синтеза.
3. Цвета минералов с драгоценными камнями
О цветах, создаваемых компонентами переходных металлов, можно судить по химическому составу минералов драгоценных камней. Например, бирюза, содержащая Cu2+ должен быть синим, в то время как Cu+ бесцветен. В таблице 3-11 перечислены цвета, создаваемые распространенными компонентами переходных металлов в природных минералах драгоценных камней.
Таблица 3-11 Цвета, создаваемые компонентами переходных металлов в минералах природных драгоценных камней
| Элемент | Цвет | Обычные минералы |
|---|---|---|
| Церий (Ce) | Желтый | Паризит |
| Хром (Cr) | Красный, зеленый, оранжевый и т.д. | Крокоизит, красный крокоизит, уваровит |
| Кобальт (Co) | Голубой | Синтетическая шпинель |
| Медь (Cu) | Синий, зеленый | Азурит, хризоколла, бирюзовый малахит, диоптаз |
| Железо (Fe) | Красный, зеленый, желтый | Альмандин, оливин, гетит |
| Марганец (Mn) | Розовый, оранжевый | Родонит, спессартин |
| Никель (Ni) | Зеленый | Бунзенит, халцедон |
Цвет большинства драгоценных камней обусловлен содержащимися в них примесями переходных металлов. Например, рубины кажутся красными из-за следовых количеств Cr3+. На цвет, вызванный ионами примесей в драгоценном камне, влияют различные факторы. Поэтому примеси могут давать разные цвета в разных драгоценных камнях. Например, Cr3+ В рубинах он кажется красным, а в изумрудах - зеленым.
Одни и те же примеси могут не обязательно вызывать один и тот же цвет драгоценного камня. Например, зеленый цвет большинства изумрудов обусловлен Cr, в то время как зеленый цвет некоторых изумрудов частично или полностью обусловлен ванадием (V).
Теория кристаллического поля может быть использована не только для объяснения цветов драгоценных камней, создаваемых компонентами или примесями переходных металлов, но и цветов, создаваемых структурными дефектами (центрами окраски); конкретный процесс генерации цвета рассматривается в главе 3.3 этой книги.
Есть и недостатки в объяснении цветов минералов драгоценных камней с помощью теории кристаллического поля, в основном отраженные в следующих аспектах:
(1) Электроны центрального иона d не полностью локализованы на своих исходных орбиталях. Они также могут появляться вокруг координирующих атомов, что указывает на ковалентное взаимодействие между центральным атомом и лигандами.
(2) Он учитывает только электростатическое ионное взаимодействие между центральным атомом и лигандами, полностью игнорируя взаимодействие ковалентной связи между центральным атомом и лигандами. В физических исследованиях результаты количественных расчетов часто значительно отличаются от реальной ситуации.
(3) Причины цвета минералов драгоценных камней, помимо взаимодействия между центральным ионом и лигандами, могут быть обусловлены совместным влиянием структурных дефектов и кристаллического поля.
Раздел II Теория молекулярных орбиталей
Малликен и Хунд первоначально предложили теорию молекулярных орбиталей (MO-теория). Благодаря постоянным исследованиям многих ученых она превратилась в зрелую теорию. Молекулярные орбитали (МО) могут быть получены путем линейных комбинаций атомных орбиталей, что является широко используемым методом построения молекулярных орбиталей. Из n атомных орбиталей можно получить n молекулярных орбиталей, а коэффициенты линейной комбинации могут быть определены с помощью вариационного метода или других методов. Молекулярные орбитали, образованные двумя атомными орбиталями с уровнями энергии ниже, чем у атомных орбиталей, называются орбиталями связи; орбитали с уровнями энергии выше, чем у атомных орбиталей, называются орбиталями антисвязи; орбитали с уровнями энергии, близкими к атомным орбиталям, обычно являются орбиталями несвязи.
Теория молекулярных орбиталей - это теория, используемая для объяснения таких вопросов, как образование, структура и свойства молекул. Она также может объяснить некоторые причины цвета драгоценных камней, которые были разработаны на основе теории кристаллического поля и теории молекулярных орбиталей переходных металлов. Молекулярные орбитали являются естественным продолжением атомных орбиталей. В молекуле электроны уже не принадлежат конкретному атому, а перемещаются по всему молекулярному ряду, поэтому движение электронов в молекуле описывается с помощью молекулярных орбиталей.
1. Основные понятия теории молекулярных орбиталей
Теория молекулярных орбиталей утверждает, что после того, как атомы образуют молекулу, электроны больше не принадлежат к исходным атомным орбиталям, как это предлагает теория кристаллического поля, а перемещаются в пределах определенных молекулярных орбиталей. Молекулярные орбитали образуют молекулу так же, как атомные орбитали образуют атом. Валентные электроны больше не считаются локализованными в пределах отдельных атомов, а перемещаются по всей молекуле. Распределение электронов в молекуле можно рассматривать в соответствии с принципами распределения электронов в атомах (принцип минимума энергии и правило Хунда).
Линейная комбинация атомных орбиталей в молекуле образует молекулярные орбитали. Число молекулярных орбиталей равно числу атомных орбиталей до комбинации. Комбинация атомных орбиталей в эффективные молекулярные орбитали должна соответствовать следующим трем принципам:
(1) Принцип соответствия симметрии: Только атомные орбитали с одинаковой симметрией могут образовывать молекулярные орбитали.
(2) Принцип энергетической близости: Только атомные орбитали с одинаковой энергией могут объединяться в эффективные молекулярные орбитали.
(3) Принцип максимального перекрытия: в условиях симметрии, чем больше перекрываются атомные орбитали, тем больше уменьшается энергия результирующих молекулярных орбиталей и тем устойчивее образующаяся химическая связь.
Молекулярная орбиталь ψ - это волновая функция одного электрона. Она может быть представлена как линейная комбинация атомных орбиталей, причем каждой орбитали соответствует определенная энергия, которая является суммой кинетической и потенциальной энергии электрона, движущегося в молекулярном электрическом поле. Две атомные орбитали, a и b, через перекрывающиеся линейные комбинации создают две молекулярные орбитали ψI и ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Когда молекулярные орбитали с электронами заполняются первыми, орбитали связи ψI заполняются первыми. Когда электроны заполняют молекулярные орбитали с одинаковой энергией, согласно правилу Хунда, они также должны занимать различные молекулярные орбитали с одинаковым направлением спина, насколько это возможно.
Молекулярные орбитали ψI полученные сложением двух атомных орбитальных функций (уравнение 3-5), называются связными молекулярными орбиталями. Молекулярные орбитали ψII полученные путем вычитания двух атомных орбитальных функций (уравнение 3-6), называются антисвязывающими молекулярными орбиталями. Энергия связывающих молекулярных орбиталей ниже, чем энергия антисвязывающих молекулярных орбиталей, и ниже, чем энергия исходных двух атомных орбиталей. Таким образом, как и в случае заполнения атомных орбиталей, при заполнении молекулярных орбиталей электроны сначала размещаются на орбиталях связи, а на молекулярной орбитали могут разместиться два электрона с противоположными спинами. Когда электроны заполняют молекулярные орбитали с одинаковой энергией, согласно правилу Хунда, они также должны занимать различные молекулярные орбитали с одинаковым направлением спина, насколько это возможно. Молекулярные орбитали, образованные двумя s-атомными орбиталями, показаны на рисунке 3-25.

p-орбитали и d-орбитали могут также образовывать молекулярные орбитали различных энергетических уровней; например, комбинация двухатомных молекулярных орбиталей в O2 Молекулы относительно сложны.
В ходе экспериментов были измерены магнитные свойства этих двух одиночных электронов, что стало убедительным подтверждением теории молекулярных орбиталей. В отличие от молекул, состоящих из одних и тех же атомов, молекулы, состоящие из двух или более различных атомов, имеют более сложные энергетические уровни молекулярных орбиталей, но принцип действия тот же.
2. Характеристики окраски с переносом заряда
Эта теория молекулярных орбиталей, где вся молекула делит электроны, также рассматривает переход электронов с одной атомной орбитали на другую, известный как перенос заряда. Перенос заряда может происходить во взаимодействиях металл-металл (М-М), неметалл-неметалл (L-L) и неметалл-металл (L-M). Среди них L-L, M-L эти два типа связей чаще всего являются преимущественно ковалентными связями. O2 относится к L-L переносу заряда, который является ковалентной связью.
(1) Перенос заряда металл-металл (M - M перенос заряда)
Этот тип переноса заряда обычно происходит между ионами обычных переходных металлов. Большинство причин окраски цветных драгоценных камней обусловлено переносом заряда металл-металл. М-М перенос заряда в основном включает следующие типы: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ти4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Мн4+/Мн.3+ - Мн3+ . Перенос заряда между металлами делится на два типа: перенос заряда между гомоядерными атомами и перенос заряда между гетероядерными атомами.
① Перенос заряда между изоэлектронными атомами
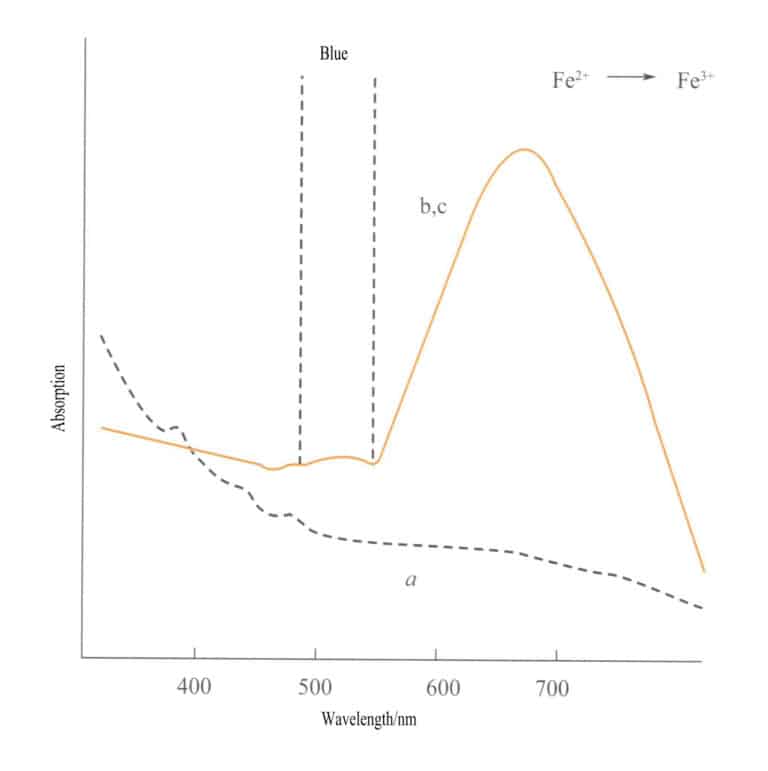
Перенос заряда между изоэлектронными атомами происходит между двумя атомами одного и того же элемента переходного металла в разных состояниях окисления. Например, Fe2+ и Fe3+ в различных окислительно-восстановительных условиях происходит перенос заряда, поглощение энергии и образование цвета. Сине-фиолетовый цвет иолита обусловлен переносом заряда ионами железа в разных состояниях окисления. Fe3+ и Fe2+ находятся в тетраэдрическом и октаэдрическом положениях, соответственно, с двумя лигандами, соединенными краями. Когда на иолит светит видимый свет, один d-электрон Fe2+ поглощает свет определенной энергии и переходит в Fe3+Поглощая желтый свет при длине волны 588 нм, турмалин приобретает сине-фиолетовый цвет. Аквамарин, зеленый турмалин и другие камни также могут иметь цвет, обусловленный переносом заряда между ионами железа.
② Перенос заряда между гетероатомами
Синие сапфиры чаще всего служат примером цвета, возникающего в результате переноса заряда между двумя типами ионов переходных металлов. Координационные полиэдры ионов переходных металлов соединены ребрами или гранями, что облегчает перенос заряда между металлами.
Например, в сапфирах, когда ионы железа и титана входят в соединенные октаэдры, и Fe, и Ti существуют в двух состояниях окисления:
Fe2+ + Ti4+ низкая энергия (3-7)
Fe3+ + Ti3+ высокая энергия (3-8)
Переход от уравнения (3-7) к уравнению (3-8) требует поглощения определенного количества световой энергии, что приводит к появлению широкой полосы поглощения, которая варьируется от желтого до красного. В отличие от этого, большая часть синего света проходит через драгоценный камень, придавая ему голубой цвет.
Перенос заряда между различными валентными состояниями имеет ярко выраженную направленность, поэтому драгоценные камни, цвет которых обусловлен этим механизмом, часто демонстрируют плеохроизм. Например, аквамарин, окрашенный Fe2+→ Fe3+ Перенос заряда показывает цвет строго вдоль направления оптической оси. На рисунке 3-26 показано, что аквамарин выглядит желтым в плоскостях b и c. В то же время вдоль направления оси a такой перенос отсутствует, что приводит к отсутствию поглощения света и, следовательно, к отсутствию цвета вдоль направления оси a.
(2) Перенос заряда от металла к металлу (L-M)
Такой перенос заряда L-M часто происходит между кислородом и ионами металлов, и некоторые кислородсодержащие драгоценные камни окрашиваются за счет переноса заряда от неметалла к металлу, например, O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
В спектре поглощения простых оксидов железа (Рисунок 3-27) у ильменита, гематита и лепидокрокита в инфракрасной области появляются две слабые полосы поглощения (d - d электронные переходы). В коротковолновой области появляется сильная полоса поглощения, создаваемая O2-→Fe3+ Перенос заряда, и эта полоса поглощения определяет характерные цвета этих соединений: красновато-коричневый, коричневый и желто-коричневый.
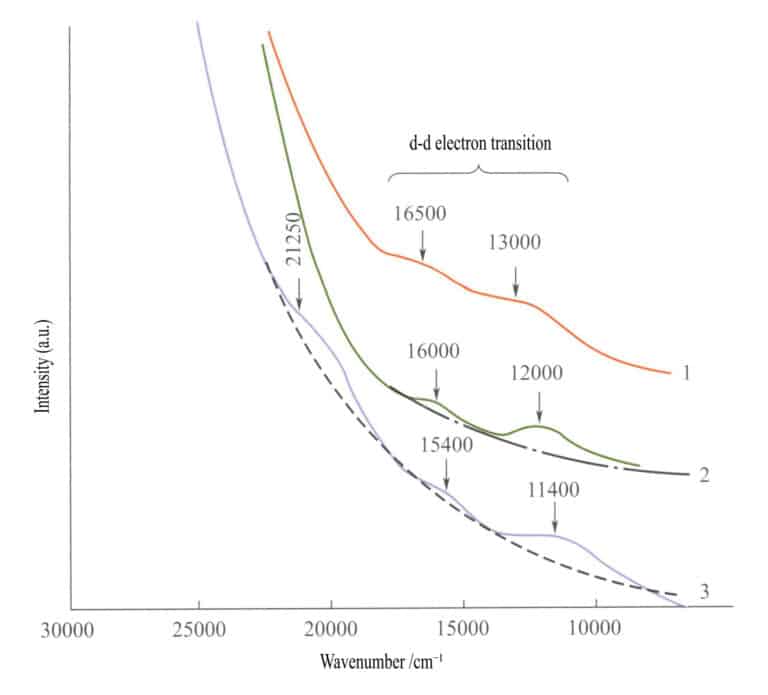
1 - ильменит; 2 - гематит; 3 - лепидокроцит
Желтый берилл приобретает свой цвет благодаря O2–→ Fe3+ перенос заряда. В структуре желтого берилла, O2–→ Fe3+ Сильное поглощение с переносом заряда может распространяться из ультрафиолетовой части в синюю часть видимого спектра, поглощая фиолетовый и синий цвета, что приводит к желтому цвету.
Сапфир, который имеет совершенно другую координационную среду, чем берилл, также может создавать те же спектральные полосы поглощения, что и берилл, что приводит к желтому цвету, который также является результатом O2–→ Fe3+ перенос заряда.
Согласно теории кристаллического поля, некоторые минералы драгоценных камней не содержат неспаренных электронов и не могут создавать цвет. Например, электронные слои крокоита (PbCrO4), Pb2+, Cr6+, и O2– полны. Тем не менее, в CrO42- атомного кластера являются "молекулярными орбиталями", которые соответствуют возбужденным состояниям в O2-→Cr6+ переноса, образуя полосы поглощения и представляя оранжевый цвет.
L→M Перенос заряда также включает перенос серы на металл, как в обычном пирите; это оптическое явление, вызванное переносом, легче понять, если обсуждать его с помощью теории полос.
(3) Перенос заряда от неметалла к неметаллу (L-L)
Согласно теории молекулярных орбиталей, глубокий синий цвет лазурита обусловлен возбуждением энергетических уровней S3- атомная группа.
В графите кольца из шести атомов углерода расположены слоями. Вдоль этого слоя электроны могут перемещаться в определенной степени свободно, что приводит к сильному поглощению света, анизотропии и проводимости.
В некоторых органических драгоценных камнях, таких как янтарь и жемчуг, электроны перемещаются и возбуждаются в атомных группах органических пигментов на общих молекулярных орбиталях, вызывая поглощение видимого света и создавая цвет. Например, "медово-желтый" цвет янтаря, цвета кораллов, некоторых раковин и цветного жемчуга.
Механизмы окраски распространенных драгоценных камней приведены в таблице 3-12.
Таблица 3-12 Классификация механизмов окраски распространенных драгоценных камней
| Перенос заряда между металлом и металлом | Fe2+ - Fe3+ /Fe3+ - Fe2+ : иолит (синий), бертьерит (голубой), магнетит (черный) и др. |
| Fe2+ -Ти4+/Fe3+ - Ти3+ : Кианит (синий), Сапфир (синий) | |
| Mn2+-Мн4+/Мн.3+-Мн3+: Манганит (черный), биксбиит (черный) | |
| Перенос заряда от металла к металлу | O2- -Fe3+: Золотисто-желтый берилл, золотисто-желтый сапфир, ильменит, гематит, лепидокроцит и др. |
| O2- - Кр6+: Крокоит (оранжевый) | |
| O2- -V5+:Ванадинит (оранжевый) | |
| Превращение серы в металл: пирит, марказит и т.д. (см. полупроводник с зазором) | |
| Неметалл - неметаллический перенос заряда | S3-: Лазурит (голубой) |
| Π электронный: графит (черный) | |
| Цвета некоторых органических драгоценных камней, таких как янтарь и коралл. |
Копирайт @ Sobling.Jewelry - Пользовательские ювелирные изделия производителя, OEM и ODM ювелирный завод
Раздел III Теория энергетических полос
Теория энергетических полос - это квантово-механическая модель для изучения материалов драгоценных камней, которая является дальнейшим продолжением и расширением теории молекулярных орбиталей. Изучение теории энергетических полос позволяет лучше объяснить механизм окраски некоторых драгоценных камней естественного цвета.
1. Основные понятия теории энергетических полос
Теория энергетических полос - это приближенная теория, используемая для изучения законов движения электронов в твердых телах. Твердые тела состоят из атомов, включающих атомные ядра и внешние электроны, которые находятся в постоянном движении. Теория полос утверждает, что электроны в твердых телах не привязаны к конкретному атому, а являются общими для всего кристалла и движутся в периодическом потенциальном поле трехмерного пространства кристалла. Диапазон движения электронов находится в пределах периодического потенциального поля решетки, что позволяет пространственному распределению электронных орбит превышать таковое у молекул, достигая максимума. Энергетические уровни отдельных электронов расширяются в энергетические полосы.
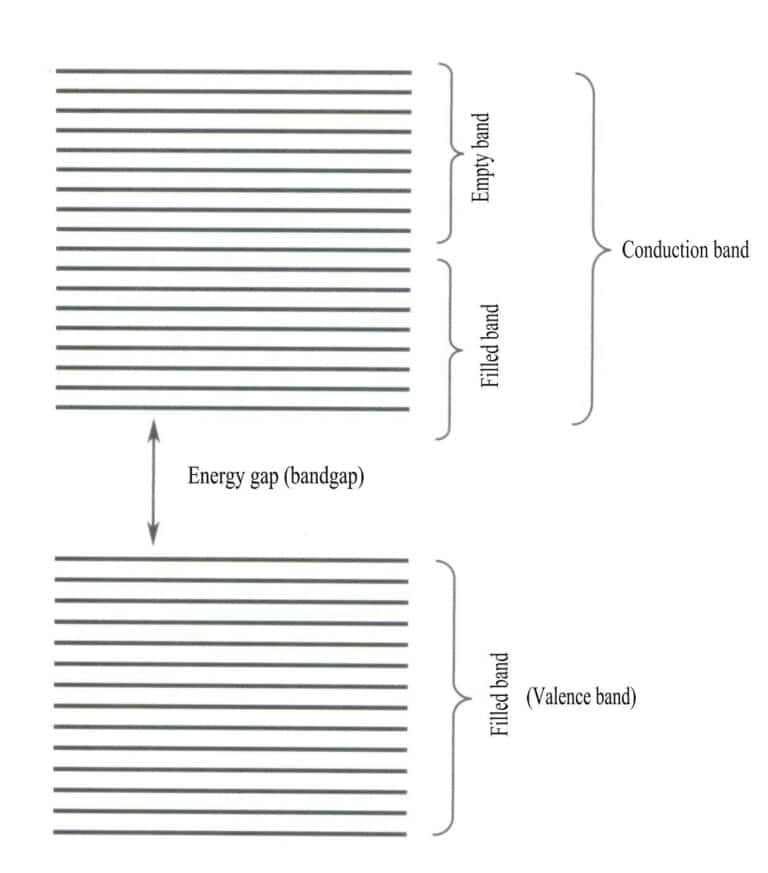
Теория полос в основном рассматривает переходы электронов между нелокальными состояниями, где все валентные электроны должны принадлежать всей решетке твердого тела. Согласно теории полос, твердые материалы можно разделить на различные энергетические полосы в зависимости от того, заполнены ли атомные орбитали: заполненная полоса образуется энергетическими уровнями атомных орбиталей, которые полностью заняты электронами, представляя собой низкоэнергетическую полосу; пустая полоса образуется энергетическими уровнями, которые не полностью заняты электронами, представляя собой высокоэнергетическую полосу. Разница в энергии между этими двумя типами полос называется "полосовой щелью" (рис. 3-28).
Когда все энергетические полосы материала заполнены, он является непроводником, а когда частично заполнены электронами - проводником. Дефекты кристаллической решетки вводят в кристалл дополнительные энергетические уровни, позволяя электронам входить на эти энергетические уровни, что приводит к условной проводимости.
2. Характеристики переходов между полосами пропускания
Некоторые минералы драгоценных камней содержат элементы из IV A группы периодической таблицы, например алмаз и муассанит, которые в основном связаны между собой ковалентно. Есть и другие минералы, например сульфид кадмия (CdS), цвета которых можно объяснить с помощью теории полос.
Электроны поглощают световую энергию и перемещаются между валентной полосой и полосой проводимости, образуя "внутриполосные переходы". Вероятность переходов тесно связана с разницей энергий между валентной и проводящей полосами, известной как энергия межполосного промежутка (Eg) (Рисунок 3-29).

На рисунке 3-29 (a) представлена типичная полосовая диаграмма полупроводника. В зависимости от величины энергии полосовой щели кристаллы можно разделить на три типа: с широкой полосовой щелью, с узкой полосовой щелью и со средней полосовой щелью. Широкая полосовая щель имеет энергию полосовой щели, превышающую энергию видимого света; когда энергия полосовой щели превышает энергию видимого света, видимый свет не поглощается и полностью проходит через нее, делая минерал бесцветным. Например, энергия полосовой щели алмаза Eg составляет около 5,5 эВ, что делает его бесцветным.
Энергия узкополосного излучения материалов с узкой полосой пропускания меньше энергии видимого света, в результате чего весь видимый свет поглощается, и получаются темные серо-зеленые или черные цвета. Например, энергия узкой зоны пропускания галенита составляет Eg менее 0,4 эВ, который кажется свинцово-серым. Когда этот "полупроводник с узкой полосой пропускания" имеет соответствующую геометрическую форму, он проявляет выпрямляющие и усиливающие свойства.
Энергия материалов со средней полосой пропускания находится точно в диапазоне видимого света, и минералы драгоценных камней имеют различные цвета. Их цветовая последовательность показана на рисунке 3-29 (c): от красно-желтого до зелено-голубого и фиолетового. Например, энергия зоны пропускания (Eg) сульфида кадмия (CdS) составляет около 2,5 эВ, который поглощает синий и фиолетовый свет, кажущийся желтым. Энергия полосы пропускания киновари составляет около 2 эВ, она пропускает только красный свет, поэтому кажется красной. Энергия полосы пропускания орпимента составляет около 2,5 эВ, и он кажется желтым.
Другая категория природных драгоценных минералов, объясняемая теорией полос, - это цвет материалов с широкой полосой пропускания, содержащих примеси. Например, в случае алмаза с примесями, энергия полосы пропускания алмаза составляет Eg около 5,5eV, и видимый свет не поглощается при прохождении через алмаз; чистый алмаз бесцветен, но ситуация меняется, когда он содержит примеси.
(1) Механизм окраски желтых бриллиантов
Атомы азота занимают места атомов углерода. Поскольку у атомов азота на один электрон больше, чем у атомов углерода, этот дополнительный электрон образует примесный энергетический уровень в полосе пропускания, известный как донорный энергетический уровень, где атомы азота выступают в качестве "доноров".
Существование этого примесного уровня снижает энергию полосовой щели до 4eV[ [Рисунок 3-30 (a)]. Она может быть еще ниже, что позволяет ему поглощать ультрафиолетовый свет и немного фиолетового света с энергией 3eV, из-за чего алмаз кажется желтым.
Этот эффект очень силен: наличие одного атома азота на каждые сто тысяч атомов углерода может сделать алмаз темно-желтым. Однако уменьшение полосовой щели все еще недостаточно для того, чтобы сделать алмаз проводящим при комнатной температуре.
(2) Механизм образования цвета в голубых бриллиантах
Поскольку у бора на один электрон меньше, чем у углерода, он образует "акцепторный уровень" в полосе пропускания алмаза. У него нет дополнительных электронов, но он может принимать электроны из валентной полосы алмаза, создавая дырки в валентной полосе [Рисунок 3-30 (b)] и формируя примесную энергетическую полосу примерно на 0,4 эВ выше валентной полосы, называемую акцепторным уровнем.

Акцепторный энергетический уровень не прост; это сложная структура энергетических полос примесей, которые могут создавать голубой цвет. Акцепторный энергетический уровень создает "дыры" в валентной полосе, что позволяет этому "дырявому" голубому алмазу типа II b проводить электричество.
Один атом бора среди каждого миллиона атомов углерода может образовывать голубой цвет. Из-за более высокого содержания алюминия в этом голубом алмазе и из-за того, что у алюминия на один электрон внешнего слоя меньше, чем у углерода, ранее считалось, что алюминий играет роль акцептора. Однако современные эксперименты доказали, что это бор, а не алюминий.
Проводящие голубые бриллианты типа II b имеют естественный голубой цвет, и их проводимость - одно из отличий от облученных голубых бриллиантов (центров цвета). Это свойство часто используется для различения двух типов бриллиантов. Однако желтые бриллианты-доноры азота не проводят электричество, поэтому этот метод не может быть использован для их отличия от облученных желтых бриллиантов.
3. Минералы драгоценных камней, окрашенные полосовыми переходами
Теория энергетических полос может частично объяснить формирование цвета природных драгоценных камней. Поскольку энергия энергетического зазора является неотъемлемым свойством кристалла и не меняется под воздействием внешних условий, цвет драгоценных камней обладает хорошей стабильностью. Проводимость кристалла можно определить по тому, заполнены ли энергетические полосы в кристалле электронами. В таблице 3-13 перечислены типы цветов драгоценных камней, которые можно объяснить с помощью теории полос, и их свойства проводимости.
Таблица 3-13 Типы цветов драгоценных камней, объясняемые теорией полос, и их проводимость
| Проводники (металлические цвета и металлический блеск) | Элемент | Медь, золото, железо, серебро, ртуть и т.д. |
| Сплав | Амальгама, метеорит никель железо | |
| Полупроводник | Узкая полоса пропускания | Непрозрачные от серого до черного: алтаит, галенит |
| Непрозрачный металлический цвет: кобальтин, марказит, пирит, смальтит | ||
| Умеренный зазор | Красный: киноварь, прустит, пираргирит | |
| Оранжевый: Realgar | ||
| Желтый: Сульфид кадмия, реальгар, сера | ||
| Широкая полоса пропускания | Бесцветные: алмаз, сфалерит | |
| Полупроводники с широкой полосой пропускания, содержащие примеси | Донорная примесь: Алмаз, легированный азотом (желтый) | |
| Примеси в хозяине: борсодержащий алмаз (синий) |
Цвет драгоценных камней, обусловленный полосовыми переходами, связан со структурой и типом связи в момент образования камня. Он мало связан с более поздними примесями и дефектами кристалла. Величина энергии полосовой щели драгоценных камней фиксирована. Она не меняется в зависимости от свойств материала драгоценного камня, поэтому обычные методы оптимизации, как правило, не могут улучшить цвет драгоценных камней.
Раздел IV Физические оптические эффекты
Большинство природных драгоценных камней способно избирательно поглощать свет, причем разные камни поглощают видимый свет с разной длиной волны, что приводит к появлению разных цветов. Помимо избирательного поглощения света, внутренняя структура кристаллов драгоценных камней также может вызывать физические оптические эффекты, приводящие к появлению различных цветов в драгоценных камнях.
1. Минералы драгоценных камней, связанные с физическими оптическими эффектами
Цвета, создаваемые физическими оптическими эффектами, образуются из-за дисперсии, интерференции, дифракции и других причин, вызванных структурой или составом кристалла и включениями. Это всего лишь оптический эффект, который может быть объяснен с помощью физической теории оптики. Разные драгоценные камни могут иметь разные цвета при одинаковых оптических эффектах. Помимо общих микроэлементов, обусловливающих цвет, причины возникновения цветов, обусловленных физическими оптическими эффектами, в основном связаны с внутренней структурой и физическими свойствами драгоценных камней. Типы минералов драгоценных камней, которые вызывают цвет из-за физических оптических эффектов, перечислены в таблице 3-14.
Таблица 3-14 Типы драгоценных минералов, вызванные физическими оптическими эффектами
| Функция | Оптические свойства и цвет | Минералы драгоценных камней |
|---|---|---|
| Рассеивание Рассеяние | Мерцающий | "Огонь" в дисперсных драгоценных камнях, таких как алмазы, циркон, рутил и титанат стронция |
| Голубой | Лунный камень, голубой кварц, опал | |
| Фиолетовый | Флюорит (рассеяние микрокристаллов кальция) | |
| Красный | Рубиновое стекло, россыпь микрокристаллов меди или золота | |
| Белый | Молочный кварц | |
| Эффект кошачьего глаза | аквамарин "кошачий глаз", пироксен "кошачий глаз" и др. | |
| Эффект звездного света | Различные звездные эффекты корунда и граната | |
| Блеск | Блеск жемчуга, апофиллита и др. | |
| Sparkle | Блеск авантюрина, обсидиана и т.д. | |
| Интерференционная дифракция | Чистые спектральные цвета тонкой пленки | Радуга халькопирита, обесцвеченная пленка в расщелине радужного кварца |
| Эффекты помех | Изменение цвета опала, эффект лабрадорита | |
| Включение | Голубой | Дюмортьерит в кварце |
| Зеленый | Зеленый халцедон и никелевые прожилки в зеленом халцедоне, фуксит в звездчатом кварце | |
| Оранжевый | Гидратированный оксид железа в огненном опале и халцедоне телесного цвета | |
| Красный | Чешуйки гематита в ортоклазе |
2. Интерференционные и дифракционные эффекты
(1) Эффекты помех
Интерференционные явления возникают, когда два луча света распространяются по одному и тому же оптическому пути или в параллельных направлениях. Распространенным интерференционным явлением в драгоценных камнях является переливчатость. Например, в переливающемся кварце цвета интерференции зависят от толщины пленки, показателя преломления пленки и характера падающего света.
Интерференционные цвета жемчуга образуются в результате концентрического чередования слоев двух веществ с разными показателями преломления (арагонита и перламутра), когда падающий свет отражается от поверхностей между чередующимися слоями, а отраженный свет интерферирует с падающим, создавая красивые интерференционные цвета.
(2) Дифракционные эффекты
Дифракция - это физическое явление, при котором световые волны отклоняются от своего первоначального прямолинейного распространения при столкновении с препятствиями. В физике световые волны в разной степени изгибаются и рассеиваются при прохождении через такие препятствия, как щели, небольшие отверстия или диски. Если между источником света и экраном наблюдения поместить препятствие, на экране появятся светлые и темные области, причем границы этих областей не будут резкими, образуя сложный узор из светлого и темного. Это явление называется дифракцией. Подобные явления могут возникать всякий раз, когда световые волны встречают препятствия на пути своего распространения. Наиболее важным фактором, вызывающим дифракцию, является наличие в минералах драгоценных камней периодически расположенных дифракционных решеток.
① Изменение цвета опала
В опале водосодержащие кремнеземные сферы имеют одинаковый диаметр и расположены в регулярной чередующейся слоистой структуре, образуя периодически расположенные дифракционные решетки. Когда свет попадает в опал, происходит дифракция, изменяющая цвет (рис. 3-31, 3-32). Типы цветов и степень их изменения зависят в основном от межплоскостного расстояния между слоями кварцевых сфер.

Например, опал с гранецентрированной кубической плоской пластинчатой структурой и шагом решетки 3×10-10м имеет цвета от зеленого до красного; этот тип опала с шагом решетки 2,5×10-10m показывает цвета от синего до желтого.
② Эффект лабрадорита
Лабрадорит также демонстрирует эффекты, схожие с опалом (рис. 3-33). Лабрадорит также называют спектролитом, поскольку он может вспыхивать от разноцветного солнечного света. Различные виды лабрадорита из Финляндии могут демонстрировать спектр спектральных цветов - явление, известное как "эффект лабрадорита". Эффект изменения цвета в лабрадорите обусловлен небольшими прослойками плагиоклаза разного состава. Небольшие различия в показателе преломления между разными полевыми шпатами вызывают интерференцию и дифракцию света, что приводит к люминесценции и изменению цвета. Цвета, создаваемые этой структурой, зависят от относительной толщины слоев и их коэффициентов преломления. Иногда андрадит из Мексики также демонстрирует дифракционные явления.

3. Рассеяние и включения
(1) Рассеивание
Рассеяние обычно возникает, когда внутренняя структура драгоценных материалов неравномерна или когда размер компонентов выходит за пределы условий дифракции. Цветовые эффекты, возникающие при рассеянии, связаны с размером и формой частиц драгоценного материала. Когда падающий свет взаимодействует с нерегулярно расположенными частицами, размер которых меньше длины волны видимого света, передаваемые высокоэнергетические световые волны сильнее низкоэнергетических, а значит, в большинстве случаев можно увидеть только фиолетовый и синий цвета. Например, SiO2 Маленькие сферы в опале имеют диаметр меньше длины волны видимого света, и когда размер рассеивающих частиц близок к длине волны видимого света, также может происходить рассеивание цветов.
Например, фиолетовый флюорит образуется в результате радиоактивного облучения, в результате которого атомы фтора исчезают, а атомы кальция, связанные с атомами фтора, конденсируются в гексагональные пластинки размером, сопоставимым с длиной волны видимого света. Взаимодействие между пластинами кальция и световыми волнами приводит к рассеянию. Он поглощает некоторые световые волны, создавая сильный пик поглощения в области зеленого-красного света, позволяя фиолетовому свету проходить через него и создавать фиолетовый цвет.
Поскольку частицы металлических элементов одинакового размера могут создавать схожие цветовые эффекты, а частицы разных металлов - разные цвета, некоторые имитации драгоценных камней изготавливаются с использованием этого свойства.
Например, "рубиновое" стекло производится путем добавления в стекло частиц меди или золота, в результате чего оно приобретает красный цвет, похожий на цвет рубинов. Если драгоценный материал содержит включения, микротрещины или пузырьки, размер которых превышает длину волны видимого света, световые волны взаимодействуют с этими рассеивающими частицами, заставляя рассеянные световые волны рекомбинировать, создавая полупрозрачный молочный свет. Например, некоторые имитации лунного камня.
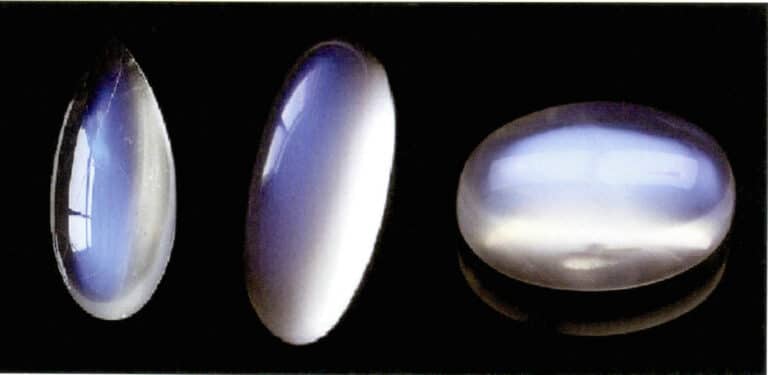
Эффект лунного света в лунном камне также возникает из-за рассеивания света (рис. 3-34). Лунный камень - это щелочной полевой шпат, композит, образованный чередующимися параллельными слоями полевого шпата с высоким содержанием калия и натрия. Толщина прослойки обычно составляет от 50 до 1000 нм, при этом более тонкие слои могут давать рассеяние. Такой же цвет рассеяния может наблюдаться и в плагиоклазе, что известно как "эффект лабрадорита".
Специально ориентированное расположение рассеивающих частиц может создавать характерные оптические эффекты. Например, когда рассеивающие частицы имеют параллельную волокнистую форму, они создают эффект "кошачьего глаза" или звезды, например звездчатые сапфиры и кварцевые "кошачьи глаза". Когда рассеивающие частицы достаточно велики, чтобы их можно было различить невооруженным глазом, они могут создавать "эффект золотого камня", например, солнечный камень (рис. 3-35) и золотокаменное стекло.

(2) Включения
Цвет и оптические явления, создаваемые включениями, представляют собой особый тип рассеяния. Цветные включения, вкрапленные в почти бесцветные основные кристаллы, будут иметь цвет включений, например никеленосный полосчатый халцедон и водосодержащий оксид железа(II) (FeO - H2O) халцедон телесного цвета; цвет ортоклаза с Мадагаскара и некоторых кордиеритов обусловлен чуть более крупными, но все же микроскопическими включениями гематита, которые создают красные оттенки; субмикроскопические включения гидроксида железа часто окрашивают огненный опал.
Бриллианты часто имеют разные цвета из-за наличия многочисленных включений. Бриллианты, окрашенные включениями, могут быть черными, оранжево-красными и коричнево-красными. Когда бриллиант содержит бесчисленные темные непрозрачные минеральные включения, он кажется черным; при осмотре в сильном проходящем свете можно заметить множество темных включений, и бриллиант кажется темно-серым; другой тип - вторичные включения, возникающие в трещинах бриллианта. Когда трещины развиваются и заполняются этими цветными включениями, алмаз выглядит коричнево-красным или оранжево-красным, что также известно как "окисленный" алмаз.
4. Дисперсия
Явление разложения белого света на различные спектральные цвета при прохождении через объект называется дисперсией. Под дисперсией драгоценных камней понимается свойство света рассеиваться на различные длины волн спектральных цветов при прохождении через наклонные плоскости прозрачных драгоценных камней. Благодаря тому, что различные длины волн монохроматического света, составляющего белый свет, распространяются с разной скоростью и показателями преломления в различных материалах, белый свет при определенных условиях может быть разложен на различные спектральные цвета. Величина дисперсии драгоценного камня определяется его физическими свойствами; каждый драгоценный камень имеет присущую ему величину дисперсии, которая не меняется в зависимости от свойств драгоценного камня. Неповторимое очарование бриллиантов тесно связано с их высоким значением дисперсии (0,044).
Большинство имитаторов бриллиантов имеют более высокое значение дисперсии, например, значение дисперсии циркона составляет 0,039, а синтетического муассанита - 0,104. Сравнение значений дисперсии бриллиантов и их распространенных камней-имитаторов приведено в таблице 3-15.
Таблица 3-15 Сравнение значений дисперсии бриллиантов и их обычных камней-имитаторов
| Название драгоценного камня | Значение дисперсии |
|---|---|
| Алмаз | 0.044 |
| Циркон | 0.039 |
| Корунд | 0.018 |
| Шпинель | 0.020 |
| Топаз | 0.014 |
| Берил | 0.014 |
| Кристалл | 0.014 |
| Синтетический рутил | 0.280 |
| Синтетический титанат стронция | 0.190 |
| Синтетический муассанит | 0.104 |
Дисперсию принято называть "огнем" драгоценных камней. Например, бриллианты обладают высоким значением дисперсии, и их огонь очень ярко выражен, что подчеркивает и без того королевский статус бриллиантов и демонстрирует их неповторимое очарование.
Существует множество типов цветов, обусловленных физическими оптическими эффектами, и все они могут быть объяснены с помощью физической теории оптики. За исключением дисперсии, которая является неотъемлемым свойством самого драгоценного камня, другие явления вызваны структурными изменениями после формирования камня и различиями в механических включениях. Понимание различных причин возникновения цвета драгоценных камней создает теоретическую основу для оптимизации обработки натуральных и синтетических драгоценных камней.