Perché le gemme hanno più colori?
I segreti della formazione dei colori e i metodi di misurazione
I colori delle gemme sono ricchi e variegati e possiedono un fascino unico che le persone hanno sempre amato. La qualità delle gemme dipende in gran parte dal loro colore. Il colore di una pietra preziosa è un indicatore importante nella valutazione delle gemme e la maggior parte dei trattamenti di ottimizzazione delle gemme prevede la modifica o il miglioramento del loro colore. Pertanto, la comprensione delle cause della colorazione delle gemme è un prerequisito fondamentale per i trattamenti di ottimizzazione delle gemme. Solo conoscendo il modo in cui le gemme acquisiscono il loro colore si può determinare se una gemma può essere ottimizzata, quale schema di ottimizzazione adottare e quale piano sperimentale stabilire. Esistono cinque teorie comuni sulla colorazione delle gemme: la teoria mineralogica classica, la teoria del campo cristallino, la teoria degli orbitali molecolari, la teoria delle bande energetiche e gli effetti ottici fisici. Queste teorie costituiscono le teorie della colorazione delle gemme naturali più comuni e quella che segue è una breve introduzione a queste cinque teorie della colorazione.

Diagramma schematico dei tre elementi del colore
Indice dei contenuti
Sezione I Colore e misurazione del colore delle gemme
I colori delle gemme sono ricchi e variegati, e determinare i tipi di colori delle gemme è fondamentale per valutarne il valore. Anche le diverse gradazioni di colore influiscono sul valore delle gemme; pertanto, valutare accuratamente i colori delle varie gemme è un prerequisito fondamentale per determinarne il valore. Nella valutazione delle gemme colorate, il colore è il fattore più importante. In generale, quanto più attraente è il colore di una gemma, tanto più alto è il suo valore. I colori brillanti, ricchi e intensi sono di solito più attraenti di quelli troppo scuri o troppo chiari. Naturalmente ci sono delle eccezioni, come nel caso dei diamanti, il cui valore è tanto più elevato quanto maggiore è il candore del colore.
1. Il significato dei colori delle gemme
Fin dall'antichità, le persone hanno amato le gemme per il loro fascino unico, in particolare per le loro tonalità ricche e colorate, come il rubino rosso sangue di piccione, lo smeraldo verde vivo e la giada, che lasciano un'impressione duratura. Il colore è un indicatore importante per valutare la qualità delle gemme e svolge un ruolo cruciale nel determinare la loro qualità, con un significato che si riflette principalmente nei tre aspetti seguenti.
(1) Il colore dei minerali delle gemme è una base importante per la valutazione delle gemme.
Il colore di una gemma è fondamentale per la sua valutazione e ne determina il valore. Per esempio, nei diamanti, una differenza di colore di un grado può portare a una differenza di prezzo di circa 5%. Maggiore è il grado di bianco, maggiore è il grado del diamante; al contrario, i diamanti con tonalità gialle o marroni hanno gradi inferiori e i loro prezzi crollano. I prezzi dei diamanti colorati variano e i diversi diamanti colorati hanno prezzi diversi. Tuttavia, in generale, i prezzi dei diamanti di colore raro possono moltiplicarsi. Anche altre gemme colorate, come rubini, zaffiri e smeraldi, sono classificate in diversi gradi in base al colore e il valore delle gemme di diverso grado può variare in modo significativo.
(2) Il trattamento di ottimizzazione delle gemme comporta spesso il miglioramento del loro colore.
I metodi di trattamento di ottimizzazione delle gemme prevedono solitamente la modifica o il miglioramento del colore delle gemme, per cui il miglioramento delle gemme può essere definito anche alterazione del colore delle gemme. Quando il colore della gemma migliora, anche la trasparenza cambia di conseguenza. Questo perché la trasparenza è una proprietà legata al colore. Ad esempio, gli zaffiri blu sembrano avere molti colori neri opachi ad occhio nudo, ma il blu trasparente può essere visto quando viene tagliato a fette sottili. Il miglioramento della trasparenza spesso si accompagna al miglioramento del colore. Pertanto, solo determinando la causa del colore della gemma si possono accertare i metodi per migliorarla. La comprensione della causa del colore è un prerequisito per lo studio dei trattamenti di ottimizzazione delle gemme.
(3) Lo studio delle cause del colore delle gemme fornisce una base teorica per le gemme sintetiche e per il miglioramento delle gemme.
I colori di gemme come il granato, la malachite e l'olivina sono dovuti ai loro componenti intrinseci e non possono essere modificati con i metodi convenzionali di ottimizzazione. La maggior parte dei colori delle gemme è dovuta a impurità causate da ioni di impurità, come nel caso di rubini, zaffiri, smeraldi, giade e agate. Sulla base delle cause del colore delle gemme, durante il miglioramento, il contenuto e lo stato di valenza di alcuni ioni impurità che causano il colore possono essere modificati per cambiare o migliorare il colore della gemma, migliorando così la qualità della gemma migliorata. Pertanto, lo studio delle cause del colore delle gemme costituisce la base teorica per il miglioramento delle gemme.
2. La fisica del colore
(1) Colore e onde luminose
I fotoni trasportano l'energia della luce e, quando raggiungono l'occhio umano, creano la sensazione del colore. Il colore è la percezione della luce da parte degli occhi e del sistema nervoso; la risposta generata dai segnali formati sulla retina dell'occhio stimola la corteccia cerebrale. La formazione della percezione del colore ha tre componenti principali: la sorgente luminosa, l'oggetto e l'occhio umano. La modifica di una o più di queste tre componenti altera la percezione del colore. Le gemme interagiscono con la luce e i fenomeni di riflessione, rifrazione, trasmissione, interferenza e diffrazione che si verificano sulla superficie della gemma danno luogo a colori diversi.
La gamma di energia dello spettro di radiazioni elettromagnetiche è piuttosto ampia, variando da fotoni a onde radio molto lunghe a fotoni a raggi molto corti, con un intervallo di energia da meno di un miliardesimo di elettronvolt a oltre cento milioni di elettronvolt.
La luce visibile che l'occhio umano è in grado di accettare e percepire è una parte molto piccola dello spettro elettromagnetico, con una gamma di lunghezze d'onda di 400-700nm e un'energia di circa 1,7-3,1eV. Se le condizioni di osservazione sono sufficientemente buone, l'intervallo può essere esteso a 380-760 nm (Figura 3-1). La luce visibile comprende i colori che vediamo: rosso, arancione, giallo, verde, ciano, blu, viola e vari altri colori. Le diverse lunghezze d'onda della luce visibile producono colori diversi; il colore della luce visibile con la lunghezza d'onda più lunga e l'energia più bassa è il rosso, con un intervallo di lunghezza d'onda di 647-760 nm; la luce visibile con la lunghezza d'onda più corta e l'energia più alta è il viola, con un intervallo di lunghezza d'onda di 400-425 nm. Gli altri colori della luce visibile sono compresi tra 425 e 647 nm. Le lunghezze d'onda dei vari colori della luce visibile e dei loro colori complementari sono riportate nella Tabella 3-1.
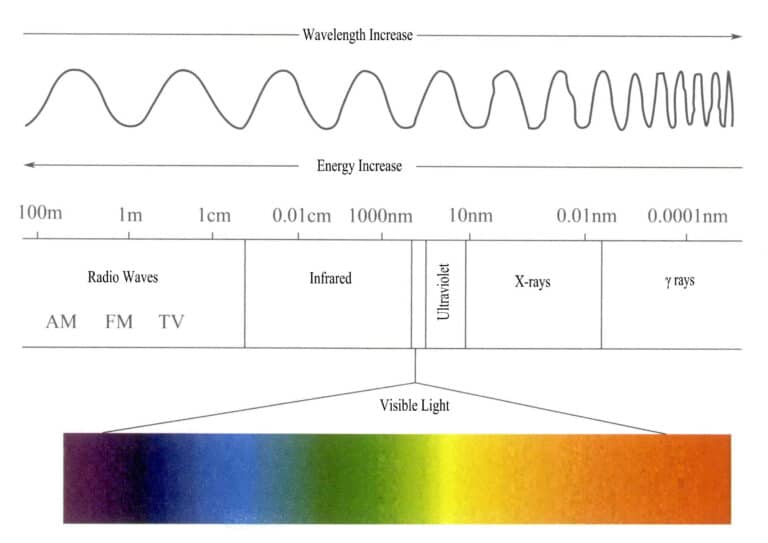
Tabella 3-1 Lunghezze d'onda dei vari colori della luce visibile e dei loro colori complementari
| Lunghezza d'onda/nm | Colore spettrale | Complementare |
|---|---|---|
| 400 ~ 425 | Viola | Giallo-verde |
| 425 ~ 455 | Blu | Giallo |
| 455 ~ 490 | Verde-blu | Arancione |
| 490 ~ 500 | Blu-verde | Rosso |
| 500 ~ 560 | Verde | Magenta |
| 560 ~ 580 | Giallo-verde | Viola |
| 580 ~ 595 | Giallo | Blu |
| 595 ~ 647 | Arancione | Verde-blu (ciano) |
| 647 ~ 760 | Rosso | Verde |
L'essenza del colore di un oggetto è il risultato dell'assorbimento selettivo di diverse lunghezze d'onda della luce visibile. L'essenza dell'assorbimento selettivo di diverse lunghezze d'onda della luce visibile da parte di un oggetto è l'assorbimento di fotoni di luce visibile con energie diverse. Quando la luce naturale illumina una gemma, questa assorbe parte della luce e ne trasmette una parte. Il colore presentato dalla gemma è il colore complementare della luce assorbita, coerente con il colore della luce trasmessa (Figura 3-2). Ad esempio, nel caso del rubino, quando la luce bianca attraversa il rubino, gli ioni di cromo contenuti nel rubino guadagnano energia assorbendo tutti i fotoni viola e verdi e la maggior parte dei fotoni blu, mentre gli altri fotoni di colore, prevalentemente rosso, attraversano il rubino, facendo apparire la gemma rossa.
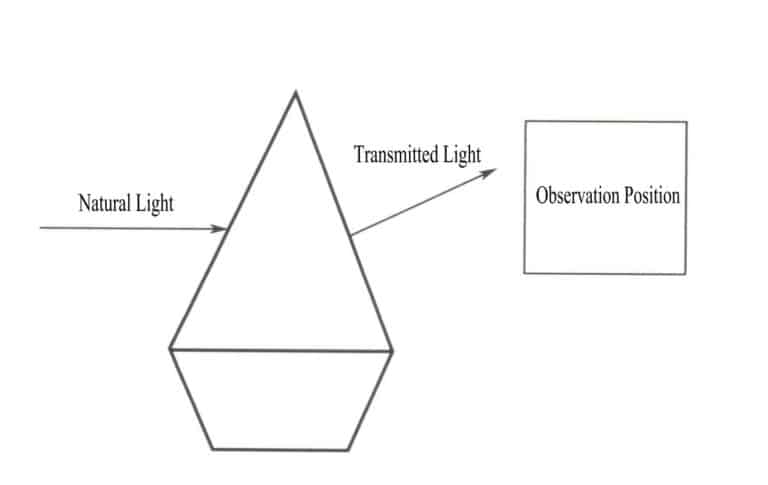
Una singola lunghezza d'onda della luce non produce il colore formato da un oggetto; piuttosto, la radiazione dell'oggetto è una miscela di fotoni con energie diverse, dove la banda energetica con la proporzione maggiore determina il colore dell'oggetto. Una miscela uniforme di vari colori di luce forma la luce bianca. La generazione dei colori delle gemme deriva dall'assorbimento selettivo di fotoni di diverse lunghezze d'onda della luce visibile. Quando la luce bianca attraversa una gemma, la luce assorbita e trasmessa dalla gemma è una miscela e il colore presentato dalla gemma dipende da quello con la maggiore percentuale di luce trasmessa. Ad esempio, nel caso di un rubino, quando la luce bianca illumina il rubino, la luce che lo attraversa è prevalentemente rossa con una piccola quantità di blu-viola. Pertanto, i rubini appaiono spesso rossi con una sfumatura blu-viola.
(2) Tipi e proprietà delle sorgenti luminose
Il colore delle gemme ha una certa soggettività, legata all'ambiente in cui l'osservatore si trova e influenzata soprattutto dalla fonte di luce. L'osservazione del colore delle gemme sotto diverse fonti di luce può mostrare differenze; ad esempio, un'alessandrite appare verde alla luce del sole ma rossa sotto la luce a incandescenza. In genere, si considera standard il colore visto alla luce naturale del sole, comunemente chiamato luce bianca.
Le prime operazioni di mercato delle gemme sono state condotte in orari specifici per ottenere un colore delle gemme relativamente accurato. Per esempio, i negozi di pietre preziose di Ratnapura, nello Sri Lanka, hanno operato per molti anni dalle 10 del mattino alle 12 del pomeriggio, poiché la fonte di luce in questo periodo è più vicina alla luce bianca. La luce solare e la luce diurna non sono sorgenti luminose isotrope e le differenze nelle quantità relative di radiazioni in diverse lunghezze d'onda tra le varie sorgenti luminose possono essere molto grandi a causa delle diverse condizioni di osservazione. La Figura 3-3 elenca le curve di distribuzione dell'energia di cinque sorgenti luminose comuni, le cui differenze di energia sono molto elevate.
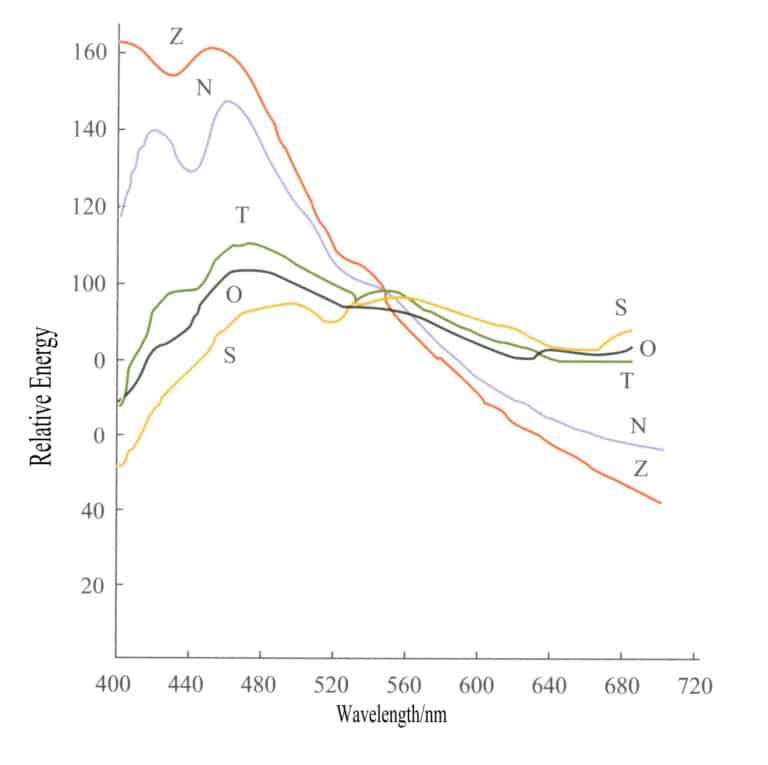
S - Luce solare diretta; O - Illuminazione della luce del cielo coperto sul piano orizzontale; T - Illuminazione della luce solare e del cielo sereno sul piano orizzontale; N - Luce del cielo sereno del nord; Z - Luce zenitale;
Le caratteristiche cromatiche della luce solare diretta sono spesso espresse in termini di temperatura di colore (misurata in K). La stessa temperatura di colore indica colori simili delle sorgenti luminose. Le temperature di colore della luce diurna attualmente riconosciute sono D6500K, D5500K e D7500K. Tre lampade sono designate a livello internazionale come sorgenti luminose standard per la misurazione del colore. SA rappresenta l'illuminazione artificiale media di una lampada a incandescenza al tungsteno, con una temperatura di colore di 2854K;SB rappresenta la luce solare media, con una temperatura di colore di 4900K; SC rappresenta la luce diurna media, con una temperatura di colore di 6700K. Nei test sulle gemme, la sorgente luminosa Sc viene utilizzata come sorgente luminosa standard.
(3) Sensibilità agli effetti della luce e del colore
L'osservazione dei colori delle gemme è soggettiva; oltre alle condizioni oggettive, il colore della gemma è anche legato alla percezione sensoriale dell'osservatore. A parità di sorgente luminosa, gli occhi umani hanno sensibilità diverse ai diversi colori e le persone hanno sensibilità diverse ai colori. L'osservazione del colore è soggettiva; per ottenere la massima oggettività possibile, i colori devono essere caratterizzati ed espressi in modo relativamente oggettivo.
① Effetto fotorecettivo:
In condizioni normali, la gamma di lunghezze d'onda delle sorgenti di luce visibile che l'occhio umano può osservare è di 400-700 nm. Migliorando le condizioni di osservazione, l'intervallo di sensibilità può essere esteso a 380-780 nm. L'occhio umano ha sensibilità diverse alle onde luminose di diversa lunghezza d'onda. Per la visione diurna, l'occhio è più sensibile alla luce verde con una lunghezza d'onda di 555 nm, mentre la lunghezza d'onda più sensibile per la visione crepuscolare si sposta a 507 nm. I semafori sulle strade sono progettati in base ai colori a cui l'occhio umano è più sensibile.
Sensazione di colore:
Il colore è la sensazione provocata dalle diverse componenti spettrali dell'energia delle radiazioni nella gamma della luce visibile. La vista di una persona normale può distinguere più di 150 sfumature di colori spettrali puri. Sebbene esista una corrispondenza uno-a-uno tra le onde luminose e i colori, la corrispondenza tra colori e onde luminose non è univoca; spesso, un colore della luce può essere formato dalla combinazione di due o più altri colori della luce. I tre colori di base indipendenti sono il rosso, il verde e il blu, noti come colori primari. Altri colori si formano mescolando due o più colori primari in proporzioni diverse, e l'occhio umano è molto sensibile ai colori, in grado di distinguerne molti diversi.
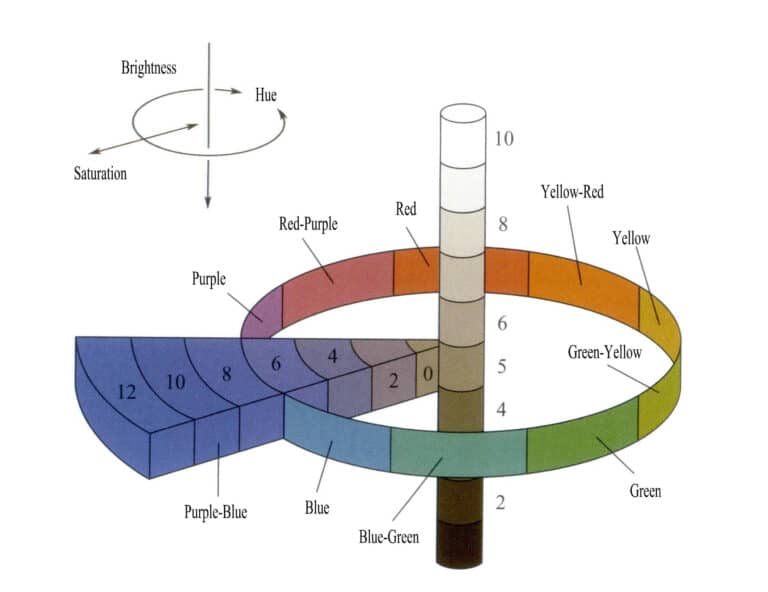
3. Tre elementi che rappresentano il colore
Il colore deriva dall'assorbimento selettivo della luce da parte delle gemme, e gemme diverse presentano colori diversi. L'attuale teoria del colore suggerisce che le caratteristiche del colore dipendono dalla luminosità, dalla tonalità e dalla saturazione (Figura 3-4). I tipi di colori delle gemme possono essere determinati descrivendo i tre elementi dei diversi colori.

(1) Luminosità
La luminosità è il grado di brillantezza causato dalla luce che agisce sull'occhio umano, riferito al grado di colori chiari e scuri, e può anche essere chiamata luminanza. La luminosità dipende in larga misura dalla percezione che l'occhio ha dei livelli di luce e buio della sorgente luminosa e della superficie dell'oggetto, determinata principalmente dall'intensità della luce. La luminosità dipende dal livello di illuminazione dell'oggetto e dalla riflettività della sua superficie.
La luminosità può essere intesa come la brillantezza di un colore; colori diversi hanno livelli di luminosità diversi e qualsiasi colore presenta variazioni di luce e buio. La luminosità ha due caratteristiche: lo stesso oggetto può presentare variazioni di luminosità dovute a un'illuminazione diversa e luci colorate diverse della stessa intensità possono avere livelli di luminosità diversi.
In assenza di colore, il colore con la massima luminosità è il bianco e quello con la minore luminosità è il nero, con una scala di grigi tra chiaro e scuro. Nel colore, ogni grado di purezza ha le sue caratteristiche di luminosità. Ad esempio, il giallo ha la massima luminosità, mentre il viola ha la minima. Il verde, il rosso, il blu e l'arancione hanno livelli di luminosità simili, che rappresentano una luminosità media. Inoltre, all'interno della stessa tonalità, esistono variazioni di luminosità da chiaro a scuro, come il verde chiaro, il verde pallido e il verde smeraldo nello spettro dei verdi.
(2) Tinta
La tinta si riferisce alle differenze tra i diversi colori ed è la caratteristica più importante del colore. La tinta è determinata dai componenti spettrali della luce che attraversano un oggetto e raggiungono l'occhio umano dopo essere stati incidenti su di esso, a seconda della lunghezza d'onda della luce trasmessa. La tinta di un oggetto è determinata dallo spettro della sorgente luminosa incidente e dalla luce riflessa o trasmessa dall'oggetto stesso.
La cosiddetta tinta si riferisce al nome che può rappresentare più accuratamente una certa categoria di colori, come il rosso rosato, il giallo arancio, il giallo limone, il blu cobalto, il rosso porpora, il verde smeraldo, ecc. Dal punto di vista dell'ottica fisica, le varie tonalità sono determinate dalle componenti spettrali della luce che entra nell'occhio umano. Per la luce monocromatica, i tipi di tinta dipendono completamente dalla lunghezza d'onda di quella luce; per la luce a colori misti, dipende dalle quantità relative delle varie lunghezze d'onda della luce. Il colore di un oggetto è determinato dalle componenti spettrali della sorgente luminosa e dalle caratteristiche della luce riflessa (o trasmessa) dalla superficie dell'oggetto. È correlato alla lunghezza d'onda della luce. Ad esempio, un colore con una lunghezza d'onda dominante di 470 nm è chiamato blu di 470 nm, comunemente visto come il blu degli zaffiri.
(3) Saturazione
La saturazione di un colore si riferisce alla purezza e alla vivacità del colore, indicando la proporzione di componenti cromatiche contenute nel colore. Maggiore è la percentuale di componenti cromatiche, maggiore è la purezza del colore; minore è la percentuale di componenti cromatiche, minore è la purezza del colore. La saturazione cambia quando un colore viene mescolato con il nero, il bianco o altri colori. Quando la proporzione del colore miscelato raggiunge un livello significativo, il colore originale perderà la sua brillantezza per l'occhio e il colore visto diventerà quello del colore miscelato. Naturalmente, questo non significa che il colore originale non esista più, ma piuttosto che il colore originale è stato assimilato a causa dei molti altri colori mescolati, rendendolo impercettibile all'occhio umano.
Le luci monocromatiche nello spettro visibile hanno la saturazione più alta e sono le più vivaci. La luce monocromatica viene solitamente considerata come 100/100 = 1 e, man mano che il colore si attenua, il valore diminuisce gradualmente, con il bianco puro che ha una saturazione pari a zero. Prendendo come esempio l'inchiostro blu puro, la saturazione dell'inchiostro blu puro è pari a 1, e quando si diluisce gradualmente fino a diventare completamente incolore, la saturazione diventa pari a zero.
4. Misurazione del colore delle gemme
Il sistema che rappresenta quantitativamente il colore è chiamato sistema cromatico. Esistono due tipi di sistemi di colore comunemente utilizzati: uno è un sistema di colore basato su campioni di colore standard per il confronto e l'altro è un insieme di sistemi di colore standard misurati con i moderni strumenti di misurazione del colore.
(1) Sistema cromatico dei campioni di colore standard
Questo sistema cromatico consiste in varie "carte colore" di carta che sono campioni di colore standard compilati in un libro. Vengono confrontati con campioni di gemme per selezionare la "carta dei colori" che corrisponde al colore della gemma.
① Sistema di colori Munsell
Il sistema di colori Munsell è uno dei primi e più classici sistemi di rappresentazione dei colori. È ancora oggi utilizzato da alcune organizzazioni. È stato creato nel 1905 dall'educatore e teorico del colore americano Albert Munsell, e prende il nome direttamente da lui. È un modo di rappresentare i colori attraverso un modello di colore-solido. Il "Munsell Color Atlas", pubblicato dalla Optical Society of America (OSA), comprende versioni lucide e opache.
La versione lucida comprende 1.450 campioni di colore, accompagnati da un set di 37 campioni acromatici; la versione opaca comprende 1.150 campioni di colore e 32 campioni acromatici.
Nell'Atlante Munsell, ogni colore è rappresentato da una serie di simboli. I simboli forniscono indicatori equidistanti per i tre elementi della rappresentazione del colore: tinta, valore e croma, rappresentati come HV/C = valore della tinta/croma.
Le tonalità sono suddivise in cinque toni primari: rosso (R), giallo-rosso (YR), giallo (Y), verde-giallo (GY), verde (G), blu-verde (BG), blu (B), viola-blu (PB), viola (P) e rosso-viola (RP), oltre a cinque toni intermedi. Ogni tono è ulteriormente suddiviso in dieci livelli (da 1 a 10), con il quinto livello che rappresenta il colore intermedio di quel tono (Figura 3-5).
Il valore è suddiviso in 11 livelli, con valori più alti che indicano una maggiore luminosità; il valore minimo è 0 (nero) e il massimo è 10 (bianco). Il croma è suddiviso in 12 livelli. L'intero atlante dei colori comprende 40 tipi di campioni di tonalità. Ad esempio, 5GY 8/7 rappresenta un giallo-verde con un valore di 8 e una saturazione di 7. La convenzione di denominazione per le serie non cromatiche (nero, bianco, grigio) è NV/= valore di luminosità neutro; ad esempio, un colore etichettato N5/ indica un grigio con un valore di luminosità pari a 5.
② Sistema di colore DIN 6164
Anche il manuale tedesco DIN 6164 è un importante sistema cromatico. Molti gemmologi in Europa e nel Regno Unito utilizzano questo sistema. Questo sistema cromatico è stato sviluppato sulla base del sistema Munsell.
La scheda colori DIN 6164 contiene 24 colori, con il retro di ciascun colore contrassegnato dalla corrispondente notazione Munsell. La rappresentazione è nel formato tinta: saturazione: luminosità. Ad esempio, 6:6:2 rappresenta la tinta 6 (rosso), la saturazione 6 (vivido) e la luminosità 2 (chiaro) della scheda colori standard.
③ Sistema cromatico ISCC-NBS
L'ISCC (Inter-Society Colour Council) è stato fondato nel 1931 come associazione nazionale di colori negli Stati Uniti e il suo sistema di colori mira a sviluppare un sistema di denominazione dei colori. Raccoglie 18 tinte nelle stesse posizioni di tonalità e luminosità di Munsell e DIN 6164.
L'ISCC-NBS (National Bureau of Standards) ha pochissimi campioni di colore nel sistema American National Standard, ma ha raccolto alcuni campioni non comuni. Anche dal punto di vista strutturale si differenzia dal sistema Munsell, in quanto i colori non sono disposti secondo una metrica percettiva equidistante. Il contributo più importante del sistema ISCC-NBS alla scienza del colore è la definizione dei nomi dei colori.
④ Standard cromatico OSA
L'OSA (Optical Society of America) ha preparato un pratico set di cartelle colori lucide in acrilico, comprendente 558 colori, di cui 424 costituiscono un set noto come OSA color standard. L'inconveniente dello standard cromatico OSA è che le cartelle colori sono fatte di carta o plastica, con una consistenza diversa da quella delle gemme, e la lucentezza della superficie delle cartelle colori differisce dalla luce riflessa dalle gemme sfaccettate, il che richiede un uso attento. A causa dello sbiadimento, la maggior parte delle cartelle colori ha un tempo di utilizzo di 4-5 anni.
(2) Coordinate cromatiche e diagramma cromatico
① Sistema di spazio colore CIE-XYZ del 1931
Questo sistema di spazio colore si basa sul sistema RGB e utilizza metodi matematici per selezionare tre colori primari ideali in sostituzione dei colori primari reali. Utilizzando i colori primari virtuali come assi, proietta diverse lunghezze d'onda della luce visibile. I valori dei colori primari sono chiamati valori tristimolo. Questo sistema richiede che i valori tristimolo non siano negativi e che y sia uguale al flusso luminoso. Utilizzando la x come asse orizzontale e la y come asse verticale, si formano le coordinate cromatiche, proiettando i valori delle coordinate cromatiche di ogni luce monocromatica per ottenere il diagramma cromatico. La Figura 3-6 è il diagramma cromatico standard del sistema (XYZ) stabilito a livello internazionale nel 1931.
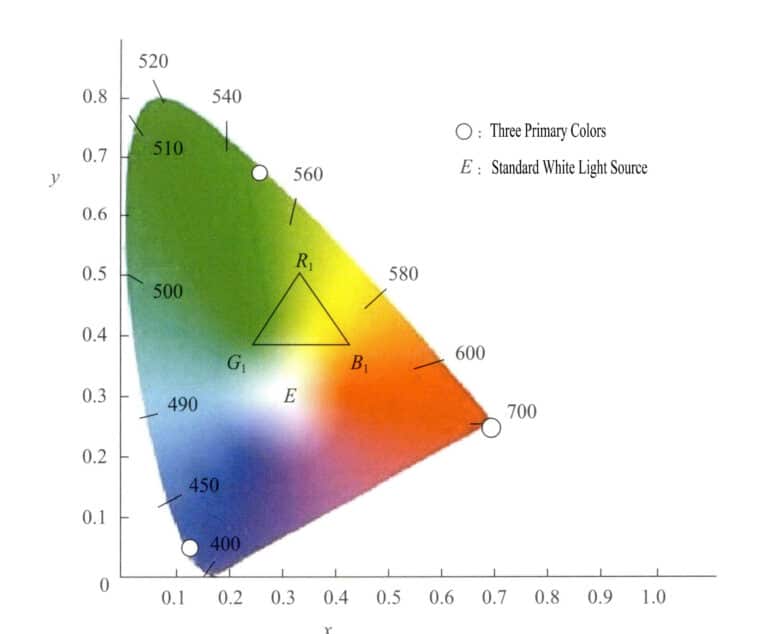
Il diagramma cromatico presenta le seguenti caratteristiche:
- I valori tristimolo dei colori primari di questo sistema sono virtuali.
- Tutti i punti che rappresentano i colori spettrali cadono sulla curva a forma di lingua chiamata colore spettrale. Collegando le estremità della curva con linee rette, tutti i colori reali sono contenuti nell'area circondata dalla curva a forma di lingua e dalle linee rette.
- Il valore delle coordinate del punto E a x=0,333, y=0,333 rappresenta il bianco teorico. Le diverse sorgenti di luce bianca hanno componenti spettrali leggermente diverse. La luce bianca comunemente utilizzata si divide in SA, SB, SC, SEe così via.
- Le coordinate cromatiche dei colori hanno una saturazione tanto più elevata quanto più si avvicinano alla traiettoria del colore spettrale. I punti sulla traiettoria spettrale del colore hanno la saturazione più alta; il punto bianco ha la saturazione più bassa. Una linea tracciata dal punto bianco alle coordinate cromatiche di un colore, estesa fino a intersecare la traiettoria del colore spettrale, presenta punti lungo questa linea che condividono la stessa tonalità.
- È possibile utilizzare un metodo grafico per ricavare il colore composito di due colori qualsiasi. Inserendo le coordinate cromatiche dei due colori nel diagramma cromatico, il colore composito deve trovarsi sulla linea che collega i due punti delle coordinate cromatiche. La distanza proiettata ai due punti di colore è legata all'intensità dei due colori, determinata dalla legge di distribuzione del centroide.
- I punti sulla linea retta tra gli estremi della curva cromatica spettrale non rappresentano colori spettrali, ma piuttosto vari colori misti ottenuti mescolando il viola a 380 nm e il rosso a 780 nm in proporzioni diverse.
- Selezionare tre punti qualsiasi all'interno della traiettoria del colore dello spettro per creare un colore. Ad esempio, se si sceglie R1, G1, B1 come i tre colori per l'abbinamento, allora tutti i vari colori formati da queste tre tonalità sono contenuti nel triangolo con vertici nei tre punti R1, G1, B1.
② Rappresentazione della lunghezza d'onda dominante e della saturazione
Nel diagramma cromatico, i colori possono essere rappresentati non solo dalle coordinate cromatiche (x, y). Un altro metodo proposto da Helmholtz è quello di rappresentarli utilizzando la lunghezza d'onda dominante λd e la saturazione (purezza dello stimolo) Pe. λd e Pe sono valori specifici derivati dalle coordinate cromatiche del diagramma (Figura 3-7). La lunghezza d'onda dominante rappresenta approssimativamente la sensazione di colore percepita dall'occhio umano.
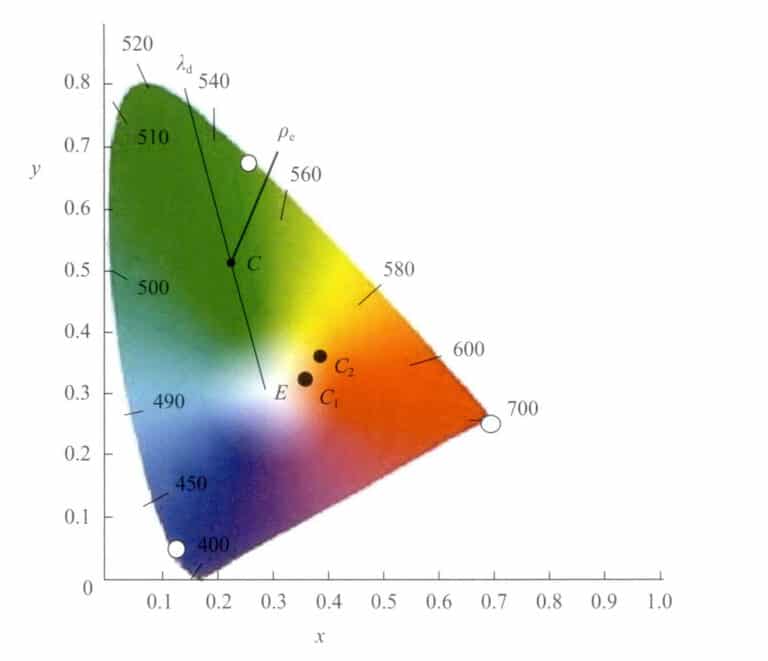
Sia la posizione di questo punto nel diagramma cromatico c(x, y). Collegare il punto c con il bianco E e prolungarlo fino a intersecare la traiettoria dello spettro in λd . Allora, il numero di lunghezza d'onda del punto λd sulla traiettoria dello spettro è la lunghezza d'onda dominante di questa luce colorata.
Il punto C si trova sulla retta che unisce i punti W e λd che rappresenta la saturazione di questo colore. Il punto W è il bianco puro (E) o una specifica sorgente di luce bianca. Quando le coordinate cromatiche di un determinato colore si spostano gradualmente lungo una direzione verso la traiettoria spettrale dal punto bianco W, la saturazione del colore aumenta gradualmente fino a raggiungere la traiettoria spettrale, con una saturazione massima pari a 1.
I colori sono rappresentati utilizzando la lunghezza d'onda dominante e la saturazione, per facilitare il confronto delle differenze cromatiche. Le lievi differenze di colore, rappresentate dalle variazioni numeriche in λd e ρe, possono essere visualizzati.
Per due colori, C1, C2, le coordinate cromatiche, la lunghezza d'onda dominante e la saturazione con la stessa illuminazione sono riportate nella Tabella 3-2. Si può notare che la lunghezza d'onda dominante del colore C1, C2 differisce di 0,052 nm e la saturazione differisce di 7%.
Tabella 3-2 Confronto dei dati di colore tra C1 e C2
| Punto di proiezione del colore | X | y | λd | ρe |
|---|---|---|---|---|
| C1 | 0.368 | 0.416 | 0.592 | 0.35 |
| C2 | 0.392 | 0.355 | 0.540 | 0.28 |
5. Strumenti per la misurazione del colore delle gemme
(1) Spettrofotometro
Principio di funzionamento: poiché la distribuzione dell'energia spettrale della sorgente luminosa standard all'interno dello strumento è nota, i valori tristimolo di un oggetto possono essere ottenuti misurando la sua riflettanza spettrale.
(2) Colorimetro a valore tristimolo
È uno strumento fotoelettrico integrativo che misura direttamente i tre valori di stimolo del colore di un oggetto. Simula principalmente le tre risposte dell'osservatore standard al colore attraverso un'appropriata combinazione di filtri e convertitori fotoelettrici.
Attualmente, il giudizio sul colore delle gemme si basa principalmente sull'osservazione dell'occhio umano. Ad esempio, smeraldi, rubini e diamanti sono influenzati da fattori ambientali che determinano una bassa precisione nelle misurazioni strumentali; pertanto, l'applicazione della misurazione strumentale del colore nell'identificazione delle gemme è relativamente rara.
Sezione II Origini teoriche del colore dei minerali delle gemme
I minerali delle gemme sono disponibili in vari colori, ma anche le ragioni della loro colorazione sono diverse. Secondo la teoria della mineralogia classica, le origini del colore dei minerali gemmari possono essere classificate in idiocromatiche, allocromatiche e pseudocromatiche.
1. Classificazione della mineralogia classica Teoria dell'origine dei colori
La teoria classica della mineralogia è la teoria fondamentale per lo studio dei colori dei minerali preziosi. A seconda che il colore del minerale sia dovuto al minerale stesso, può essere suddiviso in tre categorie: idiocromatico, allocromatico e pseudocromatico.
(1) Idiocromatico-colorato
Il colore di una gemma è formato dai componenti chimici intrinseci del minerale di cui è composta, noto come colore idiocromatico. Tali gemme sono chiamate gemme idiocromatiche. I loro componenti intrinseci causano il colore prodotto dalle gemme di colore idiocromatico; pertanto, hanno una buona stabilità del colore e non sono facilmente alterabili. Ad esempio, la composizione chimica del turchese èCuAl6(PO4)4(OH)8-5H2O, e il blu o il verde-azzurro che presenta è causato dal Cu2+; la composizione chimica dell'azzurrite è 2CuCO3 - Cu(OH)2e Cu2+ Il verde dell'olivina è prodotto dagli ioni di ferro presenti nella sua composizione chimica (Figura 3-8).

Non esistono molti tipi di gemme autocolorate nei minerali gemmari naturali; le varietà principali sono turchese, malachite, azzurrite, olivina, granato e rodocrosite. I colori comuni, gli elementi coloranti e le composizioni chimiche delle gemme autocoloranti sono riportati nella Tabella 3-3.
Tabella 3-3 Elementi coloranti comuni, composizione chimica e colori delle gemme colorate
| Elementi da colorare | Nome della pietra preziosa | Composizione chimica | Colore |
|---|---|---|---|
| Ferro | Olivina | (Mg, Fe)2 (SiO4) | Verde |
| Almandino | Fe3Al2 (SiO4)3 | Rosso | |
| Cromo | Uvarovite | Ca3Cr2 (SiO4)3 | Verde |
| Cuprum | Malachite | Cu2Co3(OH)2 | Verde |
| Crisocolla | (CuAl)2H2Si2O5(OH)4 - nH2O | Verde - Blu | |
| Turchese | CUAl6(PO4)4(OH)8.5H2O | Blu cielo - Verde | |
| Azurite | 2CuCO3 - Cu(OH)2 | Blu | |
| Manganese | Spessartine-Garnet | Mn3Al2(SiO4)3 | Arancione |
| Rodocrosite | MnCO3 | Rosa - Rosso | |
| Rodonite | (Mn, Ca, Fe) - 5(Si5O15) | Rosa - Rosso |
Copywrite @ Sobling.Jewelry - Produttore di gioielli personalizzati, fabbrica di gioielli OEM e ODM
Alcune gemme colorate possono cambiare colore in determinate condizioni. Ad esempio, il turchese e la malachite possono cambiare colore se esposti ad alte temperature, a causa dell'evaporazione delle molecole d'acqua presenti nella loro composizione; la rodocrosite, una gemma carbonatica, può decomporsi in presenza di acidi (come l'acido cloridrico o l'acido solforico) e il suo colore cambierà di conseguenza.
(2) Allochromatico-Coloreed
Il colore di una gemma è causato da tracce o impurità minori al di fuori della composizione chimica intrinseca dei minerali che la compongono, nota come colore allocromatico. Le gemme di questo tipo sono definite gemme di colore allocromatico.
Nei minerali delle gemme esistono molte varietà di gemme con colori diversi. Quando non ci sono impurità nella composizione chimica della gemma, essa è incolore e trasparente; quando contiene impurità di diversi elementi coloranti, può produrre colori diversi.
Quando il corindone puro è incolore, diventa rubino se contiene una piccola quantità di ioni cromo; quando contiene una piccola quantità di ferro e titanio, si trasforma in gemme blu o verdi. Pietre simili sono lo smeraldo, lo spinello, la tormalina, la giadeite, il calcedonio, la nefrite, ecc. Gli elementi coloranti comuni, le composizioni chimiche e le gemme dai colori allocromatici sono riportati nella Tabella 3-4.
Tabella 3-4 Elementi coloranti comuni, composizione chimica e gemme di colore allocromatico
| Elementi da colorare | Nome della pietra preziosa | Composizione chimica | Colore |
|---|---|---|---|
| Cromo | Rubino | Al2O3 | Rosso |
| Smeraldo | Essere3Al2(Si6O18) | Verde | |
| Alessandrite | BeAl2O4 | Rosso-verde | |
| Spinello | MgAl2O4 | Rosso | |
| Calcedonio | SiO2 | Verde | |
| Ferro | Acquamarina | Essere3Al2Si6O18 | Blu |
| Tormalina | (Na, K, Ca) (Al, Fe3+, Cr)6(BO3)3Si6O18(OH)4 | Verde-marrone | |
| Spinello | MgAl2O4 | Giallo | |
| Nefrite | Ca2(Mg, Fe2+) 5 (Si4O11) 2 (OH)2 | Verde | |
| Vanadio | Tanzanite | Ca2Al3(SiO4)3(OH) | Viola-blu |
| Berillo verde | Essere3Al2Si6O18 | Verde | |
| Titanio | Benitoite | BaTiSi3O9 | Blu |
| Zaffiro | Al2O3 | Blu | |
| Manganese | Berillo rosso | Essere3Al2Si6O18 | Rosso |
| Rodocrosite | MnCO3 | Rosa | |
| Cobalto | Spinello naturale | MgAl2O4 | Blu |
| Spinello sintetico | MgAl2O4 | Blu | |
| Nickle | Calcedonio verde | SiO2 | Verde |
(3) Pseudo-Coloreed
I colori prodotti dagli pseudocolori non sono correlati alla composizione chimica dei minerali delle gemme. Tuttavia, sono causati da cambiamenti strutturali e compositivi derivanti da miscele meccaniche o dalla formazione di minerali. Gli pseudocolori non sono i colori dei minerali stessi, ma piuttosto quelli causati da strutture speciali formate da influenze esterne. Ad esempio, i bellissimi colori di interferenza prodotti dall'interferenza della luce riflessa e incidente, come l'effetto Fluorescenza della labradorite e l'effetto gioco di colori dell'opale. Anche la colorazione causata dalle inclusioni rientra tra gli pseudocolori, come nel caso dei diamanti neri, dovuti alle numerose inclusioni di grafite opaca all'interno del diamante.
2. Ioni che causano il colore nei minerali delle gemme
Gli elementi chimici che producono i colori delle gemme possono essere i componenti principali o minori. Gli elementi metallici di transizione, in particolare i metalli di transizione del 4° periodo: titanio, vanadio, cromo, manganese, ferro, cobalto, nichel e rame, sono spesso indicati come cromofori o ioni coloranti. Questi otto elementi occupano posizioni consecutive nella tavola periodica, con numeri atomici che vanno da 22 (Ti) a 29 (Cu). Le proprietà fondamentali di questi elementi sono riportate nella Tabella 3-5.
Tabella 3-5 Proprietà di base di otto elementi di transizione
| Nome dell'elemento | Titanio | Vanadio | Cromo | Manganese | Ferro | Cobalto | Nichel | Rame |
|---|---|---|---|---|---|---|---|---|
| Simbolo dell'elemento | Ti | V | Cr | Mn | Fe | Co | Ni | Cu |
| Numero atomico | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| Principali stati di ossidazione | +2, +3, +4 | +2, +3, +4, +5 | +2, +3, +6 | +2, +3, +4, +6 | +2, +3, +6 | +2, +3 | +2, +3 | +1, +2 |
| Configurazione degli elettroni di valenza | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 |
Questi otto elementi metallici di transizione presentano le seguenti caratteristiche:
Gli elettroni di valenza sono riempiti negli orbitali d del penultimo guscio in sequenza e la formula generale per la configurazione degli elettroni di valenza degli atomi degli elementi di transizione è (n-1)d1-10nS1-2, quindi questi elementi sono chiamati anche elementi di blocco d.
Nei metalli di transizione, poiché gli orbitali d del penultimo guscio sono collegati agli orbitali s più esterni e gli orbitali d non hanno ancora raggiunto una struttura stabile, sia gli elettroni s che gli elettroni d possono partecipare al legame in modo parziale o completo, dando luogo a una serie di stati di ossidazione variabili per i metalli di transizione, con ossidi diversi che presentano colori diversi nelle gemme.
Gli ③ ioni generalmente mostrano il colore perché ci sono elettroni singoli non appaiati negli orbitali d e i livelli energetici di questi elettroni negli stati eccitati e a terra sono relativamente vicini, consentendo all'energia della luce visibile di eccitarli. Anche le diverse condizioni di eccitazione possono far sì che le gemme presentino colori diversi.
Se gli elettroni di spin dello ione sono tutti appaiati, come nel caso di ioni con una configurazione di elettroni di valenza di d0, d10, d10s2, gli elettroni si trovano in uno stato stabile e non sono facilmente eccitabili, per cui lo ione non ha colore; quindi, C+, Cr6+ e altri non hanno colore e non possono produrre colore nelle gemme.
Questi otto elementi metallici di transizione costituiscono la formazione del colore nelle comuni gemme di colore naturale. Cromofori diversi producono colori diversi in gemme diverse, e anche lo stesso cromoforo può produrre colori diversi. Le gemme naturali più comuni e i loro cromofori sono riportati nella Tabella 3-6.
Tabella 3-6 Colori presentati dagli ioni dei metalli di transizione nelle gemme naturali e nelle varietà di gemme comuni
| Cromoforo | Colori comuni | Varietà di gemme |
|---|---|---|
| Ione titanio (Ti) | Blu | Zaffiro, benitoite, topazio |
| Ione vanadio (V) | Verde | Corindone sintetico cambiacolore, Essonite, Smeraldo |
| Ione cromo (Cr) | Rosso, verde | Rubino, corindone, smeraldo, piropa, giada |
| Ione manganese (Mn) | Rosa, Rosso | Spessartina, Rodolite, Berillo rosso |
| Ione ferro (Fe) | Blu, verde, giallo | Zaffiro, olivina, acquamarina, tormalina, spinello |
| Ione cobalto (Co) | Blu | Spinello sintetico, staurolite color cobalto |
| Ione nichel (Ni) | Verde | Calcedonio verde |
| Ione rame (Cu) | Blu, blu-verde | Malachite, turchese, azzurrite |
I diversi ioni cromofori producono colori diversi nelle gemme, dando luogo a spettri di assorbimento con caratteristiche distinte. Per gli ioni cromofori comuni, gli spettri di assorbimento hanno un tipico significato di identificazione.
(1) Lo spettro di assorbimento degli ioni di cromo
Lo spettro di assorbimento degli ioni di cromo è caratterizzato principalmente da molte linee di assorbimento strette nella regione del rosso, con le due più forti situate nella regione del rosso intenso e altre due nella regione dell'arancione. La regione giallo-verde presenta un'ampia banda di assorbimento, la cui ampiezza, posizione e intensità sono correlate alla profondità del colore della gemma. Nella regione blu possono essere presenti diverse bande strette, mentre la regione viola è completamente assorbita. Gli ioni di cromo producono principalmente i colori rosso e verde, che variano nelle diverse gemme, e gli spettri di assorbimento mostrano alcune differenze. Ad esempio, i rubini hanno tre linee di assorbimento nella regione rossa, un'ampia banda di assorbimento nella regione giallo-verde, tre linee di assorbimento nella regione blu e un assorbimento completo nella regione viola; gli smeraldi hanno linee di assorbimento nella regione rossa, una debole banda di assorbimento nella regione giallo-arancio, deboli linee di assorbimento nella regione blu e un assorbimento completo nella regione viola; l'alessandrite ha linee di assorbimento nella regione rossa, una banda di assorbimento nella regione giallo-verde, una linea di assorbimento nella regione blu e un assorbimento completo nella regione viola. Gli spettri di assorbimento di queste tre gemme sono riportati nella Figura 3-9.

(2) Caratteristiche dello spettro di assorbimento degli ioni ferrosi
Gli ioni di ferro producono colori diversi in gemme diverse e hanno un forte effetto colorante, ma lo spettro di assorbimento degli ioni di ferro varia notevolmente. Quando la gemma è verde, produce un assorbimento nella zona rossa, mentre quando è rossa produce una caratteristica di assorbimento dominata dalla zona blu, con la principale linea di assorbimento caratteristica situata nelle zone verde e blu. Ad esempio, gli ioni di ferro nell'olivina appaiono di colore verde oliva, con lo spettro di assorbimento che mostra principalmente tre strette bande di assorbimento nella regione blu a 453nm, 473nm e 493nm; l'almandina rossa ha un tipico spettro di assorbimento del ferro, con tre forti bande di assorbimento strette a 504nm, 520nm e 573nm nella regione giallo-verde, comunemente indicata nel settore come "finestra del ferro". Inoltre, sono presenti deboli bande di assorbimento a 423nm, 460nm, 610nm e 680~690nm; lo spettro di assorbimento dello zaffiro giallo presenta tre bande di assorbimento strette nella regione blu a 450nm, 460nm e 470nm.(Figura 3-10).
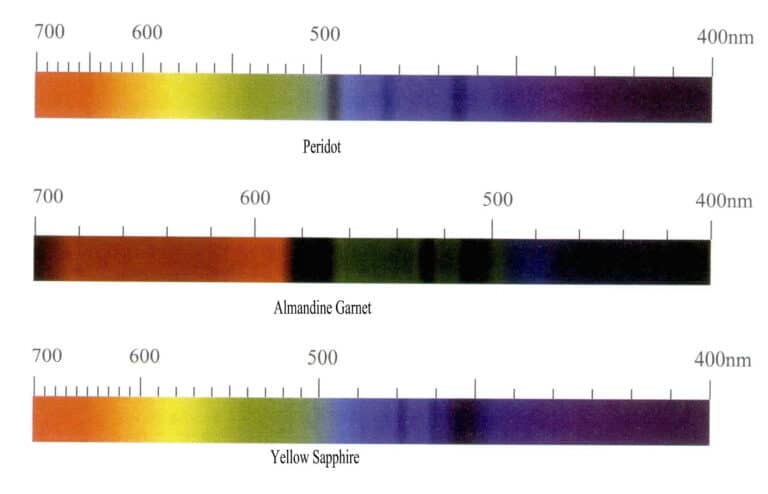
(3) Caratteristiche dello spettro di assorbimento degli ioni manganese
Gli ioni di manganese formano principalmente il rosa, l'arancione e il rosso nelle gemme, con lo spettro di assorbimento che mostra principalmente un forte assorbimento nella regione del viola, che si estende nella regione dell'ultravioletto, e un certo assorbimento nella regione del blu. Ad esempio, le caratteristiche dello spettro di assorbimento della rodocrosite rosa presentano tre bande di assorbimento a 410nm, 450nm, 540nm; le linee dello spettro di assorbimento della spessartina presentano principalmente tre bande di assorbimento a 410nm, 420nm, 430nm e linee di assorbimento a 460nm, 480nm e 520nm. A volte, possono essere presenti due linee di assorbimento a 504nm e 573nm (Figura 3-11).

(4) Caratteristiche dello spettro di assorbimento degli ioni di cobalto
Gli ioni di cobalto hanno un forte effetto colorante e di solito appaiono in un colore blu brillante nelle gemme, con lo spettro di assorbimento che mostra principalmente tre bande di assorbimento forti e ampie nella regione giallo-verde. A causa della scarsa abbondanza di cobalto nella crosta terrestre, le gemme naturali colorate dagli ioni cobalto sono molto poche. Lo spettro di assorbimento degli ioni cobalto indica anche gemme sintetiche, come lo spinello blu sintetico e il vetro di cobalto. Lo spinello blu sintetico presenta tre forti bande di assorbimento nelle regioni giallo-verde e giallo-arancio, con la banda di assorbimento della regione verde che è la più stretta; le linee di assorbimento del vetro di cobalto presentano principalmente tre forti bande di assorbimento nelle regioni giallo-verde e giallo-arancio, con la banda di assorbimento della regione gialla che è la più stretta (Figura 3-12).

3. Elementi delle terre rare da colorare
La ricerca sull'influenza degli elementi delle terre rare in tracce sul colore delle gemme sta diventando sempre più approfondita. I colori degli elementi delle terre rare sono più vivaci e le loro proprietà fisico-chimiche sono molto stabili. Anche gli elementi delle terre rare come l'apatite e la fluorite possono colorare le gemme naturali. Diversi elementi delle terre rare possono essere aggiunti a gemme sintetiche e trattate in modo ottimale per ottenere gemme di colori diversi, come il giallo del cerio e il blu del neodimio.
Gli elementi delle terre rare che colorano le pietre preziose sono principalmente i lantanidi e gli attinidi della tavola periodica degli elementi chimici e i colori che possono produrre sono mostrati nella Tabella 3-7.
Tabella 3-7 Elementi delle terre rare e loro colori nelle gemme comuni
| Simbolo dell'elemento | La | Ce | Nd | Pr | Dy | Sm | Er | Tm | U |
|---|---|---|---|---|---|---|---|---|---|
| Nome completo | Lantanio | Cerio | Neodimio | Praseodimio | Disprosio | Samario | Erbio | Tulio | Uranio |
| Colore | Incolore | Giallo | Blu | Verde | Giallo chiaro | Giallo chiaro | Rosa | Verde chiaro | Bianco-argento |
Gli elementi delle terre rare hanno spettri di assorbimento caratteristici, che spesso formano linee sottili uniche. Ad esempio, l'apatite gialla contiene spesso l'elemento delle terre rare Ce, con linee sottili di assorbimento caratteristiche nella regione gialla. Tuttavia, l'uranio non produce un giallo brillante, ma può generare linee spettrali di assorbimento distinte. Ad esempio, nello zircone verde possono comparire più di dieci linee di assorbimento in varie zone di colore (Figura 3-13).

Sezione III Colori prodotti da difetti del cristallo e centri di colore
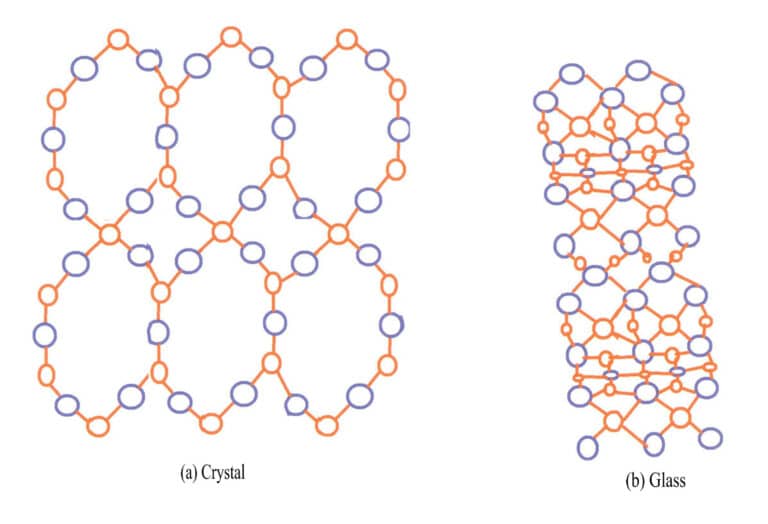
In natura, i minerali si dividono in cristalli e non cristalli in base al diverso grado di cristallizzazione. La maggior parte delle gemme, come rubini, zaffiri, diamanti, smeraldi e quarzo, sono cristalli; alcune gemme organiche, come ambra e corallo, non sono cristalline. Le strutture cristalline hanno una struttura reticolare, in cui le particelle interne (atomi, ioni o molecole) sono disposte in uno schema periodico regolare nello spazio tridimensionale e i cristalli possono formare spontaneamente forme poliedriche; i non-cristalli sono corpi amorfi con strutture non reticolari che non possono formare forme poliedriche, come il vetro, la colofonia e la resina.
L'esempio più tipico della differenza tra cristalli e solidi amorfi è rappresentato dal quarzo e dal vetro. Il quarzo naturale si forma dal materiale fuso SiO2 nel magma che si raffredda in cavità all'interno della crosta terrestre. Lo strato esterno delle comuni sfere di quarzo è costituito da agata, che non presenta la forma cristallina, mentre lo strato interno presenta la forma cristallina del quarzo. I principali componenti chimici del vetro e del quarzo sono SiO2Il quarzo è un cristallo con ioni di silicio e di ossigeno disposti in modo ordinato, mentre il vetro è un solido amorfo con ioni di silicio e di ossigeno disposti in modo caotico, senza regolarità, come mostrato nella Figura 3-14.
La maggior parte dei cristalli di gemme è colorata a causa di ioni impurità, come nel caso di rubini, smeraldi e tormaline. Alcune gemme, pur non avendo ioni cromofori, sono colorate a causa di difetti nella loro struttura cristallina. Le gemme naturali prodotte in natura possono cambiare colore a causa di condizioni esterne, come l'irradiazione e la ionizzazione, che alterano la struttura cristallina. L'esempio più comune è quello del quarzo fumé, che sviluppa il colore a causa della formazione di centri di colore da vacuità indotte dalle radiazioni. Il quarzo fumé irradiato artificialmente ha un principio di formazione simile a quello del quarzo fumé naturale, con la differenza che le radiazioni artificiali creano rapidamente il colore.
1. Difetti e tipi di cristallo
Il fenomeno per cui la disposizione delle particelle si discosta dalle regole della struttura reticolare (le particelle subiscono una ripetizione traslazionale periodica nello spazio tridimensionale) all'interno di un intervallo locale della struttura del cristallo di gemma è chiamato difetto reticolare. Le cause sono legate alle vibrazioni termiche delle particelle all'interno del cristallo di gemma, alle sollecitazioni esterne, alle alte temperature e pressioni, all'irradiazione, alla diffusione, all'impianto di ioni e ad altre condizioni.
Ad esempio, i diamanti cristallizzati nell'ambiente ad alta temperatura e alta pressione del mantello superiore, quando vengono rapidamente trasportati vicino alla superficie terrestre dal magma ospite (kimberlite o lamproite), il rapido cambiamento delle condizioni di temperatura e pressione e le collisioni reciproche tra i cristalli e le rocce circostanti possono facilmente portare a cambiamenti locali nella struttura dei cristalli di diamante intrusivi, con conseguenti difetti reticolari che cambiano il colore dei diamanti originariamente incolori, formando diamanti di colore giallo-brunastro, marrone e rosa.
La presenza di difetti nei cristalli ha un impatto significativo sulle proprietà dei cristalli. In realtà, i cristalli presentano più o meno difetti. Una quantità moderata di alcuni difetti puntiformi può migliorare notevolmente la conduttività dei materiali semiconduttori e la luminescenza dei materiali luminescenti, svolgendo un ruolo benefico. Al contrario, difetti come le dislocazioni possono rendere i materiali inclini alla frattura, riducendo la resistenza alla trazione di cristalli quasi privi di difetti reticolari a una frazione di quella.
In un cristallo idealmente perfetto, gli atomi sono rigorosamente disposti in un reticolo regolare e periodico in punti specifici dello spazio. Tuttavia, durante l'effettiva crescita e formazione dei cristalli, a causa dell'influenza degli ambienti di crescita, quali temperatura, pressione e concentrazione dei componenti del mezzo, la morfologia del cristallo dopo la crescita può talvolta deviare dalla struttura cristallina ideale. Qualsiasi deviazione dalla struttura cristallina ideale può essere definita un difetto cristallino. I difetti cristallini hanno un impatto significativo sulle proprietà fisiche e chimiche dei cristalli e molte discipline sono legate ai difetti cristallini, come il drogaggio ionico nella scienza dei materiali. Il colore delle gemme è in gran parte legato ai difetti cristallini presenti al loro interno. Questa è una delle cause del colore delle gemme: i centri di colore.
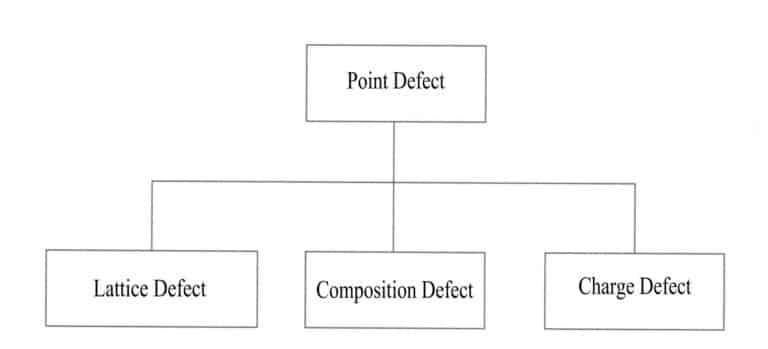
Esistono molti tipi di difetti della struttura cristallina, che possono essere classificati in quattro categorie in base all'estensione della loro distribuzione nello spazio tridimensionale: difetti di punto, difetti di linea, difetti di superficie e difetti di volume.
(1) Difetti puntuali
Altri atomi sostituiscono alcuni atomi in un cristallo ideale, altri vengono drogati o vengono creati dei posti vacanti. Alcuni atomi del cristallo vengono sostituiti o mancano a causa di atomi esterni e questi cambiamenti alterano la disposizione periodica del reticolo regolare del cristallo, causando cambiamenti nel campo potenziale delle particelle e determinando l'incompletezza della struttura cristallina, limitata a determinate posizioni, che interessano solo alcuni atomi vicini. L'impatto dei difetti puntiformi sul cristallo è minimo e i tipi più comuni di difetti puntiformi includono difetti di posizione del reticolo, difetti di composizione e difetti di carica (Figura 3-15).
(2) Difetti di linea
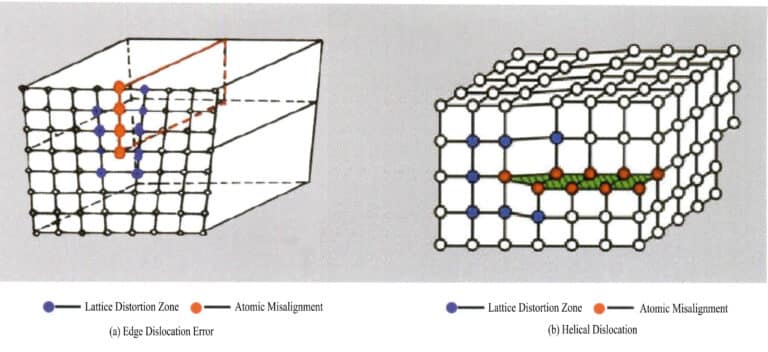
I difetti lineari hanno dimensioni molto ridotte in due direzioni e si estendono principalmente in un'altra direzione. Sono noti anche come difetti monodimensionali e consistono principalmente in varie dislocazioni. Le dislocazioni possono essere viste come il prodotto di uno slittamento locale del reticolo lungo un determinato piano atomico. Lo slittamento non penetra nell'intero reticolo; il difetto cristallino termina all'interno del reticolo, causando una disposizione disordinata delle particelle al confine tra le parti del reticolo slittate e non slittate, nota come dislocazione. Questo confine, la linea di intersezione tra le aree scivolate e non scivolate, è chiamato linea di dislocazione. Esistono due tipi fondamentali di dislocazioni: quando il cristallo è sottoposto a forze di compressione, il piano di scivolamento della particella forma una linea di dislocazione con il piano non scivolato e la linea di dislocazione è perpendicolare alla direzione di scivolamento, nota come dislocazione del bordo, detta anche dislocazione a cuneo; a causa dello sforzo di taglio, lo scivolamento si verifica tra i piani e le linee di dislocazione che si intersecano nella parte scivolata del cristallo sono parallele alla direzione di scivolamento, definita dislocazione a vite (Figura 3-16).
(3) Difetti della superficie
Il difetto superficiale più semplice è lo stacking fault, suddiviso in stacking fault intrinseco (in cui viene rimosso un piano del cristallo) e stacking fault estrinseco (in cui viene inserito uno strato atomico nel cristallo). Questi difetti si verificano in un intervallo di pochi spazi atomici su entrambi i lati di un determinato piano lungo il reticolo o tra i grani. Comprendono principalmente difetti di impilamento e interfacce all'interno e tra i cristalli, come i confini di grano a piccolo angolo, le pareti di dominio e i confini gemellari e intergranulari.
(4) Difetti di volume
I difetti di volume si riferiscono a difetti che esistono in varia misura in tutte e tre le direzioni, ovvero difetti tridimensionali, come crepe incorporate, strutture a rete, strutture familiari, gemelli e varie inclusioni di gemme.
2. I centri di colore nelle gemme
I centri di colore sono un caso particolare di difetti reticolari, che si riferiscono generalmente a difetti reticolari nelle gemme in grado di assorbire selettivamente l'energia della luce visibile e di produrre colore, appartenendo ai tipi di colore strutturale più tipici. In alcuni casi, gli elettroni spaiati che producono colore possono comparire anche in ioni di elementi non di transizione o in difetti cristallini che si formano a causa della mancanza di elettroni, come sono appunto i centri di colore. I difetti puntiformi nei cristalli ionici possono causare l'assorbimento della luce visibile, facendo apparire colorati i cristalli originariamente trasparenti; questi tipi di difetti puntiformi in grado di assorbire la luce visibile sono solitamente indicati come centri di colore. Molti tipi di gemme naturali producono colore dai centri di colore, come la fluorite viola, il cristallo di fumo e i diamanti verdi.
Nel processo di ottimizzazione del trattamento delle gemme, alcune gemme naturali e artificiali possono anche avere centri di colore generati dalle radiazioni, come i diamanti blu, gialli, rossi, verdi e il topazio blu che cambiano colore a causa delle radiazioni, e il topazio blu, tra i quali alcuni colori sono relativamente stabili e scompaiono solo se riscaldati; alcuni colori sono instabili e possono svanire anche a temperatura ambiente. Questo tipo di centro di colore è strettamente correlato alla struttura cristallina della gemma, come nel caso dei diamanti verdi, dove la causa del colore è la presenza di spazi vuoti nella struttura cristallina, ma questo difetto strutturale può anche essere rimosso per irradiazione, rendendo il diamante incolore. I tipi comuni di centri di colore nelle gemme sono i "centri di colore di elettroni" e i "centri di colore di buchi".
(1) Centro di colore degli elettroni (centro F)
I centri di colore a elettroni sono centri di colore che si formano quando gli elettroni sono presenti nelle lacune dei difetti cristallini causati da lacune anioniche nella struttura cristallina della gemma. Quando l'anione è assente, il posto vacante diventa una trappola per elettroni con carica positiva che intrappola gli elettroni. Se una lacuna cattura un elettrone e lo lega a quella lacuna, l'elettrone si eccita e assorbe selettivamente una certa lunghezza d'onda di energia, diventando colorato. Pertanto, un centro di colore elettronico è costituito da una lacuna anionica e da un elettrone legato dal campo elettrico di quella lacuna.
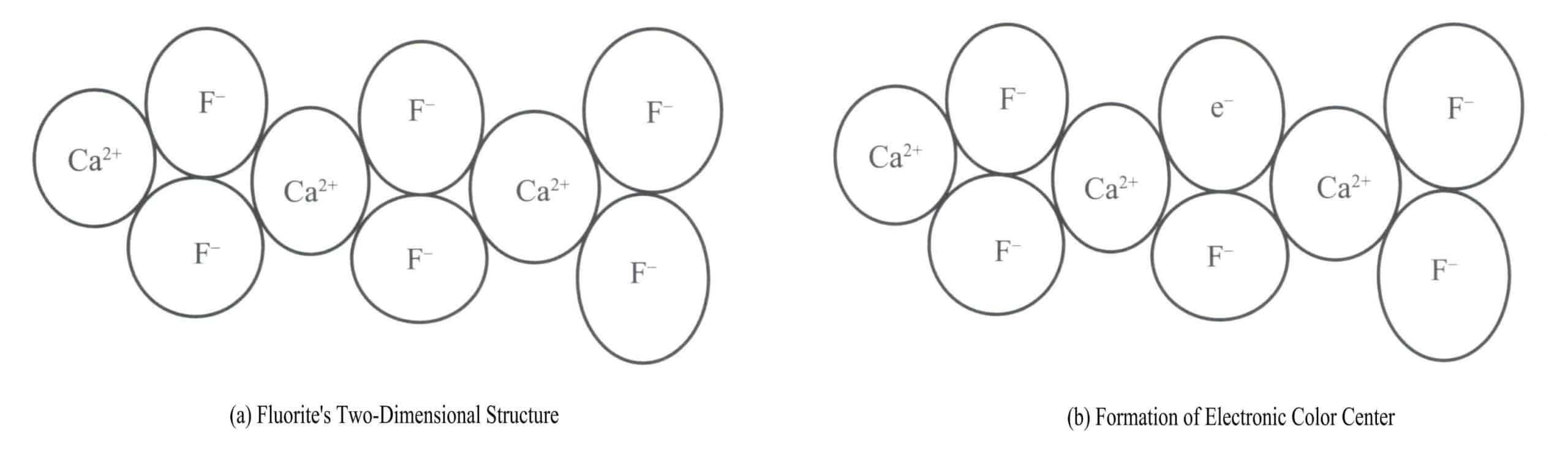
La fluorite viola è un colore prodotto dai centri di colore elettronici. La fluorite (CaF2) appartiene al sistema cristallino isometrico, con ogni Ca2+ collegato a due F– [Figura 3-17 (a)]. In alcuni casi, il valore F– nella fluorite può lasciare la sua posizione normale. In corrispondenza della posizione originale F– e per mantenere la neutralità elettrica del cristallo, un'entità carica negativamente deve occupare questo posto vacante. Un elettrone proveniente da un certo atomo del cristallo diventa l'entità carica negativamente che occupa questo posto vacante [Figura 3-17 (b)]. Si crea così un "centro di colore", noto come centro di colore elettronico. Nella fluorite, i centri di colore elettronici assorbono la luce visibile, producendo il viola.
(2) Centri del colore del foro (centri V)
Il centro di colore vacante si forma per fattori esterni, dove i cationi creano elettroni vacanti. Ciò significa che gli elettroni vengono espulsi dalle loro posizioni originali, lasciando dietro di sé un elettrone non appaiato. La ragione del colore è che, quando nel cristallo si formano dei cationi vacanti, per raggiungere l'equilibrio di carica, gli anioni vicini al catione vacante rilasciano elettroni sotto l'influenza dell'energia esterna, formando elettroni spaiati che assorbono la luce visibile e producono il colore. Ad esempio, nei diamanti e nei topazi blu irradiati, l'irradiazione fornisce energia per attivare gli elettroni, causando lo spostamento di ioni o atomi nel reticolo e formando così difetti strutturali e centri di colore dovuti all'irradiazione.
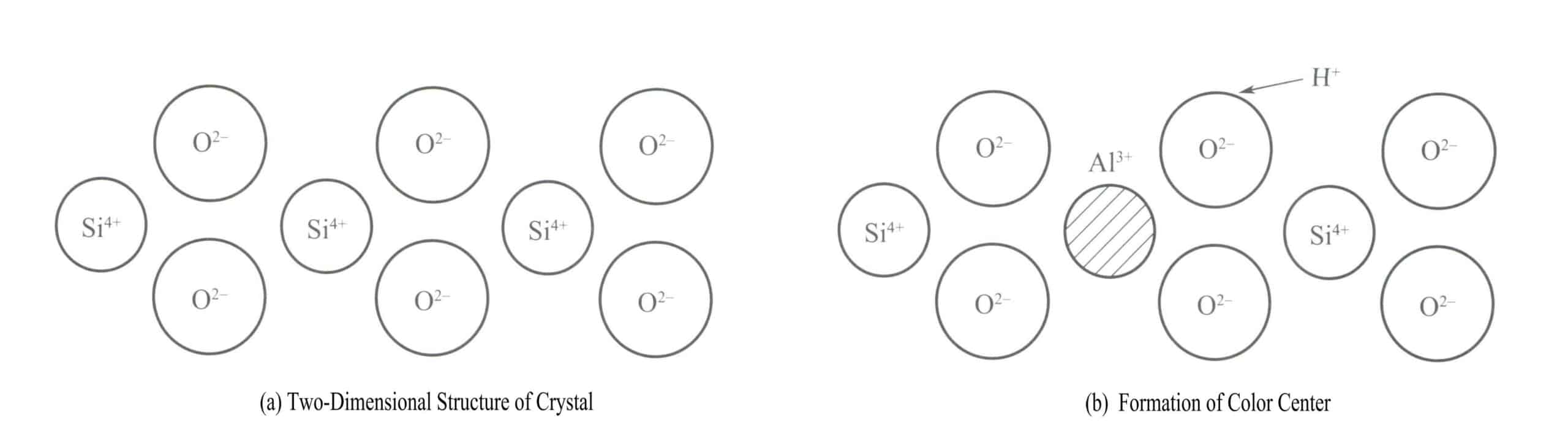
Un classico esempio di centro di colore in un cristallo è la colorazione del cristallo di fumo. La struttura cristallina del quarzo è un tetraedro silicio-ossigeno, con il silicio in uno stato a quattro coordinate, come mostrato nel diagramma strutturale bidimensionale della Figura 3-18(a). Ogni 10.000 Si4+ gli atomi di Al sono sostituiti da quelli di Al3+e quando Al3+ sostituisce il Si4+ nel cristallo, Al3+ deve essere circondato da alcuni ioni alcalini (come Na+ o H+) per mantenere la neutralità elettrica. Tuttavia, questi ioni si trovano spesso a una certa distanza da Al3+.
Quando il quarzo viene irradiato da raggi X, raggi γ e altre fonti di radiazioni, l'energia degli atomi di ossigeno adiacenti ad Al3+ aumenta, permettendo a uno degli elettroni della coppia di essere espulso dalla sua posizione normale. H+ catturerà questo elettrone per formare H . Le radiazioni ad alta energia fanno sì che l'O2- con più elettroni di valenza per rilasciare un elettrone, formando un [A1O4]4- e il centro di colore della vacazione [A1O4]4- Il cluster atomico assorbe la luce visibile per produrre il colore, formando il quarzo fumé.
[A1O4]5-→ [A1O4]4-+e– (3-1)
H+ +e–→ H (3-2)
H+ cattura gli elettroni per diventare H, che è incolore e non assorbe la luce visibile. Se l'intensità di irradiazione è elevata e la quantità di Al3+ nel cristallo, il quarzo può essere irradiato di nero. Poiché spesso c'è un posto vacante nella posizione in cui viene espulso un elettrone, questo tipo di centro di colore viene definito "centro di colore vacante".
Nel corso della storia geologica, il cristallo fumé naturale si forma per lo più a causa di radiazioni a basso dosaggio a lungo termine da materiali radioattivi. Il riscaldamento può eliminare il colore; quando questo cristallo fumé viene riscaldato a circa 400℃, gli elettroni espulsi tornano nella loro posizione originale, tutti gli elettroni si accoppiano e il quarzo diventa di nuovo incolore; se viene nuovamente irradiato, può diventare di nuovo fumé [Figura 3-18 (b)].
L'ametista ha gli stessi centri di colore per il posto vacante, ma la sua impurità è il ferro invece dell'alluminio. Quando l'impurità Fe 3+ sostituisce Si4+ nel quarzo, si verificano i seguenti cambiamenti quando viene irradiato con raggi ad alta energia:
[FeO4]5- → [FeO4]4- +e– (3-3)
H+ +e–→ H (3-4)
Simile al principio di formazione del cristallo di fumo, produce un colore viola dovuto alla formazione di [FeO4]4- centri di colore del foro dopo essere stata irradiata. Quando l'ametista viene riscaldata, diventa gialla, diventando citrina, e con un ulteriore riscaldamento si attenua fino a diventare incolore. In genere, la temperatura di riscaldamento è relativamente bassa, intorno ai 400℃. Il colore viola dell'ametista trattata termicamente può essere ripristinato irradiando nuovamente i centri di colore. Anche l'ametista sintetica viene sintetizzata in base a questo principio.
In alcune gemme, alcuni cluster di atomi di impurità possono anche formare centri di colore e mostrare il colore. Ad esempio, durante la crescita del berillo e sotto irradiazione radioattiva, può perdere un elettrone per diventare , formando una banda di assorbimento rosso-verde che produce un colore blu. Nei diamanti sono presenti molti centri di colore, la maggior parte dei quali è causata dalla formazione di vacuità o dislocazioni nella struttura in condizioni esterne, e i colori sono generalmente molto stabili.
La difficoltà di studiare il colore indotto dal centro del colore è relativamente alta e richiede diverse tecniche come la spettroscopia e la risonanza paramagnetica elettronica. Le ricerche precedenti mostrano che alcune caratteristiche tipiche del colore indotto dal centro del colore sono relativamente chiare. La Tabella 38 riassume i colori e le cause del colore indotto dal centro del colore nelle gemme comuni.
Tabella 3-8 Colori e cause del colore indotto dal centro nelle gemme comuni
| Tipi di pietre preziose | Colore | Causa |
|---|---|---|
| Diamante | Verde | Carbonio vacante GR1 colore centrale nel diamante |
| Giallo | Struttura mancante degli aggregati di diamante N3 | |
| Arancione | Natoms e difetti del centro colore H3, H4 | |
| Cristallo | Colore fumo | Posti vacanti generati da Al3+ sostituendo Si4+ , in relazione alle radiazioni |
| Giallo | Relativamente ad Al3+può essere generato anche per irraggiamento | |
| Viola | Fe3+ sostituisce il posto vacante creato da Si4+ | |
| Gemma di corindone | Giallo | Il colore è instabile, il motivo dei difetti strutturali è sconosciuto |
| Topazio | Blu | Il colore è stabile, il motivo dei difetti strutturali è sconosciuto |
| Giallo | Il colore è stabile, la causa dei difetti strutturali è sconosciuta | |
| Rosso bruno | Il colore è instabile, la causa dei difetti strutturali è sconosciuta | |
| Tormalina | Rosso | Correlato a Mn3+ può essere causata anche da radiazioni |
| Beryl | Blu | Relativo alla CO32- può essere causata anche dall'irradiazione |
| Fluorite | Viola | Elettronica e- sostituisce F- per produrre |
Il principio dei centri di colore viene utilizzato anche per migliorare il colore delle gemme naturali nell'ambito della valorizzazione delle gemme. La maggior parte dei metodi utilizza l'irradiazione per modificare il colore delle gemme. Alcuni centri di colore sono relativamente stabili, mentre alcune varietà di gemme svaniscono rapidamente, rendendo questo metodo di valorizzazione meno significativo per quelle gemme. La Tabella 3-9 elenca alcuni colori prodotti dai centri di colore, compresi i centri di colore stabili, i centri di colore instabili e i colori prodotti da altri possibili fattori.
Tabella 3-9 Colori prodotti dai centri colore
| Sostanzialmente stabile alla luce | Ametista, fluorite (rosso porpora), diamanti irradiati (verde, giallo, marrone, nero, blu, rosa); alcuni topazi naturali o irradiati (blu) |
|---|---|
| Svanisce rapidamente alla luce | Berillo verde al litio-cesio (blu intenso); alcuni topazi irradiati (marrone o marrone chiaro); zaffiro irradiato (giallo); sodalite viola irradiata con raggi ultravioletti (rosso porpora). |
| Altri colori che i centri colore possono produrre | Sylvine (blu); halite (blu o giallo); zircone (marrone); calcite (giallo); barite, celestina (blu); amazzonite (da blu a verde). |
















