Varför har ädelstenar flera färger?
Hemligheter om färgbildning och mätmetoder
Färgerna på ädelstenar är rika och varierade och har en unik charm som människor alltid har älskat. Kvaliteten på ädelstenar beror till stor del på deras färg. Färgen på en ädelsten är en viktig indikator vid utvärdering av ädelstenar, och de flesta optimeringsbehandlingar för ädelstenar innebär att färgen ändras eller förbättras. Att förstå orsakerna till ädelstenarnas färg är därför en avgörande förutsättning för optimeringsbehandling av ädelstenar. Endast genom att behärska hur ädelstenar får sin färg kan man avgöra om en ädelsten kan optimeras, vilket optimeringsschema som ska antas och vilken experimentell plan som ska upprättas. Det finns fem vanliga teorier om ädelstensfärgning: klassisk mineralogiteori, kristallfältsteori, molekylär orbitalteori, energibandteori och fysiska optiska effekter. Dessa teorier utgör färgningsteorierna för vanliga naturliga ädelstenar, och följande är en kort introduktion till dessa fem färgningsteorier.

Schematisk bild av de tre färgelementen
Innehållsförteckning
Avsnitt I Färg och mätning av ädelstenars färg
Färgerna på ädelstenar är rika och varierade, och att bestämma typerna av ädelstensfärger är avgörande för att utvärdera deras värde. Olika färgkvaliteter påverkar också värdet på ädelstenar; därför är en noggrann bedömning av färgerna på olika ädelstenar en grundläggande förutsättning för att bestämma deras värde. Vid utvärdering av färgade ädelstenar är färgen den viktigaste faktorn. Generellt sett gäller att ju mer attraktiv färg en ädelsten har, desto högre är dess värde. Ljusa, rika och intensiva färger är vanligtvis mer tilltalande än de som är för mörka eller för ljusa. Naturligtvis finns det undantag, till exempel diamanter, där ju vitare diamantens färg är, desto högre är dess värde.
1. Betydelsen av ädelstenarnas färger
Sedan urminnes tider har människor älskat ädelstenar för deras unika charm, särskilt de rika och färgstarka nyanserna av ädelstenar, såsom den duvblodsröda rubinen, den levande gröna smaragden och jade, som alla lämnar ett bestående intryck. Färg är en viktig indikator för att utvärdera kvaliteten på ädelstenar och spelar en avgörande roll för att bestämma deras kvalitet, med betydelse som främst återspeglas i följande tre aspekter.
(1) Färgen på ädelstensmineral är en viktig grund för utvärdering av ädelstenar
Färgen på en ädelsten är grundläggande för dess utvärdering och bestämmer dess värde. För diamanter kan t.ex. en färgskillnad på en grad leda till en prisskillnad på cirka 5%. Ju vitare diamanten är, desto högre klass har den; omvänt har diamanter med gula eller bruna toner lägre klass och priset på dem sjunker. Priserna på färgade diamanter varierar, och olika färgade diamanter har olika priser. Generellt sett kan dock priserna på sällsynta färgade diamanter mångdubblas. Andra färgade ädelstenar, såsom rubiner, safirer och smaragder, klassificeras också i olika kvaliteter baserat på färg, och värdet på ädelstenar i olika kvaliteter kan variera avsevärt.
(2) Optimeringsbehandlingen av ädelstenar innebär ofta att deras färg förbättras
Optimeringsbehandlingsmetoderna för ädelstenar innebär vanligtvis att ändra eller förbättra ädelstenarnas färg, så förbättringen av ädelstenar kan också kallas färgförändring av ädelstenar. När ädelstenens färg förbättras ändras också transparensen i enlighet därmed. Detta beror på att transparens är en egenskap relaterad till färg. Till exempel verkar blå safirer ha många ogenomskinliga svarta färger för blotta ögat, men transparent blå kan ses när den skärs i tunna skivor. Förbättringen av transparensen åtföljer ofta förbättringen av färgen. Därför är det bara genom att bestämma orsaken till ädelstenens färg som man kan fastställa metoderna för att förbättra ädelstenen. Att förstå orsaken till färgen är en förutsättning för att studera optimeringsbehandlingar för ädelstenar.
(3) Att studera orsakerna till ädelstensfärg ger en teoretisk grund för syntetiska ädelstenar och förbättring av ädelstenar.
Färgerna på ädelstenar som granat, malakit och olivin beror på deras inneboende komponenter, och dessa ädelstenar kan inte få sina färger ändrade med hjälp av konventionella optimeringsbehandlingsmetoder. De flesta ädelstensfärger beror på orenheter som orsakas av orenhetjoner, såsom i rubiner, safirer, smaragder, jade och agat. Baserat på orsakerna till ädelstensfärg, under förbättring, kan innehållet och valenstillståndet för vissa färgorsakande föroreningsjoner ändras för att ändra eller förbättra ädelstenens färg och därigenom förbättra kvaliteten på den förbättrade ädelstenen. Att studera orsakerna till ädelstensfärgen är därför den teoretiska grunden för att förbättra ädelstenar.
2. Fysiken bakom färger
(1) Färg och ljusvågor
Fotoner bär på ljusets energi, och när fotonerna når det mänskliga ögat skapar de känslan av färg. Färg är ögonens och nervsystemets uppfattning av ljus; det svar som genereras av de signaler som bildas på ögats näthinna stimulerar hjärnbarken. Färguppfattningen bygger på tre huvudkomponenter: ljuskällan, objektet och det mänskliga ögat. Att ändra en eller flera av dessa tre kommer att förändra uppfattningen av färg. Ädelstenar interagerar med ljus och fenomen som reflektion, refraktion, transmission, interferens och diffraktion som uppstår på ädelstenens yta resulterar i olika färger.
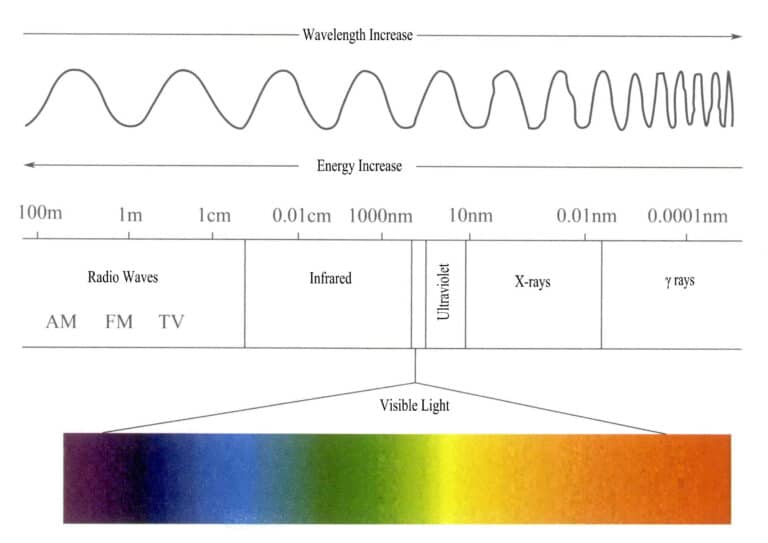
Energiområdet i det elektromagnetiska strålningsspektrumet är ganska stort och varierar från mycket långa radiovågsfotoner till mycket korta strålningsfotoner, med ett energiområde från mindre än en miljarddels elektronvolt till över hundra miljoner elektronvolt.
Det synliga ljus som det mänskliga ögat kan ta emot och uppfatta är en mycket liten del av det elektromagnetiska spektrumet, med ett våglängdsområde på 400-700 nm och en energi på ca 1,7-3,1eV. Om observationsförhållandena är tillräckligt bra kan området utökas till 380-760 nm (figur 3-1). Synligt ljus omfattar de färger vi ser, dvs. rött, orange, gult, grönt, cyan, blått, lila och olika andra färger. Olika våglängder av synligt ljus ger olika färger; den synliga ljusfärgen med den längsta våglängden och lägsta energin är röd, med ett våglängdsområde på 647-760 nm; det synliga ljuset med den kortaste våglängden och högsta energin är lila, med ett våglängdsområde på 400-425 nm. Andra färger på synligt ljus ligger mellan 425 och 647 nm. Våglängderna för de olika färgerna i det synliga ljuset och deras komplementfärger visas i tabell 3-1.
Tabell 3-1 Våglängder för olika färger av synligt ljus och deras komplementfärger
| Våglängd/nm | Spektral färg | Kompletterande |
|---|---|---|
| 400 ~ 425 | Lila | Gulgrön |
| 425 ~ 455 | Blå | Gul |
| 455 ~ 490 | Grönblå | Orange |
| 490 ~ 500 | Blågrön | Röd |
| 500 ~ 560 | Grön | Magenta |
| 560 ~ 580 | Gulgrön | Lila |
| 580 ~ 595 | Gul | Blå |
| 595 ~ 647 | Orange | Grönblå (cyan) |
| 647 ~ 760 | Röd | Grön |
Kärnan i ett föremåls färg är resultatet av föremålets selektiva absorption av olika våglängder av synligt ljus. Kärnan i ett föremåls selektiva absorption av olika våglängder av synligt ljus är absorptionen av fotoner av synligt ljus med olika energi. När naturligt ljus skiner på en ädelsten absorberar ädelstenen en del av ljuset och överför också en del av det. Den färg som ädelstenen uppvisar är komplementfärgen till det absorberade ljuset, vilket överensstämmer med färgen på det transmitterade ljuset (Figur 3-2). Till exempel, när vitt ljus passerar genom rubinen, får kromjonerna i rubinen energi genom att absorbera alla violetta och gröna fotoner samt de flesta blå fotonerna, medan de andra färgfotonerna, huvudsakligen röda, passerar genom rubinen, vilket gör att ädelstenen ser röd ut.
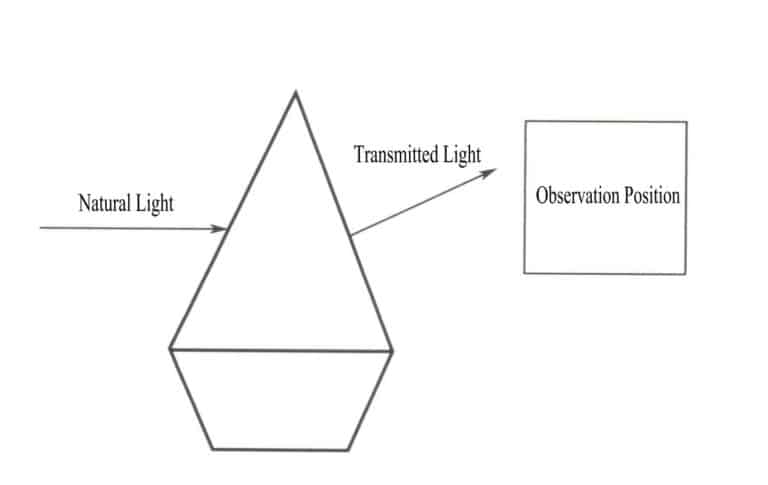
En enda våglängd av ljus ger inte den färg som ett föremål har, utan föremålets strålning är en blandning av fotoner med olika energi, där det energiband som har störst andel bestämmer föremålets färg. En enhetlig blandning av olika ljusfärger bildar vitt ljus. Generering av ädelstensfärger är resultatet av den selektiva absorptionen av fotoner med olika våglängder av synligt ljus. När vitt ljus passerar genom en ädelsten är det ljus som absorberas och överförs av ädelstenen en blandning, och den färg som presenteras av ädelstenen beror på den med den största andelen av det överförda ljuset. Till exempel, när det gäller en rubin, när vitt ljus skiner på rubinen, är ljuset som passerar övervägande rött med en liten mängd blålila. Därför ser rubiner ofta röda ut med en blålila nyans.
(2) Typer av ljuskällor och deras egenskaper
Färgen på ädelstenar har en viss subjektivitet, som är relaterad till observatörens miljö och påverkas mest av ljuskällan. Att observera färgen på ädelstenar under olika ljuskällor kan visa skillnader; till exempel verkar en alexandrit grön i solljus men röd under glödlampa. I allmänhet anser människor att den färg som ses i naturligt solljus är standarden, vanligtvis kallad vitt ljus.
De första transaktionerna på ädelstensmarknaden genomfördes vid specifika tidpunkter för att få en relativt exakt färg på ädelstenen. Exempelvis har ädelstensbutikerna i Ratnapura på Sri Lanka under många år haft öppet mellan kl. 10 och 12, eftersom ljuskällan under denna tid är närmast vitt ljus. Solljus och dagsljus är inte isotropa ljuskällor, och de relativa skillnaderna i strålningsmängd i olika våglängder mellan olika ljuskällor kan vara mycket stora på grund av olika observationsförhållanden. Figur 3-3 visar energifördelningskurvorna för fem vanliga ljuskällor, och energiskillnaderna mellan dessa ljuskällor är mycket stora.
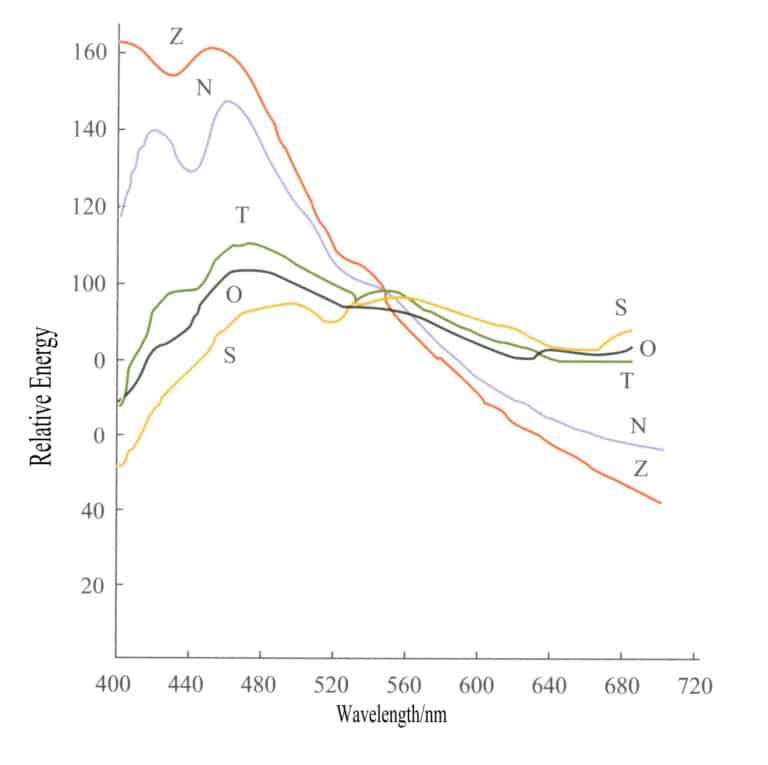
S - Direkt solljus; O - Belysning av mulet himmelsljus på horisontalplanet; T - Belysning av solljus och klar himmel på horisontalplanet; N - Ljus från den klara norra himlen; Z - Zenitljus;
Färgegenskaperna hos direkt solljus uttrycks ofta i termer av färgtemperatur (mätt i K). Samma färgtemperatur indikerar liknande färger på ljuskällor. De för närvarande erkända färgtemperaturerna för dagsljus är D6500K, D5500K och D7500K. Tre lampor är internationellt utpekade som standardljuskällor för färgmätningsarbete. SA motsvarar den genomsnittliga artificiella belysningen från en glödlampa av tungsten med en färgtemperatur på 2854 K ; SB representerar genomsnittligt solljus, med en färgtemperatur på 4900K; SC representerar genomsnittligt dagsljus, med en färgtemperatur på 6700K. Vid testning av ädelstenar används Sc-ljuskällan som standardljuskälla.
(3) Känslighet för ljus- och färgeffekter
Observationen av ädelstensfärger är subjektiv; förutom objektiva förhållanden är ädelstenens färg också relaterad till observatörens sensoriska uppfattning. Under samma ljuskälla har mänskliga ögon olika känslighet för olika färger, och olika människor har varierande känslighet för färger. Observationen av färg är subjektiv; för att uppnå objektivitet så mycket som möjligt måste färger karakteriseras och uttryckas relativt objektivt.
① Fotoreceptiv effekt:
Under normala förhållanden är våglängdsområdet för synliga ljuskällor som det mänskliga ögat kan observera 400-700 nm. Genom att förbättra observationsförhållandena kan känslighetsområdet utökas till 380-780 nm. Det mänskliga ögat har olika känslighet för ljusvågor med olika våglängder. För dagtidsseende är ögat mest känsligt för grönt ljus med en våglängd på 555 nm, medan den mest känsliga våglängden för skymningsseende skiftar till 507 nm. Trafikljusen på vägarna är utformade utifrån de färger som det mänskliga ögat är mest känsligt för.
② Färgupplevelse:
Färg är den känsla som orsakas av de olika spektrala komponenterna av strålningsenergi inom det synliga ljusområdet. En normal människas syn kan urskilja mer än 150 nyanser av rena spektralfärger. Även om det finns en en-till-en-korrespondens mellan ljusvågor och färger, är korrespondensen mellan färger och ljusvågor inte entydig; ofta kan en ljusfärg bildas genom kombinationen av två eller flera andra ljusfärger. De tre oberoende grundfärgerna är rött, grönt och blått, de s.k. primärfärgerna. Andra färger bildas genom att blanda två eller flera primärfärger i olika proportioner, och det mänskliga ögat är mycket känsligt för färger och kan urskilja många olika färger.
3. Tre element som representerar färg
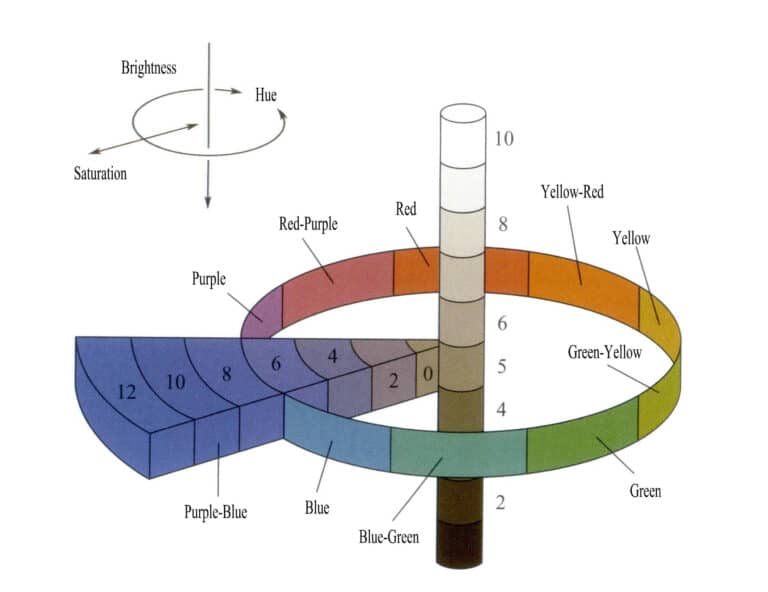
Färg beror på ädelstenarnas selektiva absorption av ljus och olika ädelstenar har olika färger. Nuvarande färgteori tyder på att färgegenskaper beror på ljusstyrka, nyans och mättnad (Figur 3-4). Typerna av ädelstensfärger kan bestämmas genom att beskriva de tre elementen i olika färger.

(1) Ljusstyrka
Ljusstyrka är graden av ljusstyrka som orsakas av ljus som verkar på det mänskliga ögat, med hänvisning till graden av ljusa och mörka färger, och kan också kallas luminans. Ljusstyrkan beror till stor del på ögats uppfattning av ljus- och mörknivåerna hos ljuskällan och objektets yta, vilket främst bestäms av ljusets intensitet. Ljusstyrkan beror på objektets belysningsnivå och reflektionsförmågan hos objektets yta.
Ljusstyrka kan förstås som ljusstyrkan hos en färg; olika färger har olika ljusstyrkor och alla färger uppvisar variationer i ljus och mörker. Ljusstyrka har två egenskaper: samma objekt kan uppvisa förändringar i ljusstyrka på grund av olika belysning, och olika färgade lampor med samma intensitet kan också ha olika ljusstyrka.
I avsaknad av färg är färgen med den högsta ljusstyrkan vit och färgen med den lägsta ljusstyrkan svart, med en gråskala mellan ljust och mörkt. I färg har varje grad av renhet sina ljushetsegenskaper. Till exempel har gult den högsta ljusstyrkan, medan lila har den lägsta. Grönt, rött, blått och orange har liknande ljushetsnivåer och representerar medelhög ljushet. Inom samma nyans finns det dessutom variationer i ljusstyrka från ljust till mörkt, t.ex. ljusgrönt, blekgrönt och smaragdgrönt i det gröna spektrumet.
(2) Hue
Nyans avser skillnaderna mellan olika färger och är den mest framträdande egenskapen hos färg. Färgtonen bestäms av de spektralkomponenter i ljuset som passerar genom ett föremål och når det mänskliga ögat efter att ha träffat det, beroende på våglängden hos det transmitterade ljuset. Ett föremåls nyans bestäms av spektrumet hos den infallande ljuskällan och det ljus som reflekteras eller transmitteras av föremålet självt.
Den så kallade nyansen avser det namn som mer exakt kan representera en viss färgkategori, till exempel rosenröd, orangegul, citrongul, koboltblå, purpurröd, smaragdgrön etc. Ur den fysiska optikens perspektiv bestäms olika nyanser av de spektrala komponenterna i det ljus som kommer in i det mänskliga ögat. För monokromatiskt ljus beror nyanserna helt på ljusets våglängd, medan de för ljus med blandade färger beror på de relativa mängderna av olika ljusvåglängder. Färgen på ett föremål bestäms av ljuskällans spektrala komponenter och egenskaperna hos det ljus som reflekteras (eller transmitteras) av föremålets yta. Den är relaterad till ljusets våglängd. En färg med en dominerande våglängd på 470 nm kallas t.ex. blå med en våglängd på 470 nm, vilket ofta ses som safirens blå färg.
(3) Mättnad
En färgs mättnad avser färgens renhet och livfullhet och anger andelen kromatiska komponenter som ingår i färgen. Ju större andel kromatiska komponenter, desto högre renhet har färgen; ju mindre andel kromatiska komponenter, desto lägre renhet har färgen. Mättnaden förändras när en färg blandas med svart, vitt eller andra färger. När andelen av den blandade färgen når en betydande nivå kommer originalfärgen att förlora sin ursprungliga glans för ögat, och den färg som ses blir den blandade färgens. Det betyder naturligtvis inte att den ursprungliga färgen inte längre finns, utan snarare att den ursprungliga färgen har assimilerats på grund av de många andra färger som blandats i, vilket gör den omärkbar för det mänskliga ögat.
De monokromatiska ljusen i det synliga spektrumet har den högsta mättnaden och är de mest levande. Monokromatiskt ljus anses vanligtvis vara 100/100 = 1, och när färgen bleknar minskar värdet gradvis, med ren vit som har noll mättnad. Om man tar rent blått bläck som exempel är mättnaden för rent blått bläck 1, och när det gradvis späds ut till helt färglöst blir mättnaden noll.
4. Mätning av ädelstenens färg
Det system som kvantitativt representerar färg kallas ett färgsystem. Det finns två vanliga typer av färgsystem: det ena är ett färgsystem som baseras på standardfärgprover för jämförelse, och det andra är en uppsättning färgstandardsystem som mäts med moderna färgmätinstrument.
(1) Färgsystem för standardfärgprover
Detta färgsystem består av olika "färgkort" gjorda av papper som är standardfärgprover som sammanställts i en bok. De jämförs med ädelstensprover för att välja det "färgkort" som matchar ädelstenens färg.
① Munsell färgsystem
Munsells färgsystem är ett av de tidigaste och mest klassiska systemen för färgåtergivning. Det används fortfarande av vissa organisationer idag. Det grundades 1905 av den amerikanske pedagogen och färgteoretikern Albert Munsell och har fått sitt namn direkt efter honom. Det är ett sätt att representera färger genom en färg-solidmodell. "Munsell Color Atlas", som publiceras av Optical Society of America (OSA), innehåller blanka och matta versioner.
Den glansiga versionen innehåller 1.450 färgprover, åtföljda av en uppsättning med 37 akromatiska prover; den matta versionen innehåller 1.150 färgprover och 32 akromatiska prover.
I Munsell Atlas representeras varje färg av en uppsättning symboler. Symbolerna ger indikatorer på lika avstånd för de tre elementen i färgåtergivningen: nyans, värde och kroma, representerade som HV/C = nyansvärde/kroma.
Färgtonerna delas in i fem primära toner: rött (R), gulrött (YR), gult (Y), gröngult (GY), grönt (G), blågrönt (BG), blått (B), purpurblått (PB), purpur (P) och rödlila (RP), samt fem mellantoner. Varje ton är vidare indelad i tio nivåer (1 till 10), där den femte nivån är den mellanliggande färgen för den tonen (Figur 3-5).
Value är indelat i 11 nivåer, där högre värden indikerar högre ljushet; det lägsta värdet är 0 (svart) och det högsta är 10 (vitt). Chroma är indelat i 12 nivåer. Hela färgatlasen innehåller 40 typer av nyansprover. Exempelvis representerar 5GY 8/7 en gulgrön färg med värdet 8 och mättnaden 7. Namnkonventionen för icke-färgserier (svart, vitt, grått) är NV/= neutralt ljushetsvärde; exempelvis indikerar en färg märkt N5/ en grå färg med ljushetsvärdet 5.
② DIN 6164 Färgsystem
Tysklands DIN 6164-manual är också ett viktigt färgsystem. Många gemologer i Europa och Storbritannien använder detta system. Detta färgsystem utvecklades baserat på Munsell-systemet.
Färgkortet DIN 6164 har 24 färger, där baksidan av varje färg är markerad med motsvarande Munsell-färgnotation. Representationen är i formatet nyans: mättnad: ljushet. Till exempel representerar 6:6:2 nyans 6 (röd), mättnad 6 (livlig) och ljushet 2 (ljus) på standardfärgkortet.
③ ISCC-NBS färgsystem
ISCC (Inter-Society Colour Council) grundades 1931 som en inhemsk färgsammanslutning i USA, och dess färgsystem syftar till att utveckla ett färgnamnssystem. Det samlar 18 nyanser på samma nyans- och ljushetspositioner i Munsell och DIN 6164.
ISCC-NBS (National Bureau of Standards) har mycket få färgprover i American National Standard-systemet men har samlat in några ovanliga prover. Strukturellt skiljer det sig också från Munsell-systemet, eftersom färger inte är ordnade enligt perceptuella ekvidistanta mätvärden. Det viktigaste bidraget från ISCC-NBS-systemet till färgvetenskapen är att det definierar färgnamn.
④ OSA:s färgstandard
OSA (Optical Society of America) har utarbetat en praktisk uppsättning färgkort med akrylglans, inklusive 558 färger, varav 424 färger utgör en uppsättning som kallas OSA-färgstandarden. Nackdelen med OSA-färgstandarden är att färgkorten är gjorda av papper eller plast, som skiljer sig i textur från ädelstenar, och färgkortens ytglans skiljer sig från det ljus som reflekteras av fasetterade ädelstenar, vilket kräver noggrann användning. På grund av blekning har de flesta färgkort en användningstid på 4 till 5 år.
(2) Kromatiska koordinater och kromatiskt diagram
① 1931 års CIE-XYZ färgrymdssystem
Detta färgrymdssystem baseras på RGB-systemet och använder matematiska metoder för att välja ut tre ideala primärfärger som ska ersätta de faktiska primärfärgerna. Med hjälp av virtuella primärfärger som axlar projiceras olika våglängder av synligt ljus. Värdena för primärfärgerna kallas tristimulusvärden. Detta system kräver att tristimulusvärdena inte är negativa och att y är lika med ljusflödet. Genom att använda x som horisontell axel och y som vertikal axel bildas kromatiska koordinater, varvid de kromatiska koordinatvärdena för varje monokromatiskt ljus projiceras för att erhålla det kromatiska diagrammet. Figur 3-6 är det kromatiska standarddiagrammet i (XYZ)-systemet som fastställdes internationellt 1931.
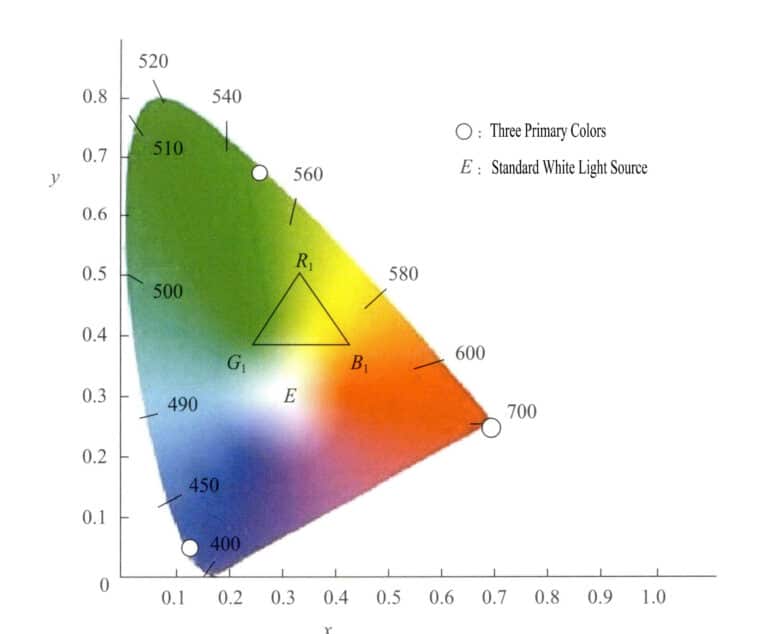
Det kromatiska diagrammet har följande egenskaper:
- Tristimulusvärdena för detta systems primärfärger är virtuella.
- Alla punkter som representerar spektralfärger faller på den tungformade kurvan som kallas spektralfärgen. Om man förbinder kurvans ändar med raka linjer finns alla faktiska färger inom det område som omges av den tungformade kurvan och de raka linjerna.
- Koordinatvärdet för punkt E vid x=0,333, y=0,333 representerar teoretiskt vitt. Olika vita ljuskällor har något olika spektralkomponenter. Det vanligt förekommande vita ljuset delas in i SA, SB, SC, SEoch så vidare.
- Färgernas kromatiska koordinater har högre mättnad ju närmare de ligger den spektrala färgbanan. Punkter på den spektrala färgbanan har den högsta mättnaden; den vita punkten har den lägsta mättnaden. En linje som dras från den vita punkten till de kromatiska koordinaterna för en färg, och som förlängs så att den skär den spektrala färgbanan, har punkter längs denna linje som har samma nyans.
- En grafisk metod kan användas för att härleda den sammansatta färgen av två valfria färger. Genom att mata in de två färgernas kromatiska koordinater i det kromatiska diagrammet måste den sammansatta färgen ligga på linjen som förbinder de två färgkoordinatpunkterna. Det projicerade avståndet till de två färgpunkterna är relaterat till intensiteten hos de två färgerna, vilket bestäms av centroidfördelningslagen.
- Punkterna på den raka linjen mellan ändpunkterna på den spektrala färgkurvan representerar inte spektrala färger utan snarare olika blandfärger som erhålls genom att blanda lila vid 380 nm och rött vid 780 nm i olika proportioner.
- Välj tre punkter inom spektrumets färgbana för att skapa en färg. Om du till exempel väljer R1, G1, B1 som de tre färgerna för matchning, så finns alla de olika färger som bildas av dessa tre nyanser i triangeln med hörn i de tre punkterna R1, G1, B1.
② Representation av dominerande våglängd och mättnad
I det kromatiska diagrammet kan färger inte bara representeras med kromatiska koordinater (x, y). En annan metod som föreslogs av Helmholtz är att representera dem med hjälp av den dominerande våglängden λd och mättnad (stimulusrenhet) Pe. λd och Pe är specifika värden som härleds från de kromatiska koordinaterna i diagrammet (Figur 3-7). Den dominerande våglängden representerar ungefär den färgkänsla som uppfattas av det mänskliga ögat.
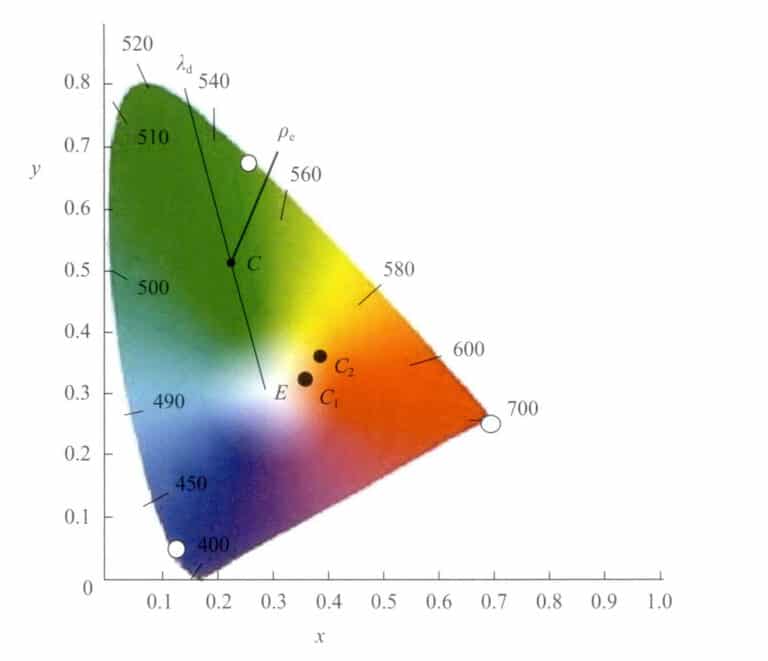
Låt positionen för denna punkt i kromatikdiagrammet vara c(x, y). Förbind punkten c med vita E och förläng den så att den skär spektrumbanan vid λd . Då är våglängdsnumret för punkten λd på spektrumbanan är den dominerande våglängden för denna ljusfärg.
Punkten C ligger på den linje som förbinder punkterna W och λd , som representerar mättnaden i denna färg. Punkt W är rent vit (E) eller en specifik vit ljuskälla. När de kromatiska koordinaterna för en viss färg gradvis rör sig i riktning mot den spektrala banan från den vita punkten W, ökar färgens mättnad gradvis tills den når den spektrala banan, med en maximal mättnad på 1.
Färgerna representeras med hjälp av dominerande våglängd och mättnad, vilket gör det enkelt att jämföra färgskillnader. De små färgskillnaderna, som representeras av de numeriska förändringarna i λd och ρekan visas.
För två färger, C1, C2, de kromatiska koordinaterna, den dominerande våglängden och mättnaden under samma belysning visas i tabell 3-2. Man kan se att den dominerande våglängden för färgen C1, C2 skiljer sig åt med 0,052 nm och mättnaden skiljer sig åt med 7%.
Tabell 3-2 Jämförelse av färgdata mellan C1 och C2
| Färgprojektionspunkt | X | y | λd | ρe |
|---|---|---|---|---|
| C1 | 0.368 | 0.416 | 0.592 | 0.35 |
| C2 | 0.392 | 0.355 | 0.540 | 0.28 |
5. Instrument för mätning av ädelstenars färg
(1) Spektrofotometer
Funktionsprincip: Eftersom den spektrala energifördelningen hos standardljuskällan i instrumentet är känd, kan tristimulusvärdena för ett objekt erhållas genom att mäta dess spektrala reflektans.
(2) Kolorimeter för Tristimulus-värde
Det är ett fotoelektriskt integrativt instrument som direkt mäter de tre stimulusvärdena för ett objekts färg. Det simulerar huvudsakligen standardobservatörens tre svar på färg genom en lämplig kombination av filter och fotoelektriska omvandlare.
För närvarande förlitar sig bedömningen av ädelstensfärg huvudsakligen på observation av mänskliga ögon. Till exempel påverkas smaragder, rubiner och diamanter av miljöfaktorer, vilket leder till låg noggrannhet i instrumentmätningar; därför är tillämpningen av instrumentfärgmätning vid identifiering av ädelstenar relativt sällsynt.
Avsnitt II Teoretiskt ursprung för ädelstenars mineralfärg
Ädelstensmineral finns i olika färger, men orsakerna till deras färgning skiljer sig också åt. Enligt klassisk mineralogiteori kan ursprunget till ädelstensmineralens färg klassificeras i idiokromatisk färg, allokromatisk färg och pseudofärg.
1. Klassificering av klassisk mineralogi Färgursprungsteori
Den klassiska teorin om mineralogi är den mest grundläggande teorin för att studera färgerna på ädelmineral. Beroende på om mineralets färg beror på själva mineralet kan den delas in i tre kategorier: idiokromatiskt färgad, allokromatiskt färgad och pseudofärgad.
(1) Idiokromatisk-färgad
Färgen på en ädelsten bildas av de inneboende kemiska komponenterna i mineralet som den består av, känd som idiokromatisk-färgad. Sådana ädelstenar kallas idiokromatiskt färgade ädelstenar. Deras inneboende komponenter orsakar den färg som produceras av idiokromatiskt färgade ädelstenar; därför har de god färgstabilitet och ändras inte lätt. Till exempel är den kemiska sammansättningen av turkosCuAl6(PO4)4(OH)8-5H2O, och den blå eller blågröna färg som den uppvisar orsakas av Cu2+; den kemiska sammansättningen av azurit är 2CuCO3 - Cu(OH)2, och Cu2+ orsakar också dess blå färg"; olivinens gröna färg produceras av järnjoner i dess kemiska sammansättning (Figur 3-8).

Det finns inte många typer av enfärgade ädelstenar i naturliga ädelmineral, och de viktigaste sorterna är turkos, malakit, azurit, olivin, granat och rhodochrosit. De vanliga färgerna, färgämnena och kemiska sammansättningarna hos enfärgade ädelstenar visas i tabell 3-3.
Tabell 3-3 Vanliga färgämnen, kemisk sammansättning och färger hos färgade ädelstenar
| Färgläggning av element | Ädelstenens namn | Kemisk sammansättning | Färg |
|---|---|---|---|
| Järn | Olivine | (Mg, Fe)2 (SiO4) | Grön |
| Almandin | Fe3Al2 (SiO4)3 | Röd | |
| Krom | Uvarovit | Ca3Cr2 (SiO4)3 | Grön |
| Cuprum | Malakit | Cu2Co3(OH)2 | Grön |
| Krysokolla | (CuAl)2H2Si2O5(OH)4 - nH2O | Grön - Blå | |
| Turkos | CUAl6(PO4)4(OH)8.5H2O | Himmelblå - Grön | |
| Azurit | 2CuCO3 - Cu(OH)2 | Blå | |
| Mangan | Spessartine-Garnet | Mn3Al2(SiO4)3 | Orange |
| Rhodokrosit | MnCO3 | Rosa - Röd | |
| Rhodonit | (Mn, Ca, Fe) - 5(Si5O15) | Rosa - Röd |
Copywrite @ Sobling.smycken - Anpassad smyckestillverkare, OEM och ODM smyckesfabrik
Vissa färgade ädelstenar kan ändra färg under vissa förhållanden. Till exempel kan turkos och malakit ändra färg när de utsätts för höga temperaturer på grund av avdunstning av vattenmolekyler i deras sammansättning; rhodochrosite, en karbonat ädelsten, kan sönderdelas när den stöter på syror (såsom saltsyra eller svavelsyra), och dess färg kommer också att förändras i enlighet därmed.
(2) Allokromatisk-färged
Färgen på en ädelsten orsakas av spår eller mindre föroreningselement utanför den inneboende kemiska sammansättningen av de ingående mineralerna, känd som allokromatisk färg. Sådana ädelstenar benämns allokromatiskt färgade ädelstenar.
I ädelstensmineraler finns det många sorter av ädelstenar med olika färger. När det inte finns några föroreningar i ädelstenens kemiska sammansättning är den färglös och transparent; när den innehåller olika färgelementföroreningar kan den producera olika färger.
När ren korund är färglös blir den rubin när den innehåller en liten mängd kromjoner; när den innehåller en liten mängd järn och titan blir den till blå eller gröna ädelstenar. Liknande ädelstenar inkluderar smaragd, spinell, turmalin, jadeit, kalcedon, nefrit etc. De vanliga färgämnena, kemiska sammansättningarna och allokromatiskt färgade ädelstenar visas i tabell 3-4.
Tabell 3-4 Vanliga färgämnen, kemisk sammansättning och allokromatiskt färgade ädelstenar
| Färgläggning av element | Ädelstenens namn | Kemisk sammansättning | Färg |
|---|---|---|---|
| Krom | Ruby | Al2O3 | Röd |
| Smaragd | Be3Al2(Si6O18) | Grön | |
| Alexandrit | BeAl2O4 | Röd-Grön | |
| Spinell | MgAl2O4 | Röd | |
| Kalcedon | SiO2 | Grön | |
| Järn | Akvamarin | Be3Al2Si6O18 | Blå |
| Turmalin | (Na, K, Ca) (Al, Fe3+, Cr)6(BO3)3Si6O18(OH)4 | Grön-brun | |
| Spinell | MgAl2O4 | Gul | |
| Nefrit | Ca2(Mg, Fe2+) 5 (Si4O11) 2 (OH)2 | Grön | |
| Vanadin | Tanzanit | Ca2Al3(SiO4)3(OH) | Lila-blå |
| Grön beryll | Be3Al2Si6O18 | Grön | |
| Titan | Benitoit | BaTiSi3O9 | Blå |
| Safir | Al2O3 | Blå | |
| Mangan | Röd beryll | Be3Al2Si6O18 | Röd |
| Rhodokrosit | MnCO3 | Rosa | |
| Kobolt | Naturlig spinell | MgAl2O4 | Blå |
| Syntetisk spinell | MgAl2O4 | Blå | |
| Nickling | Grön kalcedon | SiO2 | Grön |
(3) Pseudo-färged
Färgerna som produceras av pseudofärger är inte relaterade till den kemiska sammansättningen av ädelstensmineraler. Ändå orsakas de av strukturella och kompositionella förändringar till följd av mekaniska blandningar eller bildandet av mineraler. Pseudofärger är inte färgerna på själva mineralerna utan snarare färger som orsakas av speciella strukturer som bildas av yttre påverkan. Till exempel vackra interferensfärger som uppstår genom interferens mellan reflekterat och infallande ljus, såsom labradorits fluorescenseffekt och opals färgspel. Färgning som orsakas av inneslutningar faller också under pseudofärger, t.ex. svarta diamanter, som beror på många svarta ogenomskinliga grafitinneslutningar i diamanten.
2. Färgframkallande joner i ädelstenar
De kemiska element som producerar ädelstensfärger kan vara huvud- eller biokomponenter. Övergångsmetaller, särskilt övergångsmetallerna titan, vanadin, krom, mangan, järn, kobolt, nickel och koppar från den 4:e perioden, kallas ofta för kromoforer eller färgjoner. Dessa åtta grundämnen är placerade i följd i det periodiska systemet och har atomnummer från 22 (Ti) till 29 (Cu). De grundläggande egenskaperna hos dessa grundämnen visas i tabell 3-5.
Tabell 3-5 Grundläggande egenskaper för åtta övergångselement
| Elementets namn | Titan | Vanadin | Krom | Mangan | Järn | Kobolt | Nickel | Koppar |
|---|---|---|---|---|---|---|---|---|
| Symbol för element | Ti | V | Cr | Mn | Fe | Co | Ni | Cu |
| Atomiskt nummer | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| Huvudsakliga oxidationstal | +2, +3, +4 | +2, +3, +4, +5 | +2, +3, +6 | +2, +3, +4, +6 | +2, +3, +6 | +2, +3 | +2, +3 | +1, +2 |
| Konfiguration av valenselektroner | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 |
Dessa åtta övergångsmetallelement har följande egenskaper:
① Valenelektronerna fylls i d-orbitalerna i det näst sista skalet i följd, och den allmänna formeln för valenselektronkonfigurationen för atomer av övergångselement är (n-1)d1-10nS1-2, så dessa element kallas också d-blockelement.
② I övergångsmetaller, eftersom d-banorna i det näst sista skalet är anslutna till de yttersta s-banorna, och d-banorna ännu inte har nått en stabil struktur, kan både s-elektroner och d-elektroner delta i bindning delvis eller helt, vilket resulterar i en serie variabla oxidationstal för övergångsmetaller, med olika oxider som presenterar olika färger i ädelstenar.
③ Joner har i allmänhet färg eftersom det finns oparade enstaka elektroner i d-bitarna och energinivåerna för dessa elektroner i det exciterade tillståndet och grundtillståndet ligger relativt nära varandra, vilket gör att energi från synligt ljus kan excitera dem. Olika excitationsförhållanden kan också orsaka att ädelstenar uppvisar olika färger.
Om spinnelektronerna i jonen alla är parade, t.ex. joner med en valenselektronkonfiguration av d0, d10, d10s2befinner sig elektronerna i ett stabilt tillstånd och är inte lätt exciterade, vilket resulterar i att jonen inte har någon färg; således är C+, Cr6+ och andra har ingen färg och kan inte producera färg i ädelstenar.
Dessa åtta övergångsmetallelement utgör färgbildningen i vanliga naturfärgade ädelstenar. Olika kromoforer ger olika färger i olika ädelstenar, och samma kromofor kan också ge olika färger. Vanliga naturliga ädelstenar och kromoforer visas i tabell 3-6.
Tabell 3-6 Färger som presenteras av övergångsmetalljoner i vanliga naturliga ädelstenar och ädelstenssorter
| Kromofor | Vanliga färger | Sorter av ädelstenar |
|---|---|---|
| Titan (Ti)-jon | Blå | Safir, benitoit, topas |
| Vanadium (V)-jon | Grön | Syntetisk färgförändring korund, essonit, smaragd |
| Krom (Cr)-jon | Röd, grön | Rubin, korund, smaragd, pyrope, jade |
| Mangan (Mn)-jon | Rosa, Röd | Spessartin, Rhodolit, Röd beryll |
| Järn (Fe)-jon | Blå, grön, gul | Safir, olivin, akvamarin, turmalin, spinell |
| Kobolt (Co)-jon | Blå | Syntetisk spinell, koboltfärgad staurolit |
| Nickel (Ni)-jon | Grön | Grön kalcedon |
| Koppar (Cu)-jon | Blå, blågrön | Malakit, turkos, azurit |
Olika kromoforjoner producerar olika färger i ädelstenar, vilket resulterar i absorptionsspektra med distinkta egenskaper. För vanliga kromoforjoner har absorptionsspektra typisk betydelse för identifiering.
(1) Absorptionsspektrumet för kromjoner
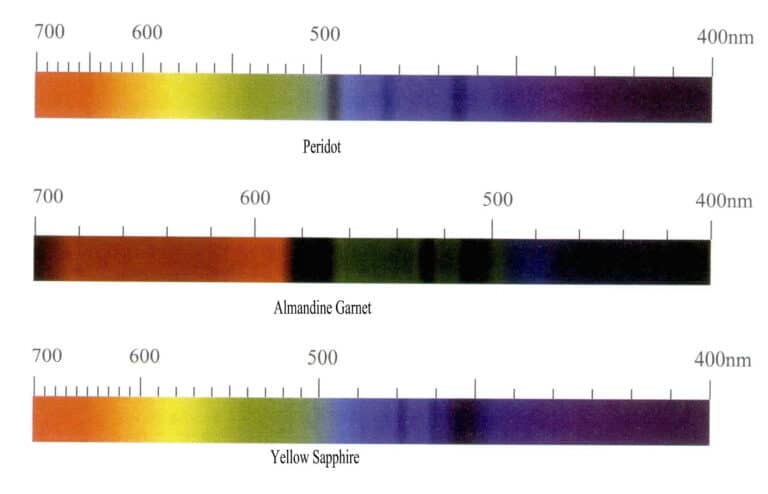
Absorptionsspektrumet för kromjoner kännetecknas huvudsakligen av många smala absorptionslinjer i den röda regionen, med de två starkaste belägna i den djupa röda regionen och ytterligare två i den orange regionen. Den gulgröna regionen har ett brett absorptionsband, och bredden, positionen och intensiteten är relaterade till djupet på ädelstenens färg. Det kan finnas flera smala band i den blå regionen, medan den lila regionen är helt absorberad. Kromjoner producerar främst röda och gröna färger, som varierar i olika ädelstenar, och absorptionsspektra visar vissa skillnader. Till exempel har rubiner tre absorptionslinjer i den röda regionen, ett brett absorptionsband i den gulgröna regionen, tre absorptionslinjer i den blå regionen och full absorption i den lila regionen; smaragder har absorptionslinjer i den röda regionen, ett svagt absorptionsband i den orange-gula regionen, svaga absorptionslinjer i den blå regionen och full absorption i den lila regionen; och alexandrit har absorptionslinjer i den röda regionen, ett absorptionsband i den gulgröna regionen, en absorptionslinje i den blå regionen och full absorption i den lila regionen. Absorptionsspektra för dessa tre ädelstenar visas i figur 3-9.

(2) Egenskaper hos järnjonens absorptionsspektrum
Järnjoner producerar olika färger i olika ädelstenar och har en stark färgningseffekt, men absorptionsspektrumet för järnjoner varierar kraftigt. När ädelstenen är grön producerar den en absorption av röd zon, och när den är röd producerar den en absorptionsfunktion som domineras av den blå zonen, med den huvudsakliga karakteristiska absorptionslinjen belägen i de gröna och blå zonerna. Exempelvis är järnjoner i olivin olivgröna, med ett absorptionsspektrum som huvudsakligen visar tre smala absorptionsband i den blå zonen vid 453 nm, 473 nm och 493 nm; röd almandin har ett typiskt järnabsorptionsspektrum med tre starka smala absorptionsband vid 504 nm, 520 nm och 573 nm i den gulgröna zonen, som i branschen brukar kallas "järnfönstret". Dessutom finns det svaga absorptionssmala band vid 423nm, 460nm, 610nm och 680~690nm; absorptionsspektrumet för gul safir har tre smala absorptionsband i den blå regionen vid 450nm, 460nm, 470nm.(Figur 3-10).
(3) Absorptionsspektrumegenskaper för manganjoner
Manganjoner bildar huvudsakligen rosa, orange och röda i ädelstenar, med absorptionsspektrumet som främst visar stark absorption i den violetta regionen, sträcker sig in i den ultravioletta regionen och viss absorption i den blå regionen. Till exempel har absorptionsspektrumegenskaperna hos rosa rhodochrosite tre absorptionsband vid 410nm, 450nm, 540nm; absorptionsspektrumlinjerna för spessartin har huvudsakligen 410nm, 420nm, 430nm tre absorptionsband och absorptionslinjer vid 460nm, 480nm och 520nm. Ibland kan det finnas 504nm, 573nm två absorptionslinjer (Figur 3-11).

(4) Absorptionsspektrumegenskaper för koboltjoner
Koboltjoner har en stark färgningseffekt och uppträder vanligtvis i en ljusblå färg i ädelstenar, med absorptionsspektrumet som huvudsakligen visar tre starka och breda absorptionsband i den gulgröna regionen. På grund av den låga förekomsten av kobolt i jordskorpan finns det mycket få naturliga ädelstenar som är färgade av koboltjoner. Absorptionsspektrumet för koboltjoner indikerar också syntetiska ädelstenar, såsom syntetisk blå spinell och koboltglas. Syntetisk blå spinell har tre starka absorptionsband i de gulgröna och orange-gula regionerna, med det gröna absorptionsbandet som det smalaste; absorptionslinjerna för koboltglas har huvudsakligen tre starka absorptionsband i de gulgröna och orange-gula regionerna, med det gula absorptionsbandet som det smalaste (Figur 3-12).

3. Sällsynta jordartsmetaller - färgläggning
Forskning om påverkan av spår av sällsynta jordartsmetaller på färgen på ädelstenar blir alltmer djupgående. Färgerna på sällsynta jordartsmetaller är mer levande och deras fysikalisk-kemiska egenskaper är också mycket stabila. Sällsynta jordartsmetaller som apatit och fluorit kan också färga naturliga ädelstenar. Olika sällsynta jordartsmetaller kan tillsättas syntetiska och optimalt behandlade ädelstenar för att få fram olikfärgade ädelstenar, t.ex. gult från cerium och blått från neodym.
De sällsynta jordartsmetaller som färgar ädelstenar är huvudsakligen lantanider och aktinider i det periodiska systemet för kemiska element och de färger de kan ge upphov till visas i tabell 3-7.
Tabell 3-7 Sällsynta jordartsmetaller och deras färger i vanliga ädelstenar
| Symbol för element | La | Ce | Nd | Pr | Dy | Sm | Er | Tm | U |
|---|---|---|---|---|---|---|---|---|---|
| Fullständigt namn | Lanthanum | Cerium | Neodym | Praseodymium | Dysprosium | Samarium | Erbium | Thulium | Uranium |
| Färg | Färglös | Gul | Blå | Grön | Ljusgul | Ljusgul | Rosa | Ljusgrön | Silvervit |
Sällsynta jordartsmetaller har karakteristiska absorptionsspektra, som ofta bildar unika fina linjer. Exempelvis innehåller gul apatit ofta det sällsynta jordartsmetallet Ce, med karakteristiska fina absorptionslinjer i det gula området. Uran ger dock inte en ljusgul färg, utan kan ge upphov till distinkta absorptionsspektrallinjer. Till exempel kan mer än tio absorptionslinjer uppträda i grön zirkon i olika färgzoner (figur 3-13).

Avsnitt III Färger framkallade av kristalldefekter och färgcentra
I naturen delas mineraler in i kristaller och icke-kristaller baserat på olika grader av kristallisering. De flesta ädelstenar, som rubiner, safirer, diamanter, smaragder och kvarts, är kristaller; vissa organiska ädelstenar, som bärnsten och korall, är icke-kristallina. Kristallstrukturer har en gitterliknande struktur, där de inre partiklarna (atomer, joner eller molekyler) är ordnade i ett regelbundet periodiskt mönster i det tredimensionella rummet, och kristaller kan spontant bilda polyedriska former; icke-kristaller är amorfa kroppar med icke-gitterstrukturer som inte kan bilda polyedriska former, t.ex. glas, kolofonium och harts.
Det mest typiska exemplet på skillnaden mellan kristaller och amorfa fasta ämnen är kvarts och glas. Naturlig kvarts bildas av smält material SiO2 i magma som svalnar i hålrum i jordskorpan. Det yttre skiktet på vanliga kvartssfärer är agat, som inte visar kristallformen, medan det inre skiktet visar kvartsens kristallform. De viktigaste kemiska komponenterna i både glas och kvarts är SiO2kvarts är en kristall med kisel- och syrejoner ordnade på ett ordnat sätt, medan glas är ett amorft fast ämne med kisel- och syrejoner ordnade på ett kaotiskt sätt, utan regelbundenhet, som visas i figur 3-14.
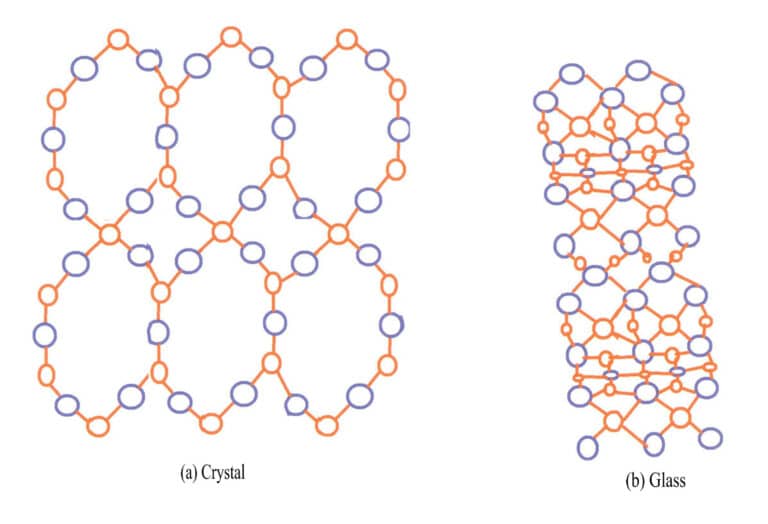
De flesta ädelstenskristaller är färgade på grund av orenhetjoner, till exempel rubiner, smaragder och turmalin. Vissa ädelstenar, även om de saknar kromoforjoner, är färgade på grund av defekter i deras kristallstruktur. Naturliga ädelstenar som produceras i naturen kan ändra färg på grund av yttre förhållanden, t.ex. bestrålning och jonisering, som förändrar kristallstrukturen. Det vanligaste exemplet är rökig kvarts, som utvecklar färg på grund av bildandet av färgcentra från strålningsinducerade vakanser. Artificiellt bestrålad rökkvarts har en liknande bildningsprincip som naturlig rökkvarts, förutom att artificiell strålning skapar färg snabbt.
1. Kristalldefekter och typer
Det fenomen där partikelarrangemanget avviker från reglerna för gitterstrukturen (partiklar genomgår periodisk translationsrepetition i tredimensionellt utrymme) inom ett lokalt område av ädelstenskristallstrukturen kallas en gitterdefekt. Orsakerna är relaterade till de termiska vibrationerna hos partiklar inom ädelstenskristallen, yttre stress, hög temperatur och tryck, bestrålning, diffusion, jonimplantation och andra förhållanden.
Till exempel kristalliserades diamanter i den övre mantelns högtemperatur- och högtrycksmiljö när de snabbt transporterades till nära jordens yta av värdmagma (kimberlit eller lamproit), den snabba förändringen i temperatur- och tryckförhållanden och de ömsesidiga kollisionerna mellan kristallerna och omgivande bergarter kan lätt leda till lokala förändringar i strukturen hos de inträngande diamantkristallerna, vilket resulterar i gitterdefekter som ändrar färgen på ursprungligen färglösa diamanter och bildar brungula, bruna och rosa diamanter.
Förekomsten av kristalldefekter har en betydande inverkan på kristallernas egenskaper. I verkligheten har kristaller mer eller mindre defekter. En måttlig mängd av vissa punktdefekter kan kraftigt förbättra halvledarmaterialens ledningsförmåga och luminescerande materials luminescens, vilket spelar en fördelaktig roll. Däremot kan defekter som dislokationer göra material benägna att spricka, vilket minskar draghållfastheten hos kristaller med nästan inga gitterdefekter till en bråkdel av den.
I en idealiskt perfekt kristall är atomerna strikt ordnade i ett regelbundet, periodiskt gitter på specifika punkter i rummet. Men under den faktiska tillväxten och bildandet av kristaller, på grund av påverkan från tillväxtmiljöer som temperatur, tryck och mediekomponentkoncentration, kan kristallmorfologin efter tillväxt ibland avvika från den ideala kristallstrukturen. Varje avvikelse från den ideala kristallstrukturen kan kallas en kristalldefekt. Kristalldefekter påverkar avsevärt kristallernas fysiska och kemiska egenskaper, och många discipliner är relaterade till kristalldefekter, såsom jonisk dopning inom materialvetenskap. Färgen på ädelstenar är till stor del relaterad till kristalldefekterna i dem. Detta är en av orsakerna till färg i ädelstenar-färgcentra.
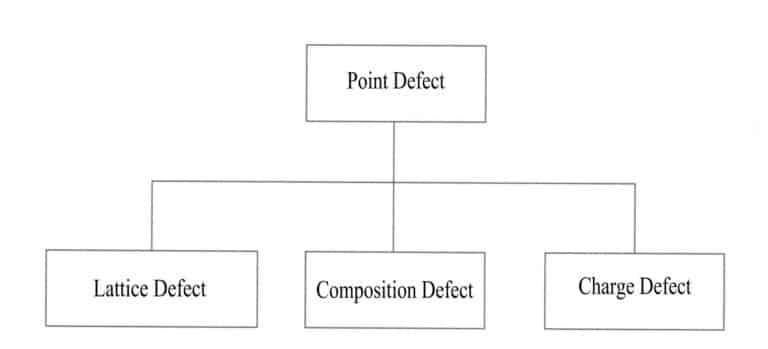
Det finns många olika typer av kristallstrukturdefekter, som kan delas in i fyra kategorier baserat på hur de fördelar sig i det tredimensionella rummet: punktdefekter, linjedefekter, ytdefekter och volymdefekter.
(1) Punktfel
Andra atomer ersätter vissa atomer i en idealisk kristall, vissa dopas in eller vakanser skapas. Vissa atomer i kristallen ersätts eller saknas på grund av externa atomer, och dessa förändringar stör det periodiska arrangemanget av kristallens regelbundna gitter, vilket orsakar förändringar i partiklarnas potentialfält och resulterar i att kristallstrukturen är ofullständig, begränsad till vissa positioner, vilket endast påverkar ett fåtal närliggande atomer. Punktdefekters inverkan på kristallen är minimal och vanliga typer av punktdefekter är gitterpositionsdefekter, sammansättningsdefekter och laddningsdefekter (figur 3-15).
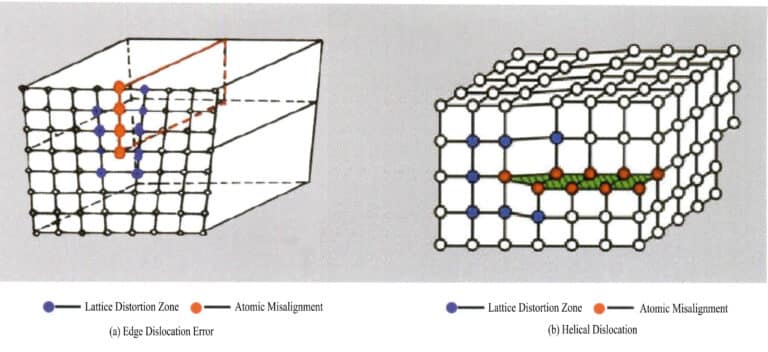
(2) Linjefel
Linjedefekter är mycket små i storlek i två riktningar och sträcker sig huvudsakligen längre i en annan riktning. De är också kända som endimensionella defekter och består främst av olika dislokationer. Dislokationer kan ses som en produkt av lokal gitterglidning längs ett visst atomplan. Glidningen tränger inte igenom hela gitteret; kristalldefekten slutar inom gitteret, vilket orsakar ett oordnat arrangemang av partiklar vid gränsen mellan de glidande och oglidande delarna av gitteret, känd som dislokation. Denna gräns, skärningslinjen mellan de glidande och oglidande områdena, kallas dislokationslinjen. Det finns två grundläggande typer av dislokationer: när kristallen utsätts för tryckkrafter bildar partikelglidplanet en dislokationslinje med det oglidna planet, och dislokationslinjen är vinkelrät mot glidriktningen, känd som kantdislokation, även kallad kildislokation; på grund av skjuvspänning sker glidning mellan plan, och de korsande dislokationslinjerna i den glidande delen av kristallen är parallella med glidriktningen, kallad skruvdislokation (Figur 3-16).
(3) Ytdefekter
Den enklaste ytdefekten är staplingsfelet, som delas in i intrinsiska staplingsfel (där ett kristallplan tas bort) och extrinsiska staplingsfel (där ett atomlager förs in i kristallen). Dessa defekter uppstår inom ett intervall på några få atomavstånd på vardera sidan om ett visst plan längs gitteret eller mellan korn. De omfattar huvudsakligen staplingsfel och gränsytor inom och mellan kristaller, t.ex. korngränser med små vinklar, domänväggar samt tvilling- och intergranulära gränser.
(4) Volymfel
Med volymdefekter avses defekter som i varierande grad finns i alla tre riktningarna, dvs. tredimensionella defekter som t.ex. inbäddade sprickor, nätstrukturer, familjestrukturer, tvillingar och olika ädelstensinneslutningar.
2. Färgcentra i ädelstenar
Color centers are a special case of lattice defects, generally referring to lattice defects in gemstones that can selectively absorb visible light energy and produce color, belonging to the most typical structural color types. In some cases, the unpaired electrons that produce color can also appear in non-transition element ions or in crystal defects formed due to a lack of electrons, which is what color centers are. Point defects in ionic crystals can cause the absorption of visible light, resulting in originally transparent crystals appearing colored; these types of point defects that can absorb visible light are usually referred to as color centers. Many types of natural gemstones produce color from color centers, such as purple fluorite, smoky crystal, and green diamonds.
In the optimization treatment process of gemstones, some natural and artificial gemstones can also have color centers generated by radiation, such as blue, yellow, red, green diamonds, and blue topaz that change color due to radiation, and blue topaz, among which some colors are relatively stable and only disappear when heated; some colors are unstable and may fade even at room temperature. This type of color-causing color center is closely related to the crystal structure of the gemstone, such as green diamonds, where the cause of color is the presence of vacancies in the crystal structure, but this structural defect can also be removed by irradiation, turning the diamond colorless. The common types of color centers in gemstones are “electron color centers” and “hole color centers.”
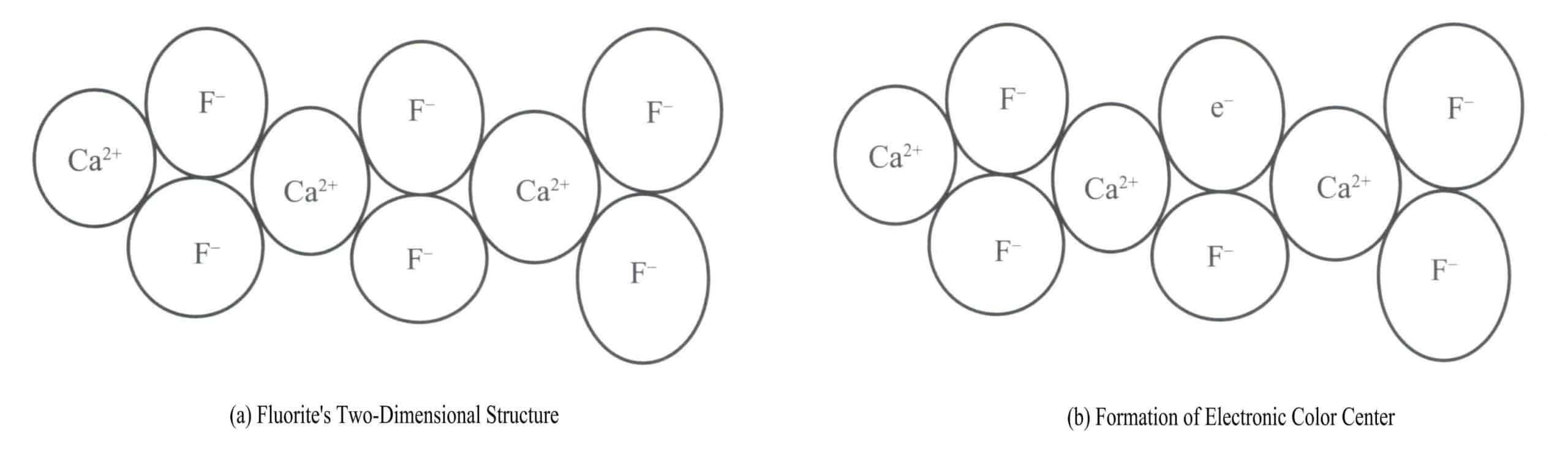
(1) Electron color center (F center)
Electron color centers are color centers formed when electrons exist in vacancies of crystal defects caused by anionic vacancies in the gemstone’s crystal structure. When the anion is absent, the vacancy becomes a positively charged electron trap that traps electrons. If a vacancy captures an electron and binds it to that vacancy, the electron becomes excited and selectively absorbs a certain wavelength of energy to become colored. Therefore, an electron color center consists of an anionic vacancy and an electron bound by the electric field of that vacancy.
Purple fluorite is a color produced by electronic color centers. Fluorite (CaF2) belongs to the isometric crystal system, with each Ca2+ connected to two F– [Figure 3-17 (a)]. In some cases, the F– in the fluorite may leave its normal position. A vacancy appears at the original F– position, and to maintain the electrical neutrality of the crystal, a negatively charged entity must occupy this vacancy. An electron from a certain atom in the crystal becomes the negatively charged entity occupying this vacancy [Figure 3-17 (b)]. This creates a “color center,” known as an electronic color center. In fluorite, electronic color centers absorb visible light, producing purple.
(2) Hole color centers (V centers)
The vacancy color center is formed by external factors, where cations create electron vacancies. This means that electrons are ejected from their original positions, leaving behind an unpaired electron. The reason for the color is that when cation vacancies form in the crystal, to achieve charge balance, the anions near the cation vacancy release electrons under the influence of external energy, forming unpaired electrons that absorb visible light and produce color. For example, in irradiated diamonds and blue topaz, irradiation provides energy to activate electrons, causing ions or atoms in the lattice to displace, thus forming structural defects and color centers due to irradiation.
A classic example of a color center in a crystal is the coloring of smoky crystal. The crystal structure of quartz is a silicon-oxygen tetrahedron, with silicon in a four-coordinate state, as shown in the two-dimensional structural diagram in Figure 3-18(a). Every 10,000 Si4+ atoms have one replaced by Al3+, and when Al3+ substitutes for Si4+ in the crystal, Al3+ must be surrounded by some alkali ions (such as Na+ or H+) to maintain electrical neutrality. Still, these ions are often at a certain distance from Al3+.
When quartz is irradiated by X-rays, γ rays, and other radiation sources, the energy of the adjacent oxygen atoms to Al3+ increases, allowing one of the electrons in its pair to be ejected from its normal position. H+ will capture this electron to form H . High-energy radiation causes the O2- with more valence electrons to release an electron, forming a [A1O4]4- vacancy color center, and the [A1O4]4- atomic cluster absorbs visible light to produce color, forming smoky quartz.
[A1O4]5-→ [A1O4]4-+e– (3-1)
H+ +e–→ H (3-2)
H+ captures electrons to become H, which is colorless and does not absorb visible light. If the irradiation intensity is high and there is enough Al3+ in the crystal, the quartz can be irradiated to black. Since there is often a vacancy at the position where an electron is ejected, this type of color center is referred to as a “vacancy color center.”
During geological history, natural smoky crystal is mostly formed through long-term low-dose radiation from radioactive materials. Heating can eliminate the color; when this smoky crystal is heated to around 400℃, the ejected electrons will return to their original positions, all the electrons will pair up, and the quartz will become colorless again; if it is irradiated again, it can turn smoky again [Figure 3-18 (b)].
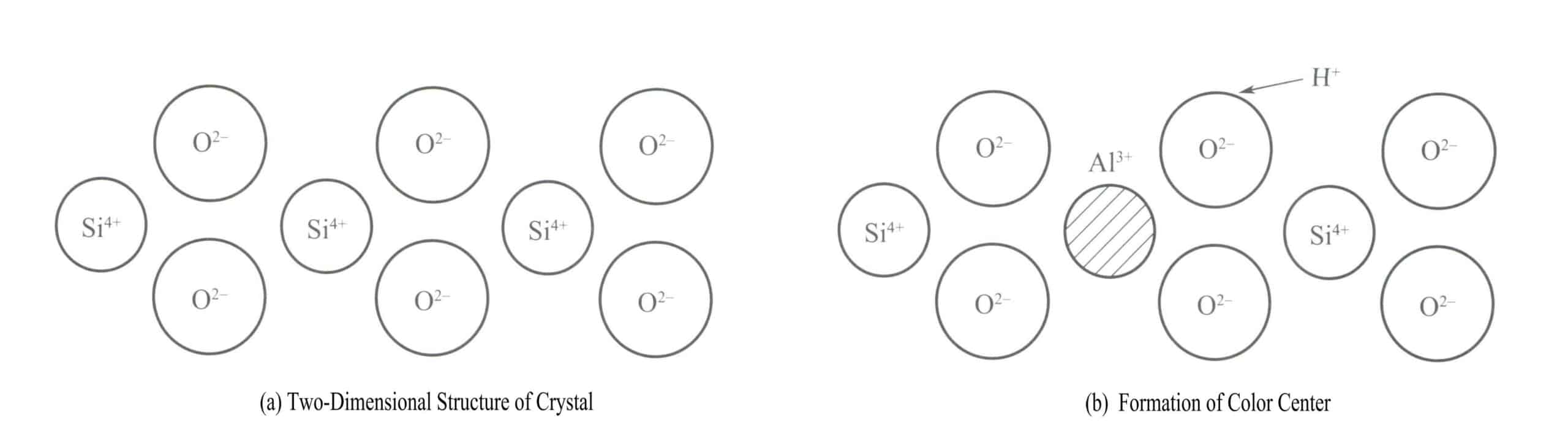
Amethyst has the same color centers for vacancy, but its impurity is iron instead of aluminum. When the impurity Fe 3+ replaces Si4+ in the quartz, the following changes occur when irradiated with high-energy rays:
[FeO4]5- → [FeO4]4- +e– (3-3)
H+ +e–→ H (3-4)
Similar to the formation principle of smoky crystal, it produces a purple color due to the formation of [FeO4]4- hole color centers after being irradiated. When this amethyst is heated, it turns yellow, becoming citrine, and with further heating, it fades to colorless. Generally, the heating temperature is relatively low, around 400℃. The purple color of heat-treated amethyst can be restored by irradiating the color centers again. Synthetic amethyst is also synthesized based on this principle.
In some gemstones, a few impurity atom clusters can also form color centers and exhibit color. For example, during the growth of beryl and under radioactive irradiation, can lose an electron to become , forming a red-green absorption band that produces a blue color. There are many color centers in diamonds, most of which are caused by the formation of vacancies or dislocations in the structure under external conditions, and the colors are generally very stable.
The difficulty of studying color center-induced color is relatively high, requiring various techniques such as spectroscopy and electron paramagnetic resonance. Previous research shows some typical characteristics of color center-induced color are relatively clear. Table 38 summarizes the colors and causes of color center-induced color in common gemstones.
Table 3-8 Colors and Causes of Color Center-Induced Color in Common Gemstones
| Types of Gemstones | Färg | Cause |
|---|---|---|
| Diamant | Grön | Carbon vacancy GR1 color center in diamond |
| Gul | Missing structure of diamond N3 aggregates | |
| Orange | Natoms and H3, H4 color center defects | |
| Kristall | Smoke color | Vacancies generated by Al3+ substituting Si4+ , related to radiation |
| Gul | Related to Al3+, it can also be generated by radiation | |
| Lila | Fe3+ replaces the vacancy created by Si4+ | |
| Corundum gemstone | Gul | Color is unstable, the reason for structural defects is unknown |
| Topas | Blå | Color is stable, the reason for structural defects is unknown |
| Gul | Color is stable, the cause of structural defects is unknown | |
| Brownish-red | Color is unstable, the cause of structural defects is unknown | |
| Turmalin | Röd | Related to Mn3+ , can also be caused by radiation |
| Beryl | Blå | Related to CO32- , can also be caused by irradiation |
| Fluorit | Lila | Electronic e- replaces F- to produce |
The principle of color centers is also used to improve the color of natural gemstones in gemstone enhancement. Most methods use irradiation to change the color of the gemstones. Some color centers are relatively stable, while some gemstone varieties fade quickly, making this enhancement method less significant for those gemstones. Table 3-9 lists some colors produced by color centers, including stable color centers, unstable color centers, and colors produced by other possible factors.
Table 3-9 Colors produced by color centers
| Basically stable in light | Amethyst, fluorite(purple-red), irradiated diamonds (green, yellow, brown, black, blue, pink); some natural or irradiated topaz (blue) |
|---|---|
| Fades quickly in light | Lithium cesium green beryl (deep blue); some irradiated topaz (brown or tan); irradiated sapphire (yellow); ultraviolet irradiated purple sodalite (purple-red) |
| Other colors that color centers may produce | Sylvine (blue); halite(blue or yellow); zircon (brown); calcite (yellow); barite, celestine (blue); amazonite (blue to green) |