Hva er kjemisk gullbelegg og hvordan fungerer det?
Kjemisk gullbelegg: Teknikker, løsninger og bruksområder for smykker
Innledning:
Hva er kjemisk gullbelegg? Det er en prosess som brukes til å avsette et tynt lag med gull på ulike materialer, noe som forbedrer utseendet og holdbarheten deres. Hvordan fungerer det? Kjemisk gullbelegg innebærer bruk av spesielle løsninger med gullioner og reduksjonsmidler. Tradisjonelle metoder bruker ofte cyanid, men det finnes også cyanidfrie alternativer. Hvorfor velge kjemisk gullbelegg? Det gir en jevn, høykvalitets finish som er ideell for smykker og andre dekorative gjenstander. Enten du er smykkemaker, designer eller forhandler, kan det å forstå disse teknikkene forbedre produktene dine.

Innholdsfortegnelse
Seksjon I Kjemisk gullbelegging med cyanid
1. Oversikt
Med den høye tettheten av elektroniske komponenter, kompleksiteten i linjedesign, mikrofabrikasjon av kretser og uavhengigheten av elektriske egenskaper, har kjemisk gullbelegging, som løser kompleksiteten i platingprosessen, blitt en uunngåelig måte å gullbelegge på. Kjemisk gullbelegging har imidlertid følgende ulemper:
① Lav hastighet;
② Smal bruksforhold og driftsområde, noe som øker vanskeligheten med administrasjon;
③ Materialoverflaten må være grundig ren;
④ Levetiden til platingløsningen er kort (utsatt for selvredoksreaksjoner);
⑤ Plateringstykkelsen er svært følsom for omrøringsforhold.
Derfor må kjemisk gullplettering utføres med spesialutstyr. Den vanlige sammensetningen av kjemisk gullpletteringsløsning er vist i tabell 1-24, fremstilt ved å kombinere forskjellige gullkoordinasjonssalter og reduksjonsmidler.
Tabell 1-24 Typer gullkoordinasjonssalt og reduksjonsmidler i kjemisk gullpletteringsløsning
| Reduksjonsmiddel | KAu(CN)2 | KAu(CN)4 | Na3Au(SO2)2 | HAuCl4 • 3H2O | HAuCl4 ・ 3 timer2O | AuCN | KAu(CN)4 | KAu ・ O2 | KAu(OH)4 | AuI | Ikke spesifikk |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Natriumhypofosfitt | 57,58 | 71 | 77 | ||||||||
| Formaldehyd | 71 | 78 | |||||||||
| Biazid | 59 | 71 | 76 | 78 | |||||||
| Borhydrid | 60,61 | 72 | 78 | 79 | |||||||
| Metylboran | 60 | 69 | 74 | 75 | 79 | 80 | |||||
| Hydroksylamin | 62 | ||||||||||
| Upublisert | 63 | 73 | 81 | ||||||||
| Tiourea | 64 | ||||||||||
| Ammoniumhydroksid | 65 | ||||||||||
| Kaliumnatriumtartrattetrahydrat (kombinert) | 66 | 70 | |||||||||
| N,N-dimetylamid | 82 | ||||||||||
| N,N-dimetylglycin | 67 | ||||||||||
| Ingen | 68 |
Tabell 1-25 Funksjoner til komponenter i kjemisk gullpletteringsløsning
| Komponent | Hensikt | Forbindelsesnavn |
|---|---|---|
| Gullion | Tilførsel av metallisk gull | KAu(CN)2KAu(CN)4、AUCN、Na3Au(SO2)2. HAuCl4 • 3H2O, KAu ・ O2 |
| Reduksjonsmiddel | Reduksjonsmidler for gullavsetning | Kaliumnatriumtartrat-tetrahydrat, borhydrid, aminboran, formaldehyd, hypofosfitt, N,N-dimetylglysin, askorbinsyre |
| Organiske chelateringsmidler | Buffervirkning for å forhindre rask gullavsetning | EDTA, kaliumsitrat, vinsyre |
| Stabilisator | Masker aktive kjerner for å forhindre nedbrytning av platingløsningen | Tiourea, metallcyanid, acetylaceton |
| Aktivator | Den bremsende effekten av det modererende chelateringsmiddelet | Ravsyre |
| Buffermiddel | Oppretthold en viss pH-verdi | Fosfater, sitrater, tartrater |
| Surfaktant | Gjør de belagte delene enkle å fukte | Alifatiske sulfonater, alkoholsulfater |
2. Hypoposfittgullbeleggløsning
Når basismetallet og gullet i platingløsningen gjennomgår en fortrengningsreaksjon, ioniserer metallet med et lavere elektrokjemisk potensial lettere enn gull. Under reaksjonen, når overflaten av basismetallet er fullstendig dekket av gull, stopper reaksjonen umiddelbart, slik at bare 0,1~0,3 μm tynt gullpletteringslag kan oppnås. Denne platingløsningen, eller Brookshires løsning, er en gammel platingløsning og er den grunnleggende sammensetningen av nåværende markedsførte kjemiske gullpletteringsløsninger. Kjennetegn på platingløsningen: basislaget for gullplettering må være nikkel for fortrengningsreaksjonen; gull kan ikke fortrengningspletteres på kobbermateriale.
(1) Sammensetning og betingelser for hypofosfitt kjemisk gullbeleggløsning
Tabell 1-26 viser den typiske sammensetningen av hypofosfitt kjemisk gullbeleggløsning.
Tabell 1-26 Sammensetning og betingelser for hypofosfitt kjemisk gullpletteringsløsning
| Sammensetning og driftsforhold | Serienummer | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Kaliumgullcyanid/(g/L) | 2 | 2 | 20 | 2 | 2 |
| Natriumhypofosfitt/(g/L) | 10 | 10 | 10 | 10 | 10 |
| Kaliumcyanid /(g/L) | 0.2 | 0.2 | 80 | 0.4 ① | 0.2 |
| Temperatur/°C | 96 | 96 | 96 | 96 | 96 |
| pH | 13.5 | 7.5 | 13.5 | 13.5 | 7.1 |
| Belastningshastighet/(cm2/cm3) | 0.25 | 0.25 | 0.25 | 0.25 | 0.25 |
| Platinghastighet/[mg/(cm²2· h)] | 9.8 | 9.85 | 12.3 | 8.2 | 3.86 |
(2) Effekten av nikkel på avsetningshastigheten til hypofosfittbeleggløsning
I den kjemiske gullbeleggløsningen med hypofosfitt som reduksjonsmiddel, aktive metallioner (Ni2+) tilsettes. Metall (nikkel) og gull avsettes i spormengder på overflaten av de belagte delene, noe som skaper en stor kjemisk drivkraft og øker gullbelegningshastigheten. Prinsippet er vist i modelldiagrammet i figur 1-25.
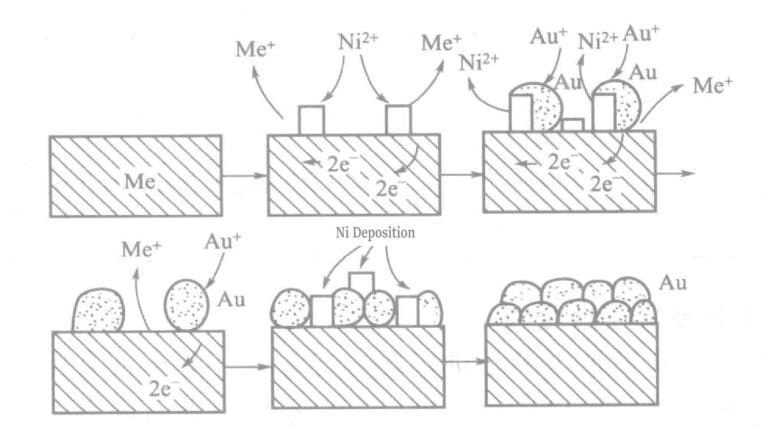
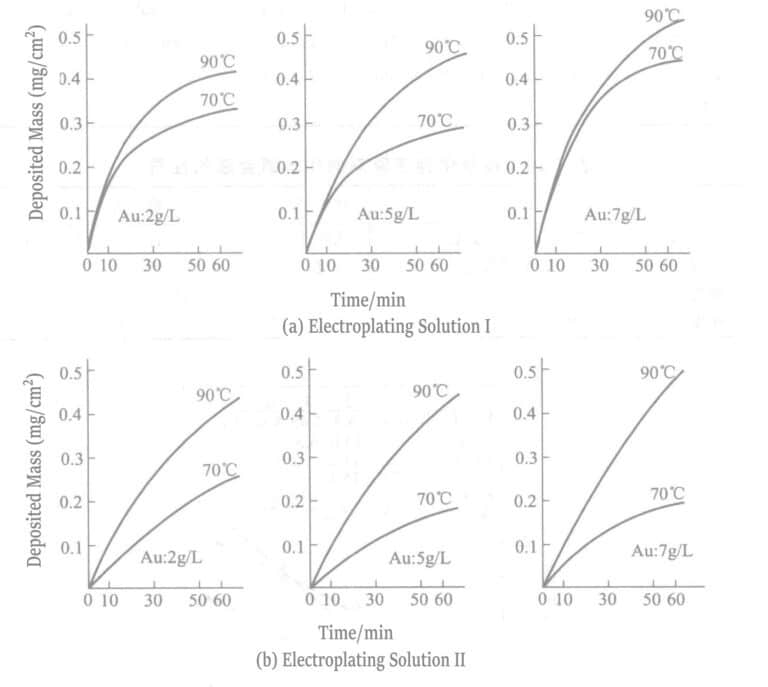
Tabell 1-27 Sammensetning og driftsforhold for hypofosfittgullbeleggløsning
| Sammensetning og driftsforhold | I | II | Sammensetning og driftsforhold | I | II |
|---|---|---|---|---|---|
| Kaliumgullcyanid/(g/L) | 2, 5, 7 | 2, 5, 7 | Kaliumcyanid /(g/L) | - | 2 |
| Natriumsitrat/(g/L) | 75 | 75 | H2NNH2 · H2O /(g/L) | - | 2 |
| Natriumhypofosfitt/(g/L) | 15 | 15 | pH | 8.5 | 4.3 |
| EDTA-2Na/(g/L) | - | - | Temperatur/℃ | 70, 90 | 70, 90 |
| Natriumklorid/(g/L) | - | 5 |
3. Borhydridsaltpletteringsløsning
(1) Sammensetning og egenskaper ved kjemisk gullbeleggingsløsning med kaliumborhydrid
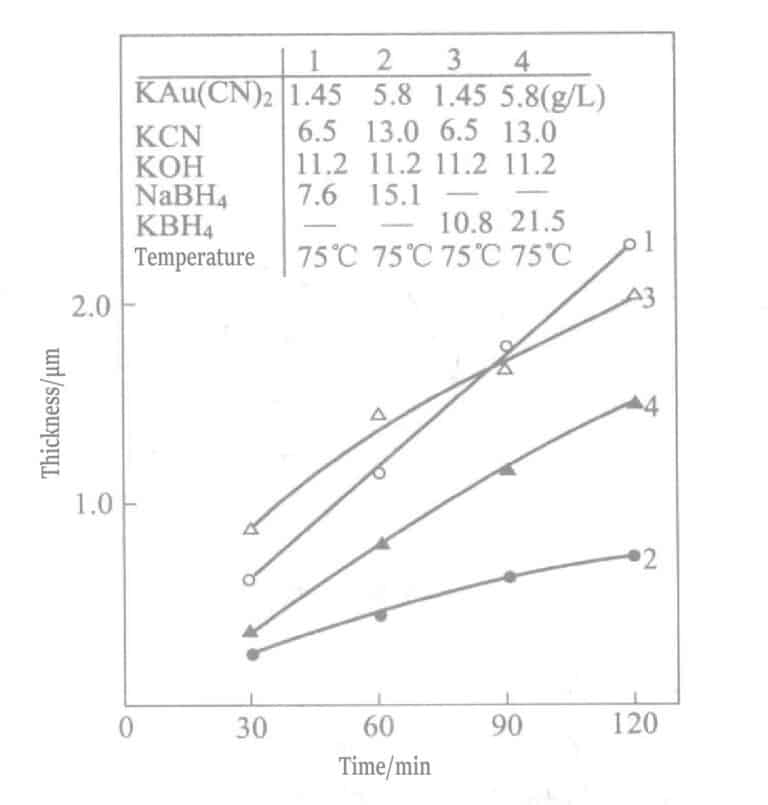
I 1969 foreslo Okinaka et al. å bruke en platingløsning med borhydridforbindelser som reduksjonsmiddel. Sammensetningen og betingelsene til den kjemiske gullpletteringsløsningen med borhydrid er vist i tabell 1-28, og egenskapene til gulllagene som er plettert med disse løsningene er vist i tabell 1-29. Tykkelsen på platingslagene som er plettert på forskjellige tidspunkter med forskjellige platingløsninger er angitt i figur 1-27. Sammendragsresultatene for reduksjonsmidlene kaliumborhydrid og dimetylaminboran er vist i tabell 1-30.
Tabell 1-28 Sammensetning og driftsforhold for kjemisk gullpletteringsløsning med kaliumborhydrid
| Sammensetning og drift | Serienummer | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Kaliumgullcyanid/(g/L) | 0,02 mol/l (5,8 g/l) | 0,03 mol/l (8,6 g/l) | 0,005 mol/l (1,45 g/l) |
| Kaliumcyanid | 0,2 mol/l (13,0 g/l) | 0,2 mol/l (13,0 g/l) | 0,1 lmol/L (6,5 g/L) |
| Kaliumhydroksid | 0,2 mol/l (11,2 g/l) | 0,2 mol/l (22,4 g/l) | 0,2 mol/l (11,2 g/l) |
| Kaliumborhydrid | 0,4 mol/l (21,6 g/l) | 0,8 mol/l (43,1 g/l) | 0,2 mol/l (10,8 g/l) |
| Temperatur/°C | 75 | 75 | 75 |
Tabell 1-29 Egenskaper til kjemisk gullpletteringsløsning med kaliumborhydridreduksjonsmiddel
| Natur | Data | Natur | Data |
|---|---|---|---|
| Bindingsstyrke | Utmerket bindingsstyrke i metalllaget | Porøsitet | Ingen porer større enn 1 μm på den ensartede overflaten |
| Utseende | Matt gul | Renhet | 99. 9% |
| Tetthet | Gullinnhold 19,3 g/cm3 | Motstandsverdi | 0,03Ω/cm2 (Au: 1 μm) |
| Hardhet | Nup-hardhet 60-80 | Loddbarhet | Glimrende |
Tabell 1-30 Funksjoner til komponenter i kjemisk gullpletteringsløsning med kaliumborhydrid
| Påvirkende faktorer | Kaliumborhydrid-pletteringsløsning | DMAB (dimetylaminoboran) platingløsning |
|---|---|---|
| Effekt av gullkonsentrasjon | Når gullkonsentrasjonen når 0,002 mol/L, øker nedbørsmengden kraftig og synker over dette. | Nedbørshastigheten øker lineært ved en gullkonsentrasjon på 0,01 mol/l, men har ingen effekt over det. |
| Effekter av kaliumcyanid |
Ustabil platingløsning når den er under 0,005 mol/l. Gull utfelles ikke over 0,2 mol/l. |
Samme som venstre |
| Effekt av kaliumborhydrid | BH er ikke stabil ved romtemperatur. Tilsetning av kaliumhydroksid forbedrer badets stabilitet, og utfellingshastigheten avtar med økende konsentrasjon. | DMAB er stabil ved romtemperatur, utfellingshastigheten øker med økningen av kaliumhydroksid. |
| Konsentrasjon av reduksjonsmiddel | Økning i nedbørsmengde med økning i konsentrasjon | |
| Effekt av temperaturen på platingbadet | Øk nedbørshastigheten med 10 ℃, og dekomponer ved 85 ℃. |
(2) Påvirkning av platinghastighet og tungmetallioner
Tilsetning av spormengder av tungmetallioner (bly, tallium, etc.) til den kjemiske gullbeleggløsningen øker avsetningshastigheten betydelig. McIntyre forklarte denne effekten slik. På grunn av lavt potensial for avsetning fremmer den katalytiske effekten av adsorberte blyatomer, som vist i mekanismene (1-4) og (1-5), kimdannelse.
Pb2+ + 2e– → Pbannonse (1–4)
2Au(CN)2– + Pbannonse → 2Au + Pb2+ + 4CN– (1–5)
På grunn av den store forskjellen i arbeidsfunksjoner mellom kobber, gullmaterialer og blyioner, reduseres og avsettes bly ved et potensial som er mer positivt enn det termodynamiske redokspotensialet, og danner et monolag. På grunn av den katalytiske reaksjonen av adsorberte blyatomer som i (1-4) og (1-5), skjer reduksjonsreaksjonen av Au(CN) raskt, noe som effektivt fremmer avsetningen av gull.
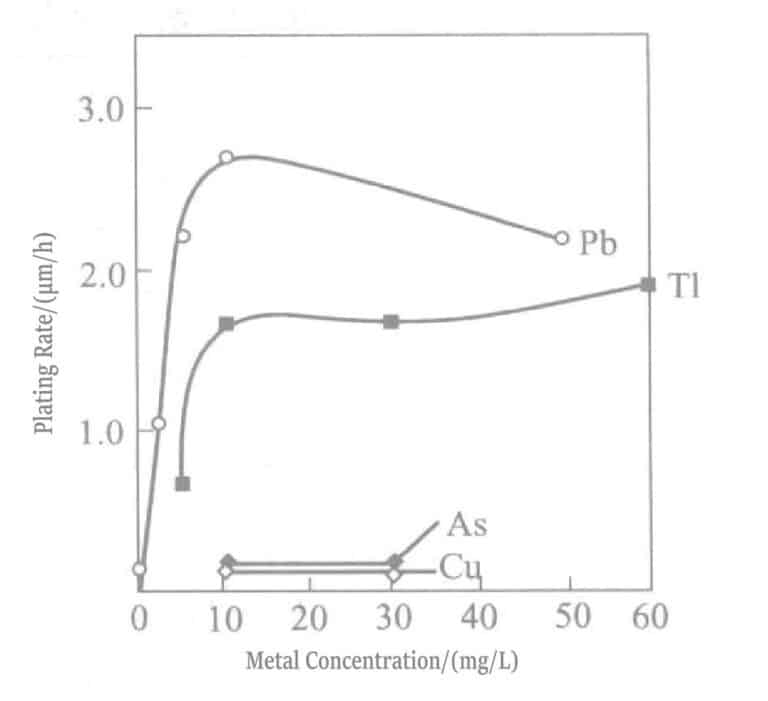
Forholdet mellom blykonsentrasjon og avsetningshastighet i kaliumborhydridreduserende gullpletteringsløsning er vist i figur 1-28, og pletteringsløsningens sammensetning er vist i tabell 1-31. Bly tilsettes i form av blynitrat. Figur 1-28 viser at blytilsetningskonsentrasjonen i pletteringsløsningen bare kan være omtrent 20 ml/l, og å tilsette mer har ingen effekt.
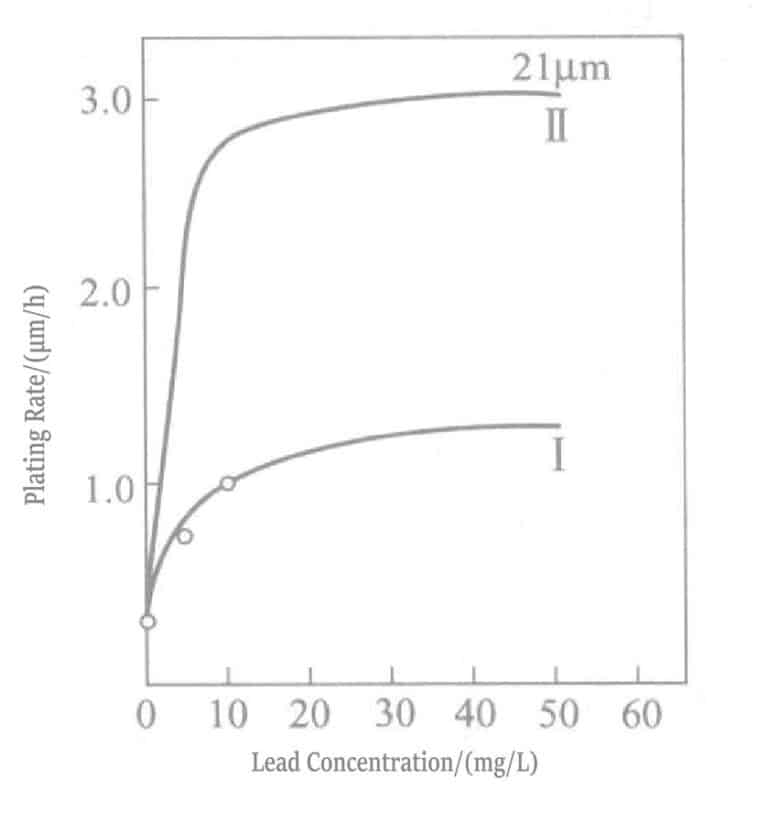
Tabell 1-31 Sammensetning og driftsforhold for gullbeleggløsning med kaliumborhydrid
| Sammensetning og driftsforhold | I | II | Sammensetning og driftsforhold | I | II |
|---|---|---|---|---|---|
| Kaliumgullcyanid/(g/L) | 2 | 2 | Kaliumcyanid /(g/L) | 10 | 10 |
| Kaliumborhydrid/(g/L) | 2 | 10 | EDTA-2Na/(g/L) | 5 | 5 |
| Kaliumcyanid/(mg/L) | 5 | 5 | Temperatur på platingløsning/°C | 75 | 75 |
Tabell 1-32 Sammensetning av BMAB-gullbelegningsløsning
| Sammensetning og driftsforhold | Konsentrasjon | Sammensetning og driftsforhold | Konsentrasjon |
|---|---|---|---|
| Kaliumgullcyanid/(g/L) | 2 | Kaliumcyanid /(g/L) | 30 |
| BMAB/(g/L) | 10 | EDTA-2Na/(g/L) | 5 |
| Kaliumcyanid/(mg/L) | 5 | pH | 13.6 |
Tabell 1-33 Sammensetning av kjemisk gullpletteringsløsning med kaliumgull(III)cyanid
| Sammensetning | Parametere | Sammensetning | Parametere |
|---|---|---|---|
| KAu(CN)4/(g/L) | 4 | KOH/(mg/L) | 11.2 |
| KBH4/(g/L) | 3 | Temperatur/℃ | 70 |
| PbCl2/(mg/L) | 0.5 |
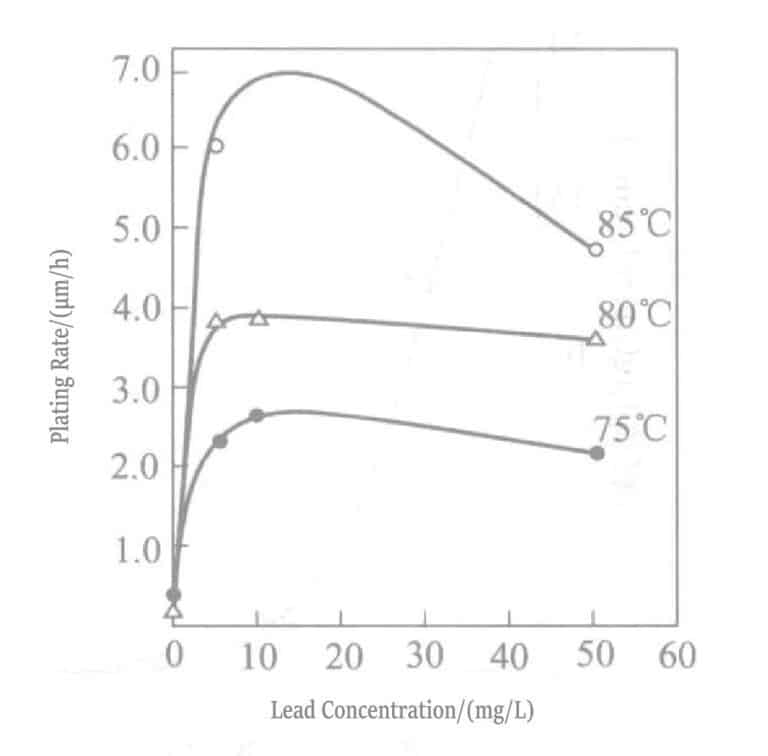
Figur 1-30 Effekt av temperatur og blykonsentrasjon på gullutfellingshastigheten
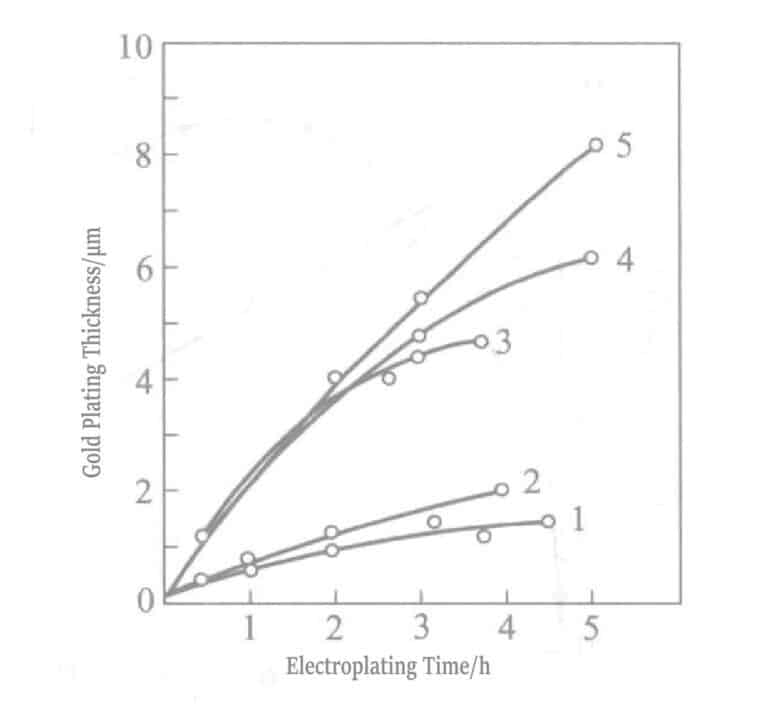
Figur 1-31 Forholdet mellom platingstid og tykkelsen på det gullbelagte laget
1 - Ingen omrøring av Au+ væske; 2 - Ingen omrøring Au3+ væske; 3 - Omrøring av Au3+ væske; 4 - Etterfylling av Au3+ væske; og 5 - Fornyelse av Au3+ flytende
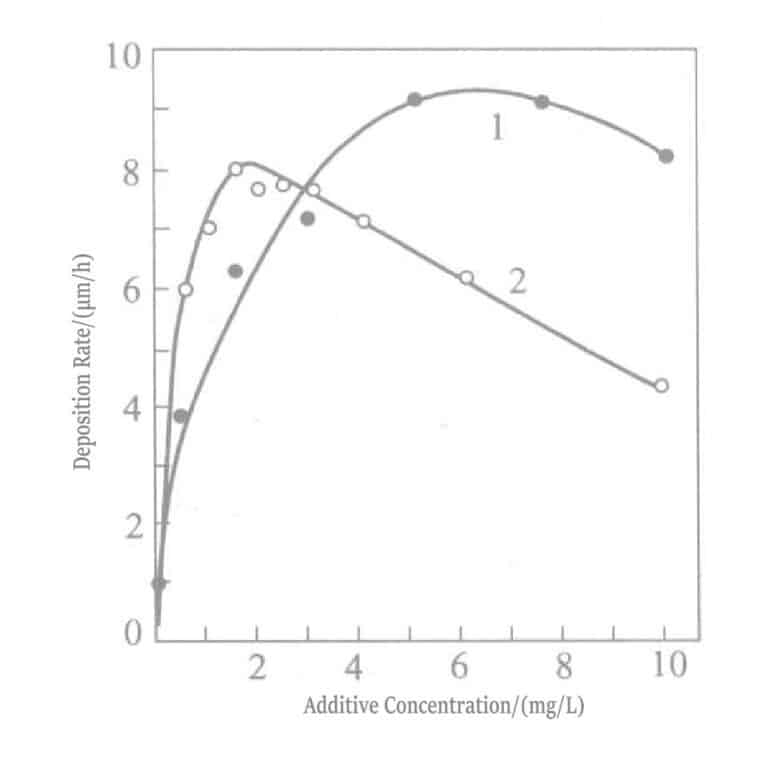
Figur 1-32 Effekt av tilsatte konsentrasjoner av bly og tallium på gullbelegghastigheten
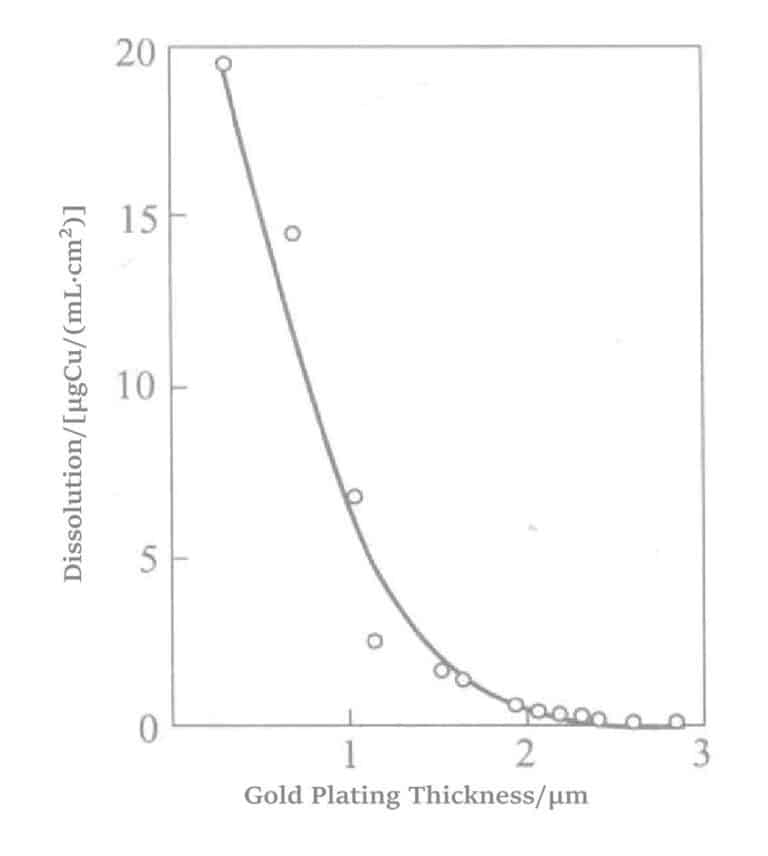
Figur 1-33 Porøsitet i det elektroløse gullbelegget
Den kjemiske gullbelegningsprosessen av krystallisert glass (SiO2 46% + Al2O3 16% + MgO 17% + K2O 10% + F 4% + B2O3 7%) er vist i figur 1-34.
4. Reaksjonsmekanisme for kjemisk gullpletteringsløsning med borhydridsalt
Lin Zhongfu et al. foreslo at gullbeleggløsningene med kaliumborhydrid og DMAB (dimetylaminboran) i tabell 1-34 kan bli praktiske gullbeleggløsninger etter tilsetning av stabilisatorer.
(1) Sammensetning av to platingløsninger: Tabell 1-34 viser de to sammensetningene.
Tabell 1-34 Kaliumborhydrid og DMAB kjemiske platingløsninger
| Sammensetning av platingløsning | Kaliumborhydrid-pletteringsløsning | DMAB-plateringsløsning |
|---|---|---|
| Kaliumgullcyanid/(mol/L) | 0.02 | 0.02 |
| Kaliumcyanid/(mol/L) | 0.2 | 0.02 |
| Kaliumhydroksid/(mol/L) | 0.2 | 0.8 |
| Kaliumborhydrid/(mol/L) | 0.4 | - |
| DMAB/(mol/L) | - | 0.4 |
| Temperatur/°C | 75 | 85 |
| Plateringshastighet/(μm/t) | 0.7 | 0.4 |
(2) Reaksjonsmekanisme: I kaliumborhydrid-gullbeleggløsningen, BH4– i seg selv produserer ikke en reduserende effekt, men den mellomliggende BH3ÅH– av hydrolyseproduktet BO2– fungerer som reduksjonsmiddel.
BH4– + H2O → BH3ÅH–+ H2 (1-6)
BH3ÅH– + H2O → B O2– + 3 timer2 (1-7)
BH3ÅH– + 3OH– → BO2– + 3/2 timer2 + 2 timer2O + 3e– (1-8)
Au(CN)2– + e– → Au + 2CN– (1-9)
BH3ÅH– + 3Au(CN)2– + 3OH– → BO2– + 3/2 timer2 + 2 timer2O + 3Au + 6CN – (1-10)
Hydrolysereaksjonene i ligningene (1-6) og (1-7) ble analysert ved hjelp av polarografi. Resultatet viser at reaksjon (1-7) er 500 ganger raskere enn reaksjon (1-6). Derfor er utnyttelsesgraden for kaliumborhydrid i gullpletteringsreaksjonen svært lav. Under typiske pletteringsforhold overstiger ikke den effektive utnyttelsesgraden 2%~3%, og mesteparten av reduksjonsmidlet forblir ineffektivt på grunn av hydrolyse.
Hydrolysereaksjonen ovenfor forløper raskt ved lav pH (syrekatalysert reaksjon), og gullavsetningshastigheten er høy når kaliumhydroksidkonsentrasjonen er lav. For å forhindre naturlig nedbrytning av gullbeleggløsningen må kaliumhydroksidkonsentrasjonen opprettholdes på minst 0,1 mol/L. Forholdet mellom gullavsetningshastigheten og kaliumhydroksidkonsentrasjonen er vist i figur 1-35.
![Figur 1-35 Kurve for variasjon i platinghastighet med kaliumhydroksidkonsentrasjon [KAu(CN)2 0,02 mol/L, KCN (heltrukket linje) 0,2 mol/L, KCN (stiplet linje) 0,1 mol/L, 80 °C]](https://sobling.jewelry/wp-content/uploads/2025/11/Page_58_docsmall.com_副本-768x801.jpg)
Figur 1-35 Kurve for variasjon i platinghastighet med kaliumhydroksidkonsentrasjon
[KAu(CN)2 0,02 mol/L, KCN (heltrukket linje) 0,2 mol/L, KCN (stiplet linje) 0,1 mol/L, 80 °C]
![Figur 1-36 Effekt av kaliumhydroksidkonsentrasjon på platinghastigheten til DMAB-platingløsning, DMAB [KAu(CN)2 0,02 mol/L, KCN 0,2 mol/L, DMAB 0,4 mol/L, 75 ℃]](https://sobling.jewelry/wp-content/uploads/2025/11/Page_58_docsmall.com_副本1-768x560.jpg)
Figur 1-36 Effekt av kaliumhydroksidkonsentrasjon på platinghastigheten til DMAB-platingløsning, DMAB
[KAu(CN)2 0,02mol/L, KCN 0,2mol/L, DMAB 0,4mol/L, 75 ℃]
(CH3)2NH2 • BH3 + ÅH– → (CH3)2NH2 + BH3ÅH– (1-11)
(3) Problemer med kaliumborhydrid-pletteringsløsning og DMAB-pletteringsløsning
Figur 1-37 viser at platinghastigheten endres med konsentrasjonen av kobber- og nikkelioner i platingløsningen. Når nikkelionkonsentrasjonen er på 10-5mol/L, begynner platinghastigheten å avta, og når nikkelionkonsentrasjonen når 10-3mol/L, dekomponerer platingløsningen. Kobberioner har nesten ingen effekt på platinghastigheten. I den første fasen av gullpletteringen gjennomgår gullioner og nikkel en fortrengningsreaksjon, spormengder av nikkelioner løses opp, og platinghastigheten avtar.

Figur 1-37 Effekt av kobberioner og nikkelioner på platinghastighet
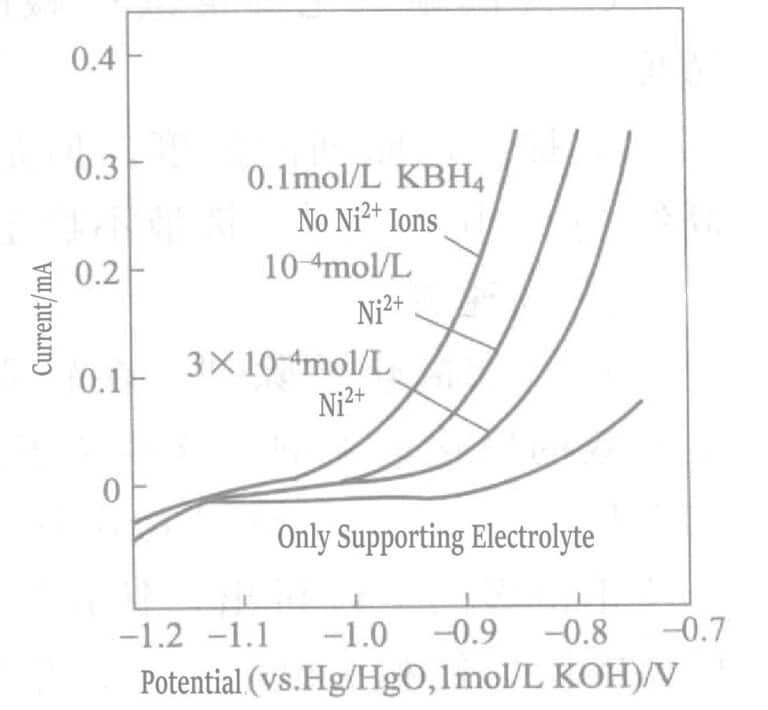
Figur 1-38 Effekt av spor av nikkelioner på den anodiske oksidasjonsstrømmen til BH3ÅH
(Roterende gullelektrode, 2000 o/min, 75 ℃, KOH 0,2 mol/L, KCN 0,1 mol/L)
Effekten av å tilsette spormengder av nikkelioner på BH3ÅH– Den anodiske oksidasjonsstrømmen er vist i figur 1-38. Tilsetning av spor av nikkelioner hemmer oksidasjonsreaksjonen til reduksjonsmiddelet BH betydelig.3ÅH– på den gullroterende skiveanoden. Dette er fordi nikkelioner finnes i form av cyanidligandsaltet Ni(CN)42- , og dette komplekse ionet adsorberer fortrinnsvis på gulloverflaten, noe som hindrer avsetningen av gull.
Ustabile basislag (som aluminiumnitrid) kan ikke bruke sterkt alkaliske løsninger. pH-verdien i platingløsningen avhenger av reduksjonsmiddelets natur, som er den største ulempen med kaliumborhydrid- og DMAB-platingløsninger.
Angående problemene ovenfor, bortsett fra at pH-verdien i platingløsningen ikke kan endres, kan andre aspekter forbedres.
(4) Forbedre gullbeleggløsningen for kaliumborhydrid og gullbeleggløsningen for DMAB
① Øk platinghastigheten
- a. Endre platingløsningens grunnleggende sammensetning og driftsforhold for å øke platinghastigheten.
- b. Øk rørehastigheten.
- c. Øk temperaturen på platingløsningen.
- d. Reduser konsentrasjonen av fritt cyanid.
- e. Reduser alkalikonsentrasjonen i kaliumborhydrid-pletteringsløsningen og øk alkalikonsentrasjonen i DMAB-pletteringsløsningen.
- f. Øk konsentrasjonen av reduksjonsmiddelet. Men når platinghastigheten uten spesielle tilsetningsstoffer øker med omtrent 2 μm/t eller mer, blir platingløsningen ustabil og utsatt for nedbrytning.
② Høyhastighets platingløsning
- a. Tilsett polarisasjonseliminatorer. I myke gullbeleggløsninger, Pb2+ , T1+ Ioner er effektive polarisasjonseliminatorer. Disse ionene adsorberer sterkt på gulloverflaten, noe som produserer det såkalte UPD-fenomenet (under potensialavsetning), der bly avsettes med et potensial som er mye mer positivt enn blyets potensial.2+ / Pb-likevektspotensial og thalliumavsetninger ved et potensial som er mer positivt enn T1+ /T1 likevektspotensial. Det avsatte blyet, thalliumet og Au(CN)2– gjennomgår fortrengningsreaksjoner, noe som fører til at gullavsetningsreaksjonen skifter til et mer positivt potensial (polarisasjonssvekkelse). På den annen side, å tilsette disse ionene til kjemiske gullbeleggløsninger, på samme måte som elektrolytisk belegg, forskyver Au(CN)2– reduksjonspotensialet i positiv retning, noe som resulterer i en økt platinghastighet, som kan nå omtrent 10 μm/t. Platingløsninger med tilsatt bly2+ , T1+ ioner er vist i tabell 1-35 og 1-36.
Tabell 1-35 Kaliumborhydrid-pletteringsløsning med tilsatt bly2+
| Løsning 1 | Løsning 1 | ||
|---|---|---|---|
| Kaliumgullcyanid | 5 g/L | Kolloidal | 2 g/L |
| Kaliumcyanid | 8 g/L | Løsning 2 | |
| Natriumsitrat | 50 g/l | Kaliumborhydrid | 200 g/l |
| EDTA | 5 g/L | Natriumhydroksid | 120 g/L |
| Blyklorid | 0,5 g/L | ||
Tabell 1-36 Kaliumborhydrid-pletteringsløsning med tilsatt T1+
| Sammensetning og driftsforhold | Parametere | Sammensetning og driftsforhold | Parametere |
|---|---|---|---|
| Kaliumgullcyanid | Juster etter behov | Kaliumborhydrid | 5,4 ~ 10,8 g/L |
| Kaliumcyanid | 6,5 g/L | Temperatur | 70 〜 80 ℃ |
| Kaliumhydroksid | 11,2 g/L | Pletteringshastighet | <10 μm/t |
| Talliumsulfat | 5 〜 100 mg/L |
Au(CN)4– + 2e– → Au(CN)2– + 2CN– (1-12)
![Figur 1-39 Effekt av tilsetning av blyklorid på polarisasjonskurven for Au(CN)2-reduksjonsreaksjonen til [Roterende gullelektrode, KAu(CN)2 0,009 mol/L, KOH 0,2 mol/L]](https://sobling.jewelry/wp-content/uploads/2025/11/Page_61_docsmall.com_副本-768x578.jpg)
Figur 1-39 Effekt av å tilsette blyklorid på Au(CN)2--reduksjonsreaksjonspolarisasjonskurve [Roterende gullelektrode, KAu(CN)2 0,009 mol/l, KOH 0,2 mol/l]
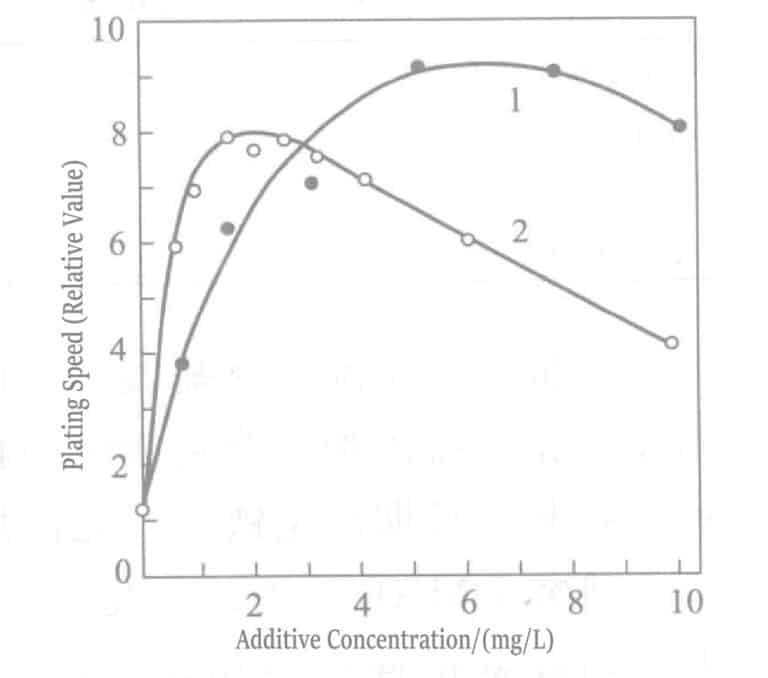
Figur 1-40 Effekt av konsentrasjonen av talliumklorid (kurve 1) og blyklorid (kurve 2) på gullpletteringshastigheten til kaliumborhydridpletteringsløsningen
- b. Tilsetning av stabilisatorer. Tilsetning av organiske stabilisatorer som reduserer gullets katalytiske aktivitet, økning av temperaturen i platingsløsningen og endring av konsentrasjonen av reduksjonsmiddelet kan forbedre platingshastigheten til løsningen. For eksempel kan platingshastigheten til platingsløsninger som inneholder aminoeddiksyre, hydroksyetyletylendiamintetraeddiksyre og diazotrieddiksyre eller ravsyrederivater nå en høy hastighet på 12~23 μm/t ved 90 ℃. Ved høye temperaturer akselererer imidlertid hydrolysereaksjonen til reduksjonsmiddelet betydelig, noe som gjør platingsløsningen vanskelig å kontrollere. Tilsetning av spormengder av p-dimetylaminoazobenzen-stabilisator påvirker ikke stabiliteten til platingsløsningen og kan øke den vanlige brukskonsentrasjonen av BH4- med 2 ganger, noe som øker platingshastigheten til 5 μm/t. Andre effektive stabilisatorer inkluderer etylenglykol, etyleter, dietylenglykol[?]etyleter og polyetylenimin.
- c. Bruk trivalente gullcyanidkomplekssalter. Platingløsninger med trivalente gullcyanidkomplekssalter, slik som de med tilsatt blyklorid eller titanklorid, som vist i tabell 1-33, er detaljert beskrevet i tabell 1-37.
Tabell 1-37 Kaliumgull(III)cyanid Kaliumborhydrid-pletteringsløsning
| Sammensetning og driftsforhold | Parametere | Sammensetning og driftsforhold | Parametere |
|---|---|---|---|
| Kaliumgull(III) | 3 g/L | Blyklorid | 0,5 mg/L |
| Kaliumhydroksid | 11,2 g/L | Temperatur | 70 ℃ |
| Kaliumborhydrid | 3 g/L |
Fordelen med trivalent gullcyanidkomplekssaltpletteringsløsning er at KAuO2 og KAu(OH)4 kan brukes som supplerende gullsalttilsetninger, noe som unngår overdreven akkumulering av frie cyanidioner i platingløsningen, reduserer platinghastigheten og favoriserer en langsiktig stabil platinghastighet. Platinghastigheten for additivfri platingløsning er 2~8 μm/t.
Studien av den elektrokjemiske oppførselen, strukturen og egenskapene til DMAB-pletteringsløsningen viser at KAu(CN) i likhet med kaliumborhydridpletteringsløsningen2 brukes kun når man tilbereder gullpletteringsløsningen, og oppløst gullhydroksid i kaliumhydroksidløsning tilsettes som et supplement for å unngå akkumulering av frie cyanidioner. Sammensetningen av pletteringsløsningen er vist i tabell 1-38.
Tabell 1-38 DMAB-pletteringsløsning (gullhydroksid oppløst i kaliumhydroksidløsning)
| Sammensetning og driftsforhold | Parametere | Sammensetning og driftsforhold | Parametere |
|---|---|---|---|
| Kaliumgullcyanid | 0,013 ~ 0,018 mol/L | Tilsetningsstoff | Liten mengde |
| DMAB | 0,07 〜 0,1 mol/L | pH | 13.1 ~ 13.4 |
| Kaliumhydroksid | 0,09 〜 0,15 mol/L | Temperatur | 70 〜 75 ℃ |
| Kaliumcyanid | 0,007 ~ 0,01 mol/L | Pletteringshastighet | 2 μm/t |
(5) Forbedre stabiliteten til platingløsningen.
Bruk av tilsetningsstoffer kan øke platinghastigheten og stabiliteten til platingløsningen, men urenhetene som produseres vil føre til at platingløsningen brytes ned.
Stoffer som EDTA og etanolamin tilsatt platingløsningen danner sterke, komplekse ioner med metallurenheter, noe som hemmer reaksjonen mellom metallurenheter og BH4.4– og BH3ÅH–, og forbedrer dermed stabiliteten til platingløsningen. Sammensetningen av kaliumborhydrid-platingløsningen med tilsatt EDTA og etanolamin er vist i tabell 1-39.
Tabell 1-39 Kaliumborhydrid-pletteringsløsning med tilsatt EDTA og etanolamin
| Sammensetning og driftsforhold | Parametere | Sammensetning og driftsforhold | Parametere |
|---|---|---|---|
| Kaliumgullcyanid | 1,45 g/L | EDTA | 5 g/L |
| Kaliumcyanid | 11 g/L | Etanolamin | 50 ml/l |
| Kaliumhydroksid | 11,2 g/L | Temperatur | 72 ℃ |
| Kaliumborhydrid | 10,8 g/L | Pletteringshastighet | 1,5 μm/t |
Tabell 1-40 Plateringsløsning med to reduksjonsmidler (hydrazin og DMAB)
| Sammensetning og driftsforhold | Parametere | Sammensetning og driftsforhold | Parametere |
|---|---|---|---|
| Kaliumgullcyanid | 0,005 mol/L | DMAB | 0,05 mol/L |
| Kaliumcyanid | 0,035 mol/L | Hydrazin | 0,25 mol/L |
| Kaliumhydroksid | 0,8 mol/L | Temperatur | 80 ℃ |
| Kaliumkarbonat | 0,45 mol/L | Pletteringshastighet på nikkelbasislaget (innledende trinn) | 2,6 μm/t |
| Blyacetat | 15X10-6 | På gullet (fast verdi) | 7,8 μm/t |
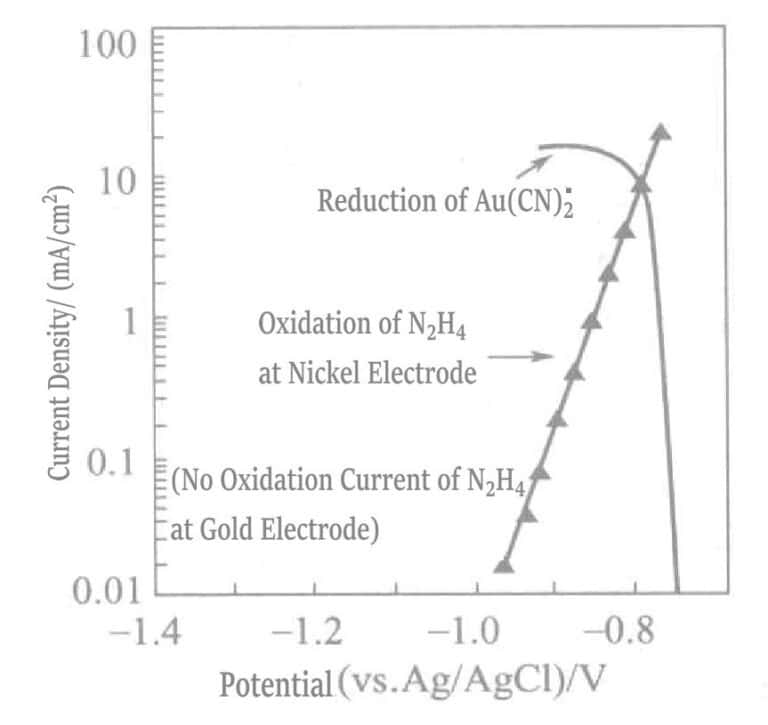
Figur 1-41 Polarisasjonskurver for den anodiske oksidasjonsreaksjonen av hydrazin på nikkelelektroden og den katodiske reduksjonsreaksjonen av Au(CN)2-.
(KOH 0,8mol/L, KCN 0,035mol/L, N2H4 0,05 mol/L, 80 ℃)
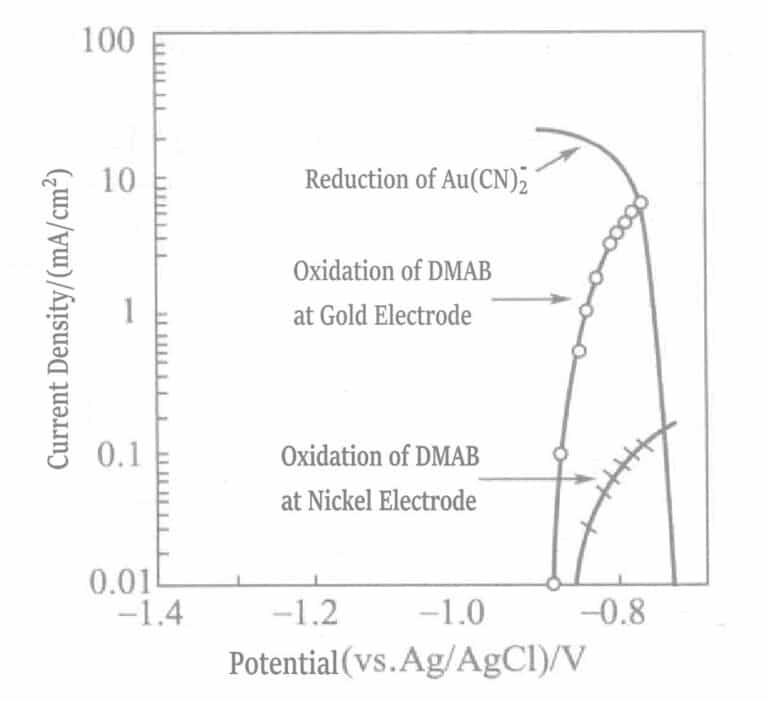
Figur 1-42 Polarisasjonskurver for den anodiske oksidasjonsreaksjonen til DMAB på nikkel- og gullelektroder og den katodiske reduksjonsreaksjonen til Au(CN)2-
(KOH 0,8mol/L, KCN 0,035mol/L, DMAB 0,05mol/L, 80℃)
I en platingløsning som kun inneholder reduksjonsmiddelet hydrazin, kan gull avsettes utelukkende ved hjelp av den katalytiske effekten av nikkelbasislaget. Når basislaget er fullstendig dekket av gull, stopper gullavsetningen, og på dette tidspunktet avhenger tykkelsen på gullplatingslaget av konsentrasjonen av fritt cyanid i platingløsningen. Selv om den maksimale platingtykkelsen til denne platingløsningen er begrenset (ca. 2 μm), er platingslaget tett nok til å oppfylle kravene til nøkkeltrykkbinding.
Foruten hydrazin finnes det mange andre tilgjengelige reduksjonsmidler i den katalytiske gullbeleggløsningen; se tabell 1-41.
Tabell 1-41 Andre reduksjonsmiddelpletteringsløsninger
| Reduksjonsmiddel | pH | Temperatur/℃ |
|---|---|---|
| Hypofosfitt | 7 〜 7. 5 | 93 |
| 7,5 〜 13,5 | 96 | |
| 3 〜 4 | 70 〜 80 | |
| Hydrazin | 7 〜 7. 5 | 92 〜 95 |
| 5. 8 〜 5. 9 | 95 | |
| 11. 7 | 95 | |
| Hydroksylamin | 2. 3 〜 2. 8 | 70 〜 85 |
| Natriumcyanoborhydrid (NaBH3CN) | 3.5 | 90 |
| Hydrazinylboran (N2H4 ・ BH3) | >13 | 60 |
| Tiourea | 6,5 〜 7,0 | 83 〜 90 |
| 4.2 | 80 ~ 85 | |
| Askorbinsyre | 8 | 63 |
| Titantriklorid | 5 | 75 |
Copywrite @ Sobling.jewelry - Tilpasset smykkeprodusent, OEM og ODM smykkefabrikk
5. Kjemisk gulllegeringsplettering
(1) Gull-sølv-legering:
En kjemisk gull-sølvlegering kan oppnås ved kontinuerlig å tilsette kaliumsølvcyanidløsning til borhydridgullbeleggingsløsningen. Ag(CN)2– reduseres lettere enn Au(CN)2–Når man tilbereder en ny platingløsning, vil sølv utfelles først hvis de to blandes, og legeringen kan ikke belegges.
Ved kontinuerlig å tilsette små mengder kaliumsølvcyanid dråpevis i plateringsløsningen, opprettholde en relativt lav kondensasjon [molforhold Au:Ag (26:10~(26:0,5)]. Et platingslag av gull-sølvlegering med et sølvinnhold på 80%~20% kan utfelles. I denne platingsløsningen er utfellingen av sølv et erstatningsreaksjonsprodukt av gullet som utfelles først og Ag(CN)2–, i løsning.
(2) Gull-kobberlegering:
I konvensjonelle kjemiske kobberpletteringsløsninger basert på koordinasjonsbasert EDTA og formaldehydreduksjonsmiddel, kan bare kaliumgullcyanid plettere en gull-kobberlegering. Ved å endre kaliumgullcyanidkonsentrasjonen kan kobbermassefraksjonen i gulllegeringspletteringslaget justeres fra 1%~94%.
(3) Gull-tinn-legering:
Kjemisk platingløsning for gull og tinnlegering bruker SnCl2 reduksjonsmiddelmetoden. Sammensetningen og konsentrasjonsområdet til platingløsningen er vist i tabell 1-42.
Tabell 1-42 Løsning for belegering av gull-tinnlegering
| Sammensetning og driftsforhold | Parametere | Sammensetning og driftsforhold | Parametere |
|---|---|---|---|
| Kaliumgull(III)-cyanid | 4–10 g/l | Triolefin | 0,05 ~ 0,5 g/L |
| Kaliumcyanid | 5–15 g/l | Temperatur | Romtemperatur |
| Kaliumhydroksid | 60–100 g/l | Pletteringshastighet | 1,5 μm/t (uten tilsetning av triolefin) |
| Stannklorid | 40–60 g/l | 5 μm/t (triolefintilsetning 0,5 g/L) |
(4) Gull-indium-legering:
Gull-indium-legeringspletteringsløsningen fremstilles ved å tilsette Ih2(SO4)3 og EDTA til en borhydridløsning. Indiuminnholdet i platinglaget er 1%~4%. Ved romtemperatur har et tynt gull-indium-legering-platingslag avsatt på palladiumaktivert n-GaAs, etter 350 ℃ varmebehandling, en kontaktmotstand som er bedre enn rent gull.
(5) Gull-nikkel, gull-kobolt-legeringer:
Uemaki utviklet 18–22 karat blanke gull-nikkel- og gull-koboltlegeringsløsninger. Ved pH 3–5 har gulllegeringslaget med cyanidbasert kjemisk gullpletteringsløsning tilsatt reduksjonsmiddel natriumhypofosfitt fysiske egenskaper som hardhet og slitestyrke som er dårligere enn de til elektropletteringslag med gulllegering som inneholder nikkel og kobolt.
Seksjon II Cyanidfri kjemisk gullbelegg
1. Oversikt
Fortrengningstype gullbelegg bruker potensialforskjellen mellom oksidasjonspotensialet til basislagsmetallet og reduksjonspotensialet til gullioner som drivkraft for platingsreaksjonen. I motsetning til dette bruker kjemisk gullbelegg av reduksjonstype potensialforskjellen mellom oksidasjonspotensialet til reduksjonsmiddelet og reduksjonspotensialet til gullioner som drivkraft for platingsreaksjonen.
Elektronene som er involvert i reduksjonsreaksjonen av gullioner, tilveiebringes enten av oksidasjonsreaksjonen av basislagsmetallet (forskyvningsgullbelegg) eller av oksidasjonsreaksjonen av reduksjonsmiddelet (reduktiv gullbelegg).
Andre metoder inkluderer: ① Tilsetning av tungmetallsalter til fortrengningsgullbeleggløsningen, hvor metalloverflaten på basislaget adsorberer tungmetallene, og dermed forskyver potensialet i en retning som gjør det lettere å redusere gullioner; ② Tilsetning av et reduksjonsmiddel til fortrengningsgullbeleggløsningen, slik at redoksreaksjoner kan forekomme samtidig for å belegge tykkere gull; ③ I gullbeleggløsninger som inneholder reduksjonsmidler, fungerer edelmetallet i basislaget som et reduksjonsmiddel og gjennomgår oksidasjon med en katalysator, noe som utfører katalytisk kjemisk gullbelegg på basislaget.
Ligander i kjemiske gullbelegningsløsninger bruker vanligvis cyanid, som danner svært stabile komplekser med gullioner (stabilitetskonstant K = 4 × 1028For tiden har mange halvlederkomponenter gått over til å bruke nesten nøytrale, lavcyanid- eller cyanidfrie gullbeleggløsninger, for eksempel sulfitt- eller tiosulfatgullbeleggløsninger og cyanidfrie kjemiske gullbeleggløsninger med tiol RSH-serieligander.
2. Kjemisk gullbelegg av fortrengningstype
Generelt er bindingsstyrken mellom redusert type tykklags elektroløs gullbelegg og basislaget av basismetaller relativt dårlig. Derfor må elektroløs gullbelegg av fortrengningstype utføres før et tykt gulllag belegges.
I fortrengningstypen forgullbeleggløsning løses basislagets basismetall opp (oksideres) i elektrolyttløsningen og frigjør elektroner. I motsetning til dette tar gullionene i løsningen imot elektroner og avsettes (reduseres) på ikke-metalloverflaten. Dannelsen av gullligander reduserer konsentrasjonen av gullioner i beleggløsningen, og forskyver reduksjonspotensialet i negativ retning, som vist i tabell 1-43.
Tabell 1-43 Ligander og reduksjonspotensialer for gullionkomplekser
| Ligander | Ligand | E/V |
|---|---|---|
| H2O |
Au(H2Å)2+ Au(H2Å)43+ |
1.68 1.50 |
| Cl- |
AuCl2 - AuCl4 - |
1.15 0.92 |
| SCN- |
Au(SCN)2 - Au(SCN)4 - |
0.67 0.64 |
| I- |
AuI2- AuI4- |
0.58 0.57 |
| NH3 | Au(NH)43+ | 0.56 |
| ÅH- | Au(OH)4 - | 0.48 |
| Tiourea | Au (tor)2+ | 0.38 |
| S2O32- | Au(S2O3)23- | 0.15 |
| SO32- | Au(SO3)23- | 0.06 |
| R-SH | Au(RS)2- | -0,3 〜 - 0,5 |
| CN- | Au(CN)2 - | -0.65 |
Tabell 1-43 viser at foruten cyanider kan andre ligander som tioler, sulfitter og tiosulfater også danne stabile komplekser med gullioner og utvise negative potensialer.
I sulfittsystemets fortrengningstype gullbeleggløsning kan man, i tillegg til sulfitterioner, også bruke ligander som polyaminpolykarboksylsyrer og deres salter, vannløselige aminer, aminsalter, etylendiamintriacetatsalter, stabilisatorer som tetraalkylammoniumsalter, etylendiamintetra(metylenfosfonat), sukkerarter og tiolforbindelser. Konsentrasjonene av ammoniumioner, kloridioner, sulfationer, bromidioner eller jodidioner må opprettholdes innenfor et bestemt område og ikke være for høye; ellers kan det dannes ammonium(kompleks)-gullligander i platingløsningen, hvis redokspotensial er mer positivt enn natriumsulfitt. Når platingløsningen blir stående eller under gullbelegg, kan natriumsulfitt oksidere og redusere gull, noe som forårsaker ustabilitet i platingløsningen.
Tiolsuksinat, acetylcystein, cystein og andre tiolserieforbindelser og gullioner kan danne stabile ligander i cyanidfrie gullbeleggløsninger. Tiolsuksinat [HOOCCH(SH)-CH2COOH] og reduksjonspotensialet til gullionliganden, det vil si Au(HOOCCHSCH2COOH)2– + e– ⇌Au(s) + 2 (HOOCCH – SCH2COOH)–, er den korrekte verdien av standardelektrodepotensialet for reaksjonen vanskelig å oppnå. Det målte reduksjonspotensialet til platingløsningen er omtrent -0,3~0,5 V. Tiolsuksinatgullliganden finnes i form av [Au(HOOC – CHSCH2COOH)2]–, med gull i oksidasjonstilstanden +1.
HAuCl4 + 3 timer2O → Au(OH)3 + 4HCl (1-13)
Au(OH)3 + 4[HOOCCH(SH)CH2 COOH] → [Au(HOOCCH—S—CH2COOH)4 ]– + 3 timer2O+H+ (1-14)
[Au( HOOCCH—S—CH2COOH)4]– → [Au(HOOCCH—S—CH2COOH)2]– + HOOCH2CHOOCCH—S—S—CHCOOHCH2COOH (1–15)
Tabell 1-44 Cyanidfri fortrengningsgullpletteringsløsning
| Sammensetning og driftsforhold | Sulfittsystem | Merkaptoravsyresystem | ||
|---|---|---|---|---|
| Natriumgullklorat/(mol/L) | 0.05 | |||
| Natriumtiosulfat/(mol/L) | 0.028 | 0.015 | ||
| Gullmerkaptosuccinat/(mol/L) | 0.01 | |||
| Natriumsulfitt/(mol/L) | 0.52 | 0.1 | ||
| Merkaptoravsyre/(mol/L) | 0.25 | 0.25 | ||
| Trinatriumcitrat/(mol/L) | 0.22 | |||
| Acetylcystein/(mol/L) | 0.03 | |||
| Tetrametylammoniumklorid/(mol/L) | 0.8 | |||
| EDTA/(mol/L) | 0.015 | |||
| EDTA - 2Na/(mol/L) | 0.02 | |||
| Amino tris(metylenfosfonsyre)/(mol/L) | 0.1 | |||
| Natriumkarboksymetylcellulose/(g/L) | 10 | |||
| pH | 7.0 | 7.0 | 1,5 (Justert med saltvann) | 7.0 |
| Temperatur /℃ | 60 | 85 | 80 ~ 90 | |
3. Redusert kjemisk tykt gullbelegglag
I gullbeleggløsninger med tiosulfat som ligand forhindrer natriumsulfitt nedbrytningen av tiosulfationer. I NaAuCl4 I plateringsløsninger som inneholder treverdige gullsalter reduseres enverdig gull med overskudd av tiosulfat. I svakt alkaliske gullplateringsløsninger tilsettes vanligvis pH-buffere som ammoniumklorid, natriumtetraborat og borsyre.
Tiolforbindelser kan danne ligander med gullioner som har utmerket stabilitet og fungerer som reduksjonsmidler. Disse tiolforbindelsene inkluderer blant annet L-cystein og 2-etanamintiol. Tabell 1-45 viser sammensetningen og driftsbetingelsene for cyanidfrie kjemiske gullbelegningsløsninger av redusert type som bruker natriumtiosulfat og tiolforbindelser som ligander.
Tabell 1-45 Cyanidfri reduksjonstype gullbeleggløsning
| Sammensetning og driftsforhold | Tiosulfatsystem | Tiol-systemet | |||
|---|---|---|---|---|---|
| Gullklorat/(g/L) | 0.01 | ||||
| Natriumgullklorat/(g/L) | 0.0125 | 0.0125 | |||
| Natriumgullsulfitt/(g/L) | 0.02 | ||||
| Gullmerkaptosuccinat/(g/L) | 0.01 | ||||
| Merkaptoravsyre/(g/L) | 0.27 | ||||
| Natriumtiosulfat/(g/L) | 0.1 | 0.17 | 0.1 | ||
| Natriumsulfitt/(g/L) | 0.1 | 0.4 | |||
| Ammoniumsulfitt/(g/L) | 0.43 | ||||
| EDTA ・ 2Na/(g/L) | 0.19 | ||||
| Trietanolamin/(g/L) | 0.034 | ||||
| Ammoniumklorid/(g/L) | 0.05 | ||||
| Natriumtetraborat/(g/L) | 0.13 | ||||
| Kaliumdihydrogenfosfat/(g/L) | 0.15 | ||||
| Tiourea/(g/L) | 0.0033 | ||||
| Hydrokinon/(g/L) | 0.002 | ||||
| Askorbinsyre/(g/L) | 0.25 | ||||
| Hydrazin/(g/L) | 0.3 | ||||
| L-cystein/(g/L) | 0.08 | ||||
| 2-aminoetylmerkaptan/(g/L) | 0.2 | ||||
| Kaliumbenzotriazol/(g/L) | 0.05 | ||||
| pH | 7.5 | 7.0 | 8.0 | 7.0 | 7.5 |
| Temperatur/℃ | 60 | 80 | 70 | 80 | 80 |
4. Katalytisk kjemisk gullbelegg for basislag
Katalytisk kjemisk gullbelegg av basislaget er en kjemisk gullbeleggmetode av reduksjonstypen som bruker et reduksjonsmiddel. Reduksjonsmidlet har kun katalytisk aktivitet på overflaten av substratet, basismetalllaget (nikkel), og har ingen katalytisk aktivitet på den avsatte gulloverflaten. Det katalytiske kjemiske gullbelegget er glattere, tettere og har færre eller mindre porer enn gullbelegget av fortrengningstypen.
I kjemiske gullbeleggløsninger med tiosulfat og sulfitt kan gull avsettes på nikkeloverflaten uten å tilsette andre reduksjonsmidler. På nikkeloverflaten reduserer sulfitt bare tiosulfatgullkomplekset og virker ikke på gulloverflaten, så det kalles en katalytisk type kjemisk gullbelegg av basislaget. En fortrengningsgullbeleggreaksjon skjer også samtidig på overflaten av basisnikkelbelegglaget. Derfor gjennomgår reduksjonsmiddelet sulfitt forskjellige oksidasjonsreaksjoner påvirket av sammensetningen av basisnikkelbelegglaget og forbehandlingsbetingelsene. Konsentrasjonen av tiosulfatnatriumliganden eller pH-verdien i platingløsningen påvirker de forskjellige forholdstallene mellom fortrengnings- og reduksjonsreaksjoner, den maksimale tykkelsen på gullbelegglaget, utseende, porøsitet og adhesjon, så det er nødvendig å velge en passende platingløsningssammensetning og gullbeleggsbetingelser.
5. Stabilitet av cyanidfri kjemisk gullpletteringsløsning
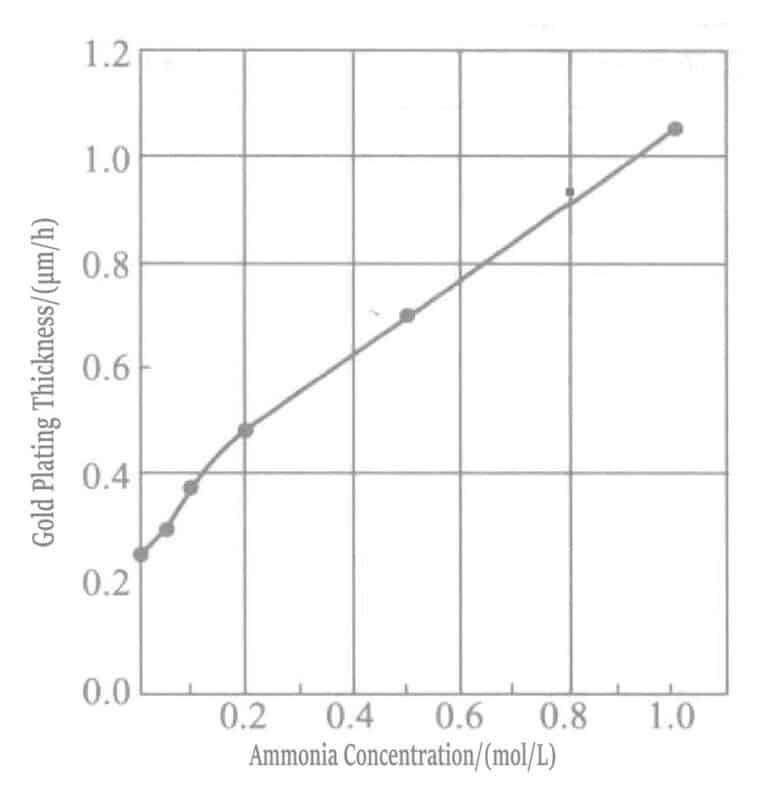
Å øke konsentrasjonen av ammoniakkvann akselererer avsetningshastigheten til gullbelegglaget. I beleggløsninger med høy ammoniakkkonsentrasjon fungerer merkaptosuksinat som et reduksjonsmiddel, og en reduksjonsreaksjon skjer samtidig med fortrengningsreaksjonen.
Forurensning av kobber- eller jernioner er hovedårsaken til ustabilitet i cyanidfrie kjemiske gullbeleggløsninger. Kobber som er oppløst fra porene i nikkelbelegglaget og jern fra substratet fremmer lett ustabiliteten til den kjemiske gullbeleggløsningen.
Årsaker: ① Gullioner tar imot elektroner som frigjøres når disse metallene oksiderer, noe som øker reduksjonshastigheten. ② Kobberioner eller jernioner katalyserer oksidasjonsreaksjonen til sulfitt eller tiol, noe som akselererer reaksjonshastigheten, noe som forårsaker defekter på overflaten av det kjemiske gullbelegget og reduserer sveiseytelsen og bindingsstyrken. I kjemiske gullbeleggløsninger bør oppløsningen og forurensningen av disse metallene undertrykkes ved å tilsette ligander som danner stabile komplekser med disse oppløste og forurensede metallionene.
6. Cyanidfri kjemisk gullpletteringsløsning
(1) Tetrakloraurat(III)-salter og svakt reduserende aminboran-gullbeleggløsninger
Tetrakloraurat(III)-salter (NaAuCl4) reduseres lett for å avsette gull. Etersubstituerte tertiære aminboranreduksjonsmidler kan brukes med NaAuCl4 for å danne en autokatalytisk platingløsning, eller reduksjonsmidler som trimetylaminboran, metylmorfolinboran og diisopropylaminboran, sammen med stabilisatorer som tioler og jodidforbindelser.
(2) Gullbeleggløsning med gullsulfittsalt:
For tiden brukes et stort antall monovalente gullsulfittbeleggløsninger, med hypofosfitter, formaldehyd, hydrazin, tetrahydroborat og DMAB som reduksjonsmidler. Gullsulfittsalt [Na3Au(SO3)2] er ustabil i vann og krever tilsetning av stabilisatorer som 1,2-diaminoetan og kaliumbromid.
(3) Tiosulfatgullbeleggløsning
① Forgyllingsløsning med tiourea og dets derivater som reduksjonsmidler:
Kombinasjonen av monovalent gulltiosulfat og tiourea-pletteringsløsning har god stabilitet, produserer ikke hydrogengass rundt nøytral pH og har ingen porøsitet. Sammensetningen av pletteringsløsningen er vist i tabell 1-46 (pletteringsløsning A).
Tabell 1-46 Tiosulfatgullpletteringsløsning
| Sammensetning og driftsforhold | Platingløsning A | Platingløsning B |
|---|---|---|
| NaAuCl4 / (mol/L) | 0.1 | 0.0125 |
| Na₂S₂O₃/(mol/L) | 0.08 | 0.1 |
| Na2SO3 /(mol/L) | 0.4 | 0.1 |
| Na₂B₄O₂/(mol/L) | 0.1 | - |
| NH4Cl/(mol/L) | - | 0.05 |
| Tiourea/(mol/L) | 0.1 | - |
| Natrium-L-askorbat/(mol/L) | - | 0.25 |
| pH | 9.0 | 6.0 |
| Temperatur/℃ | 80 | 60 |
| Pletteringshastighet/(μm/t) | 1. 9 〜 2. 3 | 1,5 〜 2,0 |
② Forgyllingsløsning med askorbinsyre som reduksjonsmiddel:
I tiosulfatpletteringsløsningen med L-askorbinsyrenatrium som reduksjonsmiddel er natriumsulfitt tilstede, som kan stabilt plettere gull. Sammensetningen av pletteringsløsningen er vist i tabell 1-46 (pletteringsløsning B).
Effektive reduksjonsmidler i natriumtiosulfat-pletteringsløsninger, i tillegg til tiourea og natriumaskorbat, inkluderer natriumtartrat, glykolsyre og hypofosforsyre.
③ Reaksjonsmekanisme for tiosulfatpletteringsløsning:
Gullfat reagerer med tiosulfat for å produsere Au(S2O3)23-Når det ikke er tiosulfat i løsningen, er det bare sulfitt som er tilstede, og det dannes Au(SO₄3)23-Reaksjonsligningen er som følger:
Au3++ 2S2O3 2- + H2O ⇌ Au(S2O3)23- + SÅ4 2- + 2 timer+ (1-16)
Au3+ + 3SO32- + H2O ⇌ Au(SO3 )23- + SÅ42- + 2 timer+ (1-17)
Au+ + 2SO32- ⇌ Au(SO3)23- K=1010 (1-18)
Au+ + 2S2O32- ⇌ Au(S2O3)23- K = 1026 (1-19)

Figur 1-44 Sammenligning av katodiske polarisasjonskurver for gullavsetningsreaksjoner i sulfitt- og tiosulfatpletteringsløsninger
(NH4Cl 0,1 mol/L, Na2SO3 0,2 mol/L)
Tiosulfat har en sterkere kompleksdannelsesevne med monovalent gull enn sulfitt, så monovalent gull er vanskeligere å avsette fra platingløsninger som inneholder natriumtiosulfat enn de som inneholder sulfitt.
I sulfittgullbeleggløsningen med reduksjonsmiddelet askorbat er gullavsetningshastigheten bare 1/10 av den i natriumtiosulfatbeleggløsningen på grunn av forskjellen i katodiske polarisasjonskurver mellom gullsulfittkompleksioner og gulltiosulfatkompleksioner. Figur 1-45 viser askorbatsulfitt- og tiosulfatgulls katodiske og anodiske polarisasjonskurver.
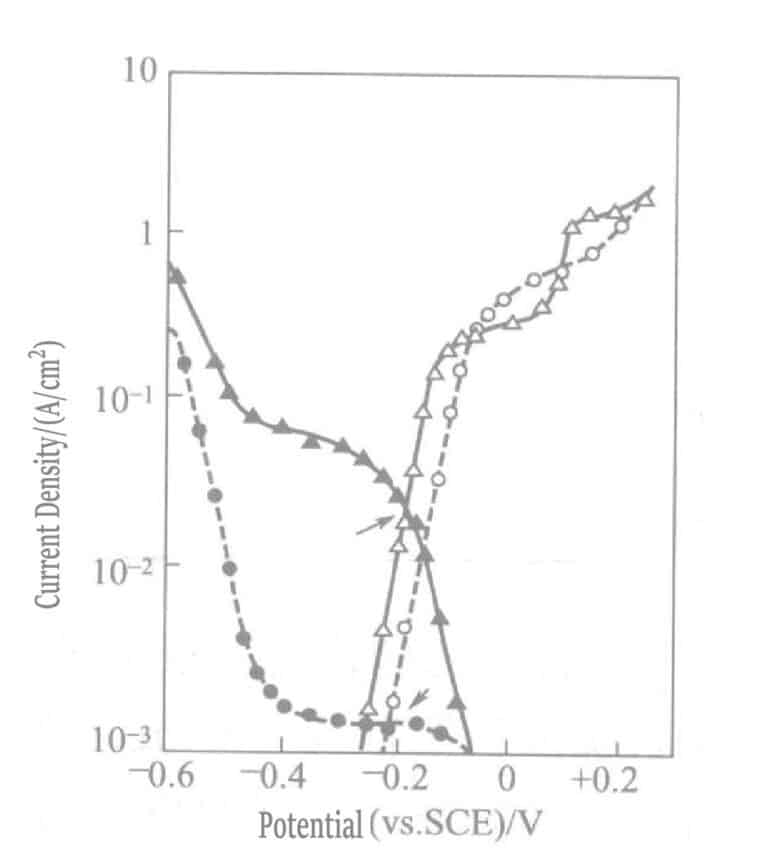
Figur 1-45 Katodiske og anodiske polarisasjonskurver for askorbinsyre, sulfittpletteringsløsning og tiosulfatgull
(Gullelektrode, NH4Cl 0,1 mol/L, pH 6,0, 60 ℃. Kurve "●" platingløsning: Na2SO3 0,2 mol/l og NaAuCl4 0,01 mol/L; Kurve "▴" samme platingløsning som før, med tilsetning av Na2S2O3 0,1 mol/L; Kurve "○" platingløsning: Na2SO3 0,2 mol/L og natriumaskorbat 0,1 mol/L; Kurve "△"-løsning, samme som før, med tilsetning av Na2S2O3 0,1 mol/L)
Reaksjonsprinsippet for tiosulfat-elektroløs gullbeleggingsløsning refererer til oksidasjonstilstanden til reduksjonsmiddelet, og de lokale reaksjonene er som følger.
Katodisk reaksjon:
Au(S2O3)23- + 2e– → Au + 2S2O32- (1-20)
Anodisk reaksjon:
Tiourea-pletteringsløsning
CS(NH2)2 + 5 timer2O → CO(NH2)2 + H2SO4 + 8 timer+ + 8e– (1-21)
Reaksjonsproduktet CO(NH2)2 er urea.
Askorbinsyre-pletteringsløsning
C6H8O6 → C6H6O6 + 2 timer+ + 2e–
7. Gullbeleggløsning av sukkertilsetning med gullsulfittsalt
Etter å ha tilsatt sakkaridforbindelser til gullsulfittpletteringsløsningen, kan den forbli stabil i lang tid, og gullpletteringslaget er godt. Sammensetningen av pletteringsløsningen er som følger.
Gullsulfittsalter: kaliumgullsulfitt, natriumgullsulfitt, ammoniumgullsulfitt, etc.
Sulfitter: kaliumsulfitt, natriumsulfitt, ammoniumsulfitt, etc.
pH-justerer: Juster til pH 6~9 med forskjellige buffere.
Stabilisatorer: vannløselige aminforbindelser, etylendiamin, dietylentriamin, trietylentetramin, etc.; Vannløselige aminosyrer eller salter, etylendiamintetraeddiksyre, trietylentetraminheksaeddiksyre, trans-1,2-cykloheksandiamintetraeddiksyre eller salter, etc.; vannløselige organofosfater eller salter, amino-tris (metylenfosfonsyre), 1-hydroksyetyliden-1,1-difosfonsyre, etylendiamintetra (metylenfosfonsyre), dietanolamin, pentakis (metylenfosfonsyre) eller salter, etc.; vannløselige aromatiske nitroforbindelser kan også tilsettes, slik som mono-, di- og tri-nitrobenzolsyre, mono- og dinitrosalisylsyre, nitrobenzendikarboksylsyre, mono-, di- og tri-nitrofenol, dinitroaminofenol, mono-, di- og tri-nitrobenzen, etc.
Andre sukkerarter enn stivelse kan også omfatte heksoser, glukose, mannose, galaktose og andre monosakkarider, erytritol, pentitol, heksanol og andre sukkeralkoholer, glukarsyre og andre aldonsyrer, glukonsyre, heksatonsyre og andre aldonsyrer, oligosakkarider, etc. Disse sukkerforbindelsene kan øke stabiliteten til platingløsningen og utvide strømtetthetsområdet for det lyse platingområdet.
Platingresultatene er vist i tabell 1-47.
Tabell 1-47 Ulike sulfittgullbeleggbad, driftsforhold og effekter av tilsetningsstoffer
| Serienummer | Ulike sulfittgullbeleggbad og driftsforhold | Additiv effekt |
|---|---|---|
| Nr. 1 |
Gullnatriumsulfitt 10 g/L Natriumsulfitt 65 g/L Trinatriumsitrat 65 g/L Etylendiamintetrametylenfosfonsyre (EDTMP) 85 g/L pH 7 Temperatur 60 ℃ Total strøm 0,2A Prøvesubstrat: 42Fe-Ni-legering Ideell strømtetthetsmetode med sterk omrøring |
Elektrolyse ved 1080 ℃, nedbrytning av elektropletteringsløsningen produserer svarte partikler. Utseendet til pletteringslaget med forskjellige strømtettheter produserer flekker og svie. |
| Nr. 1 Tilsett natriumkarboksymetylcellulose (CMC) 10 g/L til platingløsningen. Andre betingelser er de samme som nr. 1. | Elektroavsetning 1740 ℃, nedbrytning av platingløsning, svarte partikler. Utseendet på platingslaget forbedres, og flekker og svie er tydelig redusert. | |
| Nr. 2 |
Gullnatriumsulfitt 10 g/L Natriumsulfitt 130 g/L Trinatriumsitrat 65 g/L Triammoniumsitrat 65 g/L p-Nitro(benzen)fenol 1 g/L pH 7 Temperatur 40 ℃ Total strøm 0,2A Prøvesubstrat: kobber Sterk omrøring |
Områder med høy strømtetthet er brent, platinglaget ser veldig dårlig ut, diffuse flekker vises |
| Nr. 2 platingløsning med stivelse 5 g/L, andre betingelser er de samme som nr. 2. | Ingen brenning i områder med høy strømtetthet, godt utseende på platingslaget i bredt strømtetthetsområde, stabil platingløsning. | |
| Nr. 3 |
Natriumgullsulfitt 10 g/L Natriumsulfitt 100 g/L Dinatriumborat 50 g/L Borsyre 100 g/L p-Nitro(benzen)fenol 1 g/L pH 7 Temperatur 40 ℃ Total strøm 0,2A Prøvesubstrat: kobber Sterk omrøring |
Dårlig utseende på platinglaget |
| Tilsett 5 g/L stivelse til nr. 3 platingløsning, andre betingelser er de samme som nr. 3. | Godt utseende på platingslaget i et bredt spekter av strømtetthet, stabil platingløsning. | |
| Nr. 4 |
Natriumgullsulfitt 12 g/L Natriumsulfitt 100 g/L Fosfitt 3 g/L Etylendiaminhydrat 30 g/L pH 7 Temperatur 60 °C Total strøm 0,2A Prøvesubstrat: 42Fe-Ni-legering Sterk omrøring |
Høy strømtetthetsområde brent, platinglagets utseende er ekstremt dårlig |
| Nr. 4 tilsett stivelse 5 g/L til platingløsningen, andre betingelser er de samme som nr. 4. | Godt utseende på platingslaget og stabilitet av platingløsningen i et bredt spekter av strømtetthet. | |
















