¿Qué es el chapado químico en oro y cómo funciona?
Baño de oro químico: Técnicas, soluciones y aplicaciones para joyería
Introducción:
¿Qué es el chapado químico en oro? Es un proceso que se utiliza para depositar una fina capa de oro sobre diversos materiales, mejorando su apariencia y durabilidad. ¿Cómo funciona? El chapado químico en oro consiste en utilizar soluciones especiales con iones de oro y agentes reductores. Los métodos tradicionales suelen utilizar cianuro, pero también existen opciones sin cianuro. ¿Por qué elegir el chapado químico en oro? Ofrece un acabado uniforme y de alta calidad, ideal para joyería y otros artículos decorativos. Tanto si eres joyero, diseñador o vendedor, comprender estas técnicas puede elevar el nivel de tus productos.

Índice
Sección I. Chapado químico de oro con cianuro
1. Descripción general
Debido a la alta densidad de componentes electrónicos, la complejidad del diseño de líneas, la microfabricación de circuitos y la independencia de las propiedades eléctricas, el dorado químico, que simplifica el proceso de chapado, se ha convertido en un método indispensable. Sin embargo, presenta las siguientes desventajas:
① Velocidad lenta;
② Condiciones de uso y rango operativo limitados, lo que aumenta la dificultad de gestión;
③ La superficie del material debe estar completamente limpia;
④ La vida útil de la solución de recubrimiento es corta (propensa a reacciones de autorreducción);
⑤ El espesor del recubrimiento es muy sensible a las condiciones de agitación.
Por lo tanto, el dorado químico debe realizarse con equipo especializado. La composición de la solución de dorado químico de uso común se muestra en la Tabla 1-24, y se prepara combinando diversas sales de coordinación de oro y agentes reductores.
Tabla 1-24. Tipos de sales de coordinación de oro y agentes reductores en la solución de chapado químico en oro.
| agente reductor | KAu(CN)2 | KAu(CN)4 | Na3Au(SO2)2 | HAuCl4 • 3 horas2O | HAuCl4 • 3 horas2O | AuCN | KAu(CN)4 | KAu ・ O2 | KAu(OH)4 | AuI | No específico |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Hipofosfito de sodio | 57,58 | 71 | 77 | ||||||||
| Formaldehído | 71 | 78 | |||||||||
| Biazida | 59 | 71 | 76 | 78 | |||||||
| borohidruro | 60,61 | 72 | 78 | 79 | |||||||
| Metilborano | 60 | 69 | 74 | 75 | 79 | 80 | |||||
| Hidroxilamina | 62 | ||||||||||
| Inédito | 63 | 73 | 81 | ||||||||
| Tiourea | 64 | ||||||||||
| hidróxido de amonio | 65 | ||||||||||
| Tartrato de sodio y potasio tetrahidratado (combinado) | 66 | 70 | |||||||||
| N,N-dimetilamida | 82 | ||||||||||
| N,N-dimetilglicina | 67 | ||||||||||
| Ninguno | 68 |
Tabla 1-25 Funciones de los componentes en la solución química de chapado en oro
| Componente | Propósito | Nombre compuesto |
|---|---|---|
| Ion de oro | Suministro de oro metálico | KAu(CN)2KAu(CN)4、AUCN、 Na3Au(SO2)2. HAuCl4 • 3 horas2O、KAu ・ O2 |
| Agente reductor | Agentes reductores para la deposición de oro | Tartrato de sodio y potasio tetrahidratado, borohidruro, aminoborano, formaldehído, hipofosfito, N,N-dimetilglicina, ácido ascórbico |
| agentes quelantes orgánicos | Acción amortiguadora para prevenir la rápida deposición de oro | EDTA, citrato de potasio, ácido tartárico |
| Estabilizador | Enmascarar los núcleos activos para evitar la descomposición de la solución de recubrimiento. | tiourea, cianuro metálico, acetilacetona |
| Activador | El efecto ralentizador del agente quelante moderador | ácido succínico |
| agente amortiguador | Mantener un pH determinado | Fosfatos, citratos, tartratos |
| Tensioactivo | Facilita la humectación de las piezas chapadas. | sulfonatos alifáticos, sulfatos de alcohol |
2. Solución de chapado en oro con hipofosfito
Cuando el metal base y el oro en la solución de recubrimiento experimentan una reacción de desplazamiento, el metal con menor potencial electroquímico se ioniza con mayor facilidad que el oro. Durante la reacción, una vez que la superficie del metal base queda completamente cubierta por oro, la reacción se detiene inmediatamente, obteniéndose así una capa de recubrimiento de oro de tan solo 0,1 a 0,3 μm de espesor. Esta solución de recubrimiento, también conocida como solución de Brookshire, es una solución antigua y constituye la base de las soluciones químicas de recubrimiento de oro que se comercializan actualmente. Características de la solución de recubrimiento: la capa base para el recubrimiento de oro debe ser de níquel para que se produzca la reacción de desplazamiento; el oro no puede depositarse por desplazamiento sobre cobre.
(1) Composición y condiciones de la solución de chapado químico de oro con hipofosfito
Las tablas 1-26 muestran la composición típica de la solución de chapado químico de oro con hipofosfito.
Tabla 1-26 Composición y condiciones de la solución de chapado químico de oro con hipofosfito
| Composición y condiciones de funcionamiento | Número de serie | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Cianuro de oro y potasio (g/L) | 2 | 2 | 20 | 2 | 2 |
| Hipofosfito de sodio/(g/L) | 10 | 10 | 10 | 10 | 10 |
| Cianuro de potasio (g/L) | 0.2 | 0.2 | 80 | 0.4 ① | 0.2 |
| Temperatura/°C | 96 | 96 | 96 | 96 | 96 |
| pH | 13.5 | 7.5 | 13.5 | 13.5 | 7.1 |
| Tasa de carga/(cm2/centímetro3) | 0.25 | 0.25 | 0.25 | 0.25 | 0.25 |
| Tasa de recubrimiento/[mg/(cm²)]2· h)] | 9.8 | 9.85 | 12.3 | 8.2 | 3.86 |
(2) El efecto del níquel en la velocidad de deposición de la solución de recubrimiento de hipofosfito
En la solución de chapado químico de oro con hipofosfito como agente reductor, los iones metálicos activos (Ni)2+Se añaden ). El metal (níquel) y el oro se codepositan en cantidades mínimas sobre la superficie de las piezas chapadas, creando una gran fuerza motriz química y aumentando la velocidad del chapado en oro. El principio se muestra en el diagrama del modelo de la figura 1-25.
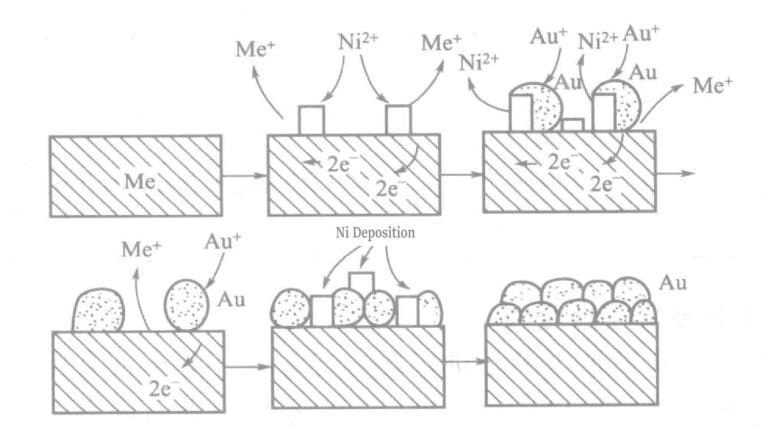
Tabla 1-27 Composición y condiciones de operación de la solución de chapado en oro con hipofosfito
| Composición y condiciones de funcionamiento | I | II | Composición y condiciones de funcionamiento | I | II |
|---|---|---|---|---|---|
| Cianuro de oro y potasio (g/L) | 2, 5, 7 | 2, 5, 7 | Cianuro de potasio (g/L) | - | 2 |
| Citrato de sodio/(g/L) | 75 | 75 | H2NNH2 · H2O /(g/L) | - | 2 |
| Hipofosfito de sodio/(g/L) | 15 | 15 | pH | 8.5 | 4.3 |
| EDTA-2Na/(g/L) | - | - | Temperatura/℃ | 70, 90 | 70, 90 |
| Cloruro de sodio/(g/L) | - | 5 |
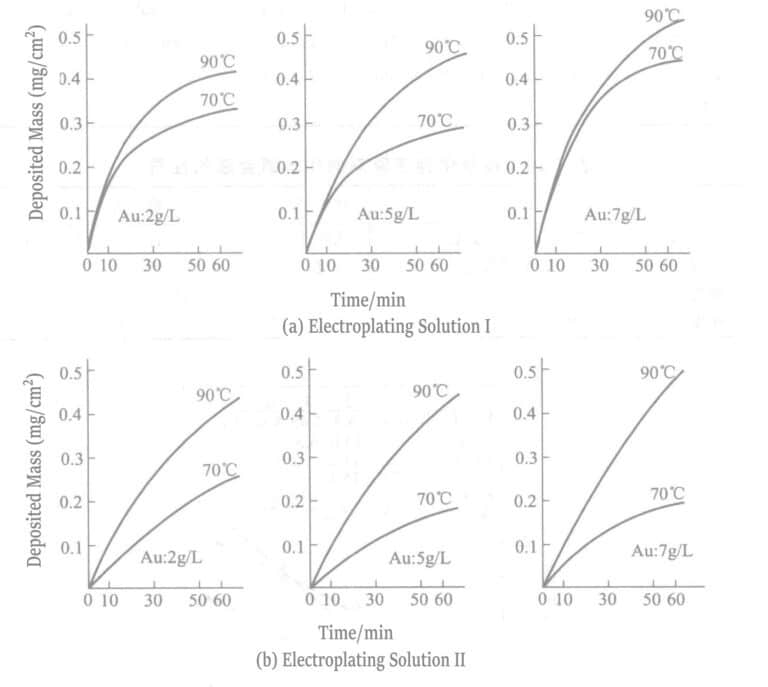
3. Solución de recubrimiento de sal de borohidruro
(1) Composición y propiedades de la solución química de chapado en oro de borohidruro de potasio
En 1969, Okinaka et al. propusieron el uso de una solución de recubrimiento con compuestos de borohidruro como agente reductor. La composición y las condiciones de la solución química de recubrimiento de oro con borohidruro se muestran en las Tablas 1-28, y las propiedades de las capas de oro depositadas con estas soluciones se muestran en las Tablas 1-29. El espesor de las capas de recubrimiento depositadas en diferentes tiempos con diversas soluciones se indica en la Figura 1-27. Los resultados resumidos de los agentes reductores borohidruro de potasio y dimetilamina borano se muestran en la Tabla 1-30.
Tabla 1-28 Composición y condiciones de operación de la solución química de chapado en oro con borohidruro de potasio
| Composición y funcionamiento | Número de serie | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Cianuro de oro y potasio (g/L) | 0,02 mol/L (5,8 g/L) | 0,03 mol/L (8,6 g/L) | 0,005 mol/L (1,45 g/L) |
| Cianuro de potasio | 0,2 mol/L (13,0 g/L) | 0,2 mol/L (13,0 g/L) | 0.1 mol/L (6,5 g/L) |
| hidróxido de potasio | 0,2 mol/L (11,2 g/L) | 0,2 mol/L (22,4 g/L) | 0,2 mol/L (11,2 g/L) |
| borohidruro de potasio | 0,4 mol/L (21,6 g/L) | 0,8 mol/L (43,1 g/L) | 0,2 mol/L (10,8 g/L) |
| Temperatura/°C | 75 | 75 | 75 |
Tabla 1-29 Propiedades de la solución de chapado químico en oro con agente reductor de borohidruro de potasio
| Naturaleza | Datos | Naturaleza | Datos |
|---|---|---|---|
| Fuerza de unión | Excelente resistencia de unión de la capa metálica | Porosidad | No se observaron poros de tamaño superior a 1 μm en la superficie uniforme. |
| Apariencia | Amarillo apagado | Pureza | 99. 9% |
| Densidad | Contenido de oro: 19,3 g/cm³3 | Valor de resistencia | 0,03 Ω/cm2 (Au: 1 μm) |
| Dureza | Dureza Nup 60〜80 | soldabilidad | Excelente |
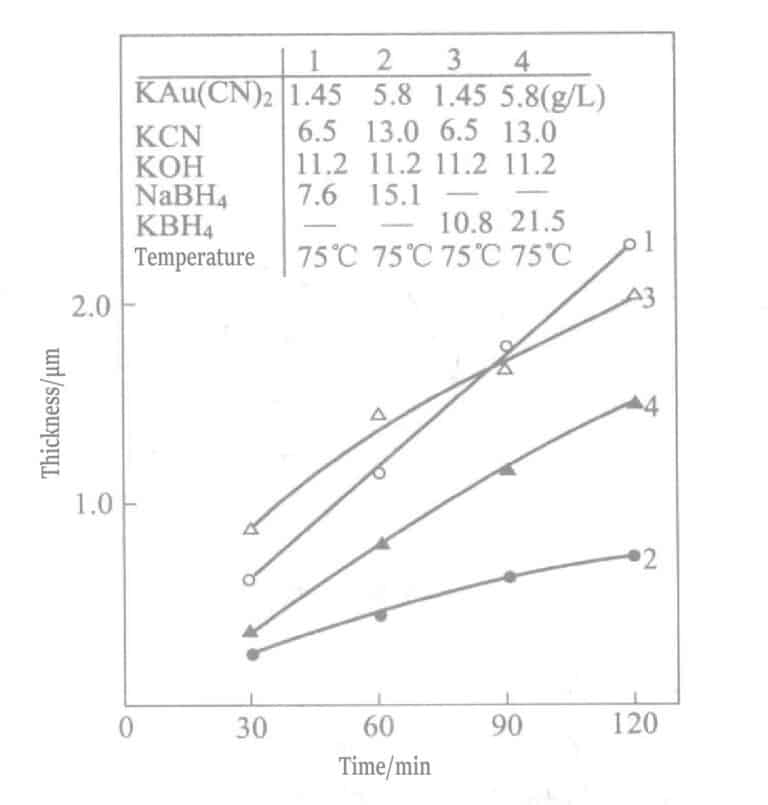
Tabla 1-30 Funciones de los componentes en la solución química de chapado en oro con borohidruro de potasio
| Factores influyentes | Solución de recubrimiento de borohidruro de potasio | solución de recubrimiento DMAB (dimetilaminoborano) |
|---|---|---|
| Efecto de la concentración de oro | Cuando la concentración de oro alcanza los 0,002 mol/L, la tasa de precipitación aumenta bruscamente y disminuye por encima de ese valor. | La tasa de precipitación aumenta linealmente a una concentración de oro de 0,01 mol/l, pero no tiene efecto por encima de esa concentración. |
| Efectos del cianuro de potasio |
Solución de recubrimiento inestable cuando está por debajo de 0,005 mol/l. El oro no precipita por encima de 0,2 mol/l. |
Igual que a la izquierda |
| Efecto del borohidruro de potasio | El BH no es estable a temperatura ambiente. La adición de hidróxido de potasio mejora la estabilidad del baño y la velocidad de precipitación disminuye al aumentar la concentración. | El DMAB es estable a temperatura ambiente; la velocidad de precipitación aumenta con el incremento de hidróxido de potasio. |
| Concentración del agente reductor | Aumento de la tasa de precipitación con el aumento de la concentración | |
| Efecto de la temperatura del baño de recubrimiento | Aumentar la tasa de precipitación en 10 ℃ y descomponer a 85 ℃. |
(2) Influencia de la velocidad de recubrimiento y de los iones de metales pesados
La adición de trazas de iones de metales pesados (plomo, talio, etc.) a la solución de dorado químico aumenta significativamente la velocidad de deposición. McIntyre explicó este efecto de la siguiente manera: debido a la baja deposición potencial, el efecto catalítico de los átomos de plomo adsorbidos, como se muestra en los mecanismos (1-4) y (1-5), promueve la nucleación.
Pb2+ + 2e– → Pbanuncio (1-4)
2Au(CN)2– + Pbanuncio → 2Au + Pb2+ + 4CN– (1-5)
Debido a la gran diferencia en las funciones de trabajo entre el cobre, el oro y los iones de plomo, este último se reduce y deposita a un potencial más positivo que el potencial redox termodinámico, formando una monocapa. Debido a la reacción catalítica de los átomos de plomo adsorbidos, como se muestra en (1-4) y (1-5), la reacción de reducción de Au(CN)₆³⁻ se produce rápidamente, promoviendo eficazmente la deposición de oro.
La relación entre la concentración de plomo y la velocidad de deposición en la solución de dorado reductora con borohidruro de potasio se muestra en la Figura 1-28, y la composición de la solución se muestra en la Tabla 1-31. El plomo se añade en forma de nitrato de plomo. La Figura 1-28 muestra que la concentración de plomo añadida a la solución solo puede ser de aproximadamente 20 ml/L, y que añadir más no tiene ningún efecto.
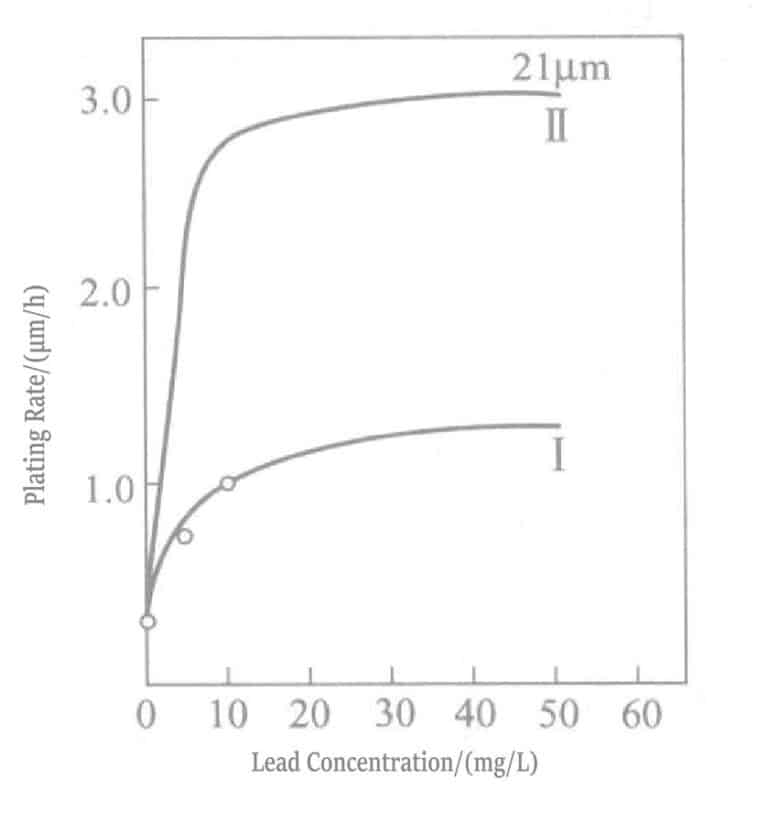
Tabla 1-31 Composición y condiciones de operación de la solución de chapado de oro con borohidruro de potasio
| Composición y condiciones de funcionamiento | I | II | Composición y condiciones de funcionamiento | I | II |
|---|---|---|---|---|---|
| Cianuro de oro y potasio (g/L) | 2 | 2 | Cianuro de potasio (g/L) | 10 | 10 |
| Borohidruro de potasio (g/L) | 2 | 10 | EDTA-2Na/(g/L) | 5 | 5 |
| Cianuro de potasio (mg/L) | 5 | 5 | Temperatura de la solución de recubrimiento/°C | 75 | 75 |
Tabla 1-32 Composición de la solución de chapado en oro BMAB
| Composición y condiciones de funcionamiento | Concentración | Composición y condiciones de funcionamiento | Concentración |
|---|---|---|---|
| Cianuro de oro y potasio (g/L) | 2 | Cianuro de potasio (g/L) | 30 |
| BMAB/(g/L) | 10 | EDTA-2Na/(g/L) | 5 |
| Cianuro de potasio (mg/L) | 5 | pH | 13.6 |
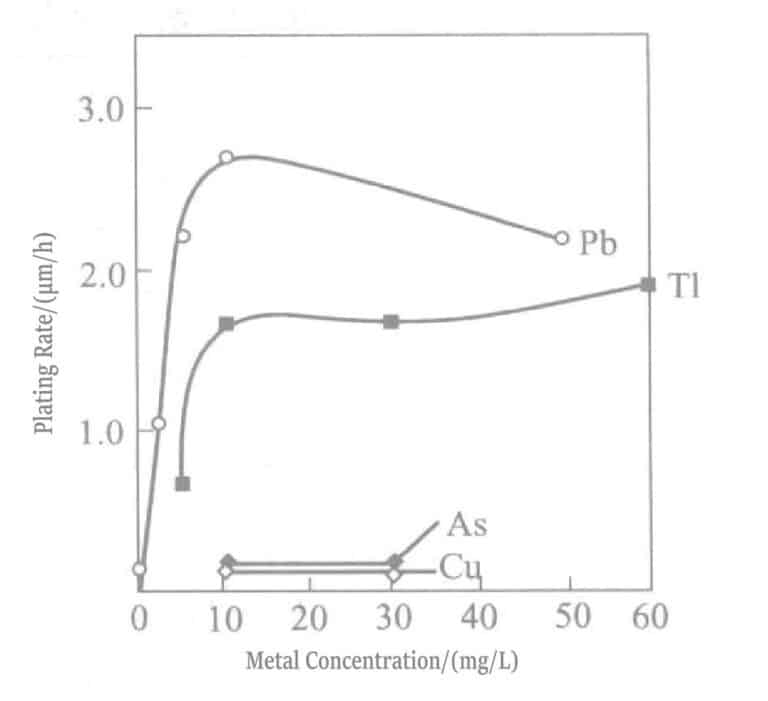
Tabla 1-33 Composición de la solución química de chapado en oro de cianuro de oro(III) y potasio
| Composición | Parámetros | Composición | Parámetros |
|---|---|---|---|
| KAu(CN)4(g/L) | 4 | KOH/(mg/L) | 11.2 |
| KBH4(g/L) | 3 | Temperatura/℃ | 70 |
| PbCl2(mg/L) | 0.5 |
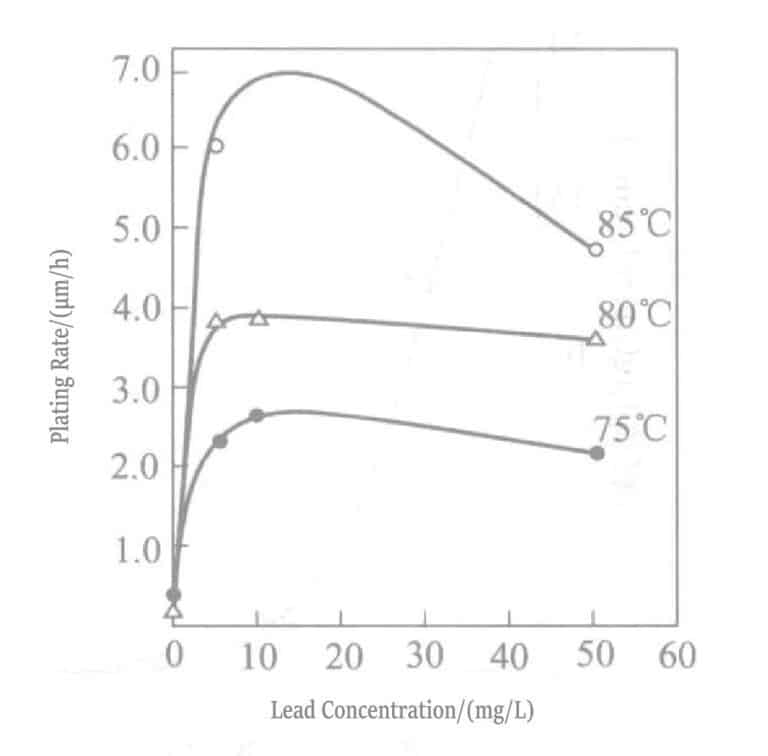
Figura 1-30 Efecto de la temperatura y la concentración de plomo en la velocidad de precipitación del oro
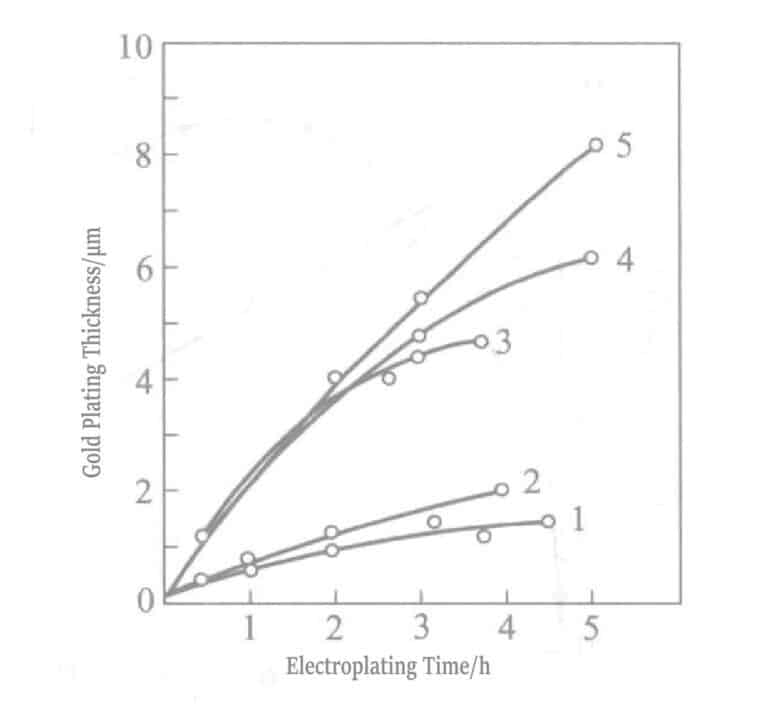
Figura 1-31 Relación entre el tiempo de chapado y el espesor de la capa chapada en oro
1 - No remover Au+ líquido; 2 - Sin agitar Au3+ líquido; 3 - Agitar Au3+ líquido; 4 - Reponer Au3+ líquido; y 5 - Au renovador3+ líquido
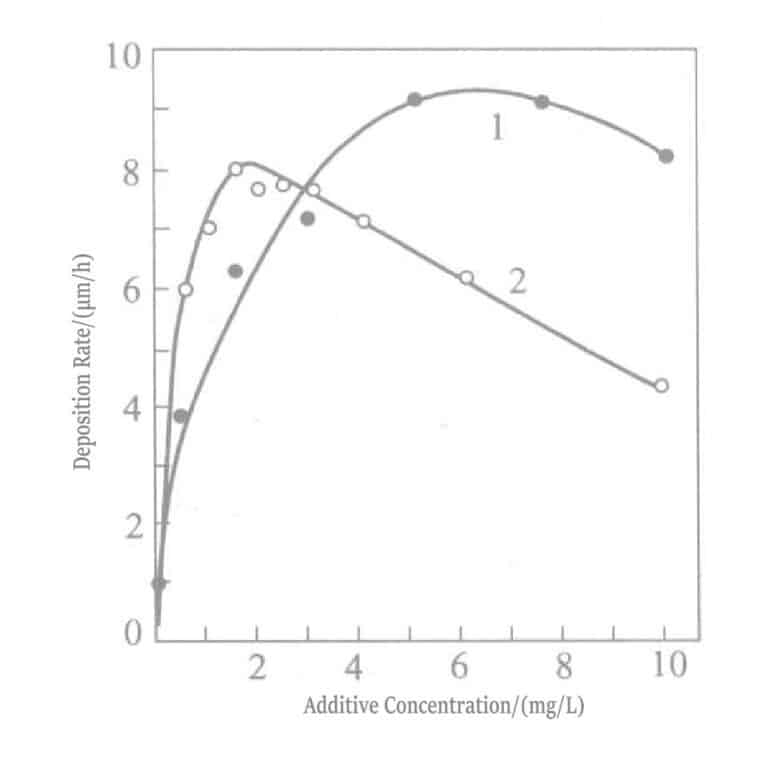
Figura 1-32 Efecto de las concentraciones añadidas de plomo y talio en la velocidad de chapado en oro
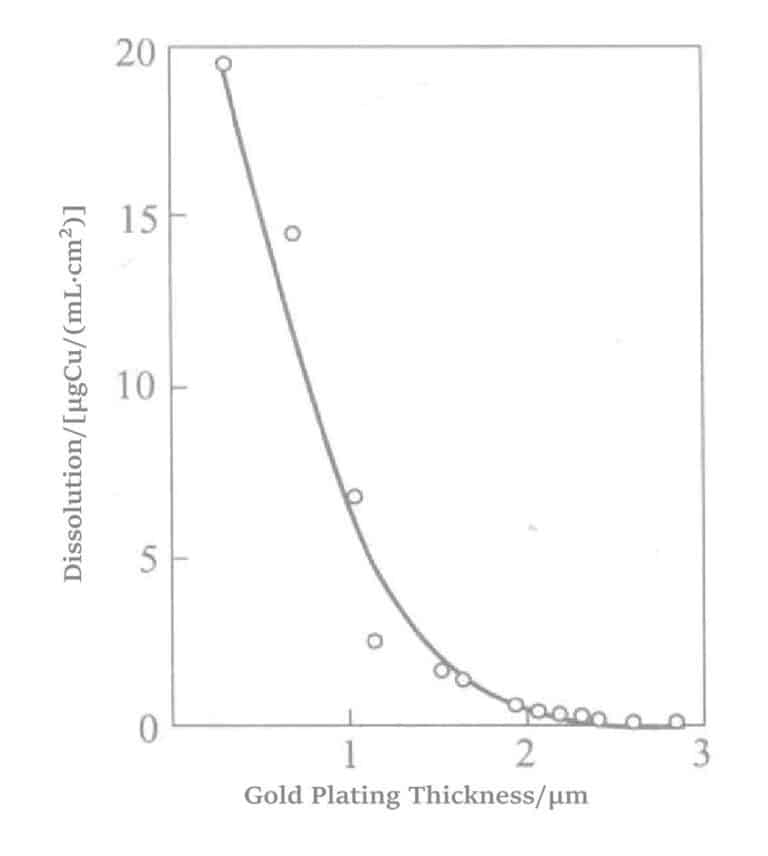
Figura 1-33 Porosidad de la capa de chapado de oro electrolítico
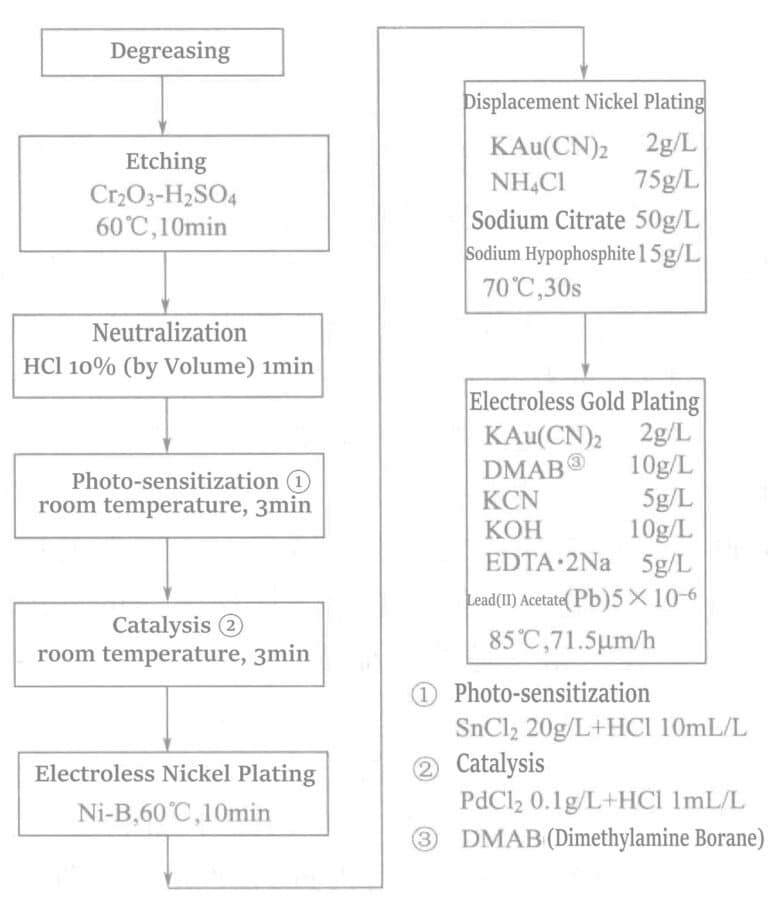
El proceso químico de chapado en oro del vidrio cristalizado (SiO₂)2 46% + Al2O3 16% + MgO 17% + K2O 10% + F 4% + B2O3 7% ) se muestra en la Figura 1-34.
4. Mecanismo de reacción de la solución química de chapado en oro con sal de borohidruro
Lin Zhongfu et al. propusieron que las soluciones de chapado de oro de borohidruro de potasio y DMAB (dimetilamina borano) de la Tabla 1-34 pueden convertirse en soluciones de chapado de oro prácticas después de agregar estabilizadores.
(1) Composición de dos soluciones de recubrimiento: La tabla 1-34 muestra las dos composiciones.
Tabla 1-34 Soluciones de recubrimiento químico con borohidruro de potasio y DMAB
| Composición de la solución de recubrimiento | Solución de recubrimiento de borohidruro de potasio | solución de recubrimiento DMAB |
|---|---|---|
| Cianuro de oro y potasio (mol/L) | 0.02 | 0.02 |
| Cianuro de potasio (mol/L) | 0.2 | 0.02 |
| Hidróxido de potasio (mol/L) | 0.2 | 0.8 |
| Borohidruro de potasio (mol/L) | 0.4 | - |
| DMAB/(mol/L) | - | 0.4 |
| Temperatura/°C | 75 | 85 |
| Velocidad de recubrimiento (μm/h) | 0.7 | 0.4 |
(2) Mecanismo de reacción: En la solución de chapado de oro con borohidruro de potasio, BH4– El BH por sí solo no produce un efecto reductor, sino el intermedio.3OH– de su producto de hidrólisis BO2– actúa como agente reductor.
BH4– + H2O → BH3OH–+ H2 (1-6)
BH3OH– + H2O → BO2– + 3 horas2 (1-7)
BH3OH– + 3OH– → BO2– + 3/2 H2 + 2H2O + 3e– (1-8)
Au(CN)2– + e– → Au + 2CN– (1-9)
BH3OH– + 3Au(CN)2– + 3OH– → BO2– + 3/2 H2 + 2H2O + 3Au + 6CN – (1-10)
Las reacciones de hidrólisis de las ecuaciones (1-6) y (1-7) se analizaron mediante polarografía. El resultado muestra que la reacción (1-7) es 500 veces más rápida que la reacción (1-6). Por lo tanto, la tasa de utilización del borohidruro de potasio en la reacción de dorado es muy baja. En condiciones típicas de dorado, la tasa de utilización efectiva no supera entre 21TP³T y 31TP³T, y la mayor parte del agente reductor permanece inactivo debido a la hidrólisis.
La reacción de hidrólisis descrita anteriormente se produce rápidamente a pH bajo (reacción catalizada por ácido), y la velocidad de deposición de oro es elevada cuando la concentración de hidróxido de potasio es baja. Para evitar la descomposición natural de la solución de dorado, la concentración de hidróxido de potasio debe mantenerse por encima de 0,1 mol/L. La relación entre la velocidad de deposición de oro y la concentración de hidróxido de potasio se muestra en la Figura 1-35.
![Figura 1-35 Curva de variación de la velocidad de recubrimiento con la concentración de hidróxido de potasio [KAu(CN)2 0,02 mol/L, KCN (línea continua) 0,2 mol/L, KCN (línea discontinua) 0,1 mol/L, 80 °C]](https://sobling.jewelry/wp-content/uploads/2025/11/Page_58_docsmall.com_副本-768x801.jpg)
Figura 1-35 Curva de variación de la velocidad de recubrimiento con la concentración de hidróxido de potasio
[KAu(CN)2 0,02 mol/L, KCN (línea continua) 0,2 mol/L, KCN (línea discontinua) 0,1 mol/L, 80 °C]
![Figura 1-36 Efecto de la concentración de hidróxido de potasio en la velocidad de recubrimiento de la solución de recubrimiento DMAB, DMAB [KAu(CN)2 0,02 mol/L, KCN 0,2 mol/L, DMAB 0,4 mol/L, 75 ℃]](https://sobling.jewelry/wp-content/uploads/2025/11/Page_58_docsmall.com_副本1-768x560.jpg)
Figura 1-36 Efecto de la concentración de hidróxido de potasio en la velocidad de deposición de la solución de deposición de DMAB, DMAB
[KAu(CN)2 0,02 mol/l, KCN 0,2 mol/l, DMAB 0,4 mol/l, 75 ℃]
(CH3)2NH2 • BH3 + OH– → (CH3)2NH2 + BH3OH– (1-11)
(3) Problemas con la solución de recubrimiento de borohidruro de potasio y la solución de recubrimiento de DMAB
La figura 1-37 muestra que la velocidad de recubrimiento varía con la concentración de iones de cobre y níquel en la solución de recubrimiento. Cuando la concentración de iones de níquel es de 10-5mol/L, la velocidad de recubrimiento comienza a disminuir, y cuando la concentración de iones de níquel alcanza 10-3A una concentración de mol/L, la solución de recubrimiento se descompone. Los iones de cobre prácticamente no influyen en la velocidad de recubrimiento. En la etapa inicial del recubrimiento de oro, los iones de oro y níquel experimentan una reacción de desplazamiento, disolviéndose trazas de iones de níquel, lo que reduce la velocidad de recubrimiento.

Figura 1-37 Efecto de los iones de cobre y níquel en la velocidad de recubrimiento
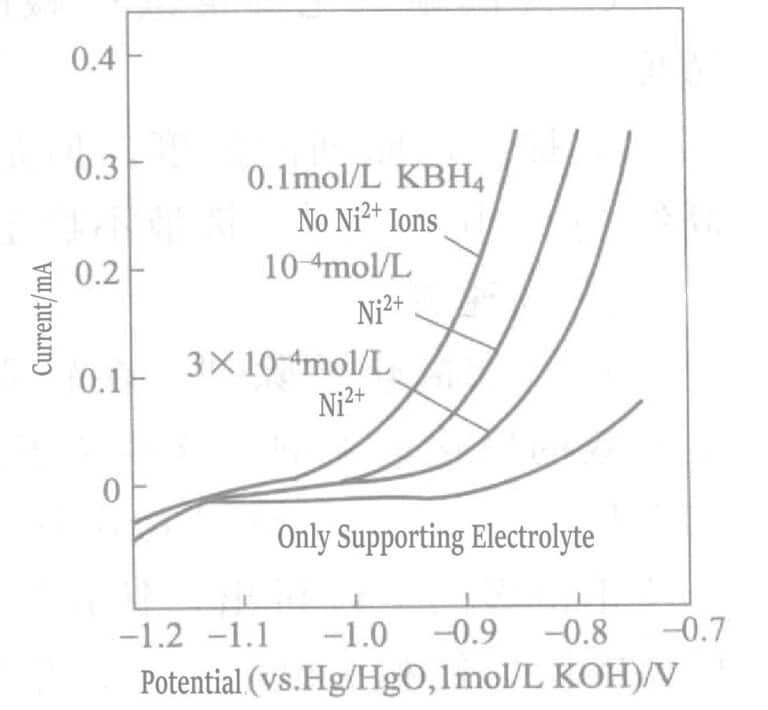
Figura 1-38 Efecto de trazas de iones de níquel en la corriente de oxidación anódica del BH3OH
(Electrodo rotatorio de oro, 2000 r/min, 75 ℃, KOH 0,2 mol/L, KCN 0,1 mol/L)
El efecto de añadir trazas de iones de níquel sobre el BH3OH– La corriente de oxidación anódica se muestra en la Figura 1-38. La adición de trazas de iones de níquel inhibe significativamente la reacción de oxidación del agente reductor BH4.3OH– en el ánodo de disco giratorio de oro. Esto se debe a que los iones de níquel existen en forma de sal de ligando de cianuro Ni(CN)42- , y este ion complejo se adsorbe preferentemente en la superficie de oro, dificultando la deposición de oro.
Las capas base inestables (como el nitruro de aluminio) no admiten soluciones fuertemente alcalinas. El pH de la solución de recubrimiento depende de la naturaleza del agente reductor, lo cual constituye el principal inconveniente de las soluciones de recubrimiento con borohidruro de potasio y DMAB.
Respecto a los problemas mencionados anteriormente, salvo que el pH de la solución de recubrimiento no se puede modificar, otros aspectos sí se pueden mejorar.
(4) Mejorar la solución de chapado en oro con borohidruro de potasio y la solución de chapado en oro con DMAB.
① Aumentar la velocidad de chapado
- a. Modificar la composición básica y las condiciones de operación de la solución de recubrimiento para aumentar la velocidad de recubrimiento.
- b. Aumentar la velocidad de agitación.
- c. Aumentar la temperatura de la solución de recubrimiento.
- d. Reducir la concentración de cianuro libre.
- e. Disminuir la concentración de álcali en la solución de recubrimiento de borohidruro de potasio y aumentar la concentración de álcali en la solución de recubrimiento de DMAB.
- f. Aumentar la concentración del agente reductor. Sin embargo, cuando la velocidad de recubrimiento sin aditivos especiales aumenta en aproximadamente 2 μm/h o más, la solución de recubrimiento se vuelve inestable y propensa a la descomposición.
② Solución de recubrimiento de alta velocidad
- a. Añadir eliminadores de polarización. En soluciones de chapado de oro blando, Pb2+ , T1+ Los iones son eliminadores de polarización eficaces. Estos iones se adsorben fuertemente en la superficie de oro, produciendo el fenómeno denominado UPD (deposición bajo potencial), donde el plomo se deposita a un potencial mucho más positivo que el Pb.2+ / Potencial de equilibrio del Pb y depósitos de talio a un potencial más positivo que el T1+ /T1 potencial de equilibrio. El plomo, el talio y el Au(CN) depositados2– sufre reacciones de desplazamiento, lo que provoca que la reacción de deposición de oro se desplace a un potencial más positivo (debilitamiento de la polarización). Por otro lado, la adición de estos iones a las soluciones de chapado químico de oro, de forma similar al chapado electrolítico, desplaza el Au(CN)2– El potencial de reducción en la dirección positiva da como resultado una mayor velocidad de deposición, que puede alcanzar aproximadamente 10 μm/h. Soluciones de deposición con Pb añadido2+ , T1+ Los iones se muestran en las Tablas 1-35 y 1-36.
Tabla 1-35 Solución de recubrimiento de borohidruro de potasio con Pb añadido2+
| Solución 1 | Solución 1 | ||
|---|---|---|---|
| Cianuro de oro y potasio | 5 g/L | coloidal | 2 g/L |
| Cianuro de potasio | 8 g/L | Solución 2 | |
| Citrato de sodio | 50 g/L | borohidruro de potasio | 200 g/L |
| EDTA | 5 g/L | hidróxido de sodio | 120 g/L |
| cloruro de plomo | 0,5 g/L | ||
Tabla 1-36 Solución de recubrimiento de borohidruro de potasio con T1 añadido+
| Composición y condiciones de funcionamiento | Parámetros | Composición y condiciones de funcionamiento | Parámetros |
|---|---|---|---|
| Cianuro de oro y potasio | Ajustar según sea necesario | borohidruro de potasio | 5,4 ~ 10,8 g/L |
| Cianuro de potasio | 6,5 g/L | Temperatura | 70 〜 80℃ |
| hidróxido de potasio | 11,2 g/L | Tasa de recubrimiento | <10 μm/h |
| sulfato de talio | 5 〜 100 mg/L |
Au(CN)4– + 2e– → Au(CN)2– + 2CN– (1-12)
![Figura 1-39 Efecto de la adición de cloruro de plomo en la curva de polarización de la reacción de reducción de Au(CN)2- del [electrodo de oro rotatorio, KAu(CN)2 0,009 mol/L, KOH 0,2 mol/L]](https://sobling.jewelry/wp-content/uploads/2025/11/Page_61_docsmall.com_副本-768x578.jpg)
Figura 1-39 Efecto de la adición de cloruro de plomo sobre el Au(CN)2--curva de polarización de la reacción de reducción [electrodo de oro rotatorio, KAu(CN)2 0,009 mol/L, KOH 0,2 mol/L]
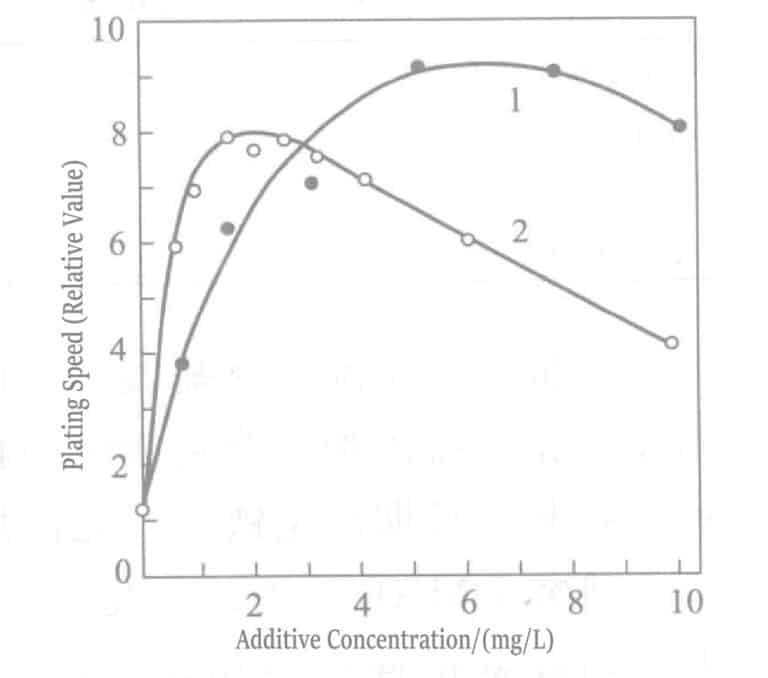
Figura 1-40 Efecto de la concentración de cloruro de talio (curva 1) y cloruro de plomo (curva 2) en la velocidad de recubrimiento de oro de la solución de recubrimiento de borohidruro de potasio
- b. Adición de estabilizadores. La adición de estabilizadores orgánicos que reducen la actividad catalítica del oro, el aumento de la temperatura de la solución de recubrimiento y la modificación de la concentración del agente reductor pueden mejorar la velocidad de recubrimiento. Por ejemplo, la velocidad de recubrimiento de soluciones que contienen ácido aminoacético, ácido hidroxietilendiaminotetraacético y ácido diazotriacético o derivados del ácido succínico puede alcanzar valores elevados de 12 a 23 μm/h a 90 °C. Sin embargo, a altas temperaturas, la reacción de hidrólisis del agente reductor se acelera significativamente, lo que dificulta el control de la solución de recubrimiento. La adición de trazas del estabilizador p-dimetilaminoazobenceno no afecta la estabilidad de la solución de recubrimiento y puede duplicar la concentración habitual de BH₄⁻, elevando la velocidad de recubrimiento a 5 μm/h. Otros estabilizadores eficaces incluyen el etilenglicol éter etílico, el dietilenglicol éter etílico y la polietilenimina.
- c. Utilizar sales de complejo de cianuro de oro trivalente. Las soluciones de recubrimiento con sales de complejo de cianuro de oro trivalente, como aquellas con cloruro de plomo o cloruro de titanio añadido, como se muestra en la Tabla 1-33, se detallan en la Tabla 1-37.
Tabla 1-37 Solución de recubrimiento de oro(III) con cianuro de potasio y borohidruro de potasio
| Composición y condiciones de funcionamiento | Parámetros | Composición y condiciones de funcionamiento | Parámetros |
|---|---|---|---|
| Oro de potasio(III) | 3 g/L | cloruro de plomo | 0,5 mg/L |
| hidróxido de potasio | 11,2 g/L | Temperatura | 70℃ |
| borohidruro de potasio | 3 g/L |
La ventaja de la solución de recubrimiento de sal compleja de cianuro de oro trivalente es que KAUO2 y KAu(OH)4 Pueden utilizarse como aditivos suplementarios de sales de oro, evitando la acumulación excesiva de iones cianuro libres en la solución de recubrimiento, reduciendo la velocidad de recubrimiento y favoreciendo una velocidad de recubrimiento estable a largo plazo. La velocidad de recubrimiento de la solución sin aditivos es de 2 a 8 μm/h.
El estudio del comportamiento electroquímico, la estructura y las propiedades de la solución de recubrimiento DMAB muestra que, de forma similar a la solución de recubrimiento de borohidruro de potasio, KAu(CN)2 Solo se utiliza al preparar la solución de chapado en oro, y se añade hidróxido de oro disuelto en hidróxido de potasio como suplemento para evitar la acumulación de iones cianuro libres. La composición de la solución de chapado se muestra en la Tabla 1-38.
Tabla 1-38 Solución de recubrimiento DMAB (hidróxido de oro disuelto en solución de hidróxido de potasio)
| Composición y condiciones de funcionamiento | Parámetros | Composición y condiciones de funcionamiento | Parámetros |
|---|---|---|---|
| Cianuro de oro y potasio | 0,013 ~ 0,018 mol/L | Aditivo | Pequeña cantidad |
| DMAB | 0,07 〜 0,1 mol/L | pH | 13.1 ~ 13.4 |
| hidróxido de potasio | 0,09 〜 0,15 mol/L | Temperatura | 70 〜 75℃ |
| Cianuro de potasio | 0,007 ~ 0,01 mol/L | Tasa de recubrimiento | 2 μm/h |
(5) Mejorar la estabilidad de la solución de recubrimiento.
El uso de aditivos puede aumentar la velocidad de recubrimiento y la estabilidad de la solución de recubrimiento, pero las impurezas producidas provocarán la descomposición de la solución de recubrimiento.
Sustancias como el EDTA y la etanolamina, añadidas a la solución de recubrimiento, forman iones complejos fuertes con los iones de impurezas metálicas, inhibiendo la reacción entre las impurezas metálicas y el BH.4– y BH3OH–De este modo, se mejora la estabilidad de la solución de recubrimiento. La composición de la solución de recubrimiento de borohidruro de potasio con EDTA y etanolamina añadidos se muestra en la Tabla 1-39.
Tabla 1-39 Solución de recubrimiento de borohidruro de potasio con EDTA y etanolamina añadidos
| Composición y condiciones de funcionamiento | Parámetros | Composición y condiciones de funcionamiento | Parámetros |
|---|---|---|---|
| Cianuro de oro y potasio | 1,45 g/L | EDTA | 5 g/L |
| Cianuro de potasio | 11 g/L | Etanolamina | 50 ml/l |
| hidróxido de potasio | 11,2 g/L | Temperatura | 72℃ |
| borohidruro de potasio | 10,8 g/L | Tasa de recubrimiento | 1,5 μm/h |
Tabla 1-40 Solución de recubrimiento con dos agentes reductores (hidrazina y DMAB)
| Composición y condiciones de funcionamiento | Parámetros | Composición y condiciones de funcionamiento | Parámetros |
|---|---|---|---|
| Cianuro de oro y potasio | 0,005 mol/L | DMAB | 0,05 mol/L |
| Cianuro de potasio | 0,035 mol/L | hidrazina | 0,25 mol/L |
| hidróxido de potasio | 0,8 mol/L | Temperatura | 80℃ |
| carbonato de potasio | 0,45 mol/L | Tasa de recubrimiento sobre la capa base de níquel (etapa inicial) | 2,6 μm/h |
| acetato de plomo | 15X10-6 | Sobre el oro (valor fijo) | 7. 8 μm/h |
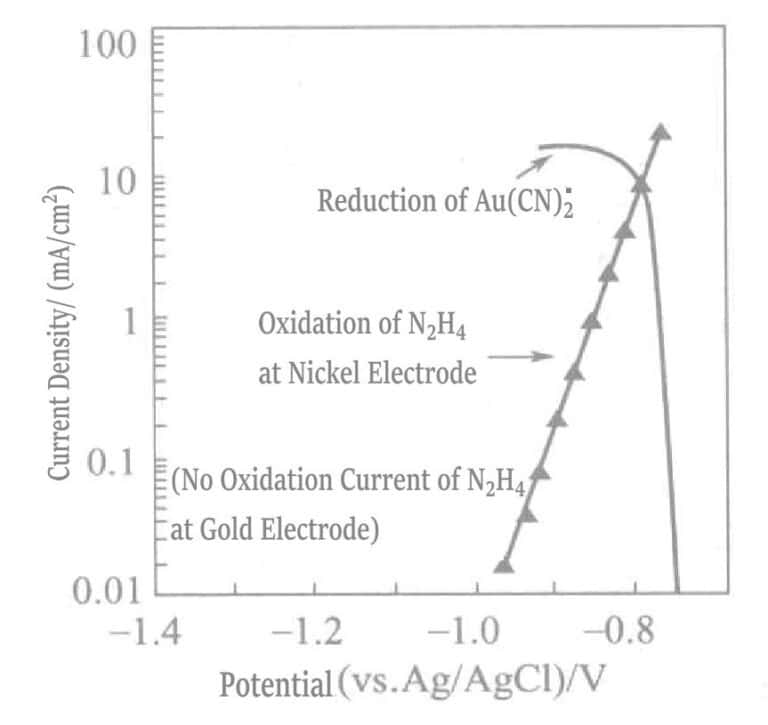
Figura 1-41 Curvas de polarización de la reacción de oxidación anódica de la hidrazina en el electrodo de níquel y la reacción de reducción catódica de Au(CN)2-.
(KOH 0, 8 mol/L, KCN 0, 035 mol/L, N2H4 0,05 mol/L, 80 °C)
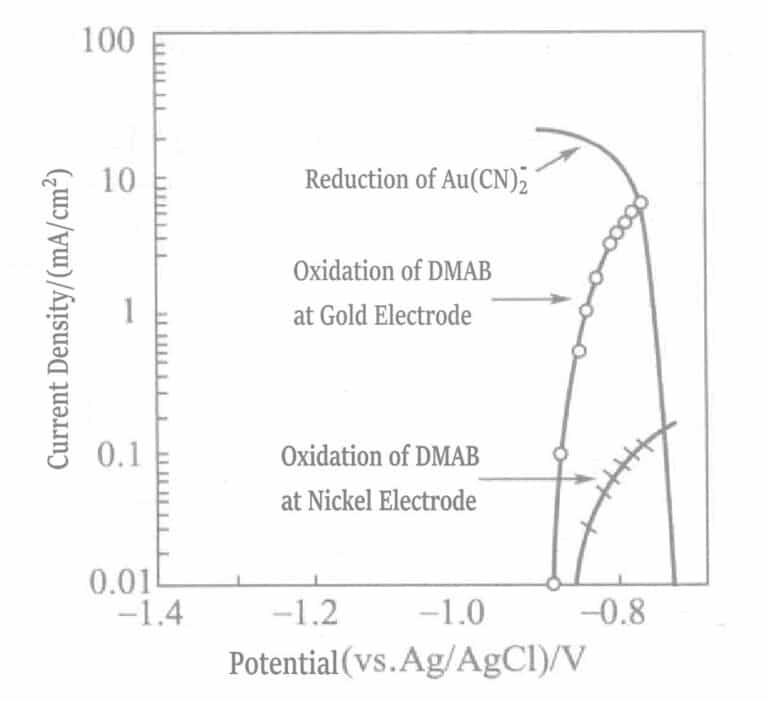
Figura 1-42 Curvas de polarización de la reacción de oxidación anódica de DMAB en electrodos de níquel y oro y la reacción de reducción catódica de Au(CN)2-
(KOH 0, 8 mol/L, KCN 0, 035 mol/L, DMAB 0, 05 mol/L, 80 ℃)
En una solución de recubrimiento que contiene únicamente hidracina como agente reductor, el oro se deposita exclusivamente gracias al efecto catalítico de la capa base de níquel. Cuando esta capa queda completamente cubierta de oro, la deposición se detiene y, en ese momento, el espesor de la capa de oro depende de la concentración de cianuro libre en la solución. Si bien el espesor máximo de recubrimiento con esta solución es limitado (aproximadamente 2 μm), la capa resultante es lo suficientemente densa como para cumplir con los requisitos de la unión por presión.
Además de la hidrazina, existen muchos otros agentes reductores disponibles en la solución de chapado de oro catalítico del material; consulte la Tabla 1-41.
Tabla 1-41 Otras soluciones de recubrimiento con agentes reductores
| agente reductor | pH | Temperatura/℃ |
|---|---|---|
| hipofosfito | 7 〜 7. 5 | 93 |
| 7.5 〜 13.5 | 96 | |
| 3 〜 4 | 70 〜 80 | |
| hidrazina | 7 〜 7. 5 | 92 〜 95 |
| 5.8 〜 5.9 | 95 | |
| 11. 7 | 95 | |
| Hidroxilamina | 2.3 〜 2.8 | 70 〜 85 |
| Cianoborohidruro de sodio (NaBH₄)3CN) | 3.5 | 90 |
| Hidrazinilborano (N2H4 ・ BH3) | >13 | 60 |
| Tiourea | 6.5 〜 7.0 | 83 〜 90 |
| 4.2 | 80 ~ 85 | |
| ácido ascórbico | 8 | 63 |
| Tricloruro de titanio | 5 | 75 |
Copywrite @ Sobling.Jewelry - Fabricante de joyería personalizada, fábrica de joyería OEM y ODM
5. Chapado químico de aleación de oro
(1) Aleación de oro y plata:
Se puede lograr un recubrimiento químico de aleación de oro y plata añadiendo continuamente una solución de cianuro de plata y potasio a la solución de recubrimiento de oro con borohidruro. Ag(CN)2– se reduce más fácilmente que el Au(CN)2–Al preparar una nueva solución de recubrimiento, si se mezclan ambos componentes, la plata precipitará primero y la aleación no podrá recubrirse.
Mediante la adición continua, gota a gota, de pequeñas cantidades de cianuro de plata y potasio a la solución de recubrimiento, manteniendo una condensación relativamente baja [relación molar Au:Ag (26:10~(26:0,5)], se puede precipitar una capa de aleación oro-plata con un contenido de plata de 80%~20%. En esta solución de recubrimiento, la precipitación de plata es un producto de reacción de sustitución del oro, que precipita primero, y del Ag(CN)2–, en solución.
(2) Aleación de oro y cobre:
En las soluciones convencionales de cobreado químico con EDTA y formaldehído como agentes reductores, basadas en la coordinación, solo el cianuro de oro y potasio permite depositar una aleación de oro y cobre. Al modificar la concentración de cianuro de oro y potasio, se puede ajustar la fracción de masa de cobre en la capa de aleación de oro entre 1% y 94%.
(3) Aleación de oro y estaño:
La solución de recubrimiento químico de aleaciones de oro y estaño utiliza SnCl₂.2 Método del agente reductor. La composición y el rango de concentración de la solución de recubrimiento se muestran en la Tabla 1-42.
Tabla 1-42 Solución de chapado de aleación de oro y estaño
| Composición y condiciones de funcionamiento | Parámetros | Composición y condiciones de funcionamiento | Parámetros |
|---|---|---|---|
| Cianuro de oro(III) de potasio | 4〜10 g/L | Triolefin | 0,05 ~ 0,5 g/L |
| Cianuro de potasio | 5-15 g/L | Temperatura | Temperatura ambiente |
| hidróxido de potasio | 60〜100 g/L | Tasa de recubrimiento | 1,5 μm/h (sin adición de triolefina) |
| cloruro de estaño | 40〜60 g/L | 5 μm/h (adición de triolefina 0,5 g/L) |
(4) Aleación de oro-indio:
La solución de recubrimiento de aleación de oro-indio se prepara añadiendo Ih2(SO4)3 y EDTA a una solución de borohidruro. El contenido de indio en la capa de recubrimiento es de 1% a 4%. A temperatura ambiente, una fina capa de recubrimiento de aleación de oro-indio depositada sobre n-GaAs activado con paladio, tras un tratamiento térmico a 350 °C, presenta una resistencia de contacto inferior a la del oro puro.
(5) Aleaciones de oro-níquel y oro-cobalto:
Uemaki desarrolló soluciones de chapado de aleación de oro-níquel y oro-cobalto de 18 a 22 quilates. Con un pH de 3 a 5, la capa de chapado de aleación de oro obtenida mediante el proceso químico de chapado con cianuro y la adición del agente reductor hipofosfito de sodio presenta propiedades físicas, como dureza y resistencia al desgaste, inferiores a las de las capas de chapado electrolítico de aleación de oro que contienen níquel y cobalto.
Sección II. Chapado químico en oro sin cianuro
1. Descripción general
El dorado por desplazamiento utiliza la diferencia de potencial entre el potencial de oxidación del metal base y el potencial de reducción de los iones de oro como fuerza impulsora de la reacción de dorado. En cambio, el dorado químico por reducción utiliza la diferencia de potencial entre el potencial de oxidación del agente reductor y el potencial de reducción de los iones de oro como fuerza impulsora de la reacción de dorado.
Los electrones involucrados en la reacción de reducción de los iones de oro son proporcionados bien por la reacción de oxidación del metal de la capa base (chapado en oro por desplazamiento) o bien por la reacción de oxidación del agente reductor (chapado en oro reductivo).
Otros métodos incluyen: ① Agregar sales de metales pesados a la solución de chapado de oro por desplazamiento, donde la superficie metálica de la capa base adsorbe los metales pesados, desplazando el potencial en la dirección que facilita la reducción de los iones de oro; ② Agregar un agente reductor a la solución de chapado de oro por desplazamiento, permitiendo que ocurran reacciones redox simultáneamente para depositar oro más grueso; ③ En soluciones de chapado de oro que contienen agentes reductores, el metal noble de la capa base actúa como agente reductor y se oxida con un catalizador, realizando un chapado de oro químico catalítico de la capa base.
Los ligandos en las soluciones químicas de chapado en oro suelen utilizar cianuro, que forma complejos muy estables con los iones de oro (constante de estabilidad K=4×10).28Actualmente, muchos componentes semiconductores han optado por utilizar soluciones de chapado de oro casi neutras, con bajo contenido de cianuro o sin cianuro, como las soluciones de chapado de oro con sulfito o tiosulfato y las soluciones de chapado de oro químicas sin cianuro con ligandos de la serie RSH de tiol.
2. Chapado químico en oro por desplazamiento
Generalmente, la resistencia de adhesión entre el dorado electrolítico de capa gruesa de tipo reducido y la capa base de metales base es relativamente baja. Por lo tanto, es necesario realizar un dorado electrolítico por desplazamiento antes de aplicar la capa gruesa de oro.
En la solución de dorado por desplazamiento, el metal base de la capa base se disuelve (oxida) en la solución electrolítica, liberando electrones. En contraste, los iones de oro en la solución aceptan electrones y se depositan (reducen) sobre la superficie no metálica. La formación de ligandos de oro disminuye la concentración de iones de oro en la solución de dorado, desplazando el potencial de reducción hacia valores más negativos, como se muestra en la Tabla 1-43.
Tabla 1-43 Ligandos y potenciales de reducción de complejos de iones de oro
| Ligandos | Ligando | E/V |
|---|---|---|
| H2O |
Au(H2O)2+ Au(H2O)43+ |
1.68 1.50 |
| Cl- |
AuCl2 - AuCl4 - |
1.15 0.92 |
| SCN- |
Au(SCN)2 - Au(SCN)4 - |
0.67 0.64 |
| I- |
AuI2- AuI4- |
0.58 0.57 |
| NH3 | Au(NH)43+ | 0.56 |
| OH- | Au(OH)4 - | 0.48 |
| Tiourea | Au(Jue)2+ | 0.38 |
| S2O32- | Au(S2O3)23- | 0.15 |
| SO32- | Au(SO3)23- | 0.06 |
| R-SH | Au(RS)2- | -0.3 〜 -0.5 |
| CN- | Au(CN)2 - | -0.65 |
La tabla 1-43 muestra que, además de los cianuros, otros ligandos como tioles, sulfitos y tiosulfatos también pueden formar complejos estables con iones de oro y exhibir potenciales negativos.
En la solución de dorado por desplazamiento con sulfito, además de los iones sulfito, se pueden utilizar ligandos como ácidos policarboxílicos poliamínicos y sus sales, aminas solubles en agua, sales de amina, sales de triacetato de etilendiamina, estabilizadores como sales de tetraalquilamonio, tetrametilenfosfonato de etilendiamina, azúcares y compuestos tiólicos. Las concentraciones de iones amonio, cloruro, sulfato, bromuro o yoduro deben mantenerse dentro de un rango específico y no ser demasiado altas; de lo contrario, pueden formarse ligandos de oro (complejos) de amonio en la solución de dorado, cuyo potencial redox es más positivo que el del sulfito de sodio. Si la solución se deja reposar o durante el dorado, el sulfito de sodio puede oxidar y reducir el oro, causando inestabilidad en la solución.
El succinato de tiol, la acetilcisteína, la cisteína y otros compuestos de la serie de tioles, junto con iones de oro, pueden formar ligandos estables en soluciones de chapado en oro libres de cianuro. El succinato de tiol [HOOCCH(SH)-CH2COOH] y el potencial de reducción del ligando del ion oro, es decir, Au(HOOCCHSCH)2COOH)2– + e– ⇌Au(s) + 2 ( HOOCCH – SCH2COOH)–Resulta difícil obtener el valor correcto del potencial de electrodo estándar para la reacción. El potencial de reducción medido de la solución de recubrimiento es de aproximadamente -0,3 a 0,5 V. El ligando de oro tiol succinato existe en la forma [Au(HOOC – CHSCH)₂]²⁺.2COOH)2]–, con oro en estado de oxidación +1.
HAuCl4 + 3 horas2O → Au(OH)3 + 4HCl (1-13)
Au(OH)3 + 4[HOOCCH(SH)CH2 COOH] → [Au(HOOCCH—S—CH2COOH)4 ]– + 3 horas2O+H+ (1-14)
[Au( HOOCCH—S—CH2COOH)4]– → [Au(HOOCCH—S—CH2COOH)2]– + ALCOHOL2CHOOCCH—S—S—CHCOOHCH2COOH (1-15)
Tabla 1-44 Solución de chapado en oro por desplazamiento sin cianuro
| Composición y condiciones de funcionamiento | Sistema de sulfitos | sistema del ácido mercaptosuccínico | ||
|---|---|---|---|---|
| Clorato de oro sódico (mol/L) | 0.05 | |||
| tiosulfato de sodio/(mol/L) | 0.028 | 0.015 | ||
| Mercaptosuccinato de oro/(mol/L) | 0.01 | |||
| sulfito de sodio/(mol/L) | 0.52 | 0.1 | ||
| Ácido mercaptosuccínico/(mol/L) | 0.25 | 0.25 | ||
| Citrato trisódico/(mol/L) | 0.22 | |||
| Acetilcisteína/(mol/L) | 0.03 | |||
| Cloruro de tetrametilamonio/(mol/L) | 0.8 | |||
| EDTA/(mol/L) | 0.015 | |||
| EDTA - 2Na/(mol/L) | 0.02 | |||
| Amino tris(ácido metilenfosfónico)/(mol/L) | 0.1 | |||
| Carboximetilcelulosa sódica (g/L) | 10 | |||
| pH | 7.0 | 7.0 | 1.5 (Ajustado con ácido clorhídrico) | 7.0 |
| Temperatura /℃ | 60 | 85 | 80 ~ 90 | |
3. Capa gruesa de chapado de oro químico de tipo reducido
En las soluciones de chapado en oro con tiosulfato como ligando, el sulfito de sodio previene la descomposición de los iones tiosulfato. En NaAuCl4 En las soluciones de chapado que contienen sales de oro trivalente, el oro monovalente se reduce por exceso de tiosulfato. En las soluciones de chapado de oro débilmente alcalinas, se suelen añadir tampones de pH como cloruro de amonio, tetraborato de sodio y ácido bórico.
Los compuestos tiólicos pueden formar ligandos con iones de oro que presentan una excelente estabilidad y actúan como agentes reductores. Entre estos compuestos tiólicos se incluyen la L-cisteína y el 2-etanamina tiol. La Tabla 1-45 muestra la composición y las condiciones de operación de las soluciones de dorado químico reductor sin cianuro, utilizando tiosulfato de sodio y compuestos tiólicos como ligandos.
Tabla 1-45 Solución de chapado en oro de tipo reductor sin cianuro
| Composición y condiciones de funcionamiento | Sistema de tiosulfato | Sistema tiol | |||
|---|---|---|---|---|---|
| clorato de oro (g/L) | 0.01 | ||||
| Clorato de oro sódico (g/L) | 0.0125 | 0.0125 | |||
| sulfito de oro sódico/(g/L) | 0.02 | ||||
| Mercaptosuccinato de oro (g/L) | 0.01 | ||||
| Ácido mercaptosuccínico/(g/L) | 0.27 | ||||
| tiosulfato de sodio/(g/L) | 0.1 | 0.17 | 0.1 | ||
| sulfito de sodio/(g/L) | 0.1 | 0.4 | |||
| sulfito de amonio/(g/L) | 0.43 | ||||
| EDTA ・ 2Na/(g/L) | 0.19 | ||||
| Trietanolamina/(g/L) | 0.034 | ||||
| Cloruro de amonio/(g/L) | 0.05 | ||||
| Tetraborato de sodio/(g/L) | 0.13 | ||||
| Fosfato dihidrógeno de potasio (g/L) | 0.15 | ||||
| Tiourea/(g/L) | 0.0033 | ||||
| Hidroquinona/(g/L) | 0.002 | ||||
| Ácido ascórbico/(g/L) | 0.25 | ||||
| Hidracina/(g/L) | 0.3 | ||||
| L-cisteína/(g/L) | 0.08 | ||||
| 2-aminoetil mercaptano/(g/L) | 0.2 | ||||
| Benzotriazol de potasio (g/L) | 0.05 | ||||
| pH | 7.5 | 7.0 | 8.0 | 7.0 | 7.5 |
| Temperatura/℃ | 60 | 80 | 70 | 80 | 80 |
4. Recubrimiento de oro químico catalítico de capa base
El dorado químico catalítico de capa base es un método de dorado químico por reducción que utiliza un agente reductor. Este agente actúa únicamente sobre la superficie del sustrato, la capa de metal base (níquel), y no sobre la superficie del oro depositado. La capa de dorado obtenida mediante este método es más lisa, densa y presenta poros menos numerosos o de menor tamaño que la obtenida mediante el dorado por desplazamiento.
En las soluciones de dorado químico con tiosulfato y sulfito, el oro se deposita sobre la superficie de níquel sin necesidad de otros agentes reductores. En la superficie de níquel, el sulfito solo reduce el complejo de oro con tiosulfato y no actúa sobre la superficie del oro, por lo que se denomina dorado químico catalítico de capa base. Simultáneamente, se produce una reacción de dorado por desplazamiento sobre la capa base de níquel. Por lo tanto, el agente reductor sulfito experimenta diferentes reacciones de oxidación, influenciadas por la composición de la capa base de níquel y las condiciones de pretratamiento. La concentración del ligando de tiosulfato sódico o el pH de la solución de dorado afectan las diferentes proporciones de las reacciones de desplazamiento y reducción, el espesor máximo de la capa de dorado, su apariencia, porosidad y adherencia; por consiguiente, es necesario seleccionar una composición adecuada de la solución y unas condiciones de dorado óptimas.
5. Estabilidad de la solución de chapado de oro químico sin cianuro
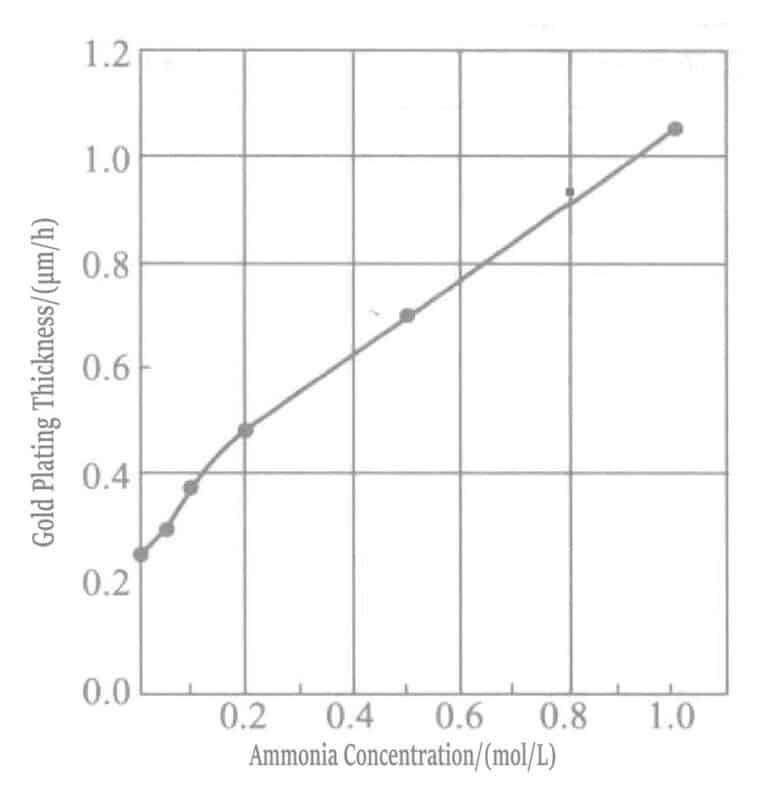
El aumento de la concentración de agua amoniacal acelera la velocidad de deposición de la capa de oro. En soluciones de recubrimiento con alta concentración de amoníaco, el succinato de mercapto actúa como agente reductor, y la reacción de reducción se produce simultáneamente con la reacción de desplazamiento.
La contaminación con iones de cobre o hierro es la principal causa de inestabilidad en las soluciones de dorado químico sin cianuro. El cobre disuelto en los poros de la capa de níquel y el hierro proveniente del sustrato favorecen fácilmente la inestabilidad de la solución de dorado químico.
Razones: ① Los iones de oro aceptan electrones liberados durante la oxidación de estos metales, lo que aumenta la velocidad de reducción. ② Los iones de cobre o hierro catalizan la reacción de oxidación del sulfito o tiol, acelerando la velocidad de reacción, lo que provoca defectos en la superficie de la capa de oro químico y reduce el rendimiento de la soldadura y la resistencia de la unión. En las soluciones de oro químico, se debe suprimir la disolución y la contaminación de estos metales mediante la adición de ligandos que formen complejos estables con los iones metálicos disueltos y contaminantes.
6. Solución química para chapado en oro sin cianuro
(1) Sales de tetracloroaurato (III) y soluciones de chapado en oro con amina borano débilmente reductoras
Sales de tetracloroaurato (III) (NaAuCl4) se reducen fácilmente para depositar oro. Se pueden usar agentes reductores de borano de amina terciaria sustituidos con éter con NaAuCl4 para formar una solución de recubrimiento autocatalítico, o agentes reductores como el borano de trimetilamina, el borano de metilmorfolina y el borano de diisopropilamina, junto con estabilizadores como tioles y compuestos de yoduro.
(2) Solución de chapado en oro con sal de sulfito de oro:
Actualmente se utilizan numerosas soluciones de recubrimiento de sulfito de oro monovalente, con hipofosfitos, formaldehído, hidrazina, tetrahidroborato y DMAB como agentes reductores. Sal de sulfito de oro [Na₂]3Au(SO3)2] es inestable en agua y requiere la adición de estabilizadores como 1,2-diaminoetano y bromuro de potasio.
(3) Solución de chapado en oro con tiosulfato
① Solución de chapado en oro con tiourea y sus derivados como agentes reductores:
La combinación de tiosulfato de oro monovalente y solución de recubrimiento de tiourea presenta buena estabilidad, no produce hidrógeno gaseoso a pH cercano a la neutralidad y carece de porosidad. La composición de la solución de recubrimiento se muestra en la Tabla 1-46 (Solución de Recubrimiento A).
Tabla 1-46 Solución de chapado en oro con tiosulfato
| Composición y condiciones de funcionamiento | Solución de recubrimiento A | Solución de recubrimiento B |
|---|---|---|
| NaAuCl4 / (mol/L) | 0.1 | 0.0125 |
| Na2S2O3/(mol/L) | 0.08 | 0.1 |
| Na2SO3 /(mol/L) | 0.4 | 0.1 |
| Na2B4O7/( mol/L) | 0.1 | - |
| NH4Cl/(mol/L) | - | 0.05 |
| Tiourea/(mol/L) | 0.1 | - |
| L-ascorbato de sodio/(mol/L) | - | 0.25 |
| pH | 9.0 | 6.0 |
| Temperatura/℃ | 80 | 60 |
| Velocidad de recubrimiento/(μm/h) | 1. 9 〜 2. 3 | 1.5 〜 2.0 |
② Solución de chapado en oro con ácido ascórbico como agente reductor:
En la solución de recubrimiento de tiosulfato con L-ascórbico sódico como agente reductor, está presente sulfito de sodio, que permite un recubrimiento estable de oro. La composición de la solución de recubrimiento se muestra en la Tabla 1-46 (Solución de Recubrimiento B).
Además de la tiourea y el ascorbato de sodio, entre los agentes reductores eficaces en las soluciones de recubrimiento con tiosulfato de sodio se incluyen el tartrato de sodio, el ácido glicólico y el ácido hipofosforoso.
③ Mecanismo de reacción de la solución de recubrimiento de tiosulfato:
La sal de oro reacciona con el tiosulfato para producir Au(S)₂.2O3)23-Cuando no hay tiosulfato en la solución, solo está presente el sulfito, que se forma en Au(SO₄)₂.3)23-La ecuación de la reacción es la siguiente:
Au3++ 2S2O3 2- + H2O ⇌ Au(S2O3)23- + SO4 2- + 2H+ (1-16)
Au3+ + 3SO32- + H2O ⇌ Au(SO3 )23- + SO42- + 2H+ (1-17)
Au+ + 2SO32- ⇌ Au(SO3)23- K=1010 (1-18)
Au+ + 2S2O32- ⇌ Au(S2O3)23- K = 1026 (1-19)

Figura 1-44 Comparación de las curvas de polarización catódica de las reacciones de deposición de oro en soluciones de recubrimiento de sulfito y tiosulfato
(NH4Cl 0,1 mol/L, Na2SO3 0,2 mol/L)
El tiosulfato tiene una mayor capacidad de complejación con el oro monovalente que el sulfito, por lo que el oro monovalente es más difícil de depositar a partir de soluciones de recubrimiento que contienen tiosulfato de sodio que de aquellas que contienen sulfito.
En la solución de dorado al sulfito con el agente reductor ascorbato, debido a la diferencia en las curvas de polarización catódica entre los iones complejos de sulfito de oro y los iones complejos de tiosulfato de oro, la velocidad de deposición de oro es solo 1/10 de la obtenida en la solución de dorado al tiosulfato de sodio. La figura 1-45 muestra las curvas de polarización catódica y anódica del oro depositado con ascorbato, sulfito y tiosulfato.
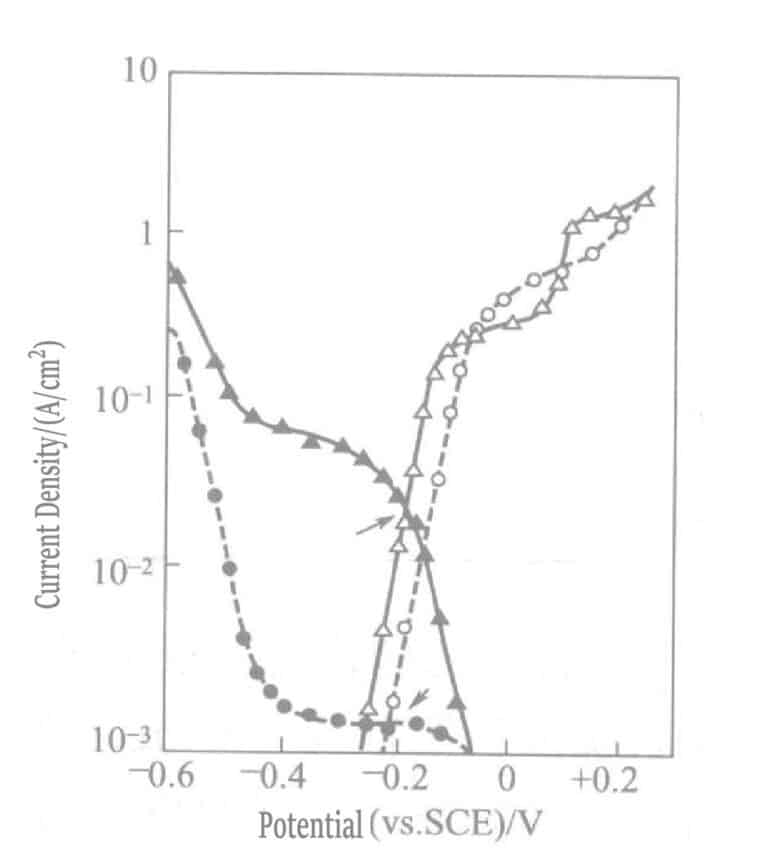
Figura 1-45 Curvas de polarización catódica y anódica del ácido ascórbico, la solución de recubrimiento de sulfito y el oro tiosulfato.
(electrodo de oro, NH4Cl 0,1 mol/L, pH 6,0, 60 °C. Curva "●" solución de recubrimiento: Na2SO3 0,2 mol/L y NaAuCl4 0,01 mol/L; Curva "▴" misma solución de recubrimiento que antes, con la adición de Na2S2O3 0,1 mol/L; Curva "○" solución de recubrimiento: Na2SO3 0,2 mol/L y ascorbato de sodio 0,1 mol/L; Curva "△" solución, igual que antes, con la adición de Na2S2O3 0,1 mol/L)
El principio de reacción de la solución de chapado de oro electrolítico con tiosulfato se refiere al estado de oxidación del agente reductor, y las reacciones locales son las siguientes.
Reacción catódica:
Au(S2O3)23- + 2e– → Au + 2S2O32- (1-20)
Reacción anódica:
solución de recubrimiento de tiourea
CS(NH2)2 + 5 horas2O → CO(NH2)2 + H2SO4 + 8 horas+ + 8e– (1-21)
El producto de reacción CO(NH₃)₂2)2 es urea.
solución de recubrimiento de ácido ascórbico
C6H8O6 → C6H6O6 + 2H+ + 2e–
7. Solución de chapado en oro con aditivo de azúcar y sal de sulfito de oro
Tras añadir compuestos de sacáridos a la solución de sulfito para el chapado de oro, esta se mantiene estable durante un tiempo prolongado y la capa de oro queda bien. La composición de la solución es la siguiente.
Sales de sulfito de oro: sulfito de oro potásico, sulfito de oro sódico, sulfito de oro amónico, etc.
Sulfitos: sulfito de potasio, sulfito de sodio, sulfito de amonio, etc.
Regulador de pH: Ajustar a pH 6~9 con diversos tampones.
Estabilizadores: compuestos de amina solubles en agua, etilendiamina, dietilentriamina, trietilenetetramina, etc.; aminoácidos o sales solubles en agua, ácido etilendiaminotetraacético, ácido trietilenetetraaminohexaacético, ácido trans-1,2-ciclohexanodiaminotetraacético o sales, etc.; organofosfatos o sales solubles en agua, aminotris(ácido metilenfosfónico), ácido 1-hidroxietilideno-1,1-difosfónico, ácido etilendiaminotetra(ácido metilenfosfónico), dietanolamina, pentakis(ácido metilenfosfónico) o sales, etc.; también se pueden agregar compuestos nitroaromáticos solubles en agua, como ácido mono-, di- y trinitrobenzoico, ácido mono- y di-nitrosalicílico, ácido nitrobencenodicarboxílico, mono-, di- y trinitrofenol, dinitroaminofenol, mono-, di- y trinitrobenceno, etc.
Los azúcares distintos del almidón también pueden incluir hexosas, glucosa, manosa, galactosa y otros monosacáridos, eritritol, pentitol, hexanol y otros alcoholes de azúcar, ácido glucárico y otros ácidos aldáricos, ácido glucónico, ácido hexatónico y otros ácidos aldónicos, oligosacáridos, etc. Estos compuestos de azúcar pueden aumentar la estabilidad de la solución de recubrimiento y ampliar el rango de densidad de corriente del área de recubrimiento brillante.
Los resultados del recubrimiento se muestran en la Tabla 1-47.
Tabla 1-47. Diversos baños de chapado en oro con sulfito, condiciones de operación y efectos de los aditivos.
| Número de serie | Diversos baños de chapado en oro con sulfito y condiciones de funcionamiento | Efecto aditivo |
|---|---|---|
| N.° 1 |
Sulfito sódico de oro 10 g/L Sulfito de sodio 65 g/L Citrato trisódico 65 g/L Ácido etilendiaminotetrametilenfosfónico (EDTMP) 85 g/L pH 7 Temperatura 60℃ Corriente total: 0,2 A Sustrato de la muestra: aleación 42Fe-Ni Método de densidad de corriente ideal con agitación intensa |
La electrólisis a 1080 ℃ provoca la descomposición de la solución de electrodeposición, produciendo partículas negras. La aparición de la capa de recubrimiento con diferentes densidades de corriente produce manchas y quemaduras. |
| N.° 1 Agregar 10 g/L de carboximetilcelulosa sódica (CMC) a la solución de recubrimiento. Las demás condiciones son las mismas que en el paso 1. | Electrodeposición a 1740 °C, descomposición de la solución de recubrimiento, partículas negras. Mejora el aspecto de la capa de recubrimiento y se reducen notablemente las manchas y el quemado. | |
| N.° 2 |
Sulfito sódico de oro 10 g/L Sulfito de sodio 130 g/L Citrato trisódico 65 g/L Citrato de triamonio 65 g/L p-Nitro(benceno)fenol 1 g/L pH 7 Temperatura 40℃ Corriente total: 0,2 A Sustrato de la muestra: cobre fuerte agitación |
Las zonas de alta densidad de corriente se quemaron, el aspecto de la capa de recubrimiento es muy deficiente y aparecen manchas difusas. |
| Solución de recubrimiento No. 2 con almidón 5 g/L, las demás condiciones son las mismas que para la solución No. 2. | Sin quemaduras en zonas de alta densidad de corriente, buen aspecto de la capa de chapado en un amplio rango de densidad de corriente, solución de chapado estable. | |
| N.° 3 |
Sulfito de oro sódico 10 g/L Sulfito de sodio 100 g/L Borato disódico 50 g/L Ácido bórico 100 g/L p-Nitro(benceno)fenol 1 g/L pH 7 Temperatura 40℃ Corriente total: 0,2 A Sustrato de la muestra: cobre fuerte agitación |
Mal aspecto de la capa de recubrimiento |
| Agregar 5 g/L de almidón a la solución de recubrimiento No. 3, las demás condiciones son las mismas que para la solución No. 3. | Buen aspecto de la capa de recubrimiento en un amplio rango de densidad de corriente, solución de recubrimiento estable. | |
| N.° 4 |
Sulfito de oro sódico 12 g/L Sulfito de sodio 100 g/L Fosfito 3 g/L Hidrato de etilendiamina 30 g/L pH 7 Temperatura 60°C Corriente total: 0,2 A Sustrato de la muestra: aleación 42Fe-Ni fuerte agitación |
Zonas con alta densidad de corriente quemadas; el aspecto de la capa de recubrimiento es extremadamente deficiente. |
| N.° 4, agregar almidón 5 g/L a la solución de recubrimiento; las demás condiciones son las mismas que en el N.° 4. | Buen aspecto de la capa de recubrimiento y estabilidad de la solución de recubrimiento en un amplio rango de densidad de corriente. | |