Jak ulepszyć swoją biżuterię za pomocą technik obróbki powierzchni?
Opanuj obróbkę powierzchni biżuterii: Od polerowania do nano-natryskiwania
Proces obróbki powierzchni biżuterii jest obróbką techniczną, która wykorzystuje różne metody, takie jak fizyczne, chemiczne, elektrochemiczne i mechaniczne, aby zmienić teksturę, kolor i dotyk powierzchni akcesorium, zapobiec korozji, upiększyć dekorację i przedłużyć jej żywotność. Znacznie wzbogaca efekt dekoracyjny produktów akcesoryjnych, poszerza dostępne środki projektowania akcesoriów, prezentuje bardziej żywy i różnorodny styl biżuterii oraz zapewnia konsumentom bardziej spersonalizowane wybory. Znacząco poprawia efekt powierzchniowy, żywotność i ekonomiczną wartość dodaną akcesoriów.
Istnieje wiele rodzajów procesów obróbki powierzchni dla nowoczesnej popularnej biżuterii, przy czym powszechnie stosowane metody obejmują głównie polerowanie, galwanizację, galwanizację chemiczną, chemiczne elektrochemiczne warstwy konwersyjne, fizyczne osadzanie z fazy gazowej, emalię, żywicę epoksydową i nano-natryskiwanie powierzchni.

Opcje kolorów poszycia pływackiego
Spis treści
Sekcja I Technologia polerowania
1. Polerowanie mechaniczne
Polerowanie mechaniczne polega na obróbce powierzchni biżuterii przy użyciu maszyn polerskich i środków ściernych. Typowe metody polerowania mechanicznego obejmują następujące kategorie.
(1) Ściernica do polerowania
Polerowanie tarczą ścierną jest wykonywane przy użyciu tarczy polerskiej zamontowanej na maszynie. Pasta polerska jest okresowo nakładana na powierzchnię roboczą tarczy polerskiej. Z kolei powierzchnia obrabianego przedmiotu jest mocno dociskana do powierzchni roboczej tarczy polerskiej, która obraca się z dużą prędkością. Za pomocą włókien tarczy polerskiej i pasty polerskiej powierzchnia obrabianego przedmiotu uzyskuje lustrzany wygląd (rysunek 11-1). Obecnie powszechnie uważa się, że zasada działania maszyn do polerowania ściernicowego polega na tym, że wysoka temperatura generowana przez tarcie między obracającą się z dużą prędkością tarczą polerską a powierzchnią obrabianego przedmiotu może powodować odkształcenie plastyczne powierzchni przedmiotu obrabianego, wypełniając mikroskopijne wgłębienia na powierzchni obrabianego przedmiotu; jednocześnie wysoka temperatura generowana podczas polerowania może również szybko utworzyć bardzo cienką warstwę tlenku na powierzchni obrabianego przedmiotu. Odsłonięta powierzchnia podłoża jest ponownie utleniana podczas usuwania tej warstwy tlenku. Proces jest kontynuowany w tym cyklu aż do zakończenia polerowania, w wyniku czego uzyskuje się płaską i gładką powierzchnię.
(2) Polerowanie wibracyjne
Jest on zainstalowany z silnikiem wibracyjnym w tarczy wibracyjnej maszyny do polerowania wibracyjnego, a tarcza wibracyjna jest połączona z podstawą za pomocą sprężyn wibracyjnych. Po uruchomieniu szlifierki wibracyjnej, silnik wibracyjny generuje silną siłę wzbudzenia, napędzając materiał ścierny w tarczy wibracyjnej, aby wytworzyć ruch w trzech kierunkach: wibracje pionowe, obracanie do wewnątrz na zewnątrz i spiralny obrót zgodnie z ruchem wskazówek zegara, tworząc w ten sposób efekt szlifowania na powierzchni biżuterii w celu uzyskania polerowanego wykończenia (Rysunek 11-2 ).

Rysunek 11-1 Polerowanie ściernicą

Rysunek 11-2 Polerowanie wibracyjne
(3) Polerowanie rolkowe
Jego zasada działania jest następująca: Cztery sześciokątne rolki są równomiernie zamontowane na obwodzie obracającego się korpusu. Rolki obracają się wraz z obracającym się korpusem, jednocześnie obracając się wokół własnej osi pod działaniem systemu kół zębatych (w przeciwnym kierunku). Ruch planetarny rolek powoduje, że materiał wewnątrz rolek zawsze pozostaje po jednej stronie zewnętrznej ściany rolek z powodu siły odśrodkowej, tworząc warstwę przepływu na powierzchni. W tej warstwie przepływowej kamienie szlifierskie i obrabiane przedmioty generują ruch względny, wykonując precyzyjne cięcie i dociskanie powierzchni przedmiotu obrabianego, uzyskując w ten sposób wypolerowaną powierzchnię przedmiotu obrabianego (Rysunek 11-3).
(4) Polerowanie Vortex
Jego zasada działania jest następująca: wykorzystując siłę odśrodkową generowaną przez szybki obrót dolnego stołu obrotowego, powstaje silne tarcie między przedmiotem obrabianym a materiałem ściernym pod działaniem stałego rowka, tworząc spiralny wir, powodując tarcie obrotowe o dużej prędkości i spiralne obracanie przedmiotu obrabianego i materiału ściernego. Pozwala to na usunięcie zadziorów i równomierne wypolerowanie polerowanej biżuterii w bardzo krótkim czasie, osiągając idealny efekt polerowania. Podstawą maszyny polerskiej jest obracająca się tarcza w pojemniku, przy czym górna część pojemnika jest otwarta, a ścianki pojemnika nie obracają się. Szczelina między pojemnikiem a tarczą może być mniejsza niż 0,05 mm, co pozwala na użycie najdrobniejszych cząstek łupin orzecha włoskiego (rysunek 11-4).

Rysunek 11-3 Polerowanie wałkiem

Rysunek 11-4 Polerowanie wirowe
(5) Polerowanie przez przeciąganie
Podczas pracy przedmiot obrabiany jest przeciągany po medium polerskim, nie poruszając się. Każdy obrabiany przedmiot ma swoją własną pozycję podparcia, powierzchnie między przedmiotami nie stykają się, co zapobiega uszkodzeniom powierzchni. W porównaniu z tradycyjnymi metodami polerowania, tworzy większy ruch względny i większą siłę przetwarzania, znacznie skracając czas przetwarzania. Ma to ogromne zalety w przypadku ciężkich przedmiotów obrabianych. Metoda polerowania wleczonego jest szczególnie odpowiednia do ciężkich pierścieni, zapięć i kopert zegarków, a także do wielu innych elementów, które można zawiesić na stałych wspornikach (Rysunek 11-5).

Tabela 11-1 Charakterystyka różnych procesów polerowania
| Metody polerowania | Środek polerski | Środek mielący | Zalety | Wady | Odpowiedni przedmiot obrabiany |
|---|---|---|---|---|---|
| Polerowanie wibracyjne | Wióry drewniane, kawałki porcelany, cząstki łupin orzecha włoskiego, mąka kukurydziana, kulki stalowe | Ceramika, tworzywa sztuczne | Tanie, duże przedmioty, części tłoczone | Ze względu na długi czas obróbki, niskie ciśnienie, wgniecenia i słaby efekt gładkości, osiągnięcie idealnych rezultatów podczas obróbki na sucho jest niemożliwe. | Mały łańcuch, łańcuch mechaniczny |
| Polerowanie lufy | Drewniana kostka, drewniana igła, cząstki łupin orzecha włoskiego, mąka kukurydziana, stalowa kulka | Ceramika, tworzywa sztuczne | Tani | Długi czas obróbki, niewygodna obróbka, powierzchnia ma kurz, powierzchnia jest tłoczona | Różne elementy biżuterii |
| Polerowanie wirowe | Cząstki skorupy orzecha włoskiego, kawałki porcelany, plastik | Ceramika, tworzywa sztuczne | Dzięki wysokiej wydajności i krótkiemu czasowi przetwarzania, maszyna wykonuje pracę 70%, mniej procesów, czysta biżuteria, łatwa obsługa, wysoka jakość powierzchni | Może obsługiwać tylko lekkie elementy (maksymalnie 20 g) i nie może przetwarzać małych łańcuszków do kamieni szlachetnych. | Większość biżuterii, produktów przemysłowych i kopert zegarków |
| Polerowanie wleczone | Cząsteczki skorupy orzecha włoskiego | Granulat z łupin orzecha włoskiego | Może polerować duże, ciężkie elementy bez uderzeń lub kolizji, z krótkim czasem przetwarzania, łatwą obsługą i wysoką jakością powierzchni | Brak szlifowania na mokro | Różne elementy biżuterii, które można zamocować na półce |
2. Polerowanie chemiczne
3. Polerowanie elektrochemiczne
Sekcja II Proces galwanizacji
1. Podstawowa wiedza na temat galwanizacji biżuterii
(1) Rodzaje galwanizacji dla biżuterii
W zależności od przeznaczenia powłoki, galwanizację biżuterii można podzielić na powłoki ochronne i powłoki dekoracyjne.
- Powłoki ochronne. Głównym celem jest zapobieganie korozji metalu. Powszechnie stosowane powłoki, takie jak warstwy galwanizowane i cynowe, należą do tej kategorii. Czarne metale są zwykle chronione przez warstwy galwanizowane w ogólnych warunkach atmosferycznych, podczas gdy warstwy cynowe są zwykle używane do ochrony czarnych metali, które wchodzą w kontakt z kwasami organicznymi.
- Powłoki dekoracyjne. Przede wszystkim do celów dekoracyjnych, ale także z pewnym poziomem ochrony. Powłoki kompozytowe najczęściej składają się z wielu warstw, ponieważ trudno jest znaleźć pojedynczą powłokę spełniającą wymagania dla powłok dekoracyjnych. Zazwyczaj najpierw na podłoże nakładana jest warstwa bazowa, a następnie warstwa powierzchniowa, a czasami także warstwa pośrednia. Na przykład galwanizowane metale szlachetne i imitacja galwanizacji złota są szeroko stosowane, szczególnie w niektórych cennych biżuteriach i drobnej biżuterii sprzętowej, przy stosunkowo dużym zużyciu i wielkości produkcji. Obejmuje głównie galwanizowane metale szlachetne i różne stopy.
Zgodnie z elektrochemiczną zależnością między powłoką a metalem podłoża podczas korozji, dekoracyjne powłoki galwaniczne można podzielić na anodowe i katodowe.
- Powłoka anodowa. Odnosi się do powłoki, która działa jak anoda i rozpuszcza się jako pierwsza, gdy powstaje mikrobateria korozyjna z metalem podłoża, takim jak cynkowanie na żelazie. Ten rodzaj powłoki nie tylko zapewnia mechaniczną ochronę podłoża, ale także zapewnia ochronę chemiczną.
- Powłoka katodowa. Odnosi się do powłoki działającej jako katoda, gdy tworzy mikrobaterię korozyjną z metalem podłoża. Na przykład cynowanie na żelazie. Ten rodzaj powłoki może zapewnić jedynie mechaniczną ochronę podłoża; gdy powłoka zostanie uszkodzona, nie chroni podłoża i przyspiesza jego korozję.
(2) Podstawowy proces galwanizacji metali
Elektrodepozycja jest procesem elektrochemicznym i redoks. Podczas elektrodepozycji metalowy element działa jak katoda, metal lub stop, który ma być powlekany, działa jak rozpuszczalna anoda lub siatka tytanowa jest używana jako nierozpuszczalna anoda, podłączona do ujemnego i dodatniego zacisku zasilacza i zanurzona w elektrolicie zawierającym składniki galwaniczne. Pod działaniem prądu można uzyskać warstwę osadzania na powierzchni ornamentu (rysunek 11-7).
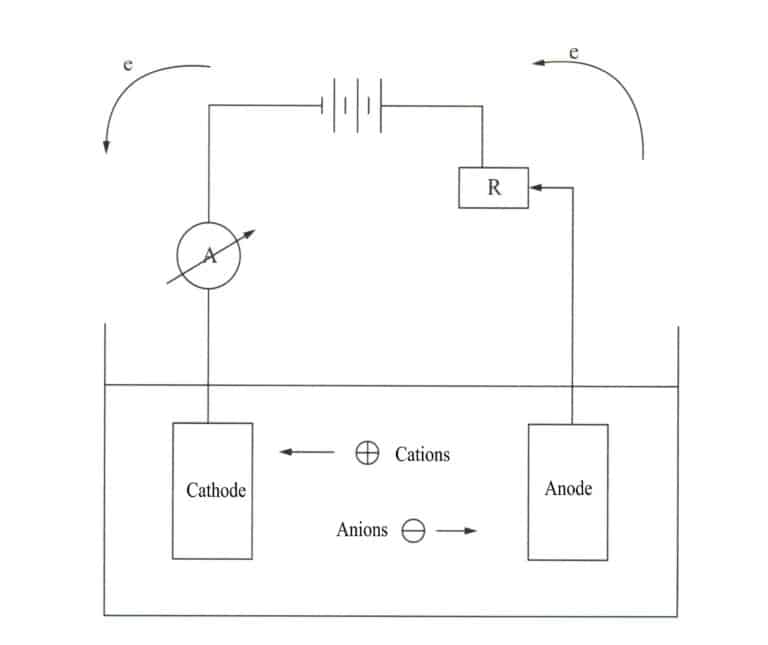
Proces galwanizacji metali redukuje metal lub jego jony kompleksowe do metalu na katodzie. Ponieważ galwanizowany metal ma strukturę krystaliczną, podobnie jak zwykłe metale, proces galwanizacji jest również znany jako proces elektrokrystalizacji. Obejmuje on następujące trzy etapy.
- Proces transferu masy. Jony metali lub jony kompleksów metali są stale transportowane na powierzchnię elektrody z elektrolitu poprzez takie etapy jak dyfuzja, konwekcja i elektromigracja.
- Proces elektrochemiczny. Jony metali lub jony kompleksów metali odwadniają się i adsorbują na powierzchni katody, uwalniając energię elektryczną i redukując się do atomów metalu.
- Proces krystalizacji. Atomy metalu układają się na katodzie, tworząc kryształy metalu o określonym kształcie, a krystalizacja zwykle zachodzi w procesie zarodkowania i wzrostu.
Drobność kryształów zależy od szybkości zarodkowania i szybkości wzrostu. Jeśli tempo zarodkowania jest szybsze niż tempo wzrostu, powstaje więcej kryształów, co skutkuje drobniejszymi i gęstszymi ziarnami; odwrotnie, ziarna będą grubsze.
2. Miedź galwaniczna i stopy miedzi
Powłoka miedziana jest różowa, jednolita i delikatna, z różnymi odcieniami w zależności od procesu. W galwanizacji miedziowanie jest szeroko stosowane, głównie jako warstwa bazowa i pośrednia, a także może być stosowane jako warstwa powierzchniowa, taka jak imitacja złocenia.
Obecnie stosowane procesy miedziowania obejmują głównie cyjanek, kwaśny siarczan i miedziowanie pirofosforanowe. Wśród nich roztwór cyjanku do miedziowania jest wysoce toksyczny, poważnie zanieczyszcza środowisko, szkodzi zdrowiu ludzkiemu i został wymieniony jako proces, który należy wyeliminować. Ponadto, miedziowanie aminosulfonianowe, miedziowanie aminami organicznymi, miedziowanie cytrynianowo-winianowe i miedziowanie HEDP również były rozwijane i stosowane w ostatnich latach.
W latach 70. badania skupiły się na zastąpieniu galwanizacji cyjankowej galwanizacją bezcyjankową, co doprowadziło do powstania pirofosforanowej i siarczanowej powłoki miedzianej. Wciąż jednak nie mogły być one bezpośrednio powlekane na podłożach stalowych jako warstwa bazowa.
2.1 Powlekanie miedzi siarczanem
Powlekanie miedzią siarczanową jest szeroko stosowane w ochronnej galwanizacji dekoracyjnej, galwanizacji tworzyw sztucznych i grubym powlekaniu miedzią do elektroformowania płytek drukowanych. Można go podzielić na dwa rodzaje: jeden to roztwór galwaniczny o wysokiej zawartości miedzi i niskiej kwasowości stosowany do galwanizacji części, który ma gładką i jasną powłokę o dobrej wytrzymałości; drugi to roztwór galwaniczny o wysokiej kwasowości i niskiej zawartości miedzi stosowany do galwanizacji płytek drukowanych, który ma doskonałe właściwości dyspersyjne i kryjące, dzięki czemu doskonale nadaje się do powlekania otworów, z jednolitą i delikatną powłoką.
(1) Główne składniki roztworu galwanicznego
① Siarczan miedzi. Jest to główna sól, która zapewnia niezbędną Cu2+ do elektroosadzania. Zbyt niskie stężenie zmniejsza górną granicę gęstości prądu, zmniejsza prędkość osadzania i wpływa na jasność powłoki. Gdy stężenie jest zbyt wysokie, zmniejszy to zdolność dyspersji roztworu galwanicznego, a ze względu na granicę rozpuszczalności siarczanu miedzi, kryształy siarczanu miedzi będą się wytrącać, przy czym odpowiednie jest 180 ~ 220 g / l.
② Kwas siarkowy. Jego główną funkcją jest zwiększenie przewodności roztworu. Gdy stężenie jest zbyt niskie, prowadzi to do niepełnego utlenienia miedzi anodowej, wytwarzając Cu2O, powodując powstawanie "proszku miedzianego" lub zadziorów w powłoce. Jednocześnie zmniejsza się zdolność dyspersji roztworu galwanicznego. Gdy stężenie kwasu siarkowego jest odpowiednie, zakres gęstości prądu powłoki jest szeroki, powłoka jest jasna, a zdolność poziomowania osiąga optymalne wyniki. Jeśli stężenie kwasu siarkowego jest zbyt wysokie, wpływa to na jasność i poziomowanie powłoki.
③ Jony chlorkowe. Są to aktywatory anodowe, które mogą pomóc w normalnym rozpuszczaniu anody, hamując produkcję Cu+poprawiają jasność i zdolność wyrównywania powłoki oraz zmniejszają wewnętrzne naprężenia w powłoce. Jeśli stężenie jonów chlorkowych jest zbyt niskie, prowadzi to do powstawania powłok dendrytycznych, z obszarem o wysokim natężeniu prądu podatnym na spalanie, a powłoka może tworzyć wżery lub otwory. Jeśli stężenie jonów chlorkowych jest zbyt wysokie, na powierzchni anody pojawia się biała, żelowa warstwa i bez względu na to, ile rozjaśniacza zostanie dodane, powłoka nie będzie jasna. Odpowiednie stężenie jonów chlorkowych wynosi 40~100ml/L.
④ Dodatki. Doskonała kombinacja dodatków może zapewnić stabilne roztwory galwaniczne, wysokie wskaźniki kwalifikacji produktu i wysoką wydajność pracy. Obecnie skomercjalizowano wiele dodatków i ich materiałów. Wymagania dotyczące dodatków różnią się w zależności od rodzaju powłoki galwanicznej. Na przykład powłoki dekoracyjne kładą większy nacisk na jasność, szybkość i wyrównanie powłoki; ochronne powłoki dekoracyjne koncentrują się bardziej na wyrównaniu i elastyczności powłoki; powłoki płytek drukowanych wymagają między innymi doskonałej wydajności w strefie niskiego prądu, równomiernego rozkładu powłoki i plastyczności powłoki. Dodatki do powlekania miedzią składają się głównie z czterech części: nośników, rozjaśniaczy, środków wyrównujących i środków zwilżających.
- Przewoźnik: Dobry nośnik może zmaksymalizować skuteczność środków rozjaśniających i wyrównujących. Nośniki są w większości formułowane ze środków powierzchniowo czynnych i niemożliwe jest osiągnięcie najlepszego efektu za pomocą pojedynczego materiału, takiego jak związki polieterowe, tetraeterowe anionowe związki etylenodiaminy itp.
- Środki rozjaśniające i wyrównujące: Organiczne związki polisiarczkowe, organiczne polisiarczki, organiczne sulfoniany polisiarczkowe, barwniki organiczne itp. mają działanie rozjaśniające i wyrównujące w połączeniu z nośnikami. Oba efekty mogą występować w tym samym materiale, przy czym barwniki koncentrują się bardziej na zdolności wyrównywania.
- Środki zwilżające: mogą poprawić działanie zwilżające roztworu galwanicznego. Powszechnie stosowane są niejonowe lub anionowe środki powierzchniowo czynne, takie jak glikol polietylenowy, emulgatory OP itp. Jasna kwaśna miedź wykorzystuje mieszanie powietrzem i może wybierać tylko niskopieniące środki zwilżające.
(2) Reakcja elektrodowa miedziowania kwasem siarkowym
Katoda: Cu2+ + 2e=Cu φ0Cu2+/Cu = +0.34V
Cu2+ + e=Cu+ φ0Cu2+/Cu+ = +0.17V
Cu+ + e=Cu φ0Cu+/Cu = +0.51V
Ze względu na standardowy potencjał elektrody Cu2+ ponieważ jest znacznie bardziej dodatni niż wodór, gazowy wodór nie zostanie uwolniony na katodzie, ale gdy nie zostanie wystarczająco zredukowany, pojawi się Cu+. Z punktu widzenia standardowego potencjału elektrody, reakcja redukcji do Cu jest bardziej prawdopodobna, a redukcja Cu doprowadzi do szorstkiej powłoki, której należy unikać.
Anoda: Anoda miedziana w roztworze kwasu siarkowego ulega rozpuszczeniu anodowemu, dostarczając jonów miedzi potrzebnych w roztworze galwanicznym, a mianowicie: Cu-2e=Cu2+.
W tym samym czasie co Cu2+ jest generowany, jest nieuchronnie generowany Cu+a mianowicie: Cu-e=Cu+. Kiedy Cu+ pojawia się i wchodzi do roztworu; jeśli w roztworze jest wystarczająca ilość kwasu siarkowego i powietrza, Cu+ można utlenić, a mianowicie: 4Cu++O2+4H+=4Cu2++2H2O, Gdy stężenie kwasu siarkowego w roztworze jest niewystarczające, Cu+ ulegnie hydrolizie, a mianowicie: 2Cu++2H2O=2CuOH+2H+=Cu2O+H2O. W tym czasie Cu2O osadzi się na katodzie w wyniku elektroforezy, tworząc zadziory. Ze względu na niestabilność Cu+mogą również zachodzić reakcje dysproporcjonowania, a mianowicie: 2Cu+=Cu2++Cu, a wygenerowana Cu również osadzi się na powłoce w wyniku elektroforezy, tworząc proszek miedzi, zadziory i chropowatość. Dlatego też, podczas procesu galwanizacji, pojawienie się Cu+ należy unikać w jak największym stopniu; stosowanie anod miedzianych zawierających fosfor i mieszanie roztworu galwanicznego z powietrzem może rozwiązać problem.
2.2 Pirofosforanowanie miedzi
Powłoka miedziana z pirofosforanem nie może być bezpośrednio powlekana na podłożach żelaznych i cynkowych. Jest on stosowany głównie na podłożach ze stopów cynku przed kwaśnym siarczanowym miedziowaniem w celu ochrony podłoża przed silną korozją kwasową i zapewnienia jakości kombinacji powłok. Jest również stosowany w procesach galwanizacji metalizacji tworzyw sztucznych, ale jego zastosowanie w galwanizacji sprzętu jest ograniczone.
Jasne kryształy do miedziowania kwasem fosforowym mają dobre właściwości dyspersyjne i kryjące. Wydajność prądu katodowego jest wysoka, ale długotrwałe użytkowanie może prowadzić do akumulacji fosforanów, co zmniejsza szybkość osadzania.
(1) Główne składniki roztworu galwanicznego
- Pirofosforan miedzi. Jest to główna sól roztworu galwanicznego, dostarczająca jonów miedzi. Jeśli zawartość miedzi jest zbyt niska, zmniejsza gęstość prądu, powodując słaby połysk i wyrównanie powłoki; jeśli zawartość miedzi jest zbyt wysoka, zmniejszy polaryzację katodową, prowadząc do szorstkiej powłoki. Zawartość miedzi w roztworze galwanicznym musi być utrzymywana w określonym stosunku do pirofosforanu potasu.
- Pirofosforan potasu. Jest to główny czynnik kompleksujący, a gdy wartość pH wynosi 8, główną formą kompleksu jest [Cu(P2O7)2]6-, utrzymując [P2O74-]:[Cu2+]=7~8 w roztworze galwanicznym jest względnie odpowiedni; jeśli stosunek jest zbyt duży, prowadzi to do zmniejszenia wydajności prądowej, otworów w powłoce, a roztwór galwaniczny jest podatny na zmętnienie.
- Aminokwas cytrynowy. Jest to pomocniczy środek kompleksujący i depolaryzator anodowy. Może poprawić rozpuszczanie anody, zwiększyć zdolność dyspersji roztworu galwanicznego i zwiększyć jasność powłoki. Jeśli zawartość jest zbyt niska, rozpuszczanie anody będzie słabe, zdolność dyspersji roztworu galwanicznego zmniejszy się i powstanie "proszek miedziany". Ogólnie rzecz biorąc, odpowiednia zawartość wynosi około 10 ~ 30 g / l.
(2) Reakcja elektrodowa miedziowania z pirofosforanem
Reakcja katodowa:[Cu(P2O7)2]6- + 2e6- = Cu + 2P2O74-
2H2O + e = H2 + 2OH–
Reakcja anodowa: Cu + 2P2O74- -2e = [Cu(P2O7)2]6-
Gdy anoda jest pasywowana, uwalniany jest tlen:4OH– - 4e = O2 + 2H2O
Gdy utlenianie anodowe jest niepełne, Cu + występuje: Cu - e = Cu+
Dwie ostatnie reakcje należy uważnie monitorować, aby zapobiec ich wystąpieniu.
2.3 Galwanizacja imitacją złota
W ostatnich latach, ze względu na rozwój galwanizacji dekoracyjnej w budownictwie, sprzęcie, oświetleniu i ozdobach, imitacja złocenia była szeroko stosowana.
(1) Główne kategorie galwanizacji imitacji złota
Powłoka imitująca złoto może być wykonana ze stopów miedzi i cynku, miedzi i cyny lub miedzi i cyny oraz stopów miedzi i cynku poddanych obróbce końcowej w celu uzyskania realistycznego efektu złota. Efekt imitacji złota może osiągnąć kolory takie jak 18K, 4K i różowe złoto. Stopy miedzi i cyny (brąz) można podzielić na trzy kategorie w zależności od zawartości cyny: brąz o niskiej zawartości cyny o zawartości cyny 5% ~ 15%, który wydaje się różowy do złotożółtego; brąz o średniej zawartości cyny o zawartości cyny 15% ~ 40%, który wydaje się żółty; oraz brąz o wysokiej zawartości cyny o zawartości cyny 40% ~ 50%, który wydaje się srebrno-biały.
Powłoka galwaniczna przypominająca złoto ma bardzo krótki czas galwanizacji, a jej połysk zależy głównie od warstwy nośnej, zwykle pokrytej jasną warstwą niklu lub inną białą i błyszczącą powłoką. Powłoka mosiężna może również służyć jako dekoracyjna cienka złota warstwa bazowa oraz warstwa ochronna i smarująca. Mosiądz jest podatny na odbarwienia w powietrzu, więc musi zostać poddany obróbce zapobiegającej odbarwieniom, gdy jest stosowany jako warstwa powierzchniowa lub cienka złota warstwa bazowa, taka jak natryskiwanie powłoką organiczną lub powlekanie katodową farbą elektroforetyczną. W ostatnich latach, aby zapobiec alergiom skórnym na nikiel w galwanizacji biżuterii, biały stop miedzi i cynku może być stosowany jako niskiej jakości substytut niklowania, a także może służyć jako baza dla chromu oraz dla białych i wymaganych białych powłok w metalowych dekoracjach zabawek.
Kluczem do uzyskania stopu poprzez jednoczesne współosadzanie dwóch metali jest to, że ich potencjały osadzania muszą być bliskie, a polaryzacja katodowa musi zapewniać osadzanie dwóch metali w pożądanym stosunku. Jony kompleksowe obecne w cyjankowym roztworze galwanicznym to głównie Cu(CN)32- i Zn(CN)42-. Stabilność jonów cyjankowych miedzi jest znacznie wyższa niż jonów cyjankowych cynku, a polaryzacja katodowa miedzi jest znacznie większa niż cynku. Dlatego, aby uzyskać powłokę spełniającą wymagania, konieczne jest ścisłe kontrolowanie całkowitej zawartości cyjanku, wolnego cyjanku, stosunku miedzi do cynku, wartości pH oraz czynników takich jak temperatura, gęstość prądu i mieszanie.
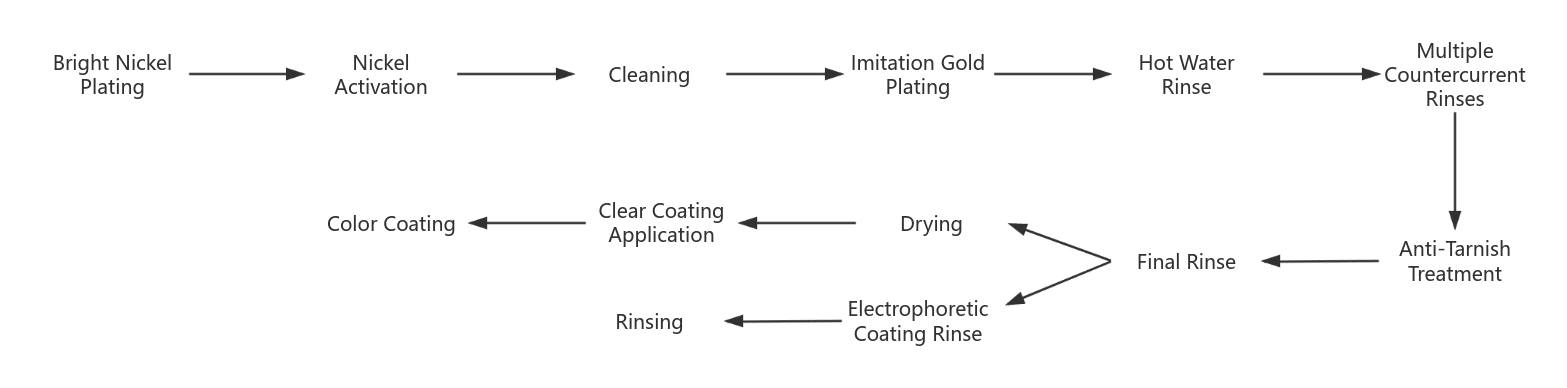
(2) Przebieg procesu galwanizacji imitacji złota
Istnieją dwa główne wyzwania związane ze złoceniem imitującym stop miedzi: po pierwsze, jak zachować połysk powłoki i zapobiec odbarwieniu powłoki ze stopu miedzi; po drugie, jak osiągnąć realistyczny efekt. Dlatego też kluczowy staje się rozsądny proces galwanizacji i obróbka końcowa. Powszechnie stosowany proces galwanizacji imitacji złota jest następujący:
- Zanim obrabiany przedmiot zostanie pokryty jasnym niklem, musi zostać poddany obróbce wstępnej. Jasna powłoka niklowa ma ostatecznie białawy odcień, który może wzmocnić blask warstwy imitacji złota.
- Aktywacja niklu ma na celu usunięcie warstwy pasywacyjnej na jasnej powierzchni niklu, aby poprawić siłę wiązania z warstwą powierzchniową. Metoda obejmuje obróbkę katodową w roztworze odtłuszczającym przez 3 ~ 5 minut, a następnie aktywację kwasem siarkowym 5% po spłukaniu wodą i dokładnym spłukaniu przed wejściem do zbiornika imitacji złota.
- Po nałożeniu galwanicznej powłoki imitującej złoto, powierzchnia przedmiotu obrabianego jest czyszczona gorącą wodą i płukana w przeciwprądzie.
- Obróbka zapobiegająca odbarwieniom mająca na celu zapobieganie odbarwieniom powłoki po myciu. Typowe procesy pasywacji obejmują dichromian potasu lub benzotriazol.
- Elektroforeza katodowa jest pokryta akrylową farbą do elektroforezy katodowej lub przezroczystymi powłokami, takimi jak lakier akrylowy lub natryskiwane lub zanurzane w przezroczystych powłokach z krzemu organicznego.
- Lakier lub farba koloryzująca. Aby stworzyć realistyczny efekt imitacji złota i zrekompensować wady tonu imitacji złota, można zastosować przezroczystą powłokę w kolorze złotym.
3. Nikiel galwanizowany
3.1 Jasny nikiel
Jasny nikiel jest obecnie jedną z najczęściej stosowanych powłok. Bazuje ona na niklu watowym z dodatkami dodawanymi w celu uzyskania jasnej i gładkiej powłoki niklowej.
(1) Główne składniki roztworu galwanicznego
① Nikiel. Źródłem jonów niklu może być siarczan niklu, chlorek niklu, aminosulfonian niklu itp. Jony niklu są głównym składnikiem roztworu galwanicznego, zazwyczaj o zawartości 52~70g/L. Wysokie stężenie jonów niklu pozwala na zwiększenie gęstości prądu. Poprawia to szybkość osadzania, ale jeśli stężenie jest zbyt wysokie, zdolność dyspersji roztworu do powlekania zmniejsza się, co może prowadzić do braku powlekania w obszarach o niskim natężeniu prądu. Jeśli stężenie jonów niklu jest zbyt niskie, szybkość osadzania spada, a w ciężkich przypadkach obszar o wysokim natężeniu prądu może zostać spalony.
② Bufor. Kwas borowy jest najlepszym buforem w roztworze do niklowania, a jego minimalne skuteczne stężenie wynosi nie mniej niż 30 g / l; ogólnie, przyjmowanie roztworu do powlekania wynosi odpowiednio 40 ~.50g/L. Kwas borowy może również zwiększyć polaryzację katodową, poprawić przewodność roztworu i poprawić właściwości mechaniczne powłoki.
③ Środki zwilżające. Podczas procesu galwanizacji na katodzie uwalniany jest wodór. Środki zwilżające mogą zmniejszać napięcie powierzchniowe roztworu galwanicznego, zwiększając efekt zwilżania roztworu na powierzchni przedmiotu obrabianego, utrudniając pęcherzykom wodoru powstającym podczas galwanizacji pozostanie na powierzchni katody, zapobiegając w ten sposób tworzeniu się otworów i skaz. Środki zwilżające składają się ze środków powierzchniowo czynnych, które można podzielić na wysokopieniące środki zwilżające i niskopieniące środki zwilżające. Wysokopieniące środki zwilżające obejmują dodecylosiarczan sodu, podczas gdy niskopieniące środki zwilżające obejmują dietyloheksylosiarczan sodu.
④ Środki rozjaśniające. W tym podstawowe środki rozjaśniające, wtórne środki rozjaśniające i pomocnicze środki rozjaśniające.
- Podstawowy rozjaśniacz: Jego główną funkcją jest udoskonalenie wielkości ziarna i zmniejszenie wrażliwości roztworu galwanicznego na zanieczyszczenia metalowe, przy ogólnej dawce około 1 ~ 10 g / l, warstwa niklowania zawierająca około 0,03%S. Typowe podstawowe rozjaśniacze obejmują sacharynę, difenylosulfonian amonu (BB1), toluenosulfonian amonu, kwas benzenosulfonowy, kwas 1,3,6 naftalenosulfonowy, kwas benzenosulfonowy i sól sodową kwasu benzenosulfonowego (BSS) itp.
- Wtórne rozjaśniacze tworzą zauważalny połysk na powłoce, ale także wprowadzają naprężenia i kruchość powłoki oraz wrażliwość na zanieczyszczenia. Dozowanie musi być ściśle kontrolowane, a w połączeniu z podstawowymi rozjaśniaczami mogą one tworzyć w pełni jasną powłokę. Typowe rozjaśniacze wtórne obejmują 1,4-butanodiol, alkohol propargilowy, heksanol, pirydynę, tiomocznik itp.
- Rozjaśniacze pomocnicze: Pomagają w rozjaśnianiu powłoki, poprawiają zdolność pokrycia powłoki i zmniejszają wrażliwość roztworu galwanicznego na zanieczyszczenia metalowe. Typowe rozjaśniacze pomocnicze obejmują allilosulfonian sodu, winylosulfonian sodu, propargilosulfonian sodu itp.
⑤ Niklowane dodatki do towarów. Różne półprodukty są łączone w oparciu o ich odpowiednią charakterystykę działania, co skutkuje kilkoma rodzajami.
- Starter do kąpieli (środek zmiękczający): składa się głównie z podstawowych i pomocniczych środków rozjaśniających.
- Środek rozjaśniający (główny środek rozjaśniający): Złożony z jednego lub więcej związków, przy czym głównym składnikiem jest wtórny środek rozjaśniający, uzupełniony innymi składnikami.
- Środki powierzchniowo czynne: Istnieją dwa rodzaje: niskopieniące i wysokopieniące.
- Środki czyszczące: takie jak zmywacze żelaza, zmywacze miedzi, zmywacze cynku, środki do pozycjonowania w niskich strefach itp.
(2) Reakcja elektrody
Katoda: Ni2+ + 2e = Ni 2H+ + 2e = H2
Anoda: Ni = Ni2+ + 2e 4OH– = 2H2O + O2 + 4e
3.2 Galwanizowany czarny nikiel i satynowany brąz
Czarny i brązowy nikiel (czarna perła) jest stosowany głównie do powłok optycznych i dekoracyjnych powłok antycznych, zwykle powlekanych na jasnych powłokach niklowych, miedzianych, brązowych i cynkowych, o grubości nieprzekraczającej 2 μm. Ten rodzaj powłoki jest twardy i kruchy, o słabej odporności na korozję, a powierzchnia powłoki musi być zabezpieczona lakierem.
Pojawienie się kolorów czarnego i brązowego wynika z różnych materiałów czerniących w roztworze galwanicznym. Czarna warstwa niklowania zawiera większą ilość faz niemetalicznych, takich jak czarny nikiel zawierający cynk, który ogólnie ma ułamek masowy niklu 40% ~ 60%, cynku 20% ~ 30%, siarki 10% ~ 15% i materii organicznej około 10%, co czyni go mieszaniną niklu, cynku, siarczku niklu, siarczku cynku i materii organicznej.
Temperatura robocza roztworu galwanicznego, wartość pH i gęstość prądu wpływają na ciemność powłoki. Jeśli powłoka nie jest ciemna, ma kolory lub wydaje się żółta, najpierw sprawdź przewodność, a następnie sprawdź, czy natężenie prądu jest zbyt wysokie lub zbyt niskie; jeśli temperatura jest zbyt wysoka, a następnie sprawdź, czy stężenie tiocyjanianu, siarczanu cynku, molibdenianu amonu itp. w roztworze galwanicznym jest niewystarczające.
3.3 Galwanizowany perłowy nikiel
Nikiel perłowy (nikiel satynowy) charakteryzuje się drobną krystalizacją, niską porowatością, niskim naprężeniem wewnętrznym, dobrą odpornością na korozję i miękkim odcieniem. Nie pozostawia śladów po dotknięciu ręką, jest ceniony i lubiany w galwanizacji dekoracyjnej, jest szeroko stosowany jako warstwa bazowa chromu, srebra i złota i może być stosowany bezpośrednio do warstw powierzchniowych, zwłaszcza w zastosowaniach takich jak zegarki i biżuteria.
Głównym procesem galwanizacji niklem satynowym jest dodanie do roztworu galwanicznego pewnych substancji organicznych, takich jak aniony i substancje amfoteryczne, które w warunkach elektrolitycznych tworzą osady o średnicy podobnej do cząstek koloidalnych. Osady te współosadzają się z niklem na katodzie, tworząc satynową powłokę niklową o perłowym połysku. Wybierając rodzaje i stężenia dodatków, można kontrolować średnicę osadów. Proces perłowego niklu prawie w całości składa się z opatentowanych dodatków handlowych.
Wadą powszechnie występującą w niklu perłowym są "jasne plamy", które można usunąć poprzez usunięcie zanieczyszczeń i dokładne wymieszanie roztworu galwanicznego przed użyciem.
4. Srebro galwaniczne i stopy srebra
Symbolem pierwiastka srebra jest Ag, względna masa atomowa wynosi 107,9; standardowy potencjał elektrody wynosi 0,799 V, a równoważnik elektrochemiczny wynosi 4,025/(A.h).
Powłoki ze srebra i stopów srebra charakteryzują się doskonałą przewodnością, niską rezystancją styku, lutownością oraz silnymi właściwościami odblaskowymi i dekoracyjnymi. Są one szeroko stosowane w zastawach stołowych, instrumentach muzycznych, biżuterii i innych jako powłoki dekoracyjne.
Posrebrzana warstwa reaguje z siarką w powietrzu, tworząc tlenek srebra i czarny siarczek srebra. Może również łatwo zmienić kolor na czarny w kontakcie z materiałami zawierającymi siarkę, takimi jak tworzywa sztuczne i guma, a tlen w powietrzu przyczynia się do ciemnienia. Odbarwienie posrebrzanej warstwy poważnie wpływa na wygląd komponentów i wpływa na lutowność i wydajność elektryczną powłoki.
Roztwory do posrebrzania nadal opierają się głównie na posrebrzaniu cyjankowym, które wytwarza cienką, czystą białą warstwę o dobrych właściwościach dyspersyjnych i kryjących, a proces jest stosunkowo stabilny. Ma ono jednak wysoką zawartość cyjanku i jest wysoce toksyczne. Przeprowadzono zarówno krajowe, jak i międzynarodowe badania nad procesami posrebrzania bezcyjankowego, a obecnie dostępne są komercyjne materiały eksploatacyjne, takie jak między innymi posrebrzanie NS, posrebrzanie niacyną, posrebrzanie tiosiarczanem, posrebrzanie imidem dibutyrylu i posrebrzanie kwasem imidazolosulfonowym. Powlekanie srebrem niecyjankowym postępuje powoli ze względu na mniej delikatny wygląd niż powlekanie cyjankowe, mniej wygodną konserwację i niespójne dostawy surowców.
4.1 Srebrzenie cyjankowe
Od pierwszego patentu na posrebrzanie w 1840 roku do chwili obecnej, posrebrzanie cyjankowe ma ponad 160-letnią historię. Posrebrzanie cyjankowe zawsze dominowało w procesie wytwarzania powłok srebrnych. Rozwój posrebrzania cyjankowego w latach 70. wprowadził rozjaśniacze, które bezpośrednio nakładały jasną warstwę srebra z roztworu galwanicznego, eliminując proces polerowania, poprawiając wydajność i oszczędzając dużą ilość srebra. Jasne srebrzenie stało się głównym nurtem srebrzenia cyjankowego.
(1) Główne składniki roztworu srebra cyjankowego
① Srebrny. Jest to główna sól w roztworze galwanicznym, występująca jako jony kompleksowe cyjanku srebra. Źródłem srebra może być AgNO3, AgCl, AgCN, KAg(CN)2ale AgNO3 a AgCl najlepiej przekształcić w AgCN lub KAg(CN)2a następnie dodawany do roztworu galwanicznego. Stężenie Ag w roztworze galwanicznym jest utrzymywane na poziomie 20~40g/L. Jeśli stężenie srebra jest zbyt wysokie, powłoka krystalizuje gruboziarniście i wydaje się żółta; jeśli stężenie srebra jest zbyt niskie, zakres gęstości prądu jest zbyt wąski, a szybkość osadzania spada.
② Cyjanek potasu. Jest to środek kompleksujący; oprócz kompleksowania z Ag, pewna ilość wolnego cyjanku potasu jest korzystna dla stabilności roztworu galwanicznego, normalnego rozpuszczania anody i zdolności dyspersyjnej roztworu galwanicznego. Ogólnie rzecz biorąc, dane odnoszą się głównie do wolnego KCN. Jeśli jego stężenie jest zbyt wysokie, szybkość osadzania roztworu galwanicznego jest powolna; jeśli stężenie jest zbyt niskie, warstwa galwaniczna jest podatna na żółknięcie, a srebrna anoda jest łatwo pasywowana, co powoduje powolną szybkość osadzania.
③ Wodorotlenek potasu, węglan potasu. Może poprawić przewodność roztworu galwanicznego, pomóc w dyspersji roztworu galwanicznego i zwiększyć jasność powłoki.
④ Winian sodu. Może zmniejszać polaryzację anody, zapobiegać pasywacji i promować rozpuszczanie srebrnej anody.
⑤ Środki rozjaśniające. Dodanie środków rozjaśniających pozwala uzyskać w pełni jasną powłokę i rozszerzyć zakres gęstości prądu, ale należy wybrać odpowiednie środki rozjaśniające dla powłok srebrnych używanych do różnych celów. W przypadku powłok dekoracyjnych wymagania dotyczące grubości nie są wysokie, ale wymagania dotyczące koloru powłoki (biel i jasność) są szczególnie wysokie, co sprawia, że stosowanie dodatków zawierających metale jest nieodpowiednie. W przypadku powłok funkcjonalnych wykorzystywanych w zastosowaniach elektrycznych i elektronicznych wymagania dotyczące grubości powłoki i wydajności elektrycznej są wyższe, a niektóre mogą uwzględniać wymagania dotyczące twardości powłoki, co pozwala na dodanie soli metali, takich jak antymonian potasu.
Rozjaśniacze niemetaliczne często zawierają siarkę, która może tworzyć jasne, białe powłoki srebrne, ale ich żywotność nie jest wystarczająco długa. Rozkładają się, jeśli nie zostaną szybko użyte w roztworze galwanicznym. Metaliczne rozjaśniacze, takie jak antymon, selen, tellur, kobalt i nikiel, mogą poprawić jasność poszycia i zwiększyć twardość, dzięki czemu są bardziej odpowiednie do twardego srebrzenia.
(2) Reakcja elektrodowa srebrzenia cyjankowego
Katoda:
Kompleksowy jon cyjanku srebra jest bezpośrednio redukowany na katodzie: Ag(CN)2- + e = Ag + 2CN–
Działanie niepożądane: 2H2O + 2e = H2 + 2OH–
Anoda:
Użycie rozpuszczalnej anody srebrnej: Ag + 2CN– = Ag(CN)2- + e
W przypadku stosowania nierozpuszczalnych anod: 4OH– = 2H2O + O2 + 4e
Wydajność prądowa posrebrzania cyjankowego jest wysoka, z wydajnością prądową zarówno katody, jak i anody zbliżoną do 100%.
4.2 Odbarwienie powłoki srebrnej
Posrebrzana biżuteria, gdy jest umieszczona w powietrzu lub używana przez jakiś czas, wchodzi w kontakt ze szkodliwymi gazami lub substancjami zawierającymi siarkę w powietrzu, powodując korozję i odbarwienie poszycia, poważnie wpływając na wygląd biżuterii. Główne przyczyny tego zjawiska są następujące.
- Sama posrebrzana warstwa może łatwo reagować i żółknąć w wilgotnej atmosferze zawierającej siarczki, a w ciężkich przypadkach może stać się czarna.
- Nieprawidłowe działanie procesu posrebrzania. Nieodpowiednie czyszczenie po galwanizacji pozostawia ślady soli srebra na powierzchni, a to zjonizowane srebro jest podatne na przebarwienia. Roztwór galwaniczny jest zanieczyszczony lub niewystarczająco czysty jonami metali, takich jak miedź, żelazo i cynk, co skutkuje niską czystością warstwy galwanicznej. Nieprawidłowe działanie prowadzi do szorstkiej warstwy galwanicznej o wysokiej porowatości. Powierzchnie o wysokiej porowatości są podatne na gromadzenie się wilgoci i czynników korozyjnych.
- Niewłaściwe pakowanie i przechowywanie po posrebrzaniu. Przyczyny przebarwień obejmują głównie: po pierwsze, posrebrzana biżuteria jest bezpośrednio wystawiona na działanie światła, co powoduje, że atomy srebra są narażone na działanie promieni ultrafioletowych, przekształcając się w jony srebra, co przyspiesza szybkość przebarwień; po drugie, przechowywanie w wilgotnym i wysokotemperaturowym środowisku jest podatne na przebarwienia; po trzecie, słabe uszczelnienie opakowania może powodować reakcję materiałów opakowaniowych ze srebrzeniem.
4.3 Proces obróbki warstwy pokrytej srebrem zapobiegającej odbarwieniom
Aby zapobiec odbarwieniu warstwy srebra, w produkcji często stosuje się procesy pasywacji warstwy srebra, które zazwyczaj obejmują następujące metody: pasywacja chemiczna, pasywacja elektrochemiczna, zanurzenie w środkach zapobiegających odbarwieniu, galwanizacja metalami szlachetnymi i zanurzenie w organicznych foliach ochronnych.
(1) Pasywacja chemiczna
Po dokładnym umyciu wodą, części platerowane, które nie zostały pokryte jasnym srebrem, powinny zostać natychmiast potraktowane kwasem chromowym.
- Obróbka kwasem chromowym. Bezwodnik chromu:80~85g/L; chlorek sodu:15~20g/L; temperatura: temperatura pokojowa; czas: 5~15 sekund. Po obróbce kwasem chromowym na powierzchni srebrzenia tworzy się stosunkowo luźna żółta warstwa.
- Proces zdejmowania izolacji. Woda amoniakalna: 300~500ml/L; temperatura pokojowa; czas: 20~30 sekund.
- Idemitsu. Ułamek masowy kwasu azotowego lub solnego 5%~10%; temperatura pokojowa; czas: 5~20 sekund. Po tym, jak warstwa srebrzenia zostanie poddana powyższym procesom, jest ona poddawana chemicznemu przypinaniu w celu uzyskania lepszych wyników. Warstwa pasywacji chemicznej jest bardzo cienka, co ma niewielki wpływ na rezystancję styku. Mimo to struktura warstwy pasywacyjnej nie jest wystarczająco gęsta, a jej zdolność do zapobiegania przebarwieniom nie jest silna, więc pasywację elektrochemiczną można przeprowadzić w następnej kolejności.
(2) Pasywacja elektrochemiczna
Można to zrobić po pasywacji chemicznej lub bezpośrednio po jasnym posrebrzaniu. Jako katody należy użyć warstwy srebra, a jako anody - stali nierdzewnej. W wyniku elektrolizy na powierzchni warstwy srebra tworzy się stosunkowo gęsta warstwa przypominająca igły, która ma wyższą odporność na odbarwienia niż warstwa pasywacji chemicznej. Jeśli pasywacja chemiczna jest połączona z elektrolizą, efekt jest jeszcze lepszy.
(3) Środek ochrony przed zanurzeniem w kontakcie elektrycznym
Rozpuścić środek ochronny w rozpuszczalniku organicznym i moczyć go przez 1 ~ 2 minuty w określonej temperaturze, co ma działanie ochronne na powierzchnię.
(4) Galwanizacja metali szlachetnych
Złoto galwaniczne, rod, pallad, stop palladu i niklu (80%), grubość 0,1 ~ 0,2 μm.
(5) Organiczna folia ochronna
Grubość wynosi zazwyczaj powyżej 5 μm, a efekt ochronny jest lepszy. Przezroczyste powłoki ochronne na bazie akrylu lub silikonu mogą być zanurzane (natryskiwane) lub katodowe elektroforetyczne farby akrylowe. Wymagania dotyczące organicznej powłoki ochronnej obejmują głównie dobrą gęstość powłoki, wysoką przezroczystość, twardość powłoki nie mniejszą niż HV4 i dobrą przyczepność do podłoża.
5. Złoto galwaniczne i stopy złota
Względna masa atomowa złota wynosi 197, standardowy potencjał elektrodowy złota jednowartościowego wynosi +1,68 V, równoważnik elektrochemiczny złota trójwartościowego wynosi +1,5 V, a równoważnik elektrochemiczny Au+ wynosi 7,357 g/(A.h), a równoważnik elektrochemiczny Au3+ wynosi 2,44977g/(A.h).
Złoto ma niezwykle wysoką stabilność chemiczną i nie ulega korozji pod wpływem kwasu solnego, kwasu siarkowego, kwasu azotowego, kwasu fluorowodorowego ani zasad. Przewodność elektryczna złota ustępuje tylko srebru i miedzi. Przewodność cieplna złota wynosi 70% przewodności cieplnej srebra, a złoto ma doskonałą ciągliwość. Ze względu na stabilność chemiczną, przewodność i dobrą lutowność, złoto jest szeroko stosowane w przemyśle dekoracyjnym.
Dekoracyjne złocenie jest zwykle stosowane w biżuterii rzemieślniczej, wymagając od powłoki dobrego koloru, połysku, odporności na zużycie i braku przebarwień. Czystość poszycia można podzielić na czyste złoto i złoto K, przy czym czyste złoto ma zawartość złota powyżej 99,9% i powszechnie stosowane rodzaje złota K, w tym 22K, 18K i 14K. Grubość powłoki można podzielić na cienkie złoto i grube złoto, przy czym cienkie złoto może być bezpośrednio powlekane na podłożach takich jak nikiel, miedź i brąz, podczas gdy grube złoto wymaga najpierw warstwy bazowej.
Powlekanie złotem rozpoczęło się na początku XIX wieku, wraz z pojawieniem się patentów na zastosowania do powlekania złotem pod koniec lat czterdziestych XIX wieku w oparciu o alkaliczne roztwory do powlekania na bazie cyjanku. Ze względu na ekstremalną toksyczność cyjanku, zarówno w kraju, jak i za granicą, prowadzono ciągłe badania nad opracowaniem roztworów do złocenia bez cyjanku i o niskiej zawartości cyjanku, co doprowadziło do pojawienia się kwaśnego czystego złocenia, kwaśnego twardego złocenia, neutralnego złocenia i złocenia bez cyjanku. Roztwory do złocenia można podzielić na cztery typy: alkaliczny cyjanek, kwaśny niskocyjanek, neutralny niskocyjanek i niecyjanek. Ogólnie rzecz biorąc, roztwory do powlekania złotem o niskiej zawartości cyjanku i bez cyjanku nadal mają pewne luki w stabilności i efektach powlekania w porównaniu z alkalicznymi roztworami do powlekania złotem z cyjankiem.
5.1 Pozłacanie cyjankowe
(1) Pozłacanie cyjankiem alkalicznym
① Główne składniki alkalicznego cyjankowego roztworu do powlekania złotem. Alkaliczny cyjankowy roztwór do powlekania złotem ma dobrą zdolność dyspersji, jest stabilnym roztworem do powlekania, jest łatwy w obsłudze i utrzymaniu oraz może łatwo zawierać różne pierwiastki stopowe, takie jak Cu, Ni, Co, Ag, Cd itp. w celu wytworzenia stopów złota o różnych odcieniach. Na przykład, dodanie niklu może dać lekko biały kolor złota, dodanie Cu i Cd daje różowe złoto; dodanie Ag może skutkować jasnozielonym złotem. Kontrolując stężenie pierwiastków stopowych w roztworze galwanicznym i warunki pracy, można uzyskać prawie każdy pożądany odcień złocenia. Porowatość złocenia cyjankowego jest stosunkowo wysoka, a jego odporność na zużycie i korozję słaba. Ze względu na wysoką zawartość cyjanku w złoceniu, jego użycie znacznie spadło w ostatnich latach; jednak w branży jubilerskiej złocenie cyjankowe pozostaje najpopularniejszym rodzajem. Główne składniki alkalicznego roztworu do złocenia cyjankowego są następujące.
- Cyjanek złota potasowego (zawierający 68,3% złota). Jest to główna sól w roztworze galwanicznym i źródło złota w warstwie galwanicznej. Warstwa galwaniczna będzie czerwona i szorstka, jeśli zawartość Au będzie zbyt niska. Jakość cyjanku złota potasowego jest bardzo ważna i należy zachować ostrożność podczas jego wyboru i stosowania. Cyjanek złota potasowego należy rozpuścić w wodzie dejonizowanej przed dodaniem do roztworu galwanicznego.
- Cyjanek potasu (cyjanek sodu). Jest to środek kompleksujący, który może stabilizować roztwór galwaniczny i umożliwiać normalny przebieg procesu elektrodowego. Jeśli jego zawartość jest zbyt niska, roztwór galwaniczny staje się niestabilny, co skutkuje szorstką powłoką o słabym kolorze.
- Fosforan. Jest to bufor, który stabilizuje roztwór galwaniczny i poprawia połysk powłoki.
- Węglan. Jest to sól przewodząca, która może poprawić przewodność roztworu galwanicznego i zwiększyć jego zdolność do dyspersji. Jeśli jednak węglan nie zostanie dodany podczas otwierania zbiornika, a roztwór jest zasadowy, z czasem CO2 z powietrza będą gromadzić się w roztworze galwanicznym. Gdy nagromadzenie węglanów jest nadmierne, może to spowodować szorstkość powłoki i powstawanie plam.
- Skład stopów Cu, Ni, Co, Ag i Cd jest w większości dodawany za pomocą soli cyjankowych, a są też takie, które są dodawane za pomocą soli EDTA. Ich stężenia muszą być odpowiednio kontrolowane, aby uzyskać powłoki stopowe 14K, 16K, 18K i 23K o różnych proporcjach. Co więcej, powłoki złoto-srebro 16K i złoto-miedź-kadm 18K mogą być stosowane jako warstwy pośrednie w grubych kombinacjach złocenia i powlekane do wymaganej grubości.
Reakcja elektrodowa alkalicznego złocenia cyjankowego. Główną solą w cyjankowym roztworze do powlekania złotem jest cyjanek złota potasu KAu(CN)2. Kompleksowy jon cyjanku Au(CN)2– is in the solution and discharged at the cathode, generating a gold plating layer.
Cathode:[Au(CN)2]– + e = Au + 2CN–
Adverse reaction:2H+ + 2e = H2
Anoda:
Using soluble silver anode: Au + 2CN– – e = [Au(CN)2]–
When using insoluble anodes:2H2O – 4e = 4H+ + O2
A portion of CN– remaining in the solution is oxidized by the oxygen in the initial ecosystem, and possible products include CNO–, COO–, CO32-, NH3, (CN)2, etc., which accumulate in the solution and become pollutants.
(2) Acidic Cyanide Gold Plating Process
The basis for an acidic micro-cyanide gold plating solution is that gold cyanide complex ions do not decompose at a pH of 3.1. The pH of the acidic gold plating solution is 3.5~5.5. The pure gold plating is bright, uniform, delicate, and has a yellowish-red hue. Adding alloying elements Co, Ni, Sb, Cu, Cd and others to the plating solution produce gold alloys to meet the decorative industry’s requirements for different hues, such as the 22.5~23.5 gold plating layers of 1N14, 2N18, 3N.
In production, acidic gold plating is mainly divided into two types: thin gold and thick gold. Thin gold plating includes pre-gold and decorative gold. Pre-gold requires excellent adhesion to the substrate and the gold layer, while the pre-gold plating solution prevents contamination of the thick gold plating solution. Decorative gold can be pure gold or gold alloy, depending on the appearance requirements. Thick gold plating solutions include ordinary and high-speed gold plating solutions. The plating solution can be plated to the required thickness as needed. The main components of acidic cyanide gold plating solution are as follows:
- Potassium cyanide. With sufficient content, the main salt can produce a bright, finely crystalline gold plating. Insufficient content results in a narrow current density range, with the plating appearing red, rough, and having high porosity.
- Citrate. It has complexing, associating, and buffering effects. If the concentration is too high, the current efficiency decreases, and the solution is prone to aging; if the concentration is too low, the dispersion ability of the plating solution is poor.
- Phosphate. A buffering agent that can stabilize the plating solution and improve the gloss of the coating.
- Cobalt, nickel, antimony, copper, cadmium, silver, etc., are alloying elements that can improve the hardness and appearance of the coating, and their concentration should be strictly controlled.
5.2 Non-Cyanide Gold Plating
In the 1960s, cyanide-free gold plating was used in production, with plating solutions containing sulfites, thiosulfates, halides, the-succinic acid, etc., but the most widely used was the sulfite plating solution with [Au(SO3)2]3- as the complex anion.
The characteristics of sulfite plating solution are: the plating solution has good dispersion and covering ability, the plating layer has good leveling and ductility (the elongation can reach 70%~90%), can achieve mirror gloss, and the purity of the plating layer is high, with good weldability. Fast sedimentation rate, few pores. The coating has good adhesion to nickel, copper, and silver metals.
The disadvantage of the sulfite plating solution is that its stability is not as good as that of the cyanide plating solution, and the wear resistance of hard gold is poor. Currently, this process has a small market share but has potential.
6. Electroplating Rhodium
Rhodium plating is silvery-white, has a strong surface gloss, is unaffected by corrosive gases such as carbon dioxide and sulfides in the atmosphere, and has high stability against acids and bases, exhibiting strong corrosion resistance. The hardness of rhodium plating is ten times that of silver plating, with good wear resistance. As a decorative rhodium layer, it has a slightly bluish tint in white, a bright luster, wear-resistant, and high hardness, making it the highest-grade decorative coating. Due to the high hardness and brittleness of rhodium, if the coating is too thick, it can easily peel off. Therefore, for general fashion jewelry, it is common to first plate silver, palladium, or nickel as a base layer before rhodium plating.
Rhodium plating solution contains sulfates, phosphates, or aminosulfonates, the most commonly used sulfates. Its plating solution is easy to maintain, has high current efficiency, and fast deposition speed, making it suitable for jewelry processing.
(1) Main Components of Rhodium Sulfate Plating Solution
- Rhodium sulfate. It is the main salt of the plating solution, and when the rhodium content is appropriate, it can produce a finely crystalline bright coating. If the content is too high, the coating will not be white and rough; if the content is too low, the coating will turn yellow and have poor brightness. Generally, the rhodium content is controlled between 1.6~2.2.g/L.
- Sulfuric acid. Its main function is to maintain the stability of the plating solution and increase conductivity, and low sulfuric acid content will affect the brightness of the plating layer.
(2) Electrode Reaction of Rhodium Plating
Anodic reaction:4OH – 4e = 2H2O + O2 ↑
Cathodic reaction: Rh2+ + 2e = Rh
Cathodic side reaction:2H+ + 2e = H2 ↑
Section III Chemical Plating Process
1. Characteristics of Chemical Plating
Compared with electroplating, chemical plating has the following advantages.
(1) Electroless plating suits various substrate materials, including metals, semiconductors, and non-metallic materials.
(2) The thickness of the chemical plating is uniform and consistent, regardless of the shape or complexity of the workpiece; as long as appropriate technical measures are taken, a uniform coating can be obtained on the workpiece.
(3) For autocatalytic chemical plating, coatings of any thickness can be obtained, and even electroforming is possible. The coatings obtained by chemical plating have excellent chemical, mechanical, and magnetic properties (such as dense coatings and high hardness).
However, chemical plating also has some disadvantages: first, the lifespan of the chemical plating solution is relatively short; second, the plating speed is slow, and only below the critical plating speed can the coating quality be guaranteed.
2. Principle of Chemical Plating
Chemical plating is a metal deposition process in which metal ions are reduced on the metal surface through self-catalysis by appropriate reducing agents in the solution. It is a chemical redox reaction involving electron transfer and a chemical deposition process without an external power source. This type of chemical deposition can be divided into three categories.
(1) Replacement Plating
Place a metal with strong reducing properties (the substrate, the workpiece to be plated) into a solution of another metal salt with strong oxidizing properties. The substrate metal acts as a strong reducing agent, and the electrons it donates are accepted by the metal ions in the solution, depositing on the substrate surface to form a coating. This process is also called immersion plating. For example, copper displacing silver, where the copper workpiece as the substrate displaces silver from the solution, and the deposited silver layer covers the copper surface. The reduction reaction stops immediately when fully covered, resulting in a very thin coating. Because the reaction is based on the substrate metal’s corrosion, the coating’s bonding strength to the substrate is relatively poor. There are not many systems suitable for the immersion plating process in terms of substrate and plating solution, so the application of this process is limited.
(2) Contact Plating
After the metal to be gold-plated comes into contact with another auxiliary metal, it is immersed in a solution of metal salts, and the potential of the auxiliary metal should be lower than that of the deposited metal. After the metal workpiece and the auxiliary metal are immersed in the solution, they form a primary battery, with the auxiliary metal being the anode due to its strong activity, dissolving and releasing electrons. In contrast, the metal workpiece is the cathode, where the metal ions in the solution are reduced and deposited as a metal layer on the workpiece. This method lacks significance in practical application but can be used to initiate chemical plating on non-catalytic active substrates.
(3) Reduction Method
First, the chemical plating solution contains metal ions for the coating, and then electrons provided by an appropriate reducing agent is added to reduce metal ions to deposit a metal coating. This chemical plating reaction must be well-controlled in terms of speed; otherwise, deposition throughout the solution becomes meaningless. The reduction method involves depositing a metal coating on an active surface with catalytic ability. Due to the self-catalytic ability of the deposited layer during the plating process, this technique can continuously deposit to form a coating of a certain thickness that has practical value, which is the true meaning of the “chemical plating” process. The method of achieving metal deposition using a reducing agent on a self-catalytic active surface is the only wet deposition process that can replace electroplating.
3. Chemical Gold Plating
Chemical gold plating can be divided into reducing type and displacement type, depending on whether a reducing agent is used in the plating solution. The reducing type chemical gold plating solution includes gold salt, complexing agent, reducing agent, pH buffer, and other additives. Its reaction utilizes the reducing agent to reduce gold, which is then uniformly deposited on the substrate to achieve the desired thickness. Generally, a thicker gold layer can be deposited, with a thickness of around 1μm. Displacement-type chemical gold plating is carried out without an external reducing agent. Due to the potential difference between metals, a more active metal can displace a less active metal from the solution through a displacement reaction. For example, in displacement gold plating on a nickel substrate, the potential difference between gold and nickel allows nickel to displace gold from the plating solution to the surface of the nickel layer. The standard potential of gold is 1.68 V, while the standard potential of nickel is only -0.25 V, indicating a significant potential difference. When the nickel substrate is immersed in the displacement gold plating solution, a displacement reaction occurs, and a layer of gold quickly replaces the nickel surface. However, gold atoms have a larger volume, resulting in a relatively loose arrangement on the nickel surface with many pores. Therefore, in the subsequent gold immersion process, as time extends, the gold ions in the plating solution continue to undergo displacement reactions with nickel atoms through the pores on the surface of the gold layer.
(1) Composition and Process Conditions of Chemical Gold Plating Solution
The chemical gold plating solution contains gold ion compounds (i.e., gold salts), complexing agents, pH buffers, reducing agents, stabilizers, and other main components.
① Gold salts and complexing agents. Suitable gold ion compounds include cyanide gold salts KAu(CN)2, KAu(CN)4, water-soluble gold compounds HAuCl4, KAuCl4, NH4AuCl4, Na3Au(SO3)2, Na3Au(S2O3)2, and gold compounds Au(OH)3 with lower solubility. They can be used alone or in combination. The gold ion concentration is generally 0.001~0.1mol/L. If the gold ion concentration is below 0.001mol/L, practical gold deposition rates cannot be achieved; if the gold ion concentration is above 0.1mol/L, gold precipitates are likely to form, and gold compounds cannot fully exert their role in chemical plating, leading to the waste of gold, which is economically unfavorable. The addition of complexing agents to the plating solution aims to form complexes with the metal components in the solution while acting as a buffer to suppress changes in the pH of the plating solution. Available complexing agents include EDTA·2Na, K2SO3, Na2SO3, K2S2O3 and others.
② Reducing agents and additives. The main reducing agents currently used in research include dimethylamine borane (DMAB), sodium hypophosphite, hydrazine, borohydrides, hydrazine borane, thiourea, sodium ascorbate, and titanium trichloride, among others.
③ Process conditions. The pH value of the plating solution is generally 5~9, with an optimal range of 6~8. A lower pH value improves the adhesion of the gold plating layer, but excessively low pH values can easily produce harmful gases and corrosion. A high pH value makes the plating solution strongly alkaline, which can dissolve the coating on the surface of the plated item. Depending on the type and concentration of gold ion compounds and complexing agents, it is appropriate to select alkaline solutions NaOH, KOH, NH4OH or inorganic acid solutions H2SO4, H3PO4, H3BO3 to adjust the pH value of the plating solution. The plating temperature is generally 50~90℃, the best being 60~85℃. A lower operating temperature is particularly suitable for items that are not heat-resistant, and it can also save energy and ensure safe operation.
(2) Cyanide-Free Chemical Gold Plating
Developing cyanide-free chemical gold plating, which replaces CN– in the gold plating solution with non-cyanide alternatives, is an important direction in chemical gold plating. It represents a significant advancement based on cyanide gold plating and has seen considerable domestic and international development in recent years. The current cyanide-free gold plating solutions mainly include sulfite gold plating, thiosulfate gold plating, halide gold plating, and thiocyanate gold plating, among which sulfite gold plating has better practical value. The following mainly introduces the sulfite gold plating system.
Sulfite system: In 1842, sulfite gold salt was first used as a gold source for cyanide-free electroplating of gold; it was later applied in chemical gold plating solutions, referred to as sulfite gold plating solutions. The reducing agents used in this gold plating solution include sodium hypophosphite, formaldehyde, hydrazine, borohydrides, DMAB, sodium ascorbate, thiourea and its derivatives, and phenyl compounds, among others. To obtain a practical cyanide-free gold plating solution, a small amount of stabilizers needs to be added to the plating solution, such as EDTA, triethanolamine, NTA, benzotriazole, 2-mercaptobenzothiazole, etc. These additives can form complex chelating agents with the monovalent gold ions in sulfite gold salt, thereby improving the stability of the plating solution.
4. Chemical Nickel Plating
The chemical nickel plating layer is independent of the coating thickness and the shape of the part and has high hardness, good wear resistance, natural lubricity, and excellent corrosion resistance, which is why it is known as the “designer’s coating.” Designers can find suitable options in the coating system based on the properties required for the parts.
Composition and Process Conditions of Chemical Nickel Plating Solution
The chemical nickel plating solution is crucial for the chemical plating process’s stability and the coating’s quality. Since the development of chemical plating, many types of plating solutions have been developed. Among them, the most commonly used solution combines nickel sulfate as the main salt and sodium hypophosphite as the reducing agent, along with appropriate additional components to adjust stability, complexation, and other properties.
(1) Nickel salts. There are mainly two types: nickel sulfate and nickel chloride. During the plating process, if the concentration of nickel salts is too low, the reaction rate is slow, making it difficult to form a plating layer. If the concentration is too high, it leads to some nickel ions being free in the plating solution, reducing the stability of the solution, which can easily result in a rough plating layer and even trigger the decomposition of the plating solution. Therefore, it is essential to maintain an appropriate content of nickel salts in the plating solution and to accurately analyze and appropriately supplement the nickel salt content during the process.
(2) Reducing agent. The common reducing agent is sodium hypophosphite. The role of the reducing agent is to catalyze dehydrogenation to provide lively primary hydrogen atoms to reduce the nickel ions to metallic nickel. The reducing agent’s content significantly impacts the deposition rate; increasing the concentration of the reducing agent can accelerate the deposition rate, but the concentration of the reducing agent should not be too high. Otherwise, the plating solution is prone to self-decomposition, which destroys the stability of the plating solution, and the deposition rate will also reach a limit value.
(3) Complexing agents. Commonly used complexing agents include glycolic acid, malic acid, tartaric acid, citric acid, and lactic acid. Adding complexing agents controls the deposition rate of nickel ions. The addition of complexing agents must consider the ability to complex all nickel ions and the deposition rate of the plating solution to maintain an appropriate ratio of the components. Complexing agents can reduce the concentration of free ions and the equilibrium potential in the solution while also adsorbing on the plated parts’ surface, enhancing the plated parts’ surface activity and accelerating the release of hydrogen ions from hypophosphite. Using composite complexing agents can effectively improve the stability of the plating solution and the deposition rate and make the surface of the coating bright and dense.
(4) pH value adjusters and buffers. The pH value of the plating solution has a significant impact on the deposition rate, reducing agent utilization and coating performance. Since H+ is a byproduct of the reduction reaction, the pH value of the plating solution will decrease as the reaction proceeds. Therefore, adjusting and controlling the pH value during chemical plating is crucial. pH value adjusters are usually NaOH, KOH or alkaline compounds such as carbonates, ammonia, etc. If it is necessary to lower the pH value, inorganic or organic acids must be added. Adding buffers prevents instability in the deposition rate caused by drastic changes in pH value during the deposition reaction. The anions of the buffer combine to form weak acid molecules with very low ionization, thus controlling the drastic changes in the pH value of the plating solution.
(5) Stabilizers. During the plating process, active crystalline cores inevitably form in the plating solution for various reasons, causing the solution to decompose and fail. By adding stabilizers, these active crystalline cores can be poisoned, losing their self-catalytic effect, thus preventing the decomposition of the plating solution. Stabilizers have become a technical secret in the chemical nickel plating process. Common stabilizers include lead ions, tin sulfides, etc.
(6) Promoters. The addition of complexing agents to the chemical nickel plating solution generally leads to a decrease in deposition rate. If added in excess, it can cause the deposition rate to become very slow or even unusable. Small amounts of organic acids are often added to the plating solution to increase the deposition rate, and these organic acids are referred to as promoters.
(7) Temperature. Temperature is the most important parameter affecting the deposition rate of chemical nickel plating. The catalytic reaction of chemical nickel plating generally can only be achieved under heating conditions, and many individual reaction steps of chemical nickel plating only show a significant deposition rate above 50℃. The operating temperature of the acidic plating solution for chemical nickel-phosphorus alloy is generally around 85~95℃, while general alkaline chemical plating solutions can deposit within a moderate temperature range. As the temperature increases, the deposition rate accelerates. However, raising the plating solution temperature will accelerate the increase of hypophosphite, making the plating solution unstable. During operation, the plating solution should be stirred evenly, and care should be taken to prevent local overheating of the plating solution, maintaining a stable working temperature to avoid severe self-decomposition of the plating solution and adverse consequences such as delamination of the coating.
(8) pH value. With the increase of the pH value of the plating solution, the deposition rate accelerates, and the solubility of phosphite decreases, which can easily lead to the self-decomposition of the plating solution. Suppose the pH value of the plating solution is too high. In that case, the reaction of hypophosphite oxidizing to phosphite accelerates, and the catalytic reaction turns into a spontaneous reaction, causing the plating solution to fail quickly. As the pH value increases, the phosphorus content in the coating decreases. When the pH value is too low, the reaction cannot proceed, such as in acidic plating solutions, when the pH value<3, it isn’t easy to deposit a nickel-phosphorus alloy coating.
(9) The effect of stirring. The diffusion process influences the chemical nickel plating process, and stirring the chemical plating solution helps to increase the transfer rate of reactants to the workpiece surface while also facilitating the removal of reaction products. Essentially, stirring alters the chemical composition and pH value within the diffusion layer at the workpiece/solution interface. Stirring methods include mechanical stirring, magnetic stirring, ultrasonic dispersion, and chemical dispersion methods. Additionally, when chemical nickel plating is conducted under heating conditions, the large amount of hydrogen gas released can create a “self-stirring” effect. Among these, mechanical stirring is simple and easy to implement, generally using external shear and impact forces to fully disperse particles in the medium; however, it does not effectively address the overall stirring of the plating solution, especially at the bottom of the beaker. Magnetic stirring utilizes a magnetic rotor to generate stirring through rotation in the plating solution. It is very effective for stirring the solution at the bottom, making it beneficial for composite plating solutions containing settling particles. However, magnetic stirrers typically only heat the bottom of the plating tank, and this heating method can easily cause local overheating of the bottom solution, which may adversely affect the plating solution’s stability and the coating’s performance. Ultrasonic dispersion has been widely recognized and effective in recent years, utilizing ultrasound’s high energy and cavitation effect to crush aggregated microparticles for dispersion. However, due to the immense energy of ultrasound, this dispersion should be applied intermittently during plating. Better results can be achieved if supplemented with a certain intensity of mechanical stirring.
5. Chemical Copper Plating
Chemical copper plating technology is mainly applied to non-metal surfaces such as plastics and wood in decorative items. Whether for decorative or functional plastic electroplating, most require chemical copper plating to ensure a good conductive base layer and achieve a good coating. Compared to other methods of metalizing plastic surfaces, chemical copper plating is the most economical and simplest method.
(1) Common Methods of Chemical Copper Plating
The chemical copper plating solution mainly consists of copper salts, reducing agents, complexing agents, stabilizers, adjusting agents, and other components. Currently, the widely used chemical copper plating solution uses copper sulfate as the main salt and formaldehyde as the reducing agent, mainly composed of two parts: one is a solution containing copper sulfate, potassium sodium tartrate, sodium hydroxide, sodium carbonate, and nickel chloride; the other is a solution containing the reducing agent formaldehyde. These two solutions must be prepared separately in advance and then mixed for use. In alkaline solutions, formaldehyde mainly exists as methylene glycol and its anions. During the chemical copper plating process, formaldehyde rapidly undergoes a disproportionation reaction, producing its redox products and leading to premature aging of the plating solution. Since no coordinating agents exist in the plating solution, only a small amount of these oxides can be dissolved while most continue accumulating. A typical plating solution formula and working conditions are 5g/L copper sulfate, 25g/L potassium sodium tartrate, 7g/L sodium hydroxide, 10ml/L formaldehyde, and time 20~30 seconds.
(2) Chemical Copper Plating on Non-Metallic Surfaces
With the expansion of the application field of chemical copper plating, the technology for chemical copper plating on non-metal surfaces has also gradually matured. For example, maskless producing the copper interconnection wires on ceramic substrates has been achieved by combining laser micro-etching technology with chemical plating. On this basis, a chemical copper plating method has been further established and implemented on the surfaces of non-metallic materials such as ceramics without the need for catalytic activation. This method simplifies the chemical copper plating process, has good coating performance, stable plating solution, and fast plating speed; it also saves precious metals and reduces production costs. Chemical metal plating is one of the main methods for metalizing plastic surfaces.
After the plastic is metalized, it can be further processed through chemical plating or electroplating to obtain plastic products with wear resistance, heat resistance, thermal stability, and special functions.
Chemical copper plating is also applied to the surface treatment of wooden materials, and the treated materials have better decorative and corrosion-resistant properties, which can enhance the added value of the products. Japan has made certain progress in researching wood copper plating and gold plating processes in recent years. The treatment objects are mainly wood from commonly used tree species such as Japanese cedar, and the test materials include wood chips and small square timber. The treatment process first involves ultrasonic treatment of the test materials in aqueous and organic solvent immersion solutions, degreasing and removing components that hinder the plating film, then sealing the resin channels with polyethylene glycol toluene solution, attaching the catalyst, and finally performing chemical plating, which requires several drying steps.
Despite the significant development of the chemical copper plating process, the following aspects still need further improvement: the relationship between the stability of chemical copper plating and plating speed; the kinetic study of chemical copper plating in multi-complex systems; the impact of additives on coating performance; the relationship between the microstructure of the coating and the surface morphology of the substrate; alternatives to formaldehyde, etc.
Copywrite @ Sobling.Jewelry - Producent biżuterii na zamówienie, fabryka biżuterii OEM i ODM
6. Chemical Plating Example: Electroplating of Leaf Veins
Leaf vein electroplating, also known as leaf decoration electroplating, first selects artistic, hard, and dense-veined leaves. After removing chlorophyll to expose the leaf veins undergo surface metallization and electroplating processing.
These leaves have been shaped and processed to maintain their original, realistic appearance and reflect the elegance and luxury after electroplating (Figure 11-8).

The main processes of leaf vein decorative electroplating are divided into three parts: leaf vein treatment, surface metallization (chemical plating), and decorative electroplating.
(1) Leaf Vein Treatment
Place the freshly picked leaves in an alkaline aqueous solution for soaking to remove chlorophyll, allowing the surface to display a relatively intact natural leaf vein pattern. The soaking solution is prepared with sodium hydroxide. After soaking for several days, chlorophyll can be removed, but this method takes a long time, and the degree of corrosion is difficult to control. Adding some sodium carbonate to the sodium hydroxide solution and heating it to a boil can quickly remove chlorophyll, with the leaves changing from green to yellow-green ideal. After washing the boiled leaves, if there are still traces of chlorophyll remaining on the veins, a soft brush must gently scrub along the veins, ensuring that the veins remain intact as a standard.
(2) Surface Metallization
Surface metallization is a treatment method that makes the surface of general non-metal materials conductive, preparing for the next electroplating step, which can be achieved through sensitization, activation, reduction, and chemical plating. Chemical nickel plating makes the surface of the leaf veins conductive, with the basic formula and process conditions being 26~28g/L nickel sulfate, 35g/L sodium hypophosphite, 20g/L citric acid, and other appropriate amounts. The operating process conditions are pH value being 4.6~4.8 and temperature at 90℃.
(3) Decorative Electroplating
After bright copper plating, mid-term production can be carried out: use spot welding to configure hanging parts, such as positioning pins, hooks, and other hangers. The material for the hanging parts is generally fine purple copper wire. Before spot welding, soak the fine copper wire in an acid solution for a short time (less than 30 seconds), and then cover it with solder for spot welding.
(4) Bright Electroplated Nickel
The nickel plating process, which is mainly used to prevent the penetration of copper and gold plating, refers to the previous one.
(5) Electroplated Gold
Finally, a thick gold plating is applied to the surface.
Section IV Chemical and Electrochemical Conversion Film Process for Popular Jewelry
Chemical and electrochemical conversion film technology is a technique that uses chemical or electrochemical means to bring metal into contact with a specific chemical treatment solution, thereby forming a layer on the metal surface that has good adhesion and can protect the base metal from the effects of water and other corrosive media, can improve the adhesion and aging resistance of organic coatings, or can impart decorative properties to the surface.
In the jewelry industry, chemical and electrochemical conversion film technology has been widely applied, forming colored films or interference films through surface conversion, creating various decorative colors and surface coloring effects, improving the appearance of materials, and enhancing corrosion resistance. This includes surface coloring treatments for copper jewelry, stainless steel jewelry, titanium jewelry, aluminum jewelry, and silver jewelry.
1. Chemical Coloring Process of Copper and Copper Alloy Ornaments
Copper alloy coloring is mainly applied to craft jewelry. Most copper compounds have intense colors, and the decorative colors on the surface of copper and its alloys almost cover the entire color spectrum through chemical coloring. Currently, the ones that are accepted by the market and can be produced on an industrial scale are primarily green (copper carbonate), black (copper sulfide), blue (alkaline copper ammonia complex), black (copper oxide), and red (cuprous oxide).
(1) The Chemical Reaction Mechanism of Surface Coloring
The surface coloring of copper and its alloys is the interaction of metallic copper with the coloring solution, forming an oxide layer, sulfide layer, and other compound films on the metal surface. Different coloring effects can be achieved by selecting different coloring formulas and conditions. For example, sulfur-based solutions that can be utilized include sulfides (such as potassium sulfide, ammonium sulfide, etc.), sodium thiosulfate, polysulfides (such as potassium persulfate), etc. The coloring principle is based on the characteristic reaction of sulfur with copper to produce copper sulfide, and under different reaction conditions and the participation of other components in the formula, colors such as black, brown, dark antique copper, blue, and purple can be formed. The interaction of copper with ammonia and chromium, along with the participation of other ions in the formula, can also produce various coloring effects under different reaction conditions. The addition of oxidants in the coloring formula can promote the reaction, but excessive oxidants can affect the quality of the oxide film.
(2) Chemical Coloring Process of Copper
- The color is antique copper. Immerse pure copper or copper-plated ornaments (the thickness of the copper plating must be greater than 5μm) in the coloring solution below and shake continuously. It will quickly turn brown and deepen over time. When it reaches a certain thickness, oxygen will start to precipitate; at this point, it should be removed, cleaned, and dried for polishing, or the colored piece can be rubbed with leather scraps in a drum. The surface layer of the convex part is ground away to reveal some of the original copper color. The parts will exhibit a gradient of color from light to dark from the convex to the concave surfaces, creating an elegant antique style. This antique color tone is favored in craft ornaments on the international market. The typical process specification for achieving antique copper color is 40~120g/L basic copper carbonate, 200ml/L ammonia, reacting at room temperature for 5~15 minutes.
- Copper coloring blue. Optional copper coloring blue process scheme: 130g/L copper sulfate, 13g/L ammonium chloride, 30ml/L ammonia, and 10ml/L acetic acid react for several minutes at room temperature.
- Copper coloring green. Optional copper coloring green process schemes: 32g/L calcium chloride, 32g/L copper nitrate, 32g/L ammonium chloride, react for a few minutes under 100℃.
- Copper coloring ancient green. Optional copper coloring ancient green process specifications: 5~10g/L sulfuric acid brocade, 10~15g/L ammonium sulfate, 25~30g/L sodium thiosulfate, water 200 ml, react for several minutes under 30~50℃.
- Copper coloring brown. Optional copper coloring brown process specifications: 6g/L copper sulfate, 4g/L copper acetate, 1g/L alum, react for 10 minutes under 95~100℃.
- Copper coloring golden yellow. Optional copper coloring golden yellow process schemes: 0.8g/L potassium sulfide, 1g/L ammonium sulfide, 0.3g/L barium sulfide, 4g/L sodium sulfide, 0.13g/L potassium permanganate, and 0.7g/L hydrogen peroxide react for several minutes at room temperature.
- Copper coloring red. Optional copper red process scheme: 25g/L copper sulfate, 200g/L sodium chloride, react for 5~10 minutes under 50℃.
- Copper coloring black. Optional copper blackening process schemes: 5~12.5g/L potassium sulfide and 20~200g/L ammonium chloride, which react for several minutes at room temperature.
(3) Chemical Coloring Process of Copper Alloys
Coloring with brass is relatively simple, with copper alloys followed by bronze, aluminum, and band bronze. The chemical coloring of copper alloys is widely used in craft jewelry.
- Copper alloy coloring red. Optional copper alloy red process schemes: 2g/L iron nitrate, 2g/L sodium sulfite, react for a few minutes under 75℃.
- Copper alloy coloring orange. Optional copper alloy orange process schemes: 25g/L sodium hydroxide and 50g/L copper carbonate, which react for a few minutes under 60~75℃.
- Copper alloy coloring brown. Optional process scheme for brown copper alloy: 12.5g/L barium sulfide, reacting for several minutes under 50℃.
- Copper alloy coloring chocolate color. Optional processes for copper alloy with chocolate color: 25g/L copper sulfate, 25g/L ammonium nickel sulfate, 25g/L potassium chlorate, react for a few minutes under 100℃.
- Copper alloy coloring ancient green color. Optional processes for achieving the ancient green color of copper alloy: 350g/L ammonium chloride, 200g/L copper acetate, react for a few minutes under 100℃.
- Copper alloys coloring blue. Optional processes for blue copper alloys: 2g/L sodium sulfite, 1g/L lead acetate, react for a few minutes under 100℃.
- Copper alloy coloring black. Optional process scheme for blackening copper alloy: 25g/L copper sulfate, a small amount of ammonia, reacts for a few minutes under 80~90℃.
(4) Factors Affecting Coloring Effects
The chemical coloring of copper and copper alloy jewelry is sometimes unstable, and the main factors affecting the coloring effect are the following three.
① The influence of substrate composition. Generally speaking, substrates with a high copper content are more likely to achieve a pure and attractive appearance. As the copper content decreases, the presence of other alloying elements, which are more reactive than copper, will affect the purity of the corrosion products and the color of the copper coating. For example, the corrosion products of zinc, tin, aluminum, etc., will mix white hydroxides into the film layer, causing the film layer to appear white. In this case, the content of stabilizers can be appropriately increased. When a β phase is present in the material’s metallographic structure, due to its poor corrosion resistance, severe pitting will occur, resulting in a large accumulation of zinc hydroxide at the pit openings, leading to obvious white spots and rendering the material unusable. At this time, reducing the stabilizer content can achieve good results.
② The impact of the workpiece surface condition. For deep-drawn or deep-stretched parts, in areas of severe deformation, 80% mechanical energy is stored in the form of crystal defects such as dislocations and vacancies, which have high chemical reactivity, leading to localized color differences. Stress relief annealing can be used to eliminate these issues. Additionally, the consistency of the surface roughness of the parts also has a certain impact on color consistency.
③ The impact of special climatic conditions. The coloring of copper alloy jewelry after applying the coloring solution may experience instability due to changes in climate during the color development reaction in the air. There may be insufficient or excessive reaction time for special climates, which requires appropriate control of the coloring time to resolve.
2. The Coloring Process of Silver and its Alloy Jewelry
The coloring treatment of silver and its alloys is mainly used for decorative craft jewelry, forming sulfides on its surface, which can create shades of black, blue-black, light gray, dark gray-green, gray-green, ancient silver, yellow-brown, green-blue, and so on.
(1) Silver Coloring Ancient Silver Color
Selectable silver alloy antique silver color process scheme: 25g/L potassium sulfide, 38g/L ammonium chloride, and 2g/L barium sulfide react at room temperature until the desired tone is reached.
(2) Silver Coloring Black
Selectable silver alloy with black process scheme: 15g/L potassium sulfide, 40g/L ammonium chloride, and a small amount of ammonia water react under 80℃ until the desired tone is reached.
(3) Silver Coloring Blue-Black
Selectable silver alloy with blue-black color process scheme: 2g/L potassium sulfide, 6g/L ammonium chloride, reacting under 60~80℃ until the desired hue is reached.
(4) Silver Coloring Blue and Yellow
Selectable silver alloy with blue-yellow process scheme: 1.5g/L potassium sulfide, reacting under 80℃ until the desired hue is reached.
(5) Silver Coloring Green
Selectable silver alloy with blue-green process scheme: 300g/L hydrochloric acid and 100g/L iodine react at room temperature until the desired hue is reached.
(6) Silver Coloring Yellow-Brown
Selectable silver alloy yellow-brown process scheme: 5g/L barium sulfide reacts at room temperature until the desired hue is reached.
3. Coloring Process of Zinc and its Alloy Jewelry
The surface conversion film formed by chromate passivation treatment of zinc and its alloys also has coloring functions, generally resulting in various colors such as rainbow, grass green, brownish yellow, green, military green, and black.
(1) Zinc Coloring Black
Selectable zinc blackening process: For 10~15 minutes, 40~50g/L copper sulfate and 30~40g/L potassium chloride react at room temperature.
(2) Zinc turns red
Selectable zinc red process scheme: copper sulfate, tartaric acid, and ammonia react at room temperature for minutes.
(3) Zinc Coloring Red
Selectable zinc coloring red craft scheme: 60g/L copper sulfate, 80g/L sodium carbonate, 60ml/L potassium bitartrate, react at room temperature for 3~5 minutes.
(4) Zinc Alloy Coloring Gray
Selectable zinc alloy gray coating process scheme: 20~25g/L copper sulfate, 50ml/L ammonia, 30g/L ammonium chloride, react for 3~5 minutes under 20~25℃.
(5) Zinc Alloy Coloring Green
Selectable zinc alloy green process scheme: 80~100g/L potassium dichromate, 25~30g/L sulfuric acid, 150g/L hydrochloric acid, react for 0.5~1 minutes under 30~40℃.
(6) Zinc Alloy Coloring Black
Selectable zinc alloy blackening process: 140~160g/L copper sulfate and 80~90g/L potassium chlorate react for 3~5 minutes under 20~25℃.
4. The Oxidation Coloring Process of Stainless Steel Jewelry
Stainless steel anodizing refers to forming an anodized color layer on the surface of stainless steel. It utilizes the colorless and transparent oxide film to create color through light interference, resulting in a durable hue formed by this film layer.
Typical methods for coloring stainless steel through oxidation include chemical and oxidation coloring methods. Chemical coloring methods include the Inco method and the Acheson method. The Inco method involves immersing the steel in a high-temperature sulfuric acid solution for coloring. In contrast, the Acheson method involves electrolysis in a medium-temperature solution to form a thin oxide film on the stainless steel surface, with color controlled by changing the thickness of the oxide film. The oxidation coloring method involves heating in the atmosphere or a controlled atmosphere to form an oxide film; this method is simple, but it is difficult to control the color, so it is limited to small stainless steel ornaments.
(1) Inco Method
In 1972, Inco established the color management and color-enhancing film technology for the acidic solution oxidation method, and its processing steps are as follows:
Pre-treatment → Water washing→Color development treatment→Water washing→Hard film treatment→Water washing→Drying
After pretreatment, the stainless steel plate is immersed in a 80~85℃ mixed solution of chromic acid and sulfuric acid. This treatment can form a chromium-based oxide film on the surface of the stainless steel, which can vary in thickness from hundreds to thousands depending on the treatment time. Due to light interference, colors can appear in the order of tea color: blue, gold, purple, green, etc. The growth of the oxide film, that is, the color change, can alter the immersion potential of the stainless steel, mastering this potential change for color management is the first feature of the Inco method (color development process). However, the color development film is porous at this stage and has poor wear resistance. Therefore, cathodic electrolysis should continue in a mixed aqueous chromic acid and phosphoric acid solution to strengthen the color development film. This treatment can seal the pores of the porous color development film, significantly improving wear and corrosion resistance. This is the second characteristic of the Inco process (hard film treatment).
Due to some issues with the process, the color in this technology is difficult to control, and the management requirements for raw materials are strict.
(2) Acheson Method
In 1985, Kawasaki Steel successfully developed the alternating current electrolysis method, also known as the Acheson method. This method involves electrolyzing stainless steel in a mixed solution of chromic acid and sulfuric acid below 60℃, forming an oxide film on the surface. Due to the repeated alternating anode electrolysis for a specified number of times, coloration and film hardening can occur simultaneously. Color control can be achieved by controlling the total electric charge. Stainless steel colored using the Acheson method has bright colors and can display unique colors such as bronze and yellow.
The color of the stainless steel surface mainly depends on factors such as the chemical composition of the surface film, its microstructure, surface smoothness, film thickness, and the angle of incident light. Generally, thin oxide films display blue or brown, medium thickness films show golden yellow or red, thick films appear green, and the thickest ones appear black. Overall, the coloring process of stainless steel is relatively difficult, with high process requirements, and its color uniformity is not easy to control.
5. Anodizing Treatment of Aluminum Alloy Jewelry
Aluminum alloy jewelry are widely colored using the anodizing method. Aluminum is one of the easiest metals to color. Through anodizing treatment, a thick and dense oxide film layer is formed on the aluminum surface, significantly changing the corrosion resistance of the aluminum alloy and improving hardness, wear resistance, and decorative performance. The methods for coloring aluminum oxide films mainly include electrolytic coloring, chemical dyeing, and electrolytic dyeing.
(1) Electrolytic Coloring Method
Electrolytic coloring is the process of anodizing and coloring completed in the same solution, directly forming a colored oxide film on aluminum alloys. Therefore, the electrolytic coloring method is also known as the one-step electrode coloring method. Electrolytic coloring is caused by the selective absorption of certain wavelengths of light by the film layer while the remaining wavelengths are reflected. The selective absorption is related to the oxidation state of the alloying elements in the film layer or the state of the electrolyte composition combined with the substances in the oxide film.
(2) Chemical Coloring Method
The anodic oxide film of aluminum jewelry can be impregnated and colored with inorganic or organic dyes. The coloring agents are deposited in the upper part of the pores of the oxide film. The most suitable oxide film for coloring is obtained through sulfuric acid anodization.
(3) Electrolytic Coloring Method (Two-Step Electrolytic Coloring Method)
After anodizing aluminum or aluminum alloys, they are immersed in a solution of more expensive metal salts, and coloring is achieved by using alternating current for polarization or direct current for cathodic polarization. Under the action of the electric field, metal ions are reduced and deposited at the bottom of the pores in the oxide film, resulting in the coloring of aluminum and its alloys.
Section V Physical Vapor Deposition Process
Physical Vapor Deposition is abbreviated as PVD. Physical Vapor Deposition is a physical vapor reaction growth method, and the deposition process occurs under vacuum or low-pressure gas discharge conditions. The source of the deposited material is a solid material, which, after “evaporation or sputtering,” generates a new solid material deposition layer on the surface of the part that is completely different in performance from the substrate.
Physical vapor deposition technology is increasingly applied to jewelry, with surface decorative coatings for crafts. The colors of the coatings are diverse, including deep gold, light gold, coffee, antique bronze, gray, black, gray-black, and multicolored, which can significantly improve the appearance color of craft jewelry and enhance characteristics such as wear resistance and corrosion resistance.
1. Classification of Physical Vapor Deposition Processes
Physical vapor deposition processes are divided into several types, including vacuum evaporation coating, ion plating, and magnetron sputtering coating, with the latter two belonging to the category of plasma vapor deposition. The deposition of the film layer occurs under low-pressure plasma gas discharge conditions, where the film layer particles gain higher energy in the electric field, resulting in significant improvements in the organization, structure, and adhesion of the film layer compared to vacuum evaporation coating. With the development of high technology, various new technologies for ion plating and magnetron sputtering coating have gradually matured and are continuously promoted and applied in various fields.
(1) Vacuum Evaporation Coating
Vacuum evaporation coating (evaporation) is vaporizing and evaporating the coating material through high-temperature heating under vacuum conditions and depositing it on the substrate surface to form a solid thin film. Evaporation technology is one of the earlier developed technologies in vacuum coating technology. Compared to sputtering and ion plating, the evaporation method is relatively simple, but under appropriate process conditions, it can produce very pure, thin film coatings with specific structures and properties. Therefore, evaporation technology still plays an important role in optics, semiconductor devices, and plastic metallization fields.
The vacuum evaporation coating has the following technical characteristics:
- The vacuum evaporation coating process includes the evaporation of the coating material, the transport of vapor atoms, and the nucleation and growth of vapor atoms on the substrate surface, which consists of evaporation, transport, and deposition.
- The deposition vacuum of vacuum evaporation coating is high, generally at 10-3~10-5Pa. The film layer particles hardly collide with gas molecules or other metal vapor atoms, reaching the workpiece directly.
- The energy of the film layer particles reaching the workpiece is the thermal energy carried during evaporation. Since the workpiece is not biased in vacuum evaporation coating, the metal atoms rely solely on the vaporization heat during evaporation, which is approximately 0.1~0.2eV. Therefore, the energy of the film layer particles is low, the bonding strength between the film layer and the substrate is small, and it isn’t easy to form compound coatings.
- The vacuum evaporation coating layer is formed under a high vacuum, and the layer particles in the vapor are atoms state, forming small cores on the surface of the workpiece, growing into a dense structure.
- The vacuum evaporation coating layer is obtained under high vacuum conditions. Generally, the coating can only be deposited on the side of the workpiece facing the evaporation source. In contrast, the side and back of the workpiece hardly receive any coating, resulting in poor coating quality.
(2) Magnetron Sputtering Coating
Under certain vacuum conditions, bombarding the surface of a material with charged particles of tens of electron volts or higher kinetic energy allows the atoms of the bombarded material to gain enough energy to escape the binding of the original material lattice and enter the gas phase. This technology is called sputtering technology. The sputtered gas phase elements are used for deposition to form a film, and this deposition process is referred to as sputter coating, as shown in Figure 11-9. When depositing hard coatings, the workpiece needs to be connected to a negative bias power supply called magnetron sputtering ion plating or bias sputtering.
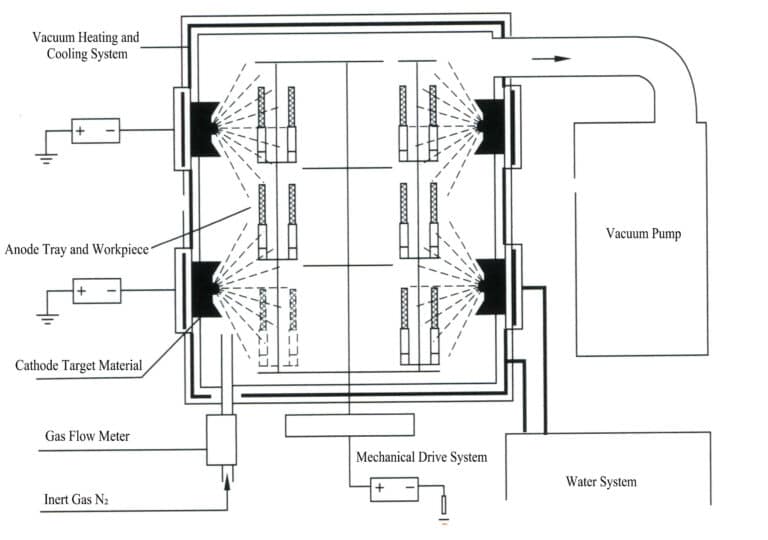
Sputter coating is currently the most widely used coating technology in PVD technology, with the following advantages:
- The quality of the sputtered coating is good, and the adhesion to the substrate is very strong.
- The application range of sputter coating is wide and suitable for various materials, and high melting point materials can also be easily sputtered.
- The thickness distribution of the sputter-coated film is relatively uniform.
- The sputtering coating process has good repeatability, is easy to achieve process control automation, and can be produced continuously on a large scale.
(3) Ion Plating
Ion plating is a process that takes place under vacuum conditions, using gas discharge to partially ionize gas or evaporated materials. While the gas ions or ions of the evaporated materials bombard the surface, the evaporated material or its reaction products are deposited onto the substrate.
In the following aspects, Ion plating combines the fast deposition rate of evaporation plating with the surface cleaning characteristics of ion bombardment in sputtering plating.
- The film layer has good adhesion to the substrate and dense film structure.
- It can improve the film’s ability to cover complex shaped surfaces, also known as the diffraction capability during the film deposition process.
- The controllable parameters of the film layer organization are numerous, the overall energy of the film layer particles is high, and it is easy to perform reactive deposition, allowing for the acquisition of compound coatings at lower temperatures.
2. The Application of PVD Coating Technology in the Jewelry Industry
2.1 Zirconium Nitride Decorative Coating
(1) Pre-Treatment for Coating
The vacuum coating process requires a high level of cleanliness for the sample surface and the vacuum furnace chamber, which is necessary for obtaining high-quality film layers. Therefore, the samples must be cleaned, and the vacuum furnace must be cleaned before coating.
Cleaning the sample surface is key to film formation. The sample surface must be clean and free of rust spots and oil stains, so the sample should be strictly cleaned before entering the furnace to remove oil, dirt, rust, and moisture. The cleaned sample should not be touched by hand to prevent secondary contamination.
The pre-treatment process flow for workpiece coating is as follows:
- Ultrasonic cleaning (1% metal cleaning agent), temperature: 50℃, time: 3 minutes.
- Ultrasonic cleaning (5% metal cleaning agent), temperature: 50℃, time: 2 minutes.
- Hot water cleaning, temperature: 50℃, time: 30 seconds.
- Rinse with cold water at room temperature for 30 seconds.
- Rinse with deionized water at room temperature for 20 seconds.
- Alcohol dehydration.
- Drying or air drying.
- Cleaning of the vacuum furnace. Wipe the dirt, attachments, and deposits inside the vacuum furnace with a dry cloth, and use a scraper to remove attachments from the corners.
(2) Coating Process Flow
① Pre-evacuation. After the sample is placed in the vacuum chamber, close the furnace door, turn on the mechanical pump for rough pumping, and when the vacuum reaches 0.1 Pa, turn on the oil diffusion pump for fine pumping. The vacuum process ends when the vacuum in the chamber reaches 6.5×10-3Pa.
② Glow discharge cleaning. The function of glow discharge cleaning involves many electrons moving toward the anode during the cleaning process. The high-speed movement of electrons ionizes the argon gas in the vacuum chamber, creating a glow phenomenon and generating softer argon ion movement. The moving argon ions, under the influence of the biased electric field, bombard the surface of the workpiece, colliding and removing the adsorbed gases and impurity atoms from the surface, exposing a clean surface of the workpiece material. At the same time, it increases the micro-roughness of the workpiece surface, which is beneficial for enhancing the bonding strength between the film layer and the workpiece. After introducing a certain argon gas flow to raise the pressure to 4×100Pa in the furnace, the bias power supply applied to the workpiece is turned on (the voltage and pulse duty cycle are adjustable). Here, the bias value is positive, and argon ions are used to clean the furnace wall, target surface, workpiece, and turntable. The cleaning time is determined based on the material and cleanliness of the workpiece.
③ Main bombardment. The role of the main bombardment is to apply a negative bias to the workpiece, which accelerates a large number of target material ions that are sputtered out. Positively charged target material ions move towards the workpiece under the influence of the negative bias, forming high-speed ion clusters with considerable energy. These ion clusters perform a certain degree of cleaning, activation, and implantation on the workpiece. The effect of the main bombardment: a large number of metal ions are implanted into the surface of the workpiece, and the implanted ions cause lattice restructuring with the substrate. Some metal ions with slightly lower energy levels produce a diffusion layer due to smaller implantation forces. Ions moving toward the workpiece may collide with it, and some will sputter and eject due to lower energy levels or differing incident angles. These ions will then collide with the next moving ions, forming secondary energy-level ions that ultimately deposit on the surface of the workpiece.
After cleaning, the vacuum chamber continues to evacuate to achieve 6.5×10-3Pa. Then, a certain flow rate of argon gas is introduced to achieve a total pressure of 0.3 Pa in the furnace; the values of pulse bias and duty cycle are adjusted (specific values depend on the requirements of the film layer); the power (voltage, current) of the cathode target’s intermediate frequency power supply is set to a certain value; the sample is subjected to main bombardment, with the bombardment time determined by process requirements.
④ Adding nitrogen gas for deposition coloring. At the end of the main bombardment process, an appropriate flow of reaction gas N2 will be introduced (at this time, the vacuum degree will slightly decrease). Manually adjust the nitrogen flow meter’s potentiometer to control the nitrogen flow based on the partial pressure of nitrogen (percentage) displayed by the mass spectrometer. At this time, the pulse bias, duty cycle, and the power (voltage, current) values of the cathode target’s intermediate frequency power supply can be adjusted according to process requirements; the sample is subjected to deposition coloring, and the deposition time is determined based on process requirements. In this way, metal ions will move towards the workpiece under appropriate bias, and during the movement, they will collide with the reaction gas to form a metallic compound film. At the same time, the movement speed will also decrease and deposit on the surface of the workpiece.
⑤ Passivation. The role of passivation is that the freshly coated film layer is a relatively active structure with a certain temperature. If it comes into contact with the atmosphere immediately, it will react again, causing a color change. Therefore, after the coating is completed, it should be cooled down, and a suitable amount of argon gas should be introduced, which protects the surface film layer of the workpiece with inert gas, allowing the film layer to be more stable with the temperature decreasing; on the other hand, it allows the target surface to absorb a large amount of argon gas and become saturated, thereby maintaining a fresh target surface and preventing the target surface from absorbing other gases after being filled with atmosphere, thus protecting the sputtering target surface from contamination. The maximum argon gas flow during the filling process is about 2 minutes.
⑥ Inflatable cooling. When the temperature of the vacuum chamber drops to 120℃, it introduces air to atmospheric pressure.
⑦ Opening the furnace and take out the sample. Open the furnace door, put on clean gloves to remove the sample, and seal the sample for color measurement, film thickness measurement, and Auger semi-quantitative analysis.
(3) Color Control of Zirconium Nitride Film
As a decorative ZrN gold-like film, the color of the film layer is particularly crucial. Due to the numerous process parameters of the medium-frequency reactive magnetron sputtering technology, many factors affect the film’s color. Under certain other process parameters, the nitrogen partial pressure and sputtering power are vital in the film’s color. As the nitrogen partial pressure increases, the color of the ZrN film changes from silver-white→light yellow→gold yellow→reddish gold→deep red. As the sputtering power increases, the color of the ZrN film changes from deep yellow→gold yellow →light yellow. By comparing the colors of ZrN films with those of gold and gold alloys, the desired gold yellow can be obtained by adjusting the nitrogen partial pressure during deposition.
2.2 Titanium Nitride Decorative Coating
(1) Magnetron Sputtering Technology for the Deposition of Titanium Nitride Process
① Install the workpiece. After installing the workpiece on the workpiece fixture, close the coating chamber.
② Vacuum extraction. Start the vacuum pump, and when the vacuum degree reaches 6 Pa, open the diffusion high spring and extract the vacuum to achieve 6×10-3Pa.
③ Baking heating. Turn on the baking heating power supply to heat the workpiece to the predetermined temperature.
④ Bombardment purification. Introduce working gas into the coating chamber, maintain a vacuum degree of 1~3Pa, bombardment voltage of 1000~3000 V, the workpiece generates glow discharge, argon ions bombard and purify the workpiece, bombardment for 10~20 minutes.
⑤ Titanium nitride deposition. First, deposit the base layer, reduce the workpiece bias to about 500 V, introduce argon gas, and adjust the vacuum to 0.3~0.5Pa. Turn on the magnetron sputtering target power supply. A glow discharge occurs on the target surface, and a high-density flow of argon ions ejects titanium atoms from the target surface. Next, deposit the titanium nitride coating, requiring the introduction of nitrogen gas, with the vacuum maintained within the range of 0.5~0.7Pa. Due to the balanced metal ionization rate of the magnetron sputtering being only 5%~10%, the reactivity of the metal is relatively low, resulting in a narrow process range (nitrogen content) for obtaining nitrogenized needle-like compounds coating. Compared to glow discharge, to achieve high-quality titanium nitride coatings, it is essential to strictly control the amount of titanium sputtering and the argon-nitrogen ratio. Otherwise, the deposition rate will be very low, and the color will be difficult to control.
⑥ Remove the workpiece. When the film thickness reaches the specified requirements, inflate the coating chamber, open the coating chamber, and remove the workpiece.
(2) The Effect of Process Parameters on the Properties of Titanium Nitride Films
① The effect of deposition temperature on the properties of nitride thin films. The deposition temperature affects the hardness and structure of TiN coatings; the hardness and adhesion of the TiN film deposited near 500℃ are the highest. Excessive and high temperatures are detrimental to the surface hardness of the TiN film. If the deposition temperature is too low, it reflects a short pre-sputtering time or low sputtering energy, affecting the film’s density, leading to insufficient nucleation of the TiN film and coarsening of the structure, resulting in a decrease in hardness. Conversely, if the deposition temperature is too high, it can cause overheating on the sample surface. Suppose the deposition temperature exceeds the tempering temperature of the substrate material. In that case, it will reduce substrate hardness, preventing a good bond with the film and causing a decrease in film hardness. Therefore, increasing the deposition temperature is beneficial for improving the hardness of the TiN film, provided that the sample surface does not overheat.
② The effect of deposition voltage on the properties of titanium nitride films. As the deposition voltage increases, the fracture morphology of the prepared TiN films becomes finer, and the microhardness and the deposition rate of the films increases. Increasing the discharge voltage under the same deposition conditions also means enhancing the plasma intensity, which promotes the chemical reactions in a direction favorable for product formation. Therefore, increasing the deposition voltage can increase the deposition rate of TiN films.
③ The effect of the workpiece on the performance of titanium nitride films. The quality of the film’s performance on the workpiece is not only related to the properties of the film itself but also to the properties of the workpiece material, especially the hardness of the workpiece material. Hard films exhibit their superior wear resistance only on relatively hard substrate materials. If the hardness of the substrate material varies, the bonding strength between the TiN film and the substrate will also differ. The greater the substrate hardness, the better the bonding between the TiN film and the substrate. In practical applications, efforts should be made to maintain a high hardness of the substrate material under certain deposition temperature conditions to improve the quality of the film. The smaller the surface roughness of the substrate, the higher the bonding strength between the titanium nitride film and the substrate, with polishing being the best for substrate surface roughness.
Section VI Enamel Craftsmanship
Enamel is a beautiful and colorful craft art made by attaching various colored glazes to a metal base (using materials such as gold, silver, copper, titanium, etc.) and firing it at high temperatures. Enamel colors are vibrant, have a gem-like luster and texture, resist corrosion, wear, and high temperatures, are waterproof and moisture-proof, are hard and solid, and do not age or deteriorate. Enamel has a long history of application in craft jewelry; in ancient centuries, it was used in the design of various decorative items for jewelry boxes, and by the 15th century, watchmakers incorporated it into watchmaking, adding bright colors to watches. The meticulous firing methods of enamel are intriguing, and its rich color expressiveness has pushed it to the forefront of fashion trends. Enamel jewelry wins with color and often attracts the attention of jewelry designers, especially when enamel is used for surface decoration on metal jewelry, greatly enhancing the artistic expressiveness of the pieces.
Enamel is commonly known as “Shaoqing” in southern China, “Shaolan” in northern China, and “shippō-yaki” in Japan.
The processing methods of jewelry enamel are divided into three types: painted enamel, champlevé enamel, and cloisonné enamel.
(1) Painted Enamel
The enamel painting craft originated in Western Europe and France and was brought to Guangdong by European merchants and missionaries during the Kangxi period of the Qing Dynasty. The art of painted enamel was first manufactured in Guangdong, where it is commonly referred to as “Shaoqing,” “Guang enamel,” or “Foreign enamel.” The emperor and ministers quickly appreciated and valued this exceptionally exquisite craft upon its arrival in China. During the Qing Dynasty, Emperors Kangxi, Yongzheng, and Qianlong established enamel workshops in both the Beijing Imperial Palace and Guangdong, and they frequently selected outstanding enamel painters from Guangdong to serve in the capital, producing large quantities of enamelware and enamel jewelry for royal use.
Painted enamel is the most difficult of the three main types of enamel techniques. The biggest advantage of painting directly on metal is that the patterns and lines can be richer, allowing for more detailed and complex designs that are unrestrained. However, omitting the step of using metal wire to outline will greatly increase the difficulty of firing the enamel. First, there is the issue of color mixing between different colors; without metal wire to separate the different colors, if the enamel materials are not mixed properly, it can lead to a chaotic situation of color bleeding.
Making painted enamel involves applying several layers of white glaze, or porcelain white, onto a metal base. Porcelain white is a white solid that must be ground into powder and mixed with appropriate water. A small brush can be applied evenly on the metal base. The firing temperature for porcelain is generally between 720~820℃. After sintering, a white base plate is obtained, and various colors of enamel are painted on this base plate, intricately depicting patterns like in oil painting. The biggest issue is color mixing; if the colors are mixed too much, the patterns will become blurred after sintering, ruining the artwork. Therefore, after depicting a section, it must be sintered first. The next section can be painted, followed by another sintering, which must be repeated until the work is completed. Sometimes, it requires dozens of repetitions of sintering, and if it gets damaged at any point, the entire piece will be ruined, making the craft of painted enamel highly valuable.

(2) Cloisonné Enamel
The cloisonné enamel technique is relatively complex, yet it is the most familiar and proudest enamel craft for the Chinese, with the famous “Jingtai Blue” being a type of cloisonné enamel. Its characteristic is that metal wires are first used on a metal base to outline the pattern, fixed with a natural adhesive, and then welded onto the metal base. Different colors of enamel glaze are then filled into the outlined contours made from finely ground minerals and metal oxides. The metal pieces are placed in a special furnace at a temperature of 800℃ for firing, causing the glaze to change color due to the high temperature. Since different metal oxides require different temperatures to change color, the enamel pieces may undergo multiple firings. Finally, the metal wires are smoothed, and a colorless transparent protective agent is applied for protection.

(3) Champlevé Enamel
The technique is similar to cloisonné enamel. The surface patterns of metal ornaments are formed using techniques such as engraving, stamping, or etching. First, patterns are carved on the metal base, leaving grooves within the carved outlines. To create vivid patterns with lines of varying thickness, the enamel painter grinds the enamel paint into a powder, mixes it with a small amount of water, and then fills the grooves with enamel, brushing a thin layer of painted patterns. Once completed, it is left to air dry and then placed in a high-temperature kiln above for firing, with each layer of paint needing to be fired for 40~60 seconds in the high-temperature kiln of 800℃. After multiple repetitions of filling with enamel and firing and polishing, a smooth and lustrous work is ultimately formed.

Section VII Resin Casting Process
The resin casting process is widely used in popular jewelry. According to the nature of the resin, it is divided into two main categories: soft resin and hard resin. Soft resin has a lower hardness and is not suitable for grinding and polishing but can be used for surface coating of craft jewelry; hard resin has a high hardness and can be processed by grinding and polishing to achieve a smooth and shiny effect.
Generally, epoxy resin crystal drop glue is used, which is composed of high-purity epoxy resin, curing agents, and other substances. Its cured product has the characteristics of being water-resistant, chemically resistant, and crystal clear. In addition to providing good protection for the surface of craft ornaments, this crystal drop glue can also enhance the surface gloss and brightness. Adding various pigments to the glue can form a rich color series, further enhancing the surface decorative effect, making it suitable for surface decoration and protection of crafts made from materials such as metal, ceramics, glass, and acrylic.
Epoxy resin has a surface effect similar to enamel and is often used as a faux enamel product, sometimes referred to as “soft enamel.” However, there are significant differences between the two. Enamel is made from enamel pigments fired at high temperatures; it is very hard and stable, has good durability, and does not age or deteriorate, but is prone to metal oxidation and softening, making it unsuitable to use for ornaments inlaid with gemstones; resin belongs to the category of organic compounds made from plastic. Products of this type of plastic resin do not need to be sintered in a high-temperature furnace to achieve color. It is sufficient to apply liquid color resin on the metal and let it air dry naturally or dry it in a baking box, making the production simple and not harmful to the metal, suitable for the final treatment of inlaid gemstone jewelry. However, due to the material properties of the resin, it is not durable, not heat-resistant, and is prone to corrosion and wear. After a certain period, it is likely to show aging, fading, and loss of luster. It is of lower grade and does not retain value. The basic process of resin is as follows.
- First, prepare the necessary tools and equipment, such as weighing instruments, glue adjusting tools, workpiece carriers, drying equipment, and the workpieces for the dripping glue operation.
- Place or adjust the balance scale (electronic scale), oven, workpiece carrier, and workbench level.
- Weigh A glue using a dry and clean wide-mouth flat container while proportionally weighing B glue (generally at a weight ratio of 3:1)
- Use a round glass rod (or round wooden stick) to stir the AB mixture to the left, right, or in a clockwise or counterclockwise direction. At the same time, the container (vessel) is preferably tilted at an angle of 45° and continuously rotated, stirring for about 1~2 minutes.
- Pour the mixed AB glue into a soft plastic bottle with a pointed nozzle for dripping, and drop the glue onto the desired accessory position.
- When the area of the resin drop is slightly larger, or the amount of resin is relatively more, to accelerate the elimination of bubbles in the glue, a gas torch fueled by liquefied gas can be used to promote defoaming. During defoaming, the torch’s flame should be adjusted to a complete combustion state, and the flame should ideally be kept about 25 cm away from the surface of the workpiece. The movement speed of the torch should not be too fast or too slow; a moderate speed should be maintained.
- After the bubbles are eliminated, the workpiece can be placed horizontally in the oven for heating and curing. The temperature should first be adjusted to 40℃ around 30 minutes and then raised to 60~70℃ until the glue is fully cured.

Section VIII Etching Technology
Etching is the process of removing unwanted metal to a certain depth using chemical methods. Its principle is similar to the production of circuit boards, where the metal parts to be retained are covered with an acid-resistant coating, and then an acidic solution is used to etch away the unwanted metal parts; the processing of negative patterns is exactly the opposite of that of positive patterns.
The etching process is suitable for the processing and producing antique-style crafts and jewelry with special surface style requirements. In recent years, the export volume of metal paintings, crafts, and hollow art pieces processed by etching methods in our country has greatly increased, becoming a new branch of craft jewelry.
Etching processes can be divided into chemical etching, electrolytic etching, laser etching, and ultrasonic etching.
1. Chemical Etching Process
Cover the areas that need not be etched with a corrosion-resistant coating, then immerse the workpiece in a special etching solution. The formula for the solution is shown in the table 11-2. Ensure that the areas to be etched are in full contact with the solution, and if necessary, heating and stirring can be applied. Control the etching time based on the required etching depth and the etching rate obtained from experiments to achieve the desired etching result.
Table 11-2 Partial Metal Etching Solution Formulas
| Ingredients and process conditions | Etching stainless steel | Etching copper alloy | Etching aluminum |
|---|---|---|---|
| Ferric chloride | 600 ~ 800 | 600 ~ 650 | 450 ~ 550 |
| Hydrochloric acid/(g・L -1) | 80 ~ 120 | ||
| Phosphoric acid/(g・L -1) | 20 ~ 30 | ||
| Copper sulfate/(g・L -1) | 200 ~ 300 | ||
| Sulfuric acid/(g・L -1) | 90 ~ 100 | 10 ~ 20 | |
| Nitric acid/(g・L -1) | 8 ~ 12 | ||
| Etching accelerator/(g・L -1) | 80 ~ 100 | ||
| Temperatura/℃ | 10 ~ 45 | 15 ~ 50 | 20 ~ 40 |
| Time/min | 15 ~ 20 | 10 ~ 15 | 10 ~ 20 |
2. Electrolytic Etching
Section IX Nano ~ Spraying Plating Technology

1. The Principle of Nano ~ Spraying and Plating
2. Characteristics of Nano ~ Spraying Plating
(1) Green and environmentally friendly. No three waste emissions, non ~ toxic and harmless, no harmful heavy metals.
(2) Low investment and low cost. Compared to electroplating, the equipment investment is small, and there is no need to equip a wastewater treatment system.
(3) The operation is both safe and simple, with high efficiency. There will be no harm if the operator accidentally sprays it on their hands or other body parts. There is no need for water electroplating treatment and complex preliminary conductive layer treatment.
(4) It can be positioned for spray plating and can spray plate in different colors on the same product. Various colors at will.
(5) The processed parts are not limited by size and shape, are not restricted by various materials, can be recycled, and save resources.
(6) The application range of color diversity is extensive. The sprayed products can be coated with gold, silver, chrome, nickel, or sand ~ colored mirror effects. They can also be coated with various other colors, such as golden yellow, brass color, antique gold yellow, cannon copper color (red, yellow, purple, green, blue), and other high ~ gloss effects. It can be sprayed on various materials such as metal, resin, plastic, glass, ceramics, acrylic, and wood, and can be widely used in various surface decoration industries such as crafts and jewelry.
(7) Products made with nano ~ spraying have excellent adhesion, impact resistance, corrosion resistance, weather resistance, wear resistance, scratch resistance, and good rust prevention capabilities.