Dlaczego kamienie szlachetne mają wiele kolorów?
Wprowadzenie do teorii pola krystalicznego i teorii orbitali molekularnych oraz teorii pasm energetycznych
Kolory kamieni szlachetnych są bogate i zróżnicowane, posiadając unikalny urok, który ludzie zawsze kochali. Jakość kamieni szlachetnych w dużej mierze zależy od ich koloru. Kolor kamienia szlachetnego jest ważnym wskaźnikiem w ocenie kamieni szlachetnych, a większość zabiegów optymalizacyjnych dla kamieni szlachetnych obejmuje zmianę lub poprawę ich koloru. Dlatego też zrozumienie przyczyn zabarwienia kamieni szlachetnych jest kluczowym warunkiem wstępnym dla ich optymalizacji. Tylko poprzez opanowanie tego, w jaki sposób kamienie szlachetne uzyskują swój kolor, można określić, czy kamień szlachetny można zoptymalizować, jaki schemat optymalizacji przyjąć i jaki plan eksperymentalny ustalić. Istnieje pięć powszechnych teorii zabarwienia kamieni szlachetnych: klasyczna teoria mineralogii, teoria pola krystalicznego, teoria orbitali molekularnych, teoria pasm energetycznych i fizyczne efekty optyczne. Teorie te stanowią teorie zabarwienia powszechnych naturalnych kamieni szlachetnych, a poniżej znajduje się krótkie wprowadzenie do tych pięciu teorii zabarwienia.
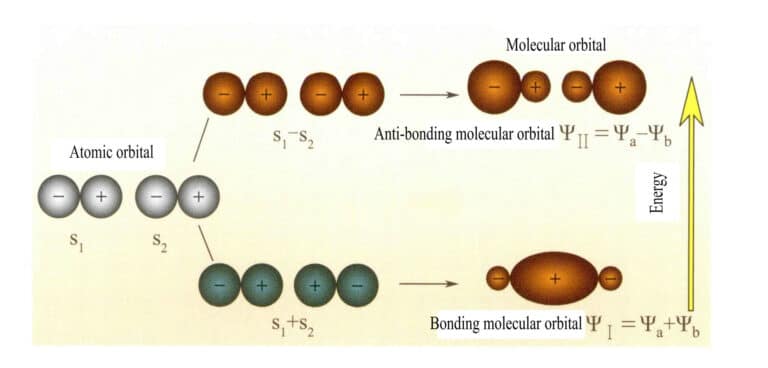
Orbitale molekularne utworzone przez dwa orbitale atomowe s
Spis treści
Sekcja I Teoria pola krystalicznego
XX wieku zaproponowali teorię pola krystalicznego, aby wyjaśnić właściwości kryształów. Teoria pola krystalicznego to teoria badająca wiązania chemiczne pierwiastków przejściowych (kompleksów). Wyjaśnia ona właściwości fizyczne i chemiczne pierwiastków przejściowych i lantanowców, łącząc niektóre punkty widzenia teorii elektrostatycznej, mechaniki kwantowej i teorii grup (teorii badającej symetrię materii), koncentrując się na wpływie ligandów na orbitale d i f jonów centralnych. W latach 50. XX wieku zastosowano teorię pola krystalicznego do kompleksów i zaproponowano teorię pola ligandów. Teoria pola ligandów jest rozwinięciem teorii pola krystalicznego; uwzględnia ona zarówno wpływ pola elektrycznego liganda na jon centralny, jak i efekt wypełnienia jonu centralnego przez elektrony liganda, co czyni ją bardziej kompletną niż teoria pola krystalicznego. Nie ma jednak zasadniczej różnicy między nimi i generalnie nie są one rozróżniane w badaniach minerałów nieorganicznych.
1. Podstawowe pojęcia teorii pola krystalicznego
Jony metali przejściowych znajdują się w polu krystalicznym otaczających je anionów lub cząsteczek dipolowych. Teoria pola krystalicznego to model elektrostatyczny, który postrzega kryształ jako oddziaływanie elektrostatyczne między jonami dodatnimi i ujemnymi, gdzie dodatnio naładowany kation nazywany jest jonem centralnym, a ujemnie naładowany anion nazywany jest ligandem.
Zastosowanie teorii pola krystalicznego do wyjaśnienia koloru minerałów kamieni szlachetnych obejmuje głównie elektrony d lub energię elektronów f jonów pierwiastków przejściowych. Na przykład, orbitale d mają pięć typów: dxy, dxz, dyz, d i d . Te pięć orbitali d ma różne rozkłady przestrzenne w stanie swobodnym jonu, ale mają taką samą energię. Ulegają one jednak znaczącym zmianom pod wpływem pola ligandu. Pięć zdegenerowanych energetycznie orbitali d centralnego atomu rozszczepia się pod wpływem ujemnego pola elektrycznego tworzonego przez otaczające ligandy. Niektóre orbitale d mają zwiększoną energię, podczas gdy inne mają zmniejszoną energię. Ze względu na rozszczepienie poziomów energetycznych orbitali d, elektrony na orbitalach d atomu centralnego zostaną przestawione, preferencyjnie zajmując orbitale o niższej energii, zmniejszając w ten sposób całkowitą energię układu i czyniąc kompleks bardziej stabilnym.
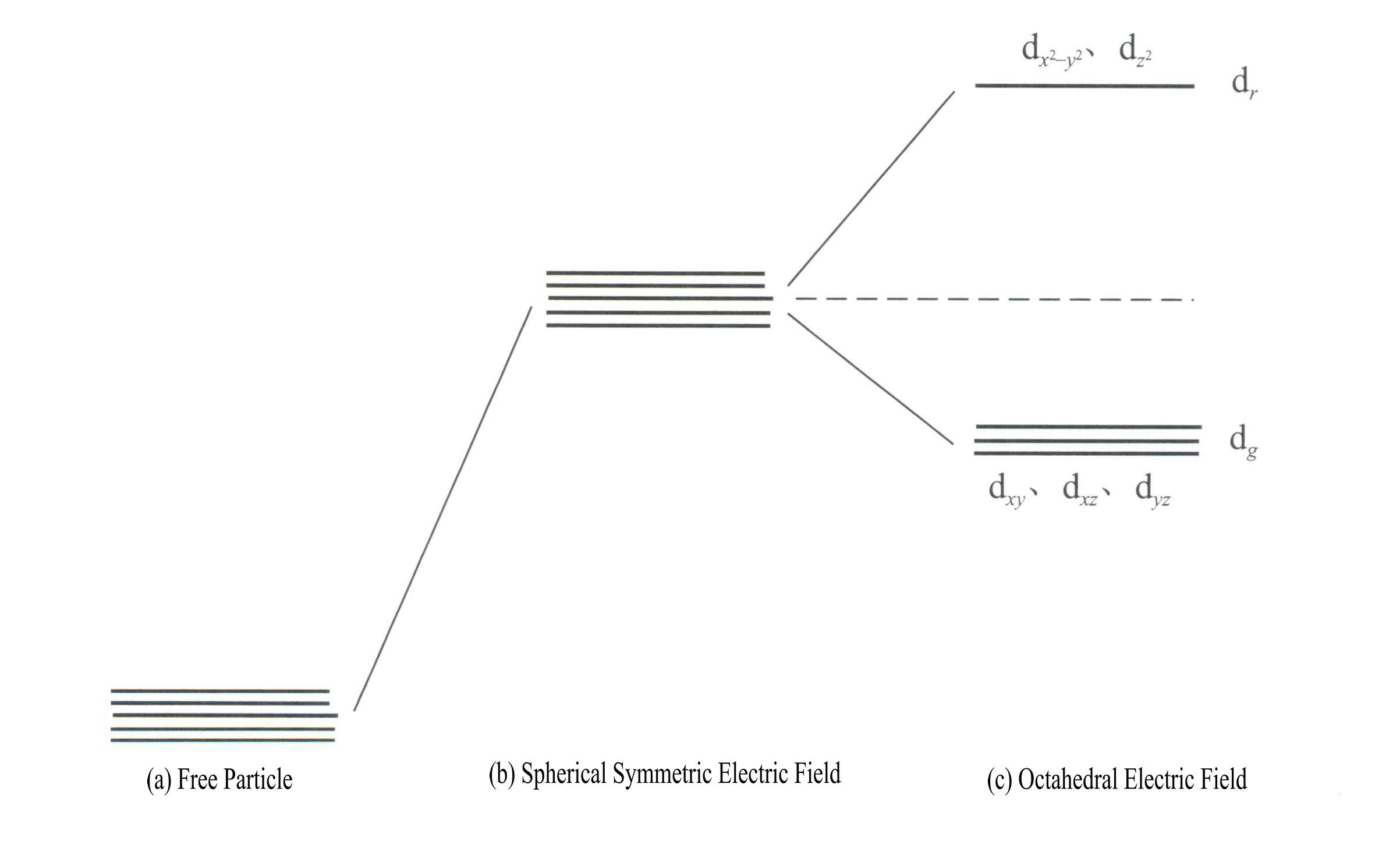
Energia orbitali d jest taka sama, gdy nie ma pola elektrycznego [Rysunek 3-19 (a)]; w sferycznie symetrycznym polu elektrostatycznym orbitale d mają zwiększoną energię, ale nie rozszczepiają się [Rysunek 3-19 (b)]; gdy pole liganda jest oktaedryczne, rozszczepia się na dr i dg. Spośród nich, dr składają się z orbitali d i d o wyższej energii; orbitale o niższej energii dg składają się z orbitali dxy, dxz, dyz.
Jony metali przejściowych znajdują się w polu krystalicznym otaczających je anionów lub cząsteczek dipolowych. Teoria pola krystalicznego to model elektrostatyczny, który postrzega kryształ jako oddziaływanie elektrostatyczne między jonami dodatnimi i ujemnymi, gdzie dodatnio naładowany kation nazywany jest jonem centralnym, a ujemnie naładowany anion nazywany jest ligandem.
Zastosowanie teorii pola krystalicznego do wyjaśnienia koloru minerałów kamieni szlachetnych obejmuje głównie elektrony d lub energię elektronów f jonów pierwiastków przejściowych. Na przykład, orbitale d mają pięć typów: dxy, dxz, dyz, d i d . Te pięć orbitali d ma różne rozkłady przestrzenne w stanie swobodnym jonu, ale mają taką samą energię. Ulegają one jednak znaczącym zmianom pod wpływem pola ligandu. Pięć zdegenerowanych energetycznie orbitali d centralnego atomu rozszczepia się pod wpływem ujemnego pola elektrycznego tworzonego przez otaczające ligandy. Niektóre orbitale d mają zwiększoną energię, podczas gdy inne mają zmniejszoną energię. Ze względu na rozszczepienie poziomów energetycznych orbitali d, elektrony na orbitalach d atomu centralnego zostaną przestawione, preferencyjnie zajmując orbitale o niższej energii, zmniejszając w ten sposób całkowitą energię układu i czyniąc kompleks bardziej stabilnym.
Energia orbitali d jest taka sama, gdy nie ma pola elektrycznego [Rysunek 3-19 (a)]; w sferycznie symetrycznym polu elektrostatycznym orbitale d mają zwiększoną energię, ale nie rozszczepiają się [Rysunek 3-19 (b)]; gdy pole liganda jest oktaedryczne, rozszczepia się na dr i dg. Spośród nich, dr składają się z orbitali dx2– y2 i dz2
o wyższej energii; dg składają się z orbitali dxy, dxz, dyz. [Rysunek 3-19 (c)]
Różnica pomiędzy najwyższym i najniższym poziomem energetycznym po rozszczepieniu orbitali d nazywana jest energią separacji △ . Energie separacji wytwarzane przez różne konfiguracje pól ligandów nie są takie same (Rysunek 3-20). Ich kolejność energetyczna jest następująca:
Pole czworościenne > Pole ośmiościenne > Pole czworościenne

Nawet w przypadku pól o tej samej konfiguracji mogą się one różnić ze względu na różnice w ligandach i jonach centralnych; im jest ona większa, tym bardziej stabilny jest kryształ. Następujące trzy czynniki określają głównie wielkość energii separacji kryształu:
(1) Kryształy utworzone przez ten sam pierwiastek przejściowy; gdy ligandy są takie same, im wyższy ładunek jonu centralnego, tym większa energia separacji △ . Im wyższy ładunek dodatni jonu centralnego, tym większe przyciąganie do ligandów, co skutkuje mniejszą odległością między jonem centralnym a jądrem liganda, a im większa siła odpychająca pola krystalicznego generowana przez ligandy na elektronach, tym większa energia separacji △ .
(2) W przypadku kryształów utworzonych przez różne jony o tym samym ładunku dodatnim i tych samych ligandach, im większy promień jonu centralnego, tym dalej orbitale d znajdują się od jądra i tym większa jest energia separacji △ .
(3) W przypadku kryształów utworzonych przez ten sam jon centralny i różne ligandy, energia separacji różni się ze względu na różne natężenia pola krystalicznego liganda. Różne ligandy mają różne natężenia pola, a energia separacji △ zmienia się wraz z natężeniem pola liganda.
Energia separacji jest wykorzystywana do jakościowego wyjaśnienia stabilności kryształów; nie jest konieczne uzyskanie wartości bezwzględnej △ , ponieważ wystarczająca jest znajomość względnych wartości kryształu w różnych warunkach.
Na podstawie względnej energii rozszczepionych orbitali d można obliczyć całkowitą energię jonów metali przejściowych w orbitalach d. Energia ta jest niższa niż przed rozszczepieniem, zapewniając w ten sposób dodatkową energię dla kryształu, znaną jako energia stabilizacji pola krystalicznego, reprezentowana przez symbol CFSE. Tabela 3-10 zawiera listę energii stabilizacji jonów zawierających orbitale dn elektronów w różnych warunkach.
Tabela 3-10 Energie stabilizacji pola krystalicznego dla różnych ligandów (Wu Ruihua, 1994)
| dn | Słabe pole | Strong Field | ||||
|---|---|---|---|---|---|---|
| dn | Kwadrat | Ośmiościan foremny | Czworościan foremny | Kwadrat | Ośmiościan foremny | Czworościan foremny |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Charakterystyka kolorystyczna jonów metali przejściowych
W jego kolorowych kamieniach szlachetnych kolor większości kamieni szlachetnych wynika z jonów metali przejściowych, a kolor kamieni szlachetnych jest związany z tym, czy jony barwiące zawierają niesparowane elektrony na orbitalach d lub f. Charakterystyka barwy jonów metali przejściowych obejmuje głównie następujące aspekty:
(1) Zabarwienie jonów metali przejściowych jest związane ze stanami elektronowymi orbitali d lub f. Gdy elektrony orbitali d lub f są zapełnione lub puste, kamień szlachetny nie będzie wykazywał koloru. Na przykład Cr6+, Ce4+i Cu+.
(2) Różne jony barwiące wykazują różne kolory w tym samym materiale kamienia szlachetnego. Ze względu na różne energie separacji różnych jonów barwiących, mogą one prezentować różne kolory nawet w tym samym materiale. Na przykład Fe2+ daje lekko szaroniebieski kolor spinelu, podczas gdy Cr3+ wytwarza kolor czerwony.
(3) Jony barwiące tego samego pierwiastka w różnych stanach walencyjnych często wykazują różne kolory w tym samym materiale kamienia szlachetnego. Ponieważ energia wymagana do przejść d-elektronowych jonu centralnego jest różna, absorbowane długości fal światła są różne, co skutkuje różnymi kolorami. Na przykład kastrum zawierające Mn2+ ma delikatny różowy odcień, podczas gdy beryl zawierający Mn2+ prezentuje jasną czerwień, znaną jako czerwony beryl.
(4) Jony barwiące tego samego pierwiastka w tym samym stanie walencyjnym często wykazują różne kolory w różnych konfiguracjach ligandów. Na przykład Co2+ w konfiguracji tetraedrycznej spinelu wykazuje charakterystyczny "diamentowo-niebieski" kolor, podczas gdy w konfiguracji oktaedrycznej kalcytu wydaje się różowy. Fe2+ w oktaedrycznie skoordynowanym oliwinie wykazuje charakterystyczną oliwkowozieloną barwę, podczas gdy w zniekształconym sześciennie skoordynowanym almandynie pojawia się głęboka czerwień.
(5) Ten sam typ kolorowych jonów ma ten sam stan walencyjny i geometrię koordynacyjną, ale różne sąsiednie atomy koordynujące wykazują różne kolory. Na przykład w tetraedrycznej koordynacji Co2+w sfalerycie, Co2+ jest połączony z siarką, pokazując kolor zielony, podczas gdy w spinelu, Co2+ jest podłączony do tlenu, pokazując kolor niebieski.
(6) Ten sam typ kolorowych jonów o tym samym stanie walencyjnym, geometrii koordynacyjnej i sąsiednich atomach wykazuje różne kolory w różnych kamieniach szlachetnych. Zniekształcenie geometrii koordynacyjnej spowodowane różnymi składami chemicznymi kamieni szlachetnych zmienia charakter wiązań chemicznych między jonem centralnym a koordynującymi ligandami, zmieniając energię przejścia elektronów d. Na przykład Cr3+ pojawia się czerwony w rubinie, zielony w szmaragdzie i wykazuje zmienne kolory w aleksandrycie. Przyczyną takich zmian w Cr3+ jest związany z jego charakterystyką i sąsiednimi ligandami koordynującymi, z konkretną analizą cech w następujący sposób.
① Cr3+ Charakterystyka:
Cr3+ ma zewnętrzną strukturę powłoki elektronowej 3s23p63d3z 11 elektronami w zewnętrznej powłoce, należący do nieregularnej (8-18) struktury powłoki elektronowej.
Struktura ta ma mniejszy efekt ekranowania jądra niż struktura powłoki 8-elektronowej, w wyniku czego Cr3+ o wyższym efektywnym ładunku dodatnim, podczas gdy jego promień jonowy jest również mniejszy, co stanowi podstawową charakterystykę Cr3+silne dodatnie pole elektryczne i puste orbitale d. Cr3+ może zapewnić sześć pustych orbitali, aby pomieścić sześć koordynujących ligandów, z konfiguracją przestrzenną oktaedryczną, należącą do d2sp3 hybrydyzacji (Rysunek 3-21).
Zgodnie z teorią pola krystalicznego, w polu oktaedrycznym orbitale d Cr3+ może rozdzielić się na niższą energię dƐ orbita i wyższa energia dr orbita. Ponieważ trzy elektrony d Cr3+ znajdują się w dƐ i wszystkie są pojedynczymi elektronami, przejścia d-d mogą wystąpić w świetle widzialnym, powodując, że klejnoty zawierające Cr3+ aby pokazać kolor.
② Mechanizm barwienia Cr3+:
W rubinie Głównym składnikiem chemicznym rubinu jest Al2O3. Gdy kilka procent Cr3+ zastępuje Al3+daje jasnoczerwony kolor. W strukturze rubinu, ze względu na większy promień Cr3+ w porównaniu do promienia Al3+, Cr3+ wchodzi do sieci korundu, zmniejszając symetrię wokół tlenku glinu.
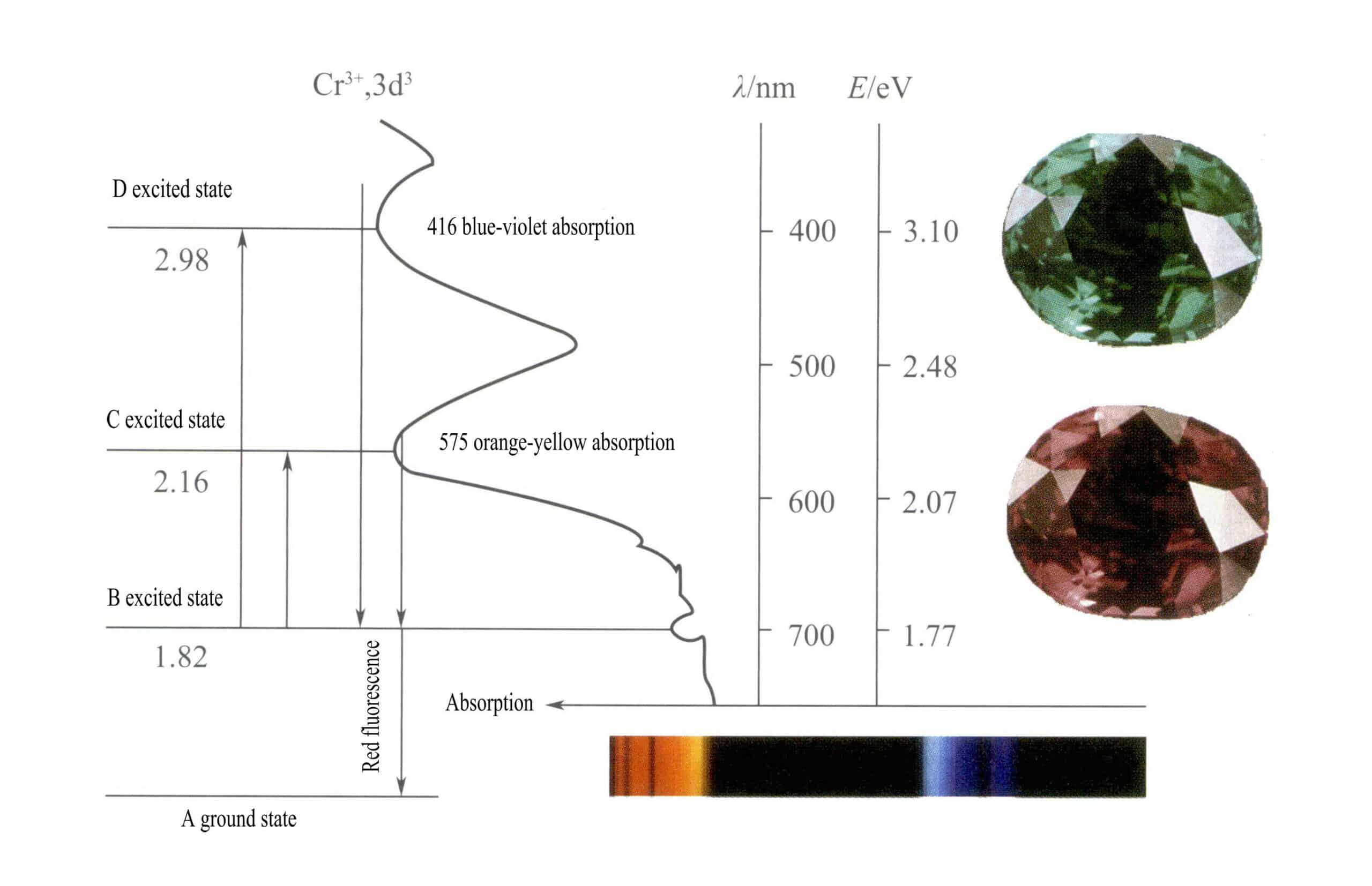
Orbitale d Cr3+ Gdy elektrony w stanie wzbudzonym powracają z D lub C do stanu podstawowego A, muszą najpierw przejść przez B, uwalniając ciepło. Wracają z B do A, czemu towarzyszy luminescencja, emitując czerwoną fluorescencję. W tym procesie elektrony absorbują energię świetlną, powodując, że rubin absorbuje fiolet D (400nm) i żółto-zielony C (555nm) widma widzialnego (Rysunek 3-22), tworząc pasmo absorpcji.

Kiedy białe światło przechodzi przez rubin, fotony w spektrum od fioletowego do żółto-zielonego są pochłaniane, podczas gdy prawie całe czerwone światło i trochę niebieskiego światła przechodzi, nadając rubinowi głęboki czerwony kolor z nutą fioletu, znany jako gołębia czerwień.
Rubiny wykazują krótkotrwałą absorpcję na poziomie B, objawiającą się czerwoną fluorescencją. Ta absorpcja na poziomie B, która powoduje czerwoną fluorescencję, sprawia, że kolor rubinu jest bardziej żywy; im wyższa zawartość jonów chromu, tym silniejsza fluorescencja.
Jony żelaza w kamieniu szlachetnym mogą tłumić fluorescencję absorpcji na poziomie B, wyjaśniając zjawisko, w którym rubiny wydają się ciemniejsze, gdy zawierają zanieczyszczenia żelazem.
③ Cr3+ Mechanizm barwienia szmaragdów
Głównym składnikiem chemicznym szmaragdu jest Be3Al2Si6O18, Cr3+który zastępuje Al3+ w szmaragdowej siatce i Cr3+ jest również otoczony przez oktaedr składający się z sześciu jonów tlenu, gdzie Cr3+-O jest również dość podobna do tej w rubinach. Jednak w porównaniu do rubinów, szmaragdy mają dwa jony więcej, Be2+ i Si4+. W strukturze szmaragdów wzrasta charakter wiązań kowalencyjnych między tlenkami metali, podczas gdy właściwości jonowe słabną.
Drobne zmiany, takie jak wiązania chemiczne, prowadzą do niewielkiego spadku Cr3+C i D, powodując nieznaczne przesunięcie pasma absorpcji (Rysunek 3-23), znacząco blokując transmisję światła niebiesko-fioletowego (425nm) i pomarańczowo-żółtego (608nm) w widmie, jednocześnie zwiększając transmisję światła niebiesko-zielonego, tworząc w ten sposób charakterystyczną szmaragdową zieleń.

Absorpcja dioptazy na poziomie B jest prawie niezmieniona. Gdy zanieczyszczenie żelazem nie ma efektu "hamującego" w szmaragdowym składniku, silna czerwona fluorescencja sprawia, że charakterystyczna szmaragdowa zieleń świeci jeszcze jaśniej.
④ Cr3+ Mechanizm koloru w aleksandrycie:
Kolor aleksandrytu jest również spowodowany przez Cr3+ zastępując Al3+ w zniekształconej koordynacji oktaedrycznej. Ze względu na skład chemiczny aleksandrytu, którym jest BeAL2O4Charakter wiązań chemicznych między jonami metalu i tlenu znajduje się między rubinem a szmaragdem. Dlatego jego pasma absorpcji również leżą pomiędzy pasmami rubinu i szmaragdu, a prawdopodobieństwo transmisji światła niebiesko-fioletowego i pomarańczowo-żółtego jest w przybliżeniu równe, co uniemożliwia określenie, czy dominuje światło czerwone czy niebiesko-zielone (rysunek 3-24).
Dlatego kolor aleksandrytu może zależeć tylko od rozkładu energii i zakresu kolorów padającego światła, co skutkuje "efektem zmiany koloru" aleksandrytu, tj. pojawiającym się zielonym w świetle dziennym z wysokim niebieskim składnikiem światła i czerwonym w świetle żarowym z wysokim czerwonym składnikiem światła. Dlatego aleksandryt jest często nazywany "szmaragdem dnia i rubinem nocy".
"Efekt zmiany koloru" pojawia się w wielu rodzajach kamieni szlachetnych, takich jak zmieniający kolor korund i zmieniający kolor granat. Obecnie sztucznie syntetyzowany korund zmieniający kolor jest produkowany przy użyciu zasady zmiany koloru, wykorzystując V3+ jako jon barwiący do syntezy.
3. Kolory kamieni szlachetnych
Kolory wytwarzane przez składniki metali przejściowych można wywnioskować ze składu chemicznego minerałów kamieni szlachetnych. Na przykład turkus zawierający Cu2+ musi być niebieska, podczas gdy Cu+ jest bezbarwny. Tabela 3-11 zawiera listę kolorów wytwarzanych przez typowe składniki metali przejściowych w naturalnych minerałach kamieni szlachetnych.
Tabela 3-11 Kolory wytwarzane przez składniki metali przejściowych w naturalnych kamieniach szlachetnych
| Element | Kolor | Minerały pospolite |
|---|---|---|
| Cer (Ce) | Żółty | Parisite |
| Chrom (Cr) | Czerwony, zielony, pomarańczowy itd. | Crocoisite, Czerwony Crocoisite, Uvarovite |
| Kobalt (Co) | Niebieski | Syntetyczny spinel |
| Miedź (Cu) | Niebieski, Zielony | Azuryt, chryzokola, turkus, malachit, dioptaza |
| Żelazo (Fe) | Czerwony, zielony, żółty | Almandyn, oliwin, goethyt |
| Mangan (Mn) | Różowy, pomarańczowy | Rodonit, spessartyn |
| Nikiel (Ni) | Zielony | Bunsenit, chalcedon |
Kolor większości kamieni szlachetnych jest spowodowany zawartymi w nich zanieczyszczeniami metalami przejściowymi. Na przykład rubiny wydają się czerwone z powodu śladowych ilości Cr3+. Różne czynniki wpływają na kolor powodowany przez jony zanieczyszczeń w kamieniu szlachetnym. Dlatego zanieczyszczenia mogą powodować różne kolory w różnych kamieniach szlachetnych. Na przykład Cr3+ pojawia się czerwony w rubinach i zielony w szmaragdach.
Te same zanieczyszczenia niekoniecznie muszą powodować ten sam kolor kamienia szlachetnego. Na przykład zielony kolor większości szmaragdów jest spowodowany przez Cr, podczas gdy zielony kolor niektórych szmaragdów jest częściowo lub całkowicie spowodowany przez wanad (V).
Teorię pola krystalicznego można wykorzystać nie tylko do wyjaśnienia kolorów kamieni szlachetnych wytwarzanych przez składniki metali przejściowych lub zanieczyszczenia, ale także kolorów wytwarzanych przez defekty strukturalne (centra kolorów); specyficzny proces generowania kolorów można znaleźć w rozdziale 3.3 tej książki.
Istnieją również niedociągnięcia w wyjaśnianiu kolorów minerałów kamieni szlachetnych za pomocą teorii pola krystalicznego, głównie odzwierciedlone w następujących aspektach:
(1) Elektrony jonu centralnego d nie są całkowicie zlokalizowane na swoich pierwotnych orbitalach. Mogą również pojawić się wokół atomów koordynujących, wskazując na kowalencyjne oddziaływanie między atomem centralnym a ligandami.
(2) Uwzględnia tylko elektrostatyczne oddziaływanie jonowe między atomem centralnym a ligandami, całkowicie ignorując kowalencyjne oddziaływanie wiązania między atomem centralnym a ligandami. W badaniach fizycznych wyniki obliczeń ilościowych często znacznie różnią się od rzeczywistych sytuacji.
(3) Przyczyny koloru minerałów kamieni szlachetnych, oprócz interakcji między jonem centralnym a ligandami, mogą również wynikać z połączonych efektów defektów strukturalnych i pola krystalicznego.
Sekcja II Teoria orbitali molekularnych
Mulliken i Hund początkowo zaproponowali teorię orbitali molekularnych (teorię MO). Dzięki ciągłym badaniom wielu naukowców rozwinęła się ona w dojrzałą teorię. Orbitale molekularne (MO) można uzyskać poprzez liniowe kombinacje orbitali atomowych, co jest powszechnie stosowaną metodą konstruowania orbitali molekularnych. Z n orbitali atomowych można uzyskać n orbitali molekularnych, a współczynniki kombinacji liniowej można określić za pomocą metody wariacyjnej lub innych metod. Orbitale molekularne utworzone przez dwa orbitale atomowe, o poziomach energii niższych niż orbitale atomowe, nazywane są orbitaliami wiążącymi; te o poziomach energii wyższych niż orbitale atomowe nazywane są orbitaliami anty-wiążącymi; te o poziomach energii zbliżonych do orbitali atomowych są na ogół orbitaliami niezwiązanymi.
Teoria orbitali molekularnych jest teorią wykorzystywaną do wyjaśniania zagadnień takich jak formacja molekularna, struktura i właściwości. Może również wyjaśnić niektóre przyczyny kolorów kamieni szlachetnych, które zostały opracowane w oparciu o teorię pola krystalicznego i teorię orbitali molekularnych metali przejściowych. Orbitale molekularne są naturalnym rozszerzeniem orbitali atomowych. W cząsteczce elektrony nie należą już do konkretnego atomu, ale poruszają się w całym zakresie molekularnym; dlatego ruch elektronów w cząsteczce jest opisywany za pomocą orbitali molekularnych.
1. Podstawowe pojęcia teorii orbitali molekularnych
Teoria orbitali molekularnych zakłada, że po utworzeniu cząsteczki przez atomy, elektrony nie należą już do oryginalnych orbitali atomowych, zgodnie z teorią pola krystalicznego, ale poruszają się po określonych orbitalach molekularnych. Orbitale molekularne tworzą cząsteczkę tak samo, jak orbitale atomowe tworzą atom. Elektrony walencyjne nie są już uważane za zlokalizowane w poszczególnych atomach, ale poruszają się po całej cząsteczce. Rozmieszczenie elektronów w cząsteczce może być traktowane zgodnie z zasadami rozmieszczenia elektronów w atomach (zasada minimalnej energii i reguła Hunda).
Liniowa kombinacja orbitali atomowych w cząsteczce tworzy orbitale molekularne. Liczba orbitali molekularnych jest równa liczbie orbitali atomowych przed połączeniem. Połączenie orbitali atomowych w efektywne orbitale molekularne musi być zgodne z następującymi trzema zasadami:
(1) Zasada dopasowania symetrii: Tylko orbitale atomowe o tej samej symetrii mogą tworzyć orbitale molekularne.
(2) Zasada bliskości energii: Tylko orbitale atomowe o podobnych energiach mogą łączyć się w efektywne orbitale molekularne.
(3) Zasada maksymalnego nakładania się: W przypadku dopasowania symetrii, im większe nakładanie się orbitali atomowych, tym bardziej zmniejsza się energia powstałych orbitali molekularnych i tym bardziej stabilne jest powstałe wiązanie chemiczne.
Orbital molekularny ψ jest funkcją falową pojedynczego elektronu. Można go przedstawić jako liniową kombinację orbitali atomowych, przy czym każdy orbital odpowiada określonej energii, która jest sumą energii kinetycznej i potencjalnej elektronu poruszającego się w molekularnym polu elektrycznym. Dwa orbitale atomowe, a i b, poprzez nakładające się kombinacje liniowe, wytwarzają dwa orbitale molekularne ψI i ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Gdy orbitale molekularne z elektronami są zapełniane jako pierwsze, orbitale wiążące ψI są zapełniane jako pierwsze. Gdy elektrony zapełniają orbitale molekularne o równej energii, zgodnie z regułą Hunda, powinny one również zajmować różne orbitale molekularne o tym samym kierunku spinu w jak największym stopniu.
Orbitale molekularne ψI otrzymane przez dodanie dwóch funkcji orbitali atomowych (równanie 3-5) nazywane są wiążącymi orbitalami molekularnymi. Orbitale molekularne ψII otrzymane przez odjęcie dwóch funkcji orbitali atomowych (równanie 3-6) nazywane są orbitalami molekularnymi anty-wiążącymi. Energia orbitali molekularnych wiążących jest niższa niż energia orbitali molekularnych anty-wiążących i niższa niż energia oryginalnych dwóch orbitali atomowych. Tak więc, podobnie jak w przypadku zapełniania orbitali atomowych, podczas zapełniania orbitali molekularnych elektrony są najpierw umieszczane na orbitalach wiążących, a orbital molekularny może pomieścić dwa elektrony o przeciwnych spinach. Gdy elektrony wypełniają orbitale molekularne o równej energii, zgodnie z regułą Hunda, powinny one również zajmować różne orbitale molekularne o tym samym kierunku spinu w jak największym stopniu. Orbitale molekularne utworzone przez dwa orbitale atomowe s pokazano na rysunku 3-25.

Orbitale p i orbitale d mogą również tworzyć orbitale molekularne o różnych poziomach energetycznych; na przykład połączenie dwuatomowych orbitali molekularnych w O2 cząsteczek jest stosunkowo złożona.
W eksperymentach zmierzono właściwości magnetyczne tych dwóch pojedynczych elektronów, zapewniając silne wsparcie dla teorii orbitali molekularnych. W przeciwieństwie do cząsteczek złożonych z tych samych atomów, te złożone z dwóch lub więcej różnych atomów mają bardziej złożone poziomy energetyczne orbitali molekularnych, ale zasada jest taka sama.
2. Charakterystyka kolorystyczna transferu ładunku
Ta teoria orbitali molekularnych, w której cała cząsteczka dzieli elektrony, jest również uważana za przejście elektronów z jednego orbitalu atomowego na inny, znany jako przeniesienie ładunku. Przeniesienie ładunku może wystąpić w interakcjach metal-metal (M-M), niemetal-niemetal (L-L) i niemetal-metal (L-M). Wśród nich L-L, M-L te dwa typy wiązań są często przede wszystkim wiązaniami kowalencyjnymi. O2 należy do przeniesienia ładunku L-L, które jest wiązaniem kowalencyjnym.
(1) Transfer ładunku metal-metal (transfer ładunku M - M)
Ten rodzaj przeniesienia ładunku występuje zazwyczaj pomiędzy jonami metali przejściowych. Większość przyczyn zabarwienia kolorowych kamieni szlachetnych powstaje w wyniku przeniesienia ładunku metal-metal. Transfer ładunku M-M obejmuje głównie następujące typy: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Przeniesienie ładunku między metalami dzieli się na dwa rodzaje: przeniesienie ładunku między atomami jednojądrowymi i przeniesienie ładunku między atomami heterojądrowymi.
① Przeniesienie ładunku między atomami izoelektronowymi
Przeniesienie ładunku między atomami izoelektronowymi zachodzi między dwoma atomami tego samego pierwiastka metalu przejściowego na różnych stopniach utlenienia. Na przykład Fe2+ i Fe3+ ulegają przeniesieniu ładunku w różnych warunkach redoks, pochłaniając energię i wytwarzając kolor. Niebiesko-fioletowy kolor iolitu powstaje w wyniku przeniesienia ładunku jonów żelaza na różnych stopniach utlenienia. Fe3+ i Fe2+ znajdują się odpowiednio w pozycji tetraedrycznej i oktaedrycznej, z dwoma ligandami połączonymi krawędziami. Gdy światło widzialne świeci na iolit, jeden elektron d Fe2+ absorbuje światło o określonej energii i przechodzi w Fe3+pochłaniając żółte światło o długości fali 588 nm i wytwarzając niebiesko-fioletowy kolor. Akwamaryn, zielony turmalin i inne mogą również wykazywać kolor z powodu transferu ładunku między jonami żelaza.
② Przeniesienie ładunku między heteroatomami
Niebieskie szafiry są najczęściej przykładem koloru wytwarzanego przez transfer ładunku między dwoma rodzajami jonów metali przejściowych. Wielościany koordynacyjne jonów metali przejściowych są połączone krawędziami lub ścianami, co ułatwia przenoszenie ładunków między metalami.
Na przykład w szafirach, gdy jony żelaza i tytanu wchodzą do połączonych oktaedrów, zarówno Fe, jak i Ti występują na dwóch stopniach utlenienia:
Fe2+ + Ti4+ niska energia (3-7)
Fe3+ + Ti3+ wysoka energia (3-8)
Przejście z równania (3-7) do równania (3-8) wymaga pochłonięcia pewnej ilości energii świetlnej, co skutkuje szerokim pasmem absorpcji, które waha się od żółtego do czerwonego. Z kolei większość niebieskiego światła przechodzi przez kamień szlachetny, nadając mu niebieski wygląd.
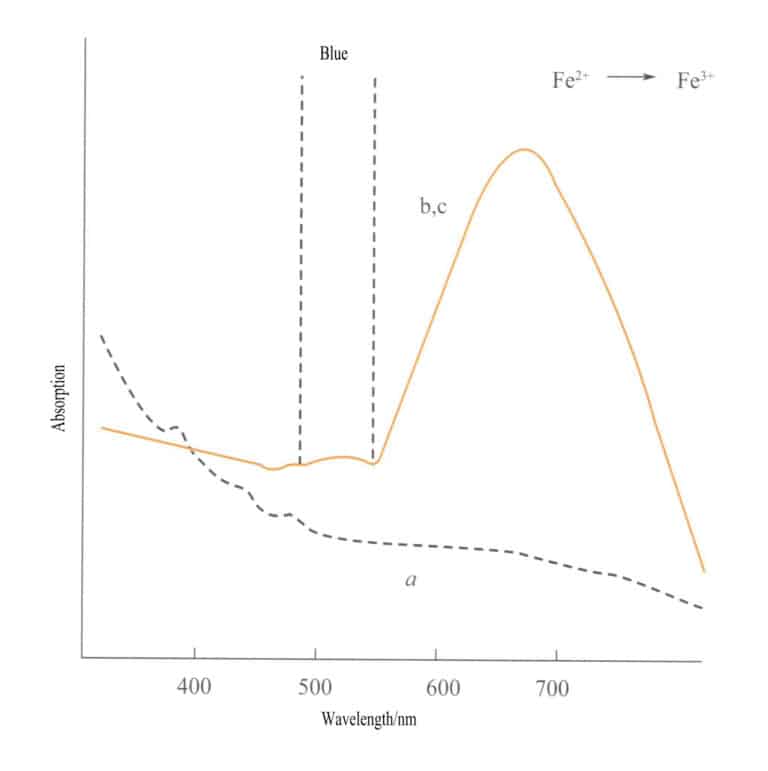
Transfer ładunku pomiędzy różnymi stanami walencyjnymi ma silną kierunkowość, a kamienie szlachetne, które wykazują kolor z powodu tego mechanizmu, często wykazują pleochroizm. Na przykład akwamaryn zabarwiony przez Fe2+→ Fe3+ Transfer ładunku pokazuje kolor ściśle wzdłuż kierunku osi optycznej. Rysunek 3-26 pokazuje, że akwamaryna wydaje się żółta w płaszczyznach b i c. Jednocześnie nie ma takiego transferu wzdłuż kierunku osi a, co powoduje brak absorpcji światła, a zatem brak koloru wzdłuż kierunku osi a.
(2) Przeniesienie ładunku z niemetalu na metal (L-M)
Ten typ przeniesienia ładunku L-M często występuje między jonami tlenu i metalu, a niektóre kamienie szlachetne zawierające tlen są zabarwione przez przeniesienie ładunku z niemetalu na metal, takie jak O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
W widmie absorpcyjnym prostych tlenków żelaza (Rysunek 3-27), dwa słabe pasma absorpcyjne pojawiają się w obszarze podczerwieni ilmenitu, hematytu i lepidokrokitu (przejścia elektronowe d - d). Silne pasmo absorpcji pojawia się w zakresie fal krótkich, wytwarzanych przez O2-→Fe3+ przeniesienie ładunku, a to pasmo absorpcji określa charakterystyczne kolory tych związków: czerwono-brązowy, brązowy i żółto-brązowy.
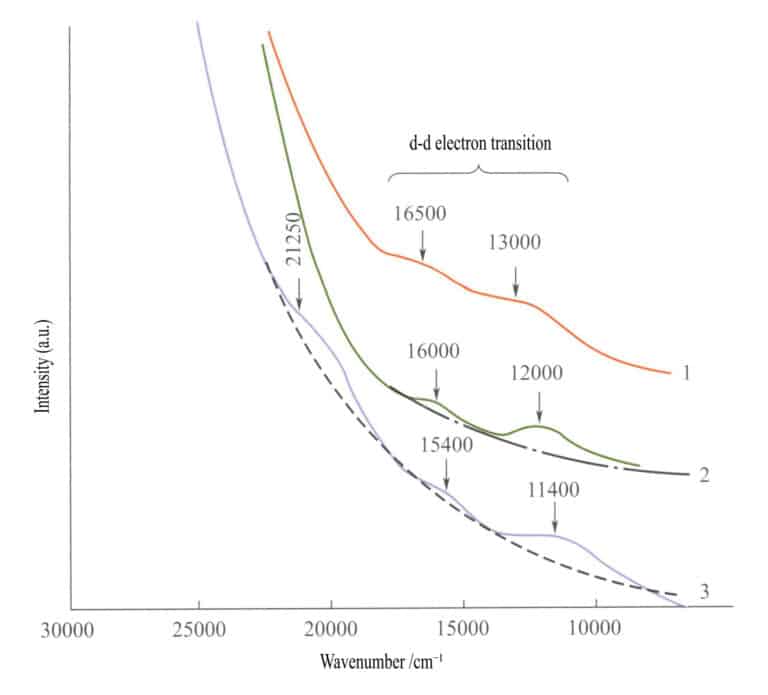
1 - iilmenit; 2 - hematyt; 3 - lepidokrokit
Żółty beryl czerpie swój kolor z O2–→ Fe3+ transfer ładunku. W strukturze żółtego berylu, O2–→ Fe3+ Silna absorpcja przeniesienia ładunku może rozciągać się od ultrafioletu do niebieskiego końca widma widzialnego, pochłaniając fiolet i niebieski, co skutkuje żółtym kolorem.
Szafir, który ma zupełnie inne środowisko koordynacyjne niż beryl, może również wytwarzać te same pasma absorpcji widmowej co beryl, co skutkuje żółtym kolorem, który jest również wynikiem O2–→ Fe3+ transfer ładunku.
Zgodnie z teorią pola krystalicznego, niektóre minerały kamieni szlachetnych nie zawierają niesparowanych elektronów i nie mogą wytwarzać koloru. Na przykład, warstwy elektronowe krokoitu (PbCrO4), Pb2+, Cr6+i O2– są pełne. Mimo to, w CrO42- są "orbitale molekularne", które odpowiadają stanom wzbudzonym podczas O2-→Cr6+ tworząc pasma absorpcyjne i prezentując kolor pomarańczowy.
L→M Transfer ładunku obejmuje również transfer siarki do metalu, jak w zwykłym pirycie; to zjawisko optyczne spowodowane transferem jest łatwiejsze do zrozumienia, gdy omawia się je przy użyciu teorii pasmowej.
(3) Przeniesienie ładunku z niemetalu na niemetal (L-L)
Teoria orbitali molekularnych sugeruje, że głęboki niebieski kolor lapis lazuli wynika z poziomów energii wzbudzenia S3- grupa atomowa.
W graficie pierścienie sześciu atomów węgla są ułożone warstwowo. Wzdłuż tej warstwy elektrony mogą poruszać się do pewnego stopnia swobodnie, co skutkuje silną absorpcją światła, anizotropią i przewodnictwem.
Niektóre organiczne kamienie szlachetne, takie jak bursztyn i perły, mają elektrony, które poruszają się i wzbudzają przez grupy atomowe pigmentów organicznych na wspólnych orbitalach molekularnych, powodując absorpcję światła widzialnego i wytwarzając kolor. Przykładem może być "miodowa żółć" bursztynu, kolory koralowców oraz niektórych muszli i kolorowych pereł.
Mechanizmy kolorów popularnych kamieni szlachetnych przedstawiono w tabeli 3-12.
Tabela 3-12 Klasyfikacja mechanizmów koloru popularnych kamieni szlachetnych
| Transfer ładunku metal-metal | Fe2+ - Fe3+ /Fe3+ - Fe2+ iolit (niebieski), bertieryt (niebieski), magnetyt (czarny) itp. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Kyanite (niebieski), Sapphire (niebieski) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganit (czarny), Bixbyite (czarny) | |
| Przenoszenie ładunku z metalu na metal | O2- -Fe3+: Złotożółty beryl, złotożółty szafir, ilmenit, hematyt, lepidokrokit itp. |
| O2- - Cr6+: Crocoite (pomarańczowy) | |
| O2- -V5+wanadynit (pomarańczowy) | |
| Siarka do metalu: piryt, markasyt itp. (patrz półprzewodnik z przerwą) | |
| Transfer ładunku niemetal - niemetal | S3-: Lapis lazuli (niebieski) |
| Π elektroniczny: grafitowy (czarny) | |
| Kolory niektórych organicznych kamieni szlachetnych, takich jak bursztyn i koral. |
Copywrite @ Sobling.Jewelry - Producent biżuterii na zamówienie, fabryka biżuterii OEM i ODM
Sekcja III Teoria pasm energetycznych
Teoria pasm energetycznych jest kwantowo-mechanicznym modelem do badania materiałów kamieni szlachetnych, który jest dalszym rozszerzeniem teorii orbitali molekularnych. Badanie teorii pasm energetycznych może lepiej wyjaśnić mechanizm koloru niektórych naturalnie zabarwionych kamieni szlachetnych.
1. Podstawowe pojęcia teorii pasm energetycznych
Teoria pasm energetycznych jest przybliżoną teorią wykorzystywaną do badania praw ruchu elektronów w ciałach stałych. Ciała stałe składają się z atomów, w tym jąder atomowych i najbardziej zewnętrznych elektronów, z których wszystkie są w ciągłym ruchu. Teoria pasmowa zakłada, że elektrony w ciałach stałych nie są związane z konkretnym atomem, ale są współdzielone przez cały kryształ i poruszają się w okresowym polu potencjału trójwymiarowej przestrzeni kryształu. Zakres ruchu elektronów mieści się w okresowym polu potencjału sieci krystalicznej, dzięki czemu rozkład przestrzenny orbit elektronowych przekracza rozkład cząsteczek, osiągając maksimum. Poziomy energetyczne poszczególnych elektronów są poszerzone do pasm energetycznych.
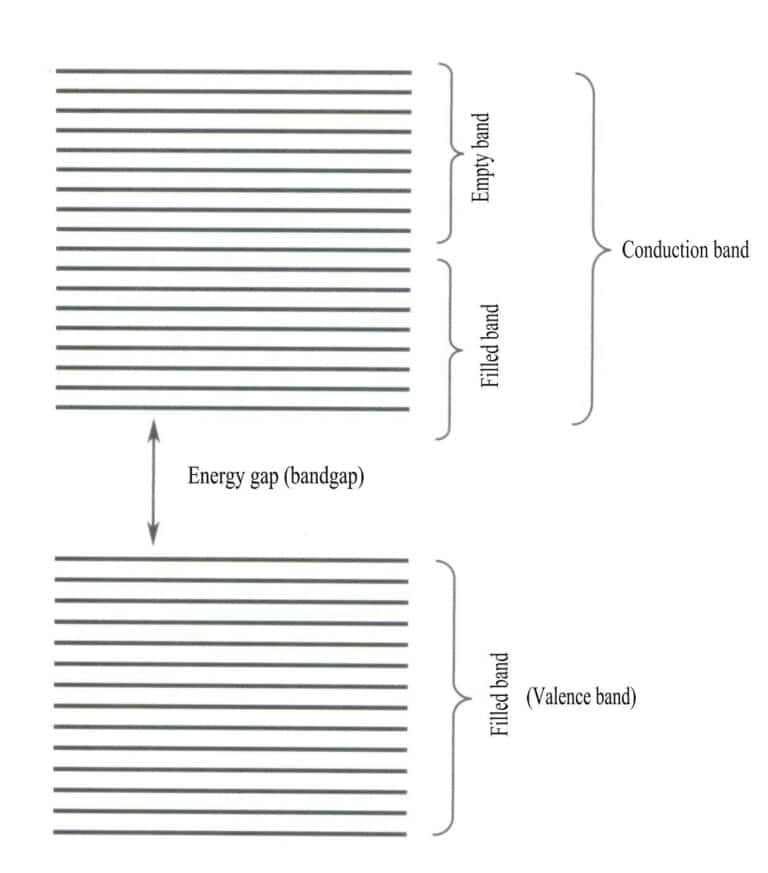
Teoria pasmowa omawia głównie przejścia elektronowe między stanami nielokalnymi, w których wszystkie elektrony walencyjne powinny należeć do całej sieci ciała stałego. Zgodnie z teorią pasmową, materiały stałe można podzielić na różne pasma energetyczne w zależności od tego, czy orbitale atomowe są wypełnione: wypełnione pasmo jest tworzone przez poziomy energetyczne orbitali atomowych, które są w pełni zajęte przez elektrony, reprezentując pasmo niskoenergetyczne; puste pasmo jest tworzone przez poziomy energetyczne, które nie są w pełni zajęte przez elektrony, reprezentując pasmo wysokoenergetyczne. Różnica energii pomiędzy tymi dwoma rodzajami pasm nazywana jest "przerwą energetyczną" (Rysunek 3-28).
Gdy wszystkie pasma energetyczne materiału są wypełnione, jest on nieprzewodnikiem; gdy jest częściowo wypełniony elektronami, jest przewodnikiem. Defekty sieci wprowadzają dodatkowe poziomy energii w krysztale, umożliwiając elektronom wejście na te poziomy energii, co skutkuje warunkowym przewodnictwem.
2. Charakterystyka przejść pasmowych
Niektóre minerały zawierają pierwiastki z grupy IV A układu okresowego, takie jak diament i moissanit, które wiążą się głównie kowalencyjnie. Istnieją również inne minerały, takie jak siarczek kadmu (CdS), których kolory można wyjaśnić za pomocą teorii pasmowej.
Elektrony absorbują energię świetlną i przemieszczają się pomiędzy pasmem walencyjnym i pasmem przewodnictwa, tworząc "wewnętrzne przejścia pasmowe". Prawdopodobieństwo przejść jest ściśle związane z różnicą energii między pasmem walencyjnym i pasmem przewodnictwa, znaną jako energia przerwy energetycznej (Eg) (Rysunek 3-29).

Rysunek 3-29 (a) przedstawia typowy wykres pasmowy półprzewodnika. W oparciu o wielkość energii przerwy pasmowej kryształu, można go podzielić na trzy typy: szeroką przerwę pasmową, wąską przerwę pasmową i średnią przerwę pasmową. Szerokie pasmo wzbronione ma energię pasma wzbronionego większą niż energia światła widzialnego; gdy energia pasma wzbronionego przekracza energię światła widzialnego, światło widzialne nie jest absorbowane i przechodzi całkowicie, dzięki czemu minerał jest bezbarwny. Na przykład, energia przerwy pasmowej diamentu Eg wynosi około 5,5eV, co czyni go bezbarwnym.
Energia pasma wzbronionego materiałów o wąskim paśmie wzbronionym jest mniejsza niż energia światła widzialnego, powodując pochłanianie całego światła widzialnego, co skutkuje ciemnoszarozielonymi lub czarnymi kolorami. Na przykład, energia pasma wzbronionego galeny wynosi Eg poniżej 0,4eV, który wydaje się być ołowiano-szary. Gdy ten "półprzewodnik o wąskim paśmie wzbronionym" ma odpowiedni kształt geometryczny, wykazuje właściwości prostujące i wzmacniające.
Energia materiałów o średnim paśmie wzbronionym mieści się dokładnie w zakresie światła widzialnego, a minerały szlachetne mają różne kolory. Ich sekwencję kolorów pokazano na rysunku 3-29 (c), od czerwono-żółtego przez zielono-niebieski do fioletowego. Na przykład, energia pasma wzbronionego (Eg) siarczku kadmu (CdS) wynosi około 2,5eV, który pochłania światło niebieskie i fioletowe, przez co wydaje się żółty. Energia pasma wzbronionego cynobru wynosi około 2eV, przepuszczając tylko światło czerwone, przez co wydaje się czerwony. Energia pasma wzbronionego orpimentu wynosi około 2,5eV, przez co ma on kolor żółty.
Inną kategorią naturalnych minerałów wyjaśnioną przez teorię pasmową jest kolor materiałów o szerokim paśmie wzbronionym zawierających zanieczyszczenia. Na przykład w przypadku diamentu z zanieczyszczeniami, energia pasma przenoszenia diamentu wynosi około 5,5eV, a światło widzialne nie jest absorbowane podczas przechodzenia przez diament; czysty diament jest bezbarwny, ale sytuacja zmienia się, gdy zawiera zanieczyszczenia.
(1) Mechanizm koloru żółtych diamentów
Atomy azotu zastępują atomy węgla. Ponieważ atomy azotu mają o jeden elektron więcej niż atomy węgla, ten dodatkowy elektron tworzy poziom energetyczny zanieczyszczenia w paśmie wzbronionym, znany jako poziom energetyczny donora, z atomami azotu działającymi jako "donory".
Istnienie tego poziomu zanieczyszczeń zmniejsza energię przerwy pasmowej do 4eV[ [Rysunek 3-30 (a)]. Może być nawet niższa, co pozwala na pochłanianie światła ultrafioletowego i nieco 3eV światła fioletowego, powodując, że diament wydaje się żółty.
Efekt ten jest silny; posiadanie jednego atomu azotu na każde sto tysięcy atomów węgla może sprawić, że diament stanie się głęboko żółty. Zmniejszenie przerwy pasmowej jest jednak nadal niewystarczające, aby diament mógł przewodzić prąd w temperaturze pokojowej.
(2) Mechanizm koloru niebieskich diamentów
Ponieważ bor ma o jeden elektron mniej niż węgiel, tworzy "poziom akceptorowy" w przerwie energetycznej diamentu. Nie ma on dodatkowych elektronów, ale może przyjmować elektrony z pasma walencyjnego diamentu, tworząc dziury w paśmie walencyjnym [Rysunek 3-30 (b)] i tworząc pasmo energii zanieczyszczenia około 0,4eV powyżej pasma walencyjnego, znane jako poziom akceptorowy.

Poziom energetyczny akceptora nie jest prosty; jest to złożona struktura pasm energetycznych zanieczyszczeń, które mogą wytwarzać kolor niebieski. Poziom energii akceptora tworzy "dziury" w paśmie walencyjnym, co pozwala temu "dziurawemu" niebieskiemu diamentowi typu II b przewodzić prąd elektryczny.
Jeden atom boru na milion atomów węgla może tworzyć kolor niebieski. Ze względu na wyższą zawartość aluminium w tym niebieskim diamencie oraz fakt, że aluminium ma o jeden elektron na zewnętrznej warstwie mniej niż węgiel, wcześniej uważano, że aluminium odgrywa rolę akceptora. Obecne eksperymenty dowiodły jednak, że jest to bor, a nie aluminium.
Przewodzące niebieskie diamenty typu II b są naturalnie niebieskie, a ich przewodnictwo jest jedną z różnic w stosunku do napromieniowanych niebieskich diamentów (centra kolorów). Właściwość ta jest często wykorzystywana do rozróżniania tych dwóch typów diamentów. Jednak żółte diamenty donorowe azotu nie przewodzą prądu, więc tej metody nie można użyć do odróżnienia ich od napromieniowanych żółtych diamentów.
3. Kamienie szlachetne zabarwione przez przejścia pasmowe
Teoria pasm energetycznych może wyjaśnić część powstawania koloru naturalnych kamieni szlachetnych. Ponieważ energia przerwy energetycznej jest nieodłączną właściwością kryształu i nie zmienia się pod wpływem warunków zewnętrznych, kolor kamieni szlachetnych ma dobrą stabilność. Przewodność kryształu można określić na podstawie tego, czy pasma energii w krysztale są wypełnione elektronami. Tabela 3-13 zawiera listę rodzajów kolorów kamieni szlachetnych, które można wyjaśnić za pomocą teorii pasmowej i ich właściwości przewodnictwa.
Tabela 3-13 Rodzaje kolorów klejnotów wyjaśnione przez teorię pasm i ich przewodnictwo
| Przewodniki (kolory metalu i metaliczny połysk) | Element | Miedź, złoto, żelazo, srebro, rtęć itp. |
| Stop | Amalgamat, meteoryt niklowo-żelazowy | |
| Półprzewodnik | Wąska szczelina pasma | Nieprzezroczysty szary do czarnego: altait, galena |
| Nieprzezroczysty metaliczny kolor: kobalt, markasyt, piryt, smaltyt | ||
| Umiarkowana przerwa pasmowa | Czerwony: cynober, proustyt, pirargiryt | |
| Pomarańczowy: Realgar | ||
| Żółty: Siarczek kadmu, realgar, siarka | ||
| Szerokie pasmo przenoszenia | Bezbarwny: diament, sfaleryt | |
| Półprzewodniki o szerokim paśmie przenoszenia zawierające zanieczyszczenia | Zanieczyszczenie donorowe: Diament domieszkowany azotem (żółty) | |
| Zanieczyszczenia w nośniku: Diament zawierający bor (niebieski) |
Kolor kamieni szlachetnych spowodowany przejściami pasmowymi jest związany ze strukturą i rodzajem wiązania w czasie formowania się kamieni szlachetnych. Ma ona niewielki związek z późniejszymi zanieczyszczeniami i defektami krystalicznymi. Wielkość energii przerwy pasmowej kamieni szlachetnych jest stała. Nie zmienia się ona wraz z właściwościami materiału kamienia szlachetnego, więc konwencjonalne metody optymalizacji generalnie nie mogą poprawić koloru kamieni szlachetnych.
Sekcja IV Fizyczne efekty optyczne
Większość naturalnych kamieni szlachetnych może powodować selektywną absorpcję światła, a różne kamienie szlachetne pochłaniają światło widzialne o różnych długościach fal, co skutkuje różnymi kolorami. Oprócz selektywnej absorpcji światła, wewnętrzna struktura kryształów kamieni szlachetnych może również powodować fizyczne efekty optyczne, prowadząc do różnych kolorów kamieni szlachetnych.
1. Minerały kamieni szlachetnych związane z fizycznymi efektami optycznymi
Kolory wytwarzane przez fizyczne efekty optyczne powstają w wyniku dyspersji, interferencji, dyfrakcji i innych przyczyn światła spowodowanych strukturą lub składem kryształu oraz wtrąceniami. Jest to jedynie efekt optyczny, który można wyjaśnić fizyczną teorią optyczną. Różne kamienie szlachetne mogą wytwarzać różne kolory pod wpływem tych samych efektów optycznych. Oprócz wspólnych pierwiastków śladowych, które powodują kolor, przyczyny kolorów wytwarzanych przez fizyczne efekty optyczne są głównie związane z wewnętrzną strukturą i właściwościami fizycznymi kamieni szlachetnych. Rodzaje minerałów kamieni szlachetnych, które powodują kolory z powodu fizycznych efektów optycznych, są wymienione w tabeli 3-14.
Tabela 3-14 Rodzaje minerałów szlachetnych spowodowane fizycznymi efektami optycznymi
| Funkcja | Właściwości optyczne i kolor | Minerały szlachetne |
|---|---|---|
| Dyspersja Rozpraszanie | Mieniący się | "Ogień" w dyspersyjnych kamieniach szlachetnych, takich jak diamenty, cyrkonia, rutyl i tytanian strontu. |
| Niebieski | Kamień księżycowy, niebieski kwarc, opal | |
| Fioletowy | Fluoryt (rozproszenie mikrokryształów wapnia) | |
| Czerwony | Rubinowe szkło, rozproszone mikrokryształy miedzi lub złota | |
| Biały | Kwarc mleczny | |
| Efekt kociego oka | akwamaryn kocie oko, piroksen kocie oko itp. | |
| Efekt światła gwiazd | Różne efekty gwiazd korundu i granatu | |
| Połysk | Połysk pereł, apofyllitu itp. | |
| Lśnienie | Błysk awenturynu, obsydianu itp. | |
| Dyfrakcja interferencyjna | Czyste kolory widmowe cienkiej warstwy | Tęcza chalkopirytu, odbarwiona warstwa w szczelinie kwarcowej irysa |
| Efekty zakłóceń | Zmiana koloru opalu, efekt labradorytu | |
| Włączenie | Niebieski | Dumortieryt w kwarcu |
| Zielony | Zielony chalcedon i żyły niklu w zielonym chalcedonie, fuchsyt w kwarcu gwiaździstym | |
| Pomarańczowy | Uwodniony tlenek żelaza w opalu ognistym i chalcedonie w kolorze cielistym | |
| Czerwony | Płatki hematytu w ortoklazie |
2. Efekty interferencji i dyfrakcji
(1) Efekty zakłóceń
Zjawisko interferencji występuje, gdy dwie wiązki światła rozchodzą się wzdłuż tej samej ścieżki optycznej lub w równoległych kierunkach. Powszechnym zjawiskiem interferencji w kamieniach szlachetnych jest opalizacja. Na przykład w opalizującym kwarcu kolory interferencyjne zależą od grubości warstwy, współczynnika załamania światła i charakteru padającego światła.
Kolory interferencyjne pereł są tworzone przez koncentryczną warstwową naprzemienną superpozycję dwóch substancji o różnych współczynnikach załamania światła (aragonit i nacrum), gdzie padające światło odbija się od powierzchni między naprzemiennymi warstwami, a odbite światło interferuje ze światłem padającym, tworząc piękne kolory interferencyjne.
(2) Efekty dyfrakcji
Dyfrakcja odnosi się do zjawiska fizycznego, w którym fale świetlne odbiegają od pierwotnej prostoliniowej propagacji po napotkaniu przeszkód. W fizyce fale świetlne ulegają różnym stopniom ugięcia i rozproszenia podczas przechodzenia przez przeszkody, takie jak szczeliny, małe otwory lub dyski. Jeśli między źródłem światła a ekranem obserwacyjnym znajduje się przeszkoda, na ekranie obserwacyjnym pojawią się jasne i ciemne obszary, a granice tych obszarów nie są ostre, tworząc złożony wzór światła i ciemności. Zjawisko to nazywane jest dyfrakcją. Takie zjawisko może wystąpić, gdy fale świetlne napotkają przeszkody na swojej drodze propagacji. Najważniejszym czynnikiem powodującym dyfrakcję jest obecność okresowo rozmieszczonych siatek dyfrakcyjnych w minerałach kamieni szlachetnych.
① Zmiana koloru opalu
W opalu kule krzemionkowe zawierające wodę mają równe średnice i są ułożone w regularną naprzemienną strukturę warstwową, tworząc okresowo rozmieszczone siatki dyfrakcyjne. Gdy światło wpada do opalu, następuje dyfrakcja, zmieniając kolor (rysunki 3-31, 3-32). Rodzaje kolorów i stopień zmiany koloru zależą głównie od odległości między płaszczyznami ułożonych krzemionkowych kulek.

Na przykład, opal o strukturze płaskiej płyty sześciennej i rozstawie sieci 3×10-10m wykazuje kolory od zielonego do czerwonego; ten typ opalu o rozstawie sieci 2,5×10-10m wyświetla kolory od niebieskiego do żółtego.
② Efekt labradorytu
Labradoryt wykazuje również efekty podobne do opalu (Rysunek 3-33). Labradoryt jest również znany jako spektrolit, ponieważ może migać kolorowym światłem słonecznym. Różne rodzaje labradorytu z Finlandii mogą wykazywać szereg kolorów spektralnych, zjawisko znane jako "efekt labradorytu". Efekt zmiany koloru w labradorycie jest spowodowany niewielkimi stopieniami międzywarstwowymi plagioklazu o różnym składzie. Niewielkie różnice w współczynniku załamania światła między różnymi skaleniami powodują interferencję i dyfrakcję światła, powodując luminescencję i zmianę koloru. Kolory wytwarzane przez tę strukturę są związane ze względną grubością warstw i ich współczynnikami załamania światła. Czasami andradyt z Meksyku również wykazuje zjawisko dyfrakcji.

3. Rozpraszanie i wtrącenia
(1) Rozpraszanie
Rozpraszanie zazwyczaj występuje, gdy wewnętrzna struktura materiałów szlachetnych jest nieregularna lub gdy rozmiar składników przekracza granice warunków dyfrakcji. Efekty kolorystyczne wytwarzane przez rozpraszanie są związane z rozmiarem i kształtem cząstek materiału. Gdy padające światło oddziałuje z nieregularnie ułożonymi cząsteczkami mniejszymi niż długość fali światła widzialnego, przenoszone fale świetlne o wysokiej energii są silniejsze niż fale świetlne o niskiej energii, co oznacza, że w większości przypadków można zobaczyć tylko fioletowy i niebieski. Na przykład SiO2 Małe kule w opalu mają średnice mniejsze niż długość fali światła widzialnego, a gdy rozmiar cząstek rozpraszających jest zbliżony do długości fali światła widzialnego, mogą również wystąpić rozpraszające kolory.
Na przykład, fioletowy fluoryt jest spowodowany promieniowaniem radioaktywnym, które wyrzuca atomy fluoru, w wyniku czego atomy wapnia, które wiążą się z atomami fluoru, kondensują się w sześciokątne płytki o rozmiarze porównywalnym z długością fali światła widzialnego. Interakcja między płytkami wapnia a falami świetlnymi powoduje rozpraszanie. Pochłania niektóre fale świetlne, tworząc silny pik absorpcji w obszarze światła od zielonego do czerwonego, umożliwiając przejście światła fioletowego i uzyskanie fioletowego koloru.
Ponieważ cząsteczki metalu o tej samej wielkości mogą dawać podobne efekty kolorystyczne, a różne cząsteczki metalu mogą dawać różne kolory, niektóre imitacje kamieni szlachetnych są produkowane z wykorzystaniem tej właściwości.
Na przykład szkło "rubinowe" jest wytwarzane przez dodanie cząstek miedzi lub złota do szkła, co skutkuje czerwonym kolorem podobnym do rubinów. Gdy materiał klejnotu zawiera inkluzje, mikropęknięcia lub pęcherzyki większe niż długość fali światła widzialnego, fale świetlne oddziałują z tymi rozpraszającymi cząstkami, powodując rekombinację rozproszonych fal świetlnych, tworząc półprzezroczyste mleczne światło. Na przykład niektóre imitacje kamienia księżycowego.
Efekt światła księżycowego kamienia księżycowego jest również wytwarzany przez rozpraszanie światła (rysunek 3-34). Kamień księżycowy jest skaleniem alkalicznym, kompozytem utworzonym przez naprzemienne równoległe warstwy skalenia bogatego w potas i sód. Grubość międzywarstw zwykle waha się od 50 ~ 1000 nm, przy czym cieńsze warstwy mogą powodować rozpraszanie. Ten sam kolor rozpraszania może również występować w plagioklazie, znanym jako "efekt labradorytu".
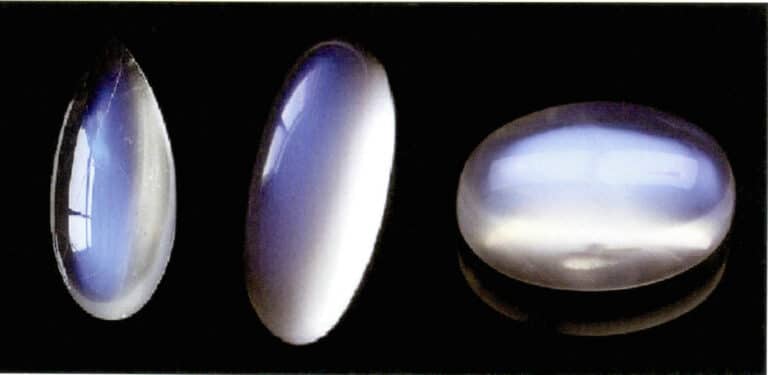
Specjalnie zorientowany układ cząstek rozpraszających może wytwarzać charakterystyczne efekty optyczne. Na przykład, gdy cząstki rozpraszające są w równoległej włóknistej formie, wytwarzają efekt kociego oka lub gwiazdy, takie jak szafiry gwiaździste i kwarcowe kocie oczy. Gdy cząstki rozpraszające są wystarczająco duże, aby można je było rozróżnić gołym okiem, mogą one wytwarzać "efekt złotego kamienia", taki jak kamień słoneczny (rysunek 3-35) i szkło ze złotego kamienia.

(2) Włączenia
Kolor i zjawiska optyczne wytwarzane przez inkluzje są szczególnym rodzajem rozpraszania. Wtrącenia z kolorem osadzone w prawie bezbarwnych kryształach głównych będą prezentować kolor wtrąceń, takich jak chalcedon pasmowy zawierający nikiel i tlenek żelaza(II) zawierający wodę (FeO - H2O) chalcedon w kolorze cielistym; kolor ortoklazu z Madagaskaru i niektórych kordierytów jest tworzony przez nieco większe, ale wciąż mikroskopijne wtrącenia hematytu, które tworzą czerwone odcienie; submikroskopijne wtrącenia wodorotlenku żelaza często barwią opal ognisty.
Diamenty często wykazują różne kolory ze względu na obecność licznych inkluzji. Diamenty zabarwione przez inkluzje mogą być czarne, pomarańczowo-czerwone i brązowo-czerwone. Gdy diament zawiera niezliczone ciemne, nieprzezroczyste inkluzje mineralne, wydaje się czarny; podczas badania w silnym świetle przechodzącym można zaobserwować wiele ciemnych inkluzji, a diament wydaje się ciemnoszary; innym rodzajem są wtórne inkluzje, które występują w pęknięciach diamentu. Kiedy pęknięcia rozwijają się i są wypełnione tymi kolorowymi wtrąceniami, diament wydaje się brązowo-czerwony lub pomarańczowo-czerwony, co jest również znane jako "utleniony" diament.
4. Dyspersja
Zjawisko rozkładu światła białego na różne kolory widmowe przez obiekt nazywane jest dyspersją. Dyspersja kamieni szlachetnych odnosi się do właściwości światła rozpraszającego się na różne długości fal kolorów widmowych podczas przechodzenia przez nachylone płaszczyzny przezroczystych kamieni szlachetnych. Ze względu na różne długości fal światła monochromatycznego, które składają się na światło białe rozchodzące się z różnymi prędkościami i współczynnikami załamania światła w różnych materiałach, światło białe może zostać rozłożone na różne kolory widmowe w określonych warunkach. Wielkość wartości dyspersji kamienia szlachetnego zależy od jego właściwości fizycznych; każdy kamień szlachetny ma swoją własną wartość dyspersji, która nie zmienia się wraz z właściwościami kamienia szlachetnego. Wyjątkowy urok diamentów jest ściśle związany z ich wysoką wartością dyspersji (0,044).
Większość imitacji diamentów ma wyższą wartość dyspersji, taką jak wartość dyspersji cyrkonii wynosząca 0,039 i wartość dyspersji syntetycznego moissanitu wynosząca 0,104. Porównanie wartości dyspersji diamentów i ich popularnych imitacji kamieni szlachetnych przedstawiono w tabeli 3-15.
Tabela 3-15 Porównanie wartości dyspersji diamentów i ich popularnych kamieni imitujących kamienie szlachetne
| Nazwa kamienia szlachetnego | Wartość rozproszenia |
|---|---|
| Diament | 0.044 |
| Cyrkon | 0.039 |
| Korund | 0.018 |
| Spinel | 0.020 |
| Topaz | 0.014 |
| Beryl | 0.014 |
| Kryształ | 0.014 |
| Syntetyczny rutyl | 0.280 |
| Syntetyczny tytanian strontu | 0.190 |
| Syntetyczny moissanit | 0.104 |
Dyspersja jest powszechnie określana jako "ogień" kamieni szlachetnych. Na przykład diamenty mają wysoką wartość dyspersji, a ich ogień jest bardzo wyraźny, co wzmacnia i tak już królewski status diamentów i podkreśla ich wyjątkowy urok.
Istnieje wiele rodzajów kolorów wytwarzanych przez fizyczne efekty optyczne, z których wszystkie można wyjaśnić fizyczną teorią optyczną. Z wyjątkiem dyspersji, która jest nieodłączną właściwością samego kamienia szlachetnego, inne zjawiska są spowodowane zmianami strukturalnymi po utworzeniu kamienia szlachetnego i różnicami w inkluzjach mechanicznych. Zrozumienie różnych przyczyn kolorów kamieni szlachetnych stanowi teoretyczną podstawę do optymalizacji obróbki naturalnych i syntetycznych kamieni szlachetnych.
















