なぜ宝石には複数の色があるのか?
結晶場理論・分子軌道理論・エネルギーバンド理論の紹介
宝石の色は豊かで変化に富み、人々が愛してやまない独特の魅力を持っている。宝石の品質は、その色に大きく左右されます。宝石の色は、宝石の評価における重要な指標であり、宝石の最適化治療のほとんどは、その色を変更または改善することを含む。したがって、宝石の着色の原因を理解することは、宝石の最適化治療のための重要な前提条件です。宝石がどのようにしてその色を獲得するのかをマスターすることによってのみ、宝石を最適化できるかどうか、どの最適化方式を採用すべきか、どの実験計画を立てるべきかを判断することができる。宝石の発色には、古典鉱物学理論、結晶場理論、分子軌道理論、エネルギーバンド理論、物理光学効果の5つの一般的な理論があります。これらの理論は、一般的な天然宝石の発色理論を構成しており、以下にこれら5つの発色理論について簡単に紹介する。
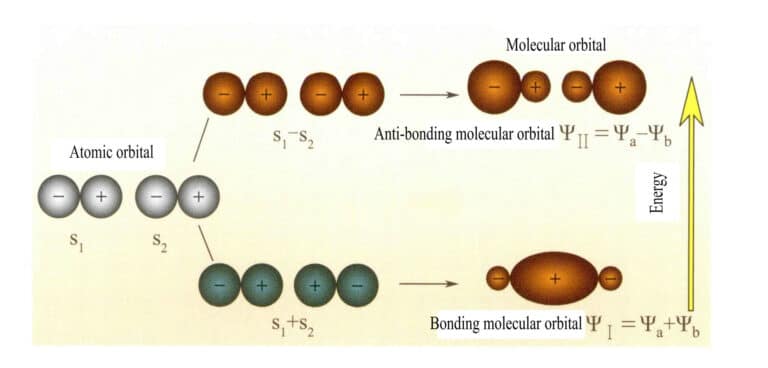
2つのs原子軌道によって形成される分子軌道
目次
セクション I 結晶場の理論
1930年代の科学者たちは、結晶の性質を説明するために結晶場理論を提唱した。結晶場理論とは、遷移元素(錯体)の化学結合を研究する理論である。中心イオンのd軌道とf軌道に対する配位子の影響に着目し、静電論、量子力学、群論(物質の対称性を研究する理論)のいくつかの視点を組み合わせることで、遷移元素やランタノイド元素の物理的・化学的性質を説明する。1950年代になると、結晶場理論を錯体に応用し、リガンド場理論を提唱する人々が現れた。リガンド場理論は結晶場理論を発展させたもので、リガンドの電場が中心イオンに与える影響と、リガンドの電子が中心イオンに与える充填効果の両方を考慮し、結晶場理論よりも完全な理論となっている。しかし、両者に本質的な違いはなく、無機鉱物の研究では一般に区別されない。
1.結晶場理論の基本概念
遷移金属のイオンは、周囲のアニオンまたは双極子分子の結晶場にある。結晶場理論とは、結晶をプラスイオンとマイナスイオンの静電的相互作用として捉える静電モデルであり、プラスに帯電した陽イオンを中心イオン、マイナスに帯電した陰イオンを配位子と呼ぶ。
宝石鉱物の色を説明するために結晶場理論を適用すると、主に遷移元素イオンのd電子またはf電子のエネルギーが関係する。例えば、d軌道には次の5種類がある。xy, dxz, dyzおよびd 。これら5つのd軌道は、自由イオン状態では空間分布が異なるが、エネルギーは同じである。しかし、リガンド電場の影響を受けると大きく変化する。中心原子の5つのエネルギー縮退したd軌道は、周囲の配位子によって形成される負の電場の影響を受けて分裂する。一部のd軌道はエネルギーが増加し、他のd軌道はエネルギーが減少する。d軌道のエネルギー準位が分裂するため、中心原子のd軌道の電子は再配列し、よりエネルギーの低い軌道を優先的に占めるようになり、それによって系の全エネルギーが減少し、錯体がより安定になる。
d軌道のエネルギーは、電場がないときは同じである[図3-19(a)]。球対称の静電場下では、d軌道のエネルギーは増加するが、分裂はしない[図3-19(b)]。r とdg. このうち、dr 軌道は、エネルギーの高い d と d から構成される。g 軌道はdxy, dxz, dyz.
遷移金属のイオンは、周囲のアニオンまたは双極子分子の結晶場にある。結晶場理論とは、結晶をプラスイオンとマイナスイオンの静電的相互作用として捉える静電モデルであり、プラスに帯電した陽イオンを中心イオン、マイナスに帯電した陰イオンを配位子と呼ぶ。
宝石鉱物の色を説明するために結晶場理論を適用すると、主に遷移元素イオンのd電子またはf電子のエネルギーが関係する。例えば、d軌道には次の5種類がある。xy, dxz, dyzおよびd 。これら5つのd軌道は、自由イオン状態では空間分布が異なるが、エネルギーは同じである。しかし、リガンド電場の影響を受けると大きく変化する。中心原子の5つのエネルギー縮退したd軌道は、周囲の配位子によって形成される負の電場の影響を受けて分裂する。一部のd軌道はエネルギーが増加し、他のd軌道はエネルギーが減少する。d軌道のエネルギー準位が分裂するため、中心原子のd軌道の電子は再配列し、よりエネルギーの低い軌道を優先的に占めるようになり、それによって系の全エネルギーが減少し、錯体がより安定になる。
d軌道のエネルギーは、電場がないときは同じである[図3-19(a)]。球対称の静電場下では、d軌道のエネルギーは増加するが、分裂はしない[図3-19(b)]。r とdg. このうち、dr 軌道はdx2- y2 とdz2
エネルギーが高いほど、低エネルギーのdg 軌道はdxy, dxz, dyz.[図3-19(c)]。
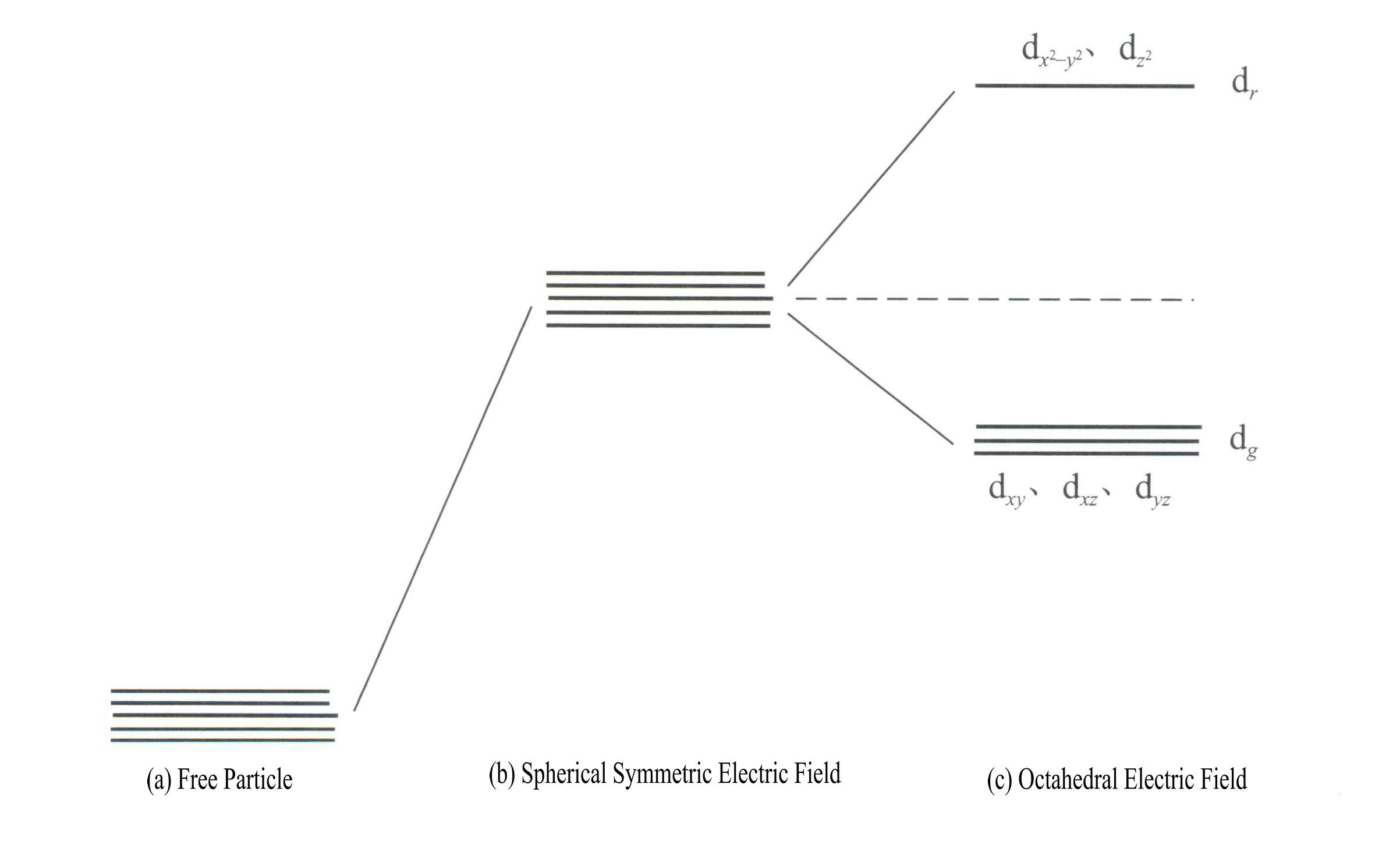
d軌道分割後の最高エネルギー準位と最低エネルギー準位の差を分離エネルギー△と呼ぶ。配位子の配置の違いによって生じる分離エネルギーは同じではありません(図3-20)。そのエネルギー順位は
正方形フィールド > 八面体フィールド > 四面体フィールド

また、同じ配置の場であっても、配位子や中心イオンの違いにより異なる場合があり、大きければ大きいほど結晶は安定である。結晶分離エネルギーの大きさは、主に以下の3つの要因で決まります:
(1)同じ遷移元素によって形成される結晶。配位子が同じ場合、中心イオンの電荷が高いほど、分離エネルギー△は大きくなる。中心イオンの正電荷が高いほど配位子との引力が大きくなり、中心イオンと配位子核との距離が小さくなり、配位子が電子に与える結晶場の反発力が大きくなるため、分離エネルギー△は大きくなる。
(2) 同じ正電荷を持ち、同じ配位子を持つ異なるイオンによって形成される結晶では、中心イオンの半径が大きいほどd軌道は原子核から離れ、分離エネルギー△は大きくなる。
(3) 同じ中心イオンと異なる配位子によって形成される結晶では、配位子の結晶場の強さが異なるため、分離エネルギーが異なる。配位子によって場の強さが異なり、分離エネルギー△は配位子の場の強さによって変化する。
分離エネルギーは、結晶の安定性を定性的に説明するために用いられる。絶対値△を求める必要はなく、異なる条件下での結晶の相対値を知っていれば十分である。
分割されたd軌道の相対エネルギーに基づいて、d軌道における遷移金属イオンの全エネルギーを計算することができる。このエネルギーは分割前より低いため、結晶に付加的なエネルギーを与え、結晶場安定化エネルギーとして知られ、記号CFSEで表される。表3-10にdn 異なる条件下での電子。
表3-10 配位子の違いによる結晶場の安定化エネルギー (Wu Ruihua, 1994)
| dn | 弱いフィールド | ストロングフィールド | ||||
|---|---|---|---|---|---|---|
| dn | 正方形 | 正八面体 | 正四面体 | 正方形 | 正八面体 | 正四面体 |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2.遷移金属イオンの色彩特性
彼のカラーストーンにおいて、ほとんどの宝石の色は遷移金属イオンによるものであり、宝石の色は着色イオンがd軌道またはf軌道に不対電子を含むかどうかに関係している。遷移金属イオンの発色特性には、主に以下のような側面がある:
(1) 遷移金属イオンの発色は、d軌道またはf軌道の電子状態に関係している。d軌道またはf軌道の電子が満たされているか空である場合、宝石は色を示さない。例えば、Cr6+セ4+とCu+.
(2)異なる着色イオンは、同じ宝石素材でも異なる色を示す。異なる着色イオンの分離エネルギーが異なるため、同じ素材であっても異なる色を示すことがある。例えば、Fe2+ はスピネルにやや灰青色を呈するが、Cr3+ は赤を生み出す。
(3)同じ元素の異なる価数状態の着色イオンは、同じ宝石材料でも異なる色を示すことが多い。中心イオンのd電子遷移に必要なエネルギーが異なるため、吸収される光の波長が異なり、異なる色になる。例えば、Mn2+ を含むベリルは柔らかいピンク色を呈する。2+ は、レッドベリルとして知られる鮮やかな赤色を呈する。
(4) 同じ価数状態の同じ元素の着色イオンは、配位子の配置が異なると異なる色を示すことが多い。例えば、Co2+ スピネルの四面体配置では特徴的な "ダイヤモンドブルー "を示し、方解石の八面体配置ではピンク色に見える。鉄2+ 八面体配位のオリビンでは特徴的なオリーブグリーンを示し、歪んだ立方配位のアルマンディンでは深紅色に見える。
(5)同じ種類の着色イオンは同じ価数状態と配位形状を持つが、隣接する配位原子が異なると異なる色を示す。例えば、四面体配位のCo2+閃亜鉛鉱、Co2+ は硫黄と結びついて緑色を示すが、スピネルではCo2+ は酸素とつながっており、青色を示している。
(6)同じ価数状態、配位幾何学、隣接原子を持つ同種の着色イオンが、異なる宝石では異なる色を示す。宝石の化学組成の違いによる配位構造の歪みは、中心イオンと配位子間の化学結合の性質を変化させ、d電子の遷移エネルギーを変化させる。例えば、Cr3+ ルビーでは赤く、エメラルドでは緑に見え、アレキサンドライトではさまざまな色を示す。このようなCr3+ は、その特性と隣接する配位子に関連しており、具体的な特徴分析は以下の通りである。
Cr3+ 特徴
Cr3+ の外殻電子構造は3sである。23p63d3外殻に11個の電子を持ち、不規則な(8-18)電子殻構造に属する。
この構造は、8電子殻構造よりも原子核に対する遮蔽効果が小さく、その結果、Cr3+ の基本特性を形成している。3+強い正電場と空のd軌道。Cr3+ に属する八面体の空間配置を持つ6つの配位子を収容するために、6つの空の軌道を提供することができる。2sp3 ハイブリダイゼーション(図3-21)。
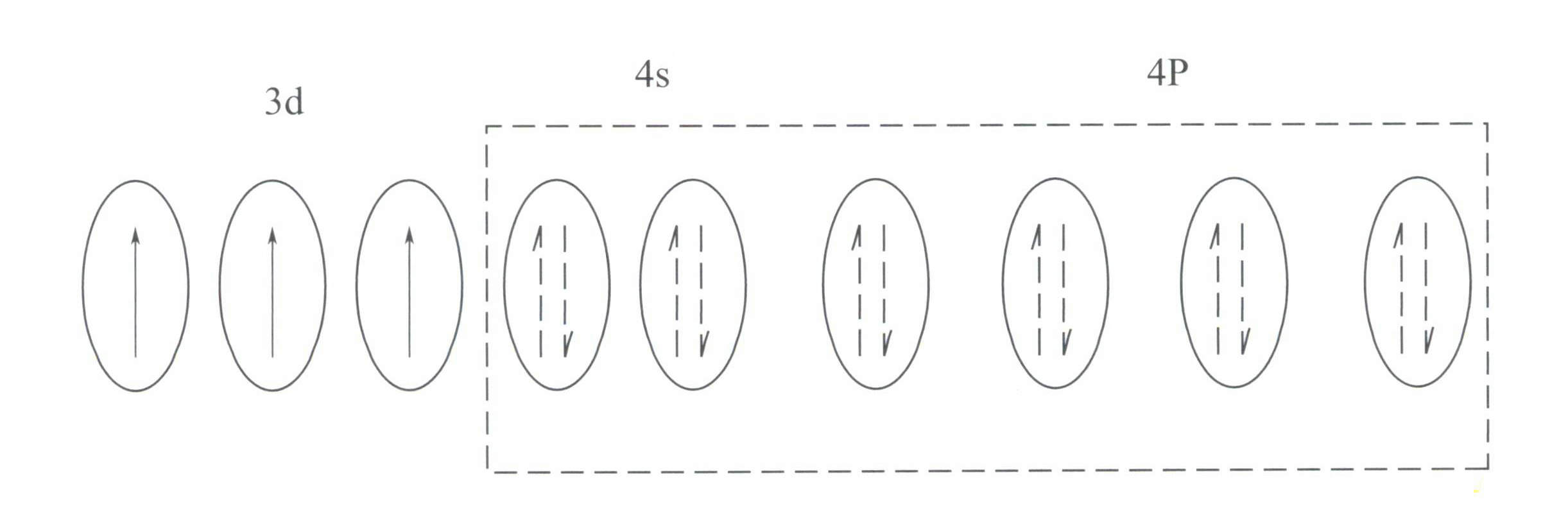
結晶場理論によると、八面体場ではCrのd軌道は3+ は、より低エネルギーのdƐ 軌道と、より高いエネルギーのdr 軌道を描く。Crの3個のd電子は3+ はすべてdƐ 軌道を持ち、すべて単電子であるため、可視光の下ではd-d遷移が起こり、Crを含む宝石のCr-d遷移を引き起こす。3+ 色彩を示す。
Crの着色メカニズム3+:
ルビー ルビーの主な化学成分はAlである。2O3.数パーセントのCr3+ アルに代わる3+鮮やかな赤色を呈する。ルビーの構造では、Crの半径が大きいため3+ の半径に比べ、Al3+Cr3+ がコランダム格子に入り込み、酸化アルミニウムの周りの対称性を低下させる。
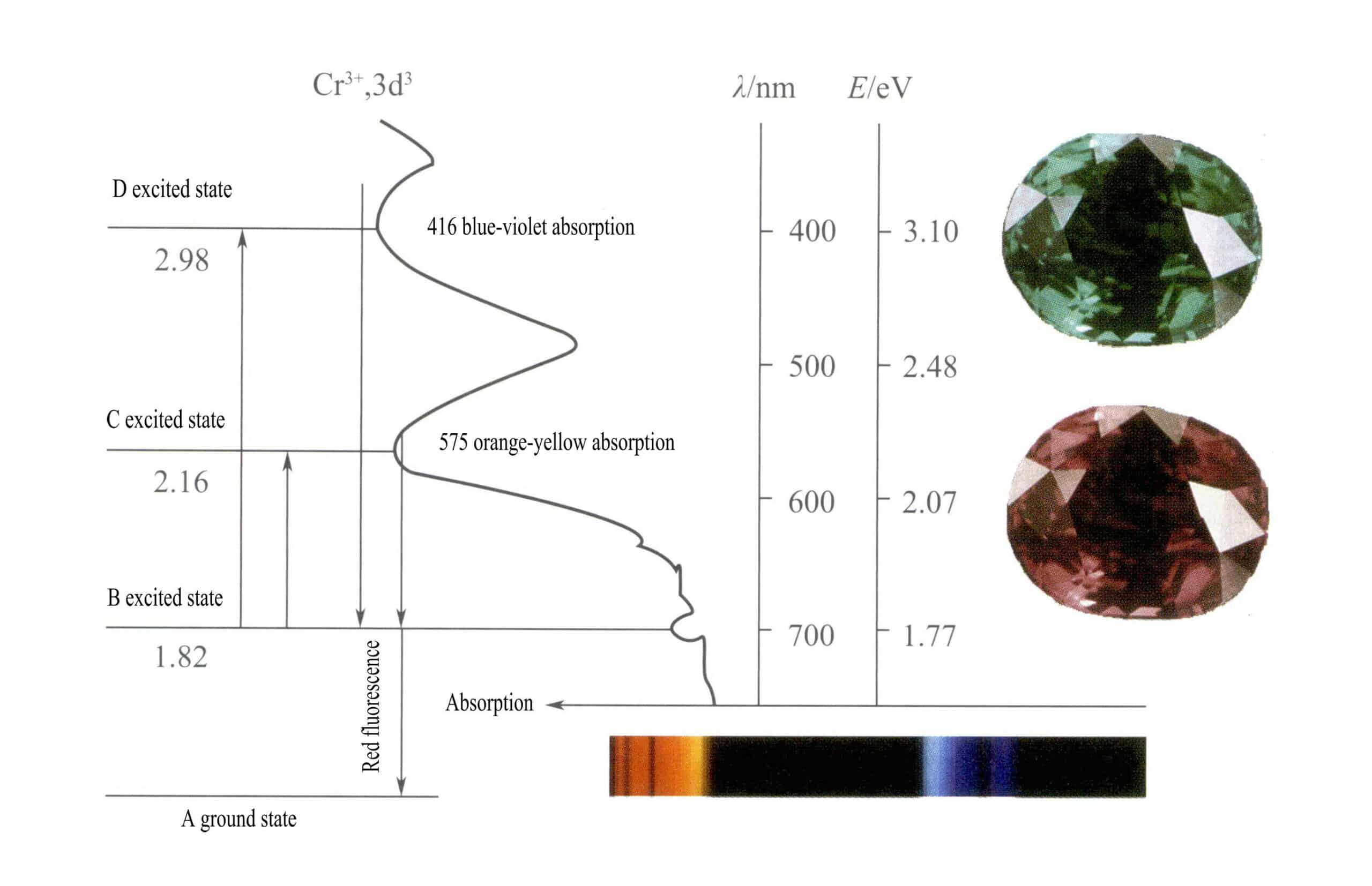
Crのd軌道3+ 分裂し、励起状態の電子がDまたはCから基底状態のAに戻るとき、まずBを通過しなければならず、熱を放出する。電子は発光を伴ってBからAに戻り、赤い蛍光を発する。この過程で電子は光エネルギーを吸収し、ルビーはD紫(400nm)とC黄緑(555nm)の可視スペクトルを吸収し(図3-22)、吸収帯を形成する。

白色光がルビーを通過するとき、紫から黄緑までのスペクトルの光子は吸収されるが、ほとんどすべての赤色光と一部の青色光は通過する。
ルビーは短時間のBレベル吸収を示し、赤色蛍光として現れる。赤い蛍光を発するこのBレベルの吸収は、ルビーの色をより鮮やかにする。クロムイオンの含有量が多いほど、蛍光は強くなる。
宝石中の鉄イオンはBレベル吸収の蛍光を抑制することができ、鉄不純物を含むとルビーが暗く見える現象を説明する。
Cr3+ エメラルドの着色メカニズム
エメラルドの主な化学成分はBeである。3アル2Si6O18Cr3+に代わるものである。3+ エメラルド格子のCr3+ もまた、6個の酸素イオンからなる8面体に囲まれている。3+-O結合の長さもルビーとよく似ている。しかし、エメラルドはルビーに比べて、Be2+ およびSi4+.エメラルドの構造では、金属酸化物間の共有結合性が高まり、イオン性は弱まる。
化学結合のような小さな変化は、Crのわずかな減少につながる。3+C準位とD準位のエネルギーにより、吸収帯がわずかにシフトし(図3-23)、スペクトルの青紫色(425nm)と橙黄色(608nm)の光の透過が著しく阻害される一方、青緑色の光の透過が増加するため、特徴的なエメラルドグリーンが形成される。

ジオプターゼのBレベルの吸収はほとんど変化しない。不純物である鉄がエメラルド成分の「阻害」作用を持たない場合、強い赤色蛍光が特徴的なエメラルドグリーンをさらに輝かせる。
Cr3+ アレキサンドライトの色のメカニズム:
アレキサンドライトの色は、Cr3+ アルに代わる3+ を歪んだ八面体配位で形成している。アレキサンドライトの化学組成はBeAL2O4また、金属-酸素イオン間の化学結合の性質は、ルビーとエメラルドの中間にある。したがって、その吸収帯もルビーとエメラルドの中間に位置し、青紫色光と橙黄色光の透過確率はほぼ等しく、赤色光と青緑色光のどちらが支配的か判断できない(図3-24)。
そのため、アレキサンドライトの色は、入射光のエネルギー分布と色域にのみ依存することができ、その結果、アレキサンドライトの「変色効果」、すなわち、青色光成分の多い昼光色では緑色に見え、赤色光成分の多い白熱灯では赤色に見えるという現象が生じる。そのため、アレキサンドライトはしばしば "昼のエメラルド、夜のルビー "と呼ばれる。
カラーチェンジ効果」は、カラーチェンジコランダムやカラーチェンジガーネットなど、多くの種類の宝石に現れる。現在、人工的に合成されたカラーチェンジコランダムは、色変化の原理を利用して製造されており、V3+ を合成のための着色イオンとした。
3.宝石鉱物の色
遷移金属成分が作り出す色は、宝石の鉱物の化学組成から推測することができる。例えば、Cu2+ は青でなければならない。+ は無色である。表3-11に、天然宝石鉱物に含まれる一般的な遷移金属成分によって生成される色を示す。
表3-11 天然宝石鉱物に含まれる遷移金属成分が生み出す色
| エレメント | カラー | 一般鉱物 |
|---|---|---|
| セリウム | イエロー | パリ石 |
| クロム(Cr) | 赤、緑、オレンジなど | クロコイサイト、レッド・クロコイサイト、ウバロバイト |
| コバルト | ブルー | 合成スピネル |
| 銅(Cu) | 青、緑 | アズライト、クリソコラ、ターコイズマラカイト、ダイオプテーズ |
| 鉄(Fe) | 赤、緑、黄 | アルマンディン、カンラン石、ゲータイト |
| マンガン (Mn) | ピンク、オレンジ | ロードナイト、スペサルティン |
| ニッケル(Ni) | グリーン | ブンゼナイト、カルセドニー |
ほとんどの宝石の色は、含まれる遷移金属の不純物によって引き起こされる。例えば、ルビーが赤く見えるのは、微量のCr3+.宝石中の不純物イオンによって引き起こされる色に影響を与える様々な要因。したがって、不純物は異なる宝石で異なる色を生成する可能性があります。例えば、Cr3+ ルビーでは赤く、エメラルドでは緑に見える。
同じ不純物でも宝石の色が同じとは限りません。例えば、ほとんどのエメラルドの緑色はCrによるものですが、一部のエメラルドの緑色は部分的または全体的にバナジウム(V)によるものです。
結晶場理論は、遷移金属成分や不純物によって生成される宝石の色だけでなく、構造欠陥(色中心)によって生成される色も説明することができる。具体的な色の生成過程は、本書の第3.3章を参照されたい。
また、結晶場理論による宝石鉱物の色の説明には、主に次のような欠点がある:
(1) 中心イオンdの電子は、元の軌道に完全に局在しているわけではない。また、配位原子の周りにも現れることがあり、中心原子と配位子との間に共有結合的な相互作用があることを示している。
(2) 中心原子と配位子間の静電イオン相互作用のみを考慮し、中心原子と配位子間の共有結合相互作用を完全に無視している。物理学研究では、定量計算の結果が実際の状況と大きく異なることがよくある。
(3)宝石鉱物の色の理由は、中心イオンと配位子との相互作用に加えて、構造欠陥と結晶場の複合的な影響によるものかもしれない。
セクション II 分子軌道理論
マリケンとフンドは当初、分子軌道理論(MO理論)を提唱した。多くの科学者の絶え間ない探求を経て、成熟した理論へと発展した。分子軌道(MO)は、原子軌道の線形結合によって得ることができる。n個の原子軌道からn個の分子軌道を得ることができ、変分法などを用いて線形結合係数を決定することができる。つの原子軌道によって形成される分子軌道のうち、原子軌道よりもエネルギー準位が低いものを結合軌道、原子軌道よりもエネルギー準位が高いものを反結合軌道、原子軌道にエネルギー準位が近いものを一般に非結合軌道と呼ぶ。
分子軌道理論は、分子の形成、構造、性質などの問題を説明するために用いられる理論である。また、結晶場理論や遷移金属分子軌道理論に基づいて開発された宝石の色の原因の一部を説明することもできる。分子軌道は原子軌道の自然な延長である。したがって、分子内の電子の動きは分子軌道を用いて記述される。
1.分子軌道理論の基本概念
分子軌道理論は、原子が分子を形成した後、電子はもはや結晶場理論が提唱するような元の原子軌道には属さず、特定の分子軌道の中を移動すると仮定している。分子軌道は、原子軌道が原子を構成するのと同様に分子を構成する。価電子はもはや個々の原子内に局在しているとはみなされず、分子全体にわたって移動する。分子内の電子分布は、原子内の電子分布の原理(最小エネルギーの原理とフントの法則)に従って扱うことができる。
分子内の原子軌道の線形結合は分子軌道を形成する。分子軌道の数は、結合前の原子軌道の数に等しい。原子軌道を有効な分子軌道に結合するには、次の3つの原則を守らなければならない:
(1) 対称性一致の原理:同じ対称性を持つ原子軌道のみが分子軌道を形成できる。
(2) エネルギー近接の原理:エネルギーの近い原子軌道のみが結合して有効な分子軌道を形成できる。
(3)最大重なり原理:対称性の一致の下では、原子軌道の重なりが大きいほど、得られる分子軌道のエネルギーは減少し、得られる化学結合はより安定になる。
分子軌道ψは1個の電子の波動関数である。これは原子軌道の線形結合として表すことができ、各軌道は分子電場中を移動する電子の運動エネルギーと位置エネルギーの和である特定のエネルギーに対応する。2つの原子軌道a、bが重なり合った線形結合によって、2つの分子軌道ψI とψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
電子を持つ分子軌道が最初に満たされると、結合軌道ψI が最初に満たされる。電子が等しいエネルギーの分子軌道を満たすとき、フントの法則によれば、電子はできるだけ同じスピン方向の異なる分子軌道も占めるべきである。
分子軌道ψI 2つの原子軌道関数(式3-5)を加算して得られる分子軌道を結合分子軌道と呼ぶ。分子軌道ψII 2つの原子軌道関数(式3-6)を減算して得られる分子軌道は、反結合分子軌道と呼ばれる。結合分子軌道のエネルギーは反結合分子軌道のエネルギーよりも低く、元の2つの原子軌道のエネルギーよりも低い。したがって、原子軌道を満たす場合と同様に、分子軌道を満たす場合も、まず電子を結合軌道に置く。電子が等しいエネルギーの分子軌道を満たすとき、フントの法則によれば、電子はできるだけ同じスピンの向きの異なる分子軌道も占めるべきである。二つのs原子軌道によって形成される分子軌道を図3-25に示す。

p軌道とd軌道は、異なるエネルギー準位の分子軌道を形成することもできる。2 分子は比較的複雑である。
実験では、この2つの単一電子の磁気特性が測定され、分子軌道理論の強力な裏付けとなった。同じ原子から構成される分子とは異なり、2つ以上の異なる原子から構成される分子は、より複雑な分子軌道エネルギー準位を持つが、原理は同じである。
2.電荷移動着色特性
分子全体が電子を共有するこの分子軌道の理論は、電荷移動として知られる、ある原子軌道から別の原子軌道への電子の遷移ともみなされている。電荷移動は、金属-金属(M-M)、非金属-非金属(L-L)、非金属-金属(L-M)の相互作用で起こりうる。その中でもL-L、M-Lこの2種類の結合は主に共有結合であることが多い。O2 はL-L電荷移動に属し、これは共有結合である。
(1) 金属-金属電荷移動(M - M電荷移動)
この種の電荷移動は一般に、一般的な遷移金属イオン間で起こる。着色宝石の着色原因のほとんどは、金属-金属電荷移動によって生成される。M-M電荷移動には主に以下のタイプがある:Fe2+ - フェ3+/フェ3+ - フェ2+ティ3+ - ティ4+ / ティ4+- T3+ フェ2+ - T4+/フェ3+ - T3+Mn2+ - ムン4+/Mn3+ - ムン3+ .金属間の電荷移動は、同核原子間の電荷移動と異核原子間の電荷移動の2種類に分けられる。
等電子原子間の電荷移動
等電子原子間の電荷移動は、異なる酸化状態にある同じ遷移金属元素の2つの原子間で起こる。例えば、Fe2+ およびFe3+ は、異なる酸化還元条件下で電荷移動を起こし、エネルギーを吸収して色を生成する。アイオライトの青紫色は、異なる酸化状態の鉄イオンの電荷移動によって生成される。鉄3+ およびFe2+ はそれぞれ四面体と八面体の位置にあり、2つの配位子がエッジでつながっている。可視光がアイオライトに当たると、Fe2+ はあるエネルギーの光を吸収し、Feに遷移する。3+588nmの黄色い光を吸収して青紫色に発色する。アクアマリンやグリーントルマリンなども、鉄イオン間の電荷移動によって発色することがある。
ヘテロ原子間の電荷移動
ブルーサファイアは、2種類の遷移金属イオン間の電荷移動によって生じる色を最も典型的に例示している。遷移金属イオンの配位多面体は、金属間の電荷移動を促進するエッジまたは面によって接続されている。
例えば、サファイアでは、鉄イオンとチタンイオンが連結した八面体に入ると、FeとTiの両方が2つの酸化状態で存在する:
フェ2+ + プラス・ティ4+ 低エネルギー(3-7)
フェ3+ + プラス・ティ3+ ハイエナジー(3-8)
式(3-7)から式(3-8)に移行するには、一定量の光エネルギーを吸収する必要があり、その結果、黄色から赤色までの幅広い吸収帯が生じる。対照的に、ほとんどの青い光は宝石を通過するため、青く見える。
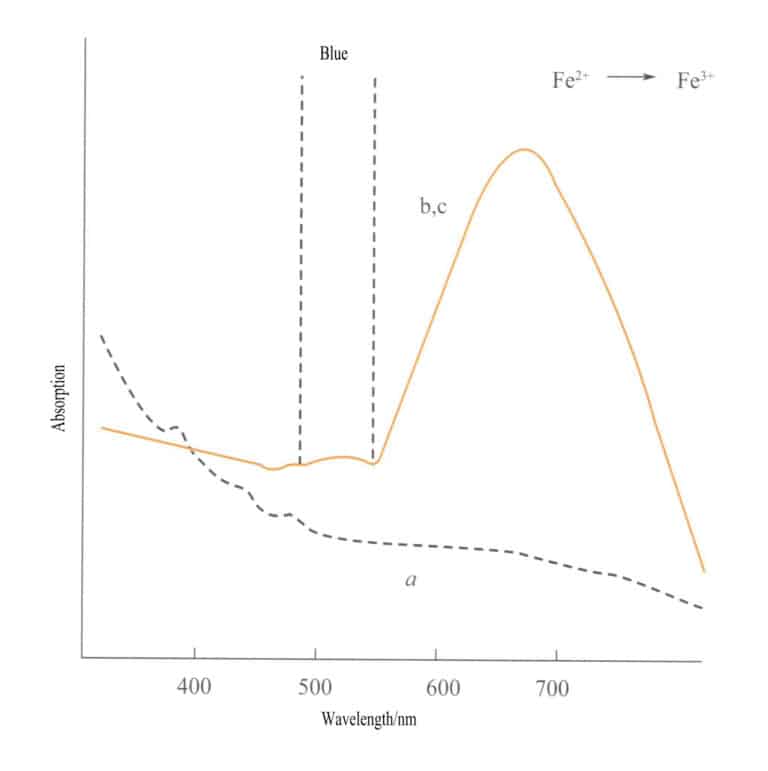
異なる価数状態間の電荷移動には強い方向性があり、このメカニズムによって色を示す宝石は、しばしば多色性を示す。例えば、Fe2+→ 鉄3+ 電荷移動は光軸方向に沿って厳密に色を示す。図3-26は、アクアマリンがb面とc面で黄色に見えることを示している。同時に、a軸方向にはこのような電荷移動がないため、光吸収は起こらず、したがってa軸方向には色がつかない。
(2) 非金属-金属(L-M)電荷移動
この種のL-M電荷移動は、酸素と金属イオンの間でしばしば起こり、酸素を含む宝石の中には、非金属から金属への電荷移動によって着色されるものもある。2-→ 鉄3+, O2- →Cr6+, O2-→ムン6+O →V5+.
単純な鉄酸化物の吸収スペクトル(図3-27)では、イルメナイト、ヘマタイト、レピドクロサイトの赤外領域に2つの弱い吸収帯が現れる(d - d電子遷移)。短波長域には強い吸収帯が現れ、これはO2-→鉄3+ この吸収帯が、これらの化合物の特徴的な色、すなわち赤褐色、褐色、黄褐色を決定している。
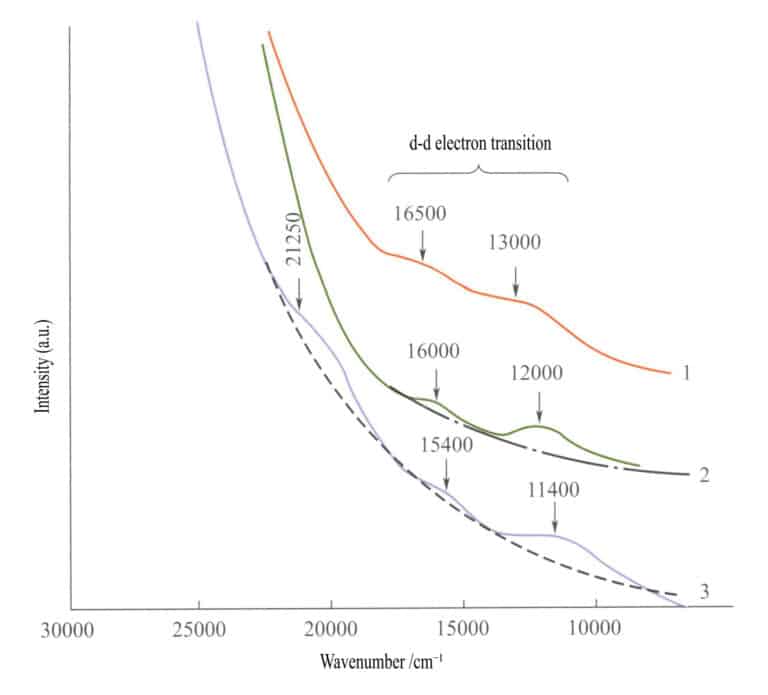
1-イルメナイト; 2-ヘマタイト; 3-レピドクロサイト
イエローベリルの色はO2-→ 鉄3+ 電荷移動。イエローベリルの構造では、O2-→ 鉄3+ 強い電荷移動吸収は紫と青を吸収し、結果として黄色になる。
ベリルとは全く異なる配位環境を持つサファイアも、ベリルと同じスペクトルの吸収帯を生成することができ、その結果、黄色になるが、これもO2-→ 鉄3+ 電荷移動。
結晶場理論によれば、宝石鉱物の中には不対電子を含まず、色を発しないものがある。例えば、クロコアイトの電子層(PbCrO4)、鉛2+Cr6+とO2- は満杯である。それでも、CrO42- 原子団は「分子軌道」であり、これはO2-→Cr6+ 吸収バンドを形成し、オレンジ色を呈する。
L→M 電荷移動には、一般的な黄鉄鉱のように、硫黄から金属への移動も含まれる。この移動によって引き起こされる光学現象は、バンド理論を使って議論すると理解しやすい。
(3) 非金属-非金属(L-L)電荷移動
分子軌道理論によると、ラピスラズリの深い青色はS3- 原子グループ。
グラファイトでは、6個の炭素原子の環が層状に並んでいる。この層に沿って電子がある程度自由に移動できるため、強い光吸収、異方性、導電性が生じる。
琥珀や真珠のようないくつかの有機宝石は、共有された分子軌道で有機顔料の原子団を移動し励起する電子を持ち、可視光の吸収を引き起こし、色を作り出す。例えば、琥珀の "蜂蜜の黄色"、珊瑚の色、そしていくつかの貝と色のついた真珠。
一般的な宝石の色のメカニズムを表3-12に示す。
表3-12 一般的な宝石の色のメカニズムの分類
| 金属-金属の電荷移動 | フェ2+ - フェ3+ /フェ3+ - フェ2+ アイオライト(青)、ベルティエライト(青)、マグネタイト(黒)など。 |
| フェ2+ -ティ4+/フェ3+ - ティ3+ :カイヤナイト(青)、サファイア(青) | |
| ムン2+-ムン4+/Mn3+-ムン3+: マンガン鉱(黒)、ビックスバイト(黒) | |
| 非金属から金属への電荷移動 | O2- -フェ3+:ゴールデンイエローベリル、ゴールデンイエローサファイア、イルメナイト、ヘマタイト、レピドクロサイトなど。 |
| O2- - Cr6+:クロコアイト(オレンジ) | |
| O2- -V5+バナディナイト(オレンジ) | |
| 硫黄から金属:黄鉄鉱、マルカサイトなど(ギャップのある半導体を参照) | |
| 非金属-非金属電荷移動 | S3-:ラピスラズリ(青) |
| Π電子:グラファイト(黒) | |
| 琥珀や珊瑚のような有機宝石の色。 |
コピーライト @ Sobling.Jewelry - ジュエリー カスタムジュエリーメーカー、OEMおよびODMジュエリー工場
セクション III エネルギーバンド理論
エネルギーバンド理論は、宝石材料を研究するための量子力学的モデルであり、分子軌道理論をさらに拡張・発展させたものである。エネルギーバンド理論の研究は、いくつかの天然着色宝石の色のメカニズムをよりよく説明することができます。
1.エネルギーバンド理論の基本概念
エネルギーバンド理論とは、固体中の電子運動の法則を研究するために用いられる近似理論である。固体は原子核と最外殻電子を含む原子で構成されており、そのすべてが一定の運動状態にある。バンド理論では、固体中の電子は特定の原子に束縛されているのではなく、結晶全体で共有されており、結晶の3次元空間の周期的なポテンシャル場内で運動すると仮定している。電子の運動範囲は格子の周期的ポテンシャル場内にあり、電子軌道の空間分布は分子のそれを超え、最大に達することができる。個々の電子のエネルギー準位はエネルギーバンドに広がっている。
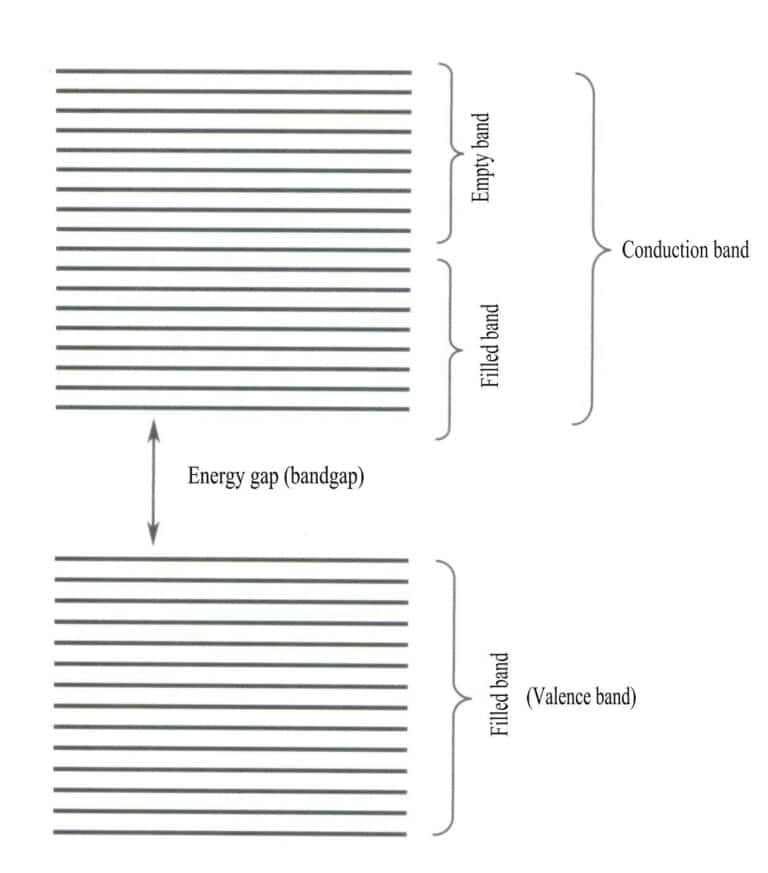
バンド理論では主に、すべての価電子が固体格子全体に属するべき非局所状態間の電子遷移について議論する。バンド理論によると、固体物質は原子軌道が満たされているかどうかに基づいて、異なるエネルギーバンドに分けることができる。満たされているバンドは、電子によって完全に占有されている原子軌道のエネルギー準位によって形成され、低エネルギーバンドを表し、空のバンドは、電子によって完全に占有されていないエネルギー準位によって形成され、高エネルギーバンドを表す。この2種類のバンド間のエネルギー差は「バンドギャップ」と呼ばれる(図3-28)。
物質のすべてのエネルギーバンドが満たされている場合、それは不導体であり、部分的に電子で満たされている場合、それは導体である。格子欠陥は、結晶に追加のエネルギー準位を導入し、電子がこれらのエネルギー準位に入ることを可能にする。
2.バンドギャップ遷移の特徴
宝石鉱物の中には、ダイヤモンドやモアッサナイトのように、主に共有結合で結合する周期表第IV族Aの元素を含むものがある。また、硫化カドミウム(CdS)のように、バンド理論で色が説明できる鉱物もある。
電子は光のエネルギーを吸収して価電子帯と伝導帯の間を移動し、"内部バンド遷移 "を形成する。遷移の起こりやすさは、価電子帯と伝導帯のエネルギー差と密接に関係しており、バンドギャップエネルギー(Eg図3-29)。

図3-29(a)は典型的な半導体のバンド図です。結晶のバンドギャップエネルギーの大きさから、ワイドバンドギャップ、ナローバンドギャップ、ミディアムバンドギャップの3種類に分けられます。ワイドバンドギャップは、バンドギャップエネルギーが可視光のエネルギーより大きいもので、バンドギャップエネルギーが可視光のエネルギーを超えると、可視光は吸収されずに完全に透過し、鉱物は無色になります。例えば、ダイヤモンドのバンドギャップエネルギーEg は約5.5eVで無色である。
バンドギャップの狭い物質のバンドギャップエネルギーは可視光のそれよりも小さいため、可視光はすべて吸収され、暗い灰緑色や黒色になる。例えば、ガレナのバンドギャップエネルギーはEg 0.4eV未満で、鉛の灰色に見える。この「ナローバンドギャップ半導体」が適切な幾何学的形状になると、整流と増幅の特性を示す。
中バンドギャップ物質のエネルギーは、まさに可視光域にあり、宝石鉱物は様々な色を示す。その色の並びは図3-29(c)に示すように、赤-黄色から緑-青-紫に至る。例えば、バンドギャップエネルギー(Eg硫化カドミウム(CdS)のバンドギャップエネルギーは約2.5eVで、青と紫の光を吸収するため黄色に見える。辰砂のバンドギャップエネルギーは約2eVで、赤色光のみを通すため赤色に見える。オルピメントのバンドギャップエネルギーは約2.5eVで、黄色に見える。
バンド理論によって説明される天然宝石の鉱物のもう一つのカテゴリーは、不純物を含むワイドバンドギャップ物質の色である。例えば、不純物を含むダイヤモンドの場合、ダイヤモンドのバンドギャップエネルギーはEg約5.5eVであり、可視光線はダイヤモンドを通過しても吸収されない。純粋なダイヤモンドは無色であるが、不純物を含むと状況は変わる。
(1) イエローダイヤモンドの色のメカニズム
窒素原子は炭素原子の位置を置き換える。窒素原子は炭素原子よりも電子が1つ多いため、この余分な電子はバンドギャップ内にドナーエネルギー準位と呼ばれる不純物エネルギー準位を形成し、窒素原子は "ドナー "として働く。
この不純物準位が存在すると、バンドギャップのエネルギーが4eVに低下する[[図3-30(a)]。不純物準位が存在すると、バンドギャップのエネルギーは4eV[図3-30 (a)]に低下し、さらに低いエネルギーになると、紫外線とわずかな3eVの紫外線を吸収し、ダイヤモンドが黄色く見えるようになります。
この効果は強力で、炭素原子10万個に対して窒素原子1個を持つことで、ダイヤモンドを濃い黄色にすることができる。しかし、バンドギャップの減少は、ダイヤモンドを室温で導電性にするにはまだ不十分である。
(2) ブルーダイヤモンドの色のメカニズム
ホウ素は炭素より電子が1個少ないので、ダイヤモンドのバンドギャップに「アクセプター準位」を形成する。ボロンは余分な電子を持たないが、ダイヤモンドの価電子帯から電子を受け取ることができ、価電子帯に正孔を作り[図3-30 (b)]、アクセプター準位として知られる価電子帯の約0.4eV上の不純物エネルギー帯を形成する。

アクセプターのエネルギー準位は単純ではなく、不純物のエネルギーバンドが複雑に絡み合って青色を生み出す構造になっている。アクセプターエネルギー準位は価電子帯に「正孔」を作り、この「正孔」タイプII bブルーダイヤモンドが電気を通すことを可能にする。
100万個の炭素原子のうち1個のホウ素原子が青色を形成する。この青いダイヤモンドにはアルミニウムが多く含まれ、アルミニウムは炭素よりも外層の電子が1つ少ないため、以前はアルミニウムがアクセプターの役割を果たすと考えられていた。しかし、現在の実験では、アルミニウムではなくホウ素であることが証明されている。
タイプII b導電性ブルーダイヤモンドは、天然のブルーダイヤモンドであり、その導電性は、照射されたブルーダイヤモンド(カラーセンター)との違いの一つです。この特性は、2つのタイプのダイヤモンドを区別するためによく使用されます。しかし、イエローの窒素ドナーダイヤモンドは電気を通さないため、この方法では照射済みのイエローダイヤモンドと区別することはできません。
3.バンド遷移によって着色された宝石鉱物
エネルギーバンド理論は、天然宝石の色形成の一部を説明することができる。バンドギャップエネルギーは結晶固有の性質であり、外的条件によって変化することはないため、宝石の色は安定性に優れている。結晶の導電性は、結晶中のエネルギーバンドが電子で満たされているかどうかで判断できる。表3-13に、バンド理論で説明できる宝石の色の種類とその導電性の特性を示します。
表3-13 バンド理論で説明される宝石の色の種類とその導電率
| 導体(金属色と金属光沢) | エレメント | 銅、金、鉄、銀、水銀など |
| 合金 | アマルガム、隕鉄ニッケル鉄 | |
| 半導体 | 狭いバンドギャップ | 不透明灰色~黒色:アルタイト、ガレナ |
| 不透明なメタリック色:コバルト、マーカサイト、パイライト、スマルタイト | ||
| 中程度のバンドギャップ | 赤:辰砂、プルースタイト、ピラーギライト | |
| オレンジリアルガー | ||
| 黄色:硫化カドミウム、レアルガー、硫黄 | ||
| ワイドバンドギャップ | 無色:ダイヤモンド、閃亜鉛鉱 | |
| 不純物含有ワイドバンドギャップ半導体 | ドナー不純物:窒素ドープダイヤモンド(黄色) | |
| ホスト中の不純物:ホウ素含有ダイヤモンド(青色) |
バンド遷移によって引き起こされる宝石の色は、宝石の形成時の構造と結合の種類に関連しています。後の不純物や結晶欠陥とはほとんど関係がない。宝石のバンドギャップエネルギーの大きさは固定されている。そのため、従来の最適化方法では一般的に宝石の色を改善することはできません。
セクション IV 物理的光学効果
ほとんどの天然宝石は、光の選択的吸収を引き起こす可能性があり、異なる宝石は、異なる波長で可視光を吸収し、その結果、異なる色になります。選択的光吸収に加えて、宝石の結晶の内部構造はまた、宝石の異なる色につながる物理的な光学効果を引き起こすことができます。
1.物理的光学効果に関連する宝石鉱物
物理光学効果によって生み出される色は、結晶構造や組成、内包物に起因する光の分散、干渉、回折、その他の理由によって形成される。これは物理光学理論で説明できる光学効果に過ぎません。同じ光学的効果でも、宝石が違えば異なる色を発します。色の原因となる一般的な微量元素に加えて、物理的な光学効果によって生成された色の理由は、主に宝石の内部構造と物理的性質に関連しています。物理光学効果によって発色する宝石の鉱物の種類を表3-14に示す。
表3-14 物理的光学効果による宝石鉱物の種類
| 機能 | 光学特性と色 | 宝石鉱物 |
|---|---|---|
| 分散 散乱 | きらめく | 「ダイヤモンド、ジルコン、ルチル、チタン酸ストロンチウムなどの分散型宝石の「火 |
| ブルー | ムーンストーン、ブルークォーツ、オパール | |
| パープル | 蛍石(カルシウムの微結晶の散乱) | |
| レッド | ルビーガラス、銅または金の微結晶の散乱 | |
| ホワイト | ミルキークォーツ | |
| キャッツアイ効果 | キャッツアイ・アクアマリン、キャッツアイ輝石など。 | |
| スターライト効果 | コランダムとガーネットの様々なスター効果 | |
| 光沢 | 真珠、アポフィライトなどの光沢。 | |
| スパークル | アベンチュリン、黒曜石などの輝き。 | |
| 干渉回折 | 薄膜の純粋なスペクトルカラー | 黄銅鉱の虹、虹彩石英の亀裂の変色膜 |
| 妨害効果 | オパールの色変わり、ラブラドライトの効果 | |
| インクルージョン | ブルー | 石英中のデュモルチエライト |
| グリーン | グリーンカルセドニーとニッケル鉱脈、フューサイト・イン・スタークォーツ | |
| オレンジ | ファイアー・オパールとフレッシュ・カラー・カルセドニーに含まれる水和酸化鉄 | |
| レッド | 斜長石中のヘマタイト薄片 |
2.干渉と回折効果
(1) 干渉効果
干渉現象は、2つの光線が同じ光路を伝搬するとき、あるいは平行な方向に伝搬するときに起こる。宝石における一般的な干渉現象は虹色である。例えば、虹色の石英では、干渉色は膜の厚さ、膜の屈折率、入射光の性質に依存する。
真珠の干渉色は、屈折率の異なる2つの物質(アラゴナイトとナクラム)が同心円状に交互に重なり合うことで形成され、入射光は交互に重なる層の間の表面で反射し、その反射光が入射光と干渉して美しい干渉色を生み出す。
(2) 回折効果
回折とは、光波が障害物にぶつかると、本来の直線的な伝播から外れる物理現象を指す。物理学では、光波がスリットや小さな穴、円盤などの障害物を通過する際に、さまざまな角度で曲がったり散乱したりする。光源と観察スクリーンの間に障害物があると、観察スクリーンに明るい部分と暗い部分が現れ、その境界は鋭くなく、明暗の複雑なパターンが形成される。この現象を回折という。このような現象は、光波が伝搬経路上で障害物に遭遇するたびに発生する。回折現象を発生させる最も重要な要因は、宝石鉱物に周期的な間隔を置いた回折格子が存在することである。
オパール・カラー・チェンジ
オパールでは、水を含むシリカ球が等しい直径を持ち、規則的な交互積層構造に配置され、周期的な間隔の回折格子を形成している。オパールに光が入ると回折が起こり、色が変化する(図3-31、3-32)。色の種類と変化の度合いは、主に積層されたシリカ球の面間隔に依存する。

例えば、面心立方平板構造を持ち、格子間隔が3×10であるオパール。-10mは緑から赤までの色を示す。このタイプのオパールは格子間隔が2.5×10-10mは青から黄色までの色を示す。
ラブラドライト効果
ラブラドライトもオパールに似た効果を示す(図3-33)。ラブラドライトは、太陽のカラフルな光で点滅することから、スペクトロライトとも呼ばれる。フィンランド産の様々な種類のラブラドライトは、"ラブラドライト効果 "として知られる、様々なスペクトル色を示すことができる。ラブラドライトの色変化効果は、組成の異なる斜長石の小さな層間融解によるものである。異なる長石間のわずかな屈折率の違いが光の干渉と回折を引き起こし、発光と色の変化をもたらす。この構造が生み出す色は、層の相対的な厚さと屈折率に関係している。メキシコ産のアンドラダイトにも回折現象が見られることがある。

3.散乱と介在物
(1) 散乱
散乱は一般的に、宝石の内部構造が不規則であったり、成分のサイズが回折条件の限界を超えている場合に発生する。散乱によって生じる色彩効果は、宝石材料の粒子サイズと形状に関係する。入射光が可視光の波長よりも小さい不規則に配列された粒子と相互作用する場合、透過する高エネルギーの光波は低エネルギーの光波よりも強く、ほとんどの場合、紫色と青色しか見えないことを意味する。例えば、SiO2 オパールに含まれる小さな球の直径は可視光の波長よりも小さく、散乱粒子の大きさが可視光の波長に近い場合、散乱色も発生する。
例えば、紫色の蛍石は、放射線の照射によってフッ素原子が放出され、フッ素原子と結合したカルシウム原子が可視光の波長に匹敵する大きさの六角形の板に凝縮することによって生じる。カルシウム板と光波の相互作用によって散乱が生じる。一部の光波を吸収し、緑から赤の光領域に強い吸収ピークを作り、紫色の光を透過させて紫色を発色させる。
同じ大きさの金属元素の粒子は同じような色の効果を生み出し、異なる金属粒子は異なる色を生み出すことができるため、この性質を利用して模造宝石が製造されることもある。
例えば、「ルビー」ガラスは、ガラスに銅や金の粒子を添加することで製造され、ルビーに似た赤色を呈する。宝石の素材に、可視光の波長よりも大きなインクルージョン、マイクロクラック、気泡が含まれていると、光波がこれらの散乱粒子と相互作用して散乱光波が再結合し、半透明の乳白色の光が生じる。例えば、ある種のムーンストーンの模造品。
ムーンストーンの月光効果も光の散乱によって生じる(図3-34)。ムーンストーンはアルカリ長石で、カリウムに富む長石とナトリウムに富む長石が交互に平行な層をなして形成される複合体である。層間の厚さは通常50~1000nmで、より薄い層でも散乱を生じることができる。同じ散乱色は斜長石にも見られ、"ラブラドライト効果 "として知られている。
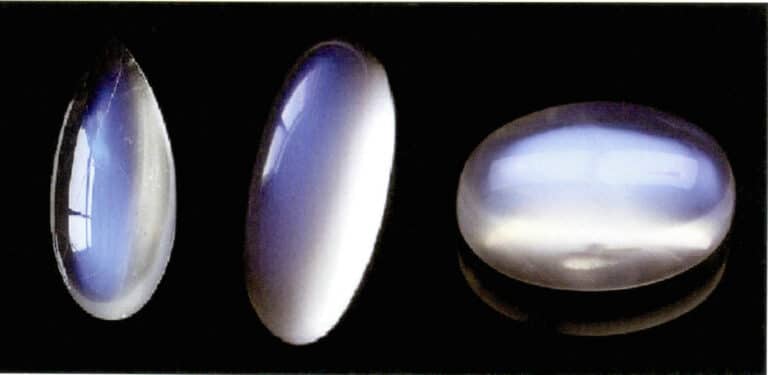
散乱粒子を特殊な方向に配列することで、特徴的な光学効果を生み出すことができる。例えば、散乱粒子が平行な繊維状である場合、スターサファイアやクォーツキャッツアイのようなキャッツアイ効果やスター効果を生み出す。散乱粒子が肉眼で識別できるほど大きい場合、サンストーン(図3-35)やゴールドストーンガラスなどの「ゴールドストーン効果」を生み出すことができる。

(2) 含有物
内包物によって生じる色と光学現象は、特殊な散乱の一種である。ほぼ無色の主結晶に埋め込まれた色を持つ介在物は、ニッケルを含むバンドカルセドニーや水を含む酸化鉄(II)(FeO - H)のように、介在物の色を呈します。2マダガスカル産のオルソクレースや一部のコーディエライトの色は、赤色を作り出すヘマタイトの少し大きめで、まだ微小なインクルージョンによって形成される。
ダイヤモンドは、多くのインクルージョン(内包物)が存在するために、しばしば異なる色を示す。内包物によって着色されたダイヤモンドは、黒色、橙赤色、褐赤色となる。強い透過光で観察すると、多くの暗いインクルージョンが観察され、ダイヤモンドは濃い灰色に見えます。別のタイプは、ダイヤモンドのクラックに発生する二次的なインクルージョンです。クラックが発達し、これらの色のインクルージョンで満たされると、ダイヤモンドは褐色またはオレンジ色に見え、これは「酸化」ダイヤモンドとしても知られています。
4.分散
物体を透過した白色光がさまざまな分光色に分解される現象を「分散」という。宝石の分散とは、光が透明な宝石の傾斜面を通過する際に、異なる波長の分光色に分散する性質を指す。白色光を構成する単色光の波長は、物質によって伝播速度や屈折率が異なるため、白色光は特定の条件下で様々な分光色に分解される。宝石の分散値の大きさは、その宝石の物理的性質によって決まります。それぞれの宝石には固有の分散値があり、宝石の性質によって変化することはありません。ダイヤモンドの独特の魅力は、その高い分散値(0.044)と密接な関係があります。
ジルコンの分散値は0.039、合成モアッサナイトの分散値は0.104である。ダイヤモンドと一般的な模造宝石の分散値の比較を表3-15に示す。
表3-15 ダイヤモンドと一般的な模造宝石の分散値の比較
| 宝石名 | 分散値 |
|---|---|
| ダイヤモンド | 0.044 |
| ジルコン | 0.039 |
| コランダム | 0.018 |
| スピネル | 0.020 |
| トパーズ | 0.014 |
| ベリル | 0.014 |
| クリスタル | 0.014 |
| 合成ルチル | 0.280 |
| 合成チタン酸ストロンチウム | 0.190 |
| 合成モアッサナイト | 0.104 |
分散は一般的に宝石の「ファイヤー」と呼ばれています。例えば、ダイヤモンドは分散値が高く、そのファイアは非常に顕著で、ダイヤモンドのすでに王室的な地位を高め、そのユニークな魅力を披露しています。
物理的な光学効果によって生み出される色には多くの種類があり、そのすべては物理光学理論によって説明することができる。宝石自体の固有の性質である分散を除けば、他の現象は宝石形成後の構造変化や機械的内包物の違いによって引き起こされる。宝石の色の様々な原因を理解することは、天然宝石や合成宝石の処理を最適化するための理論的基礎を提供します。












