Erforschen Sie reines Silber und Silberlegierungen, die für Schmuck verwendet werden
Ein umfassender Leitfaden zu den Eigenschaften und Merkmalen von reinem Silber und Silberlegierungen
Silber hat einen verführerischen weißen Glanz, eine hohe chemische Beständigkeit und einen ästhetischen Sammlerwert, weshalb es bei den Menschen (insbesondere bei Frauen) sehr beliebt ist und den Titel "das Metall der Frauen" verdient hat. Es wird häufig für Schmuck, Dekorationsartikel, Tafelsilber, Tafelgeschirr, Glückwunschgeschenke, Medaillen und Gedenkmünzen verwendet. Silberschmuck hat einen großen Markt in den Entwicklungsländern, und Silbergeschirr ist bei Familien sehr beliebt. Silber-Gedenkmünzen sind exquisit gestaltet, werden in begrenzter Stückzahl ausgegeben und haben die Funktion, den Wert zu erhalten und zu steigern, was sie bei Münzsammlern und Anlegern sehr begehrt macht.

Inhaltsübersicht
Abschnitt Ⅰ Grundlegende Eigenschaften von Silber
1. Physikalische Eigenschaften von Silber
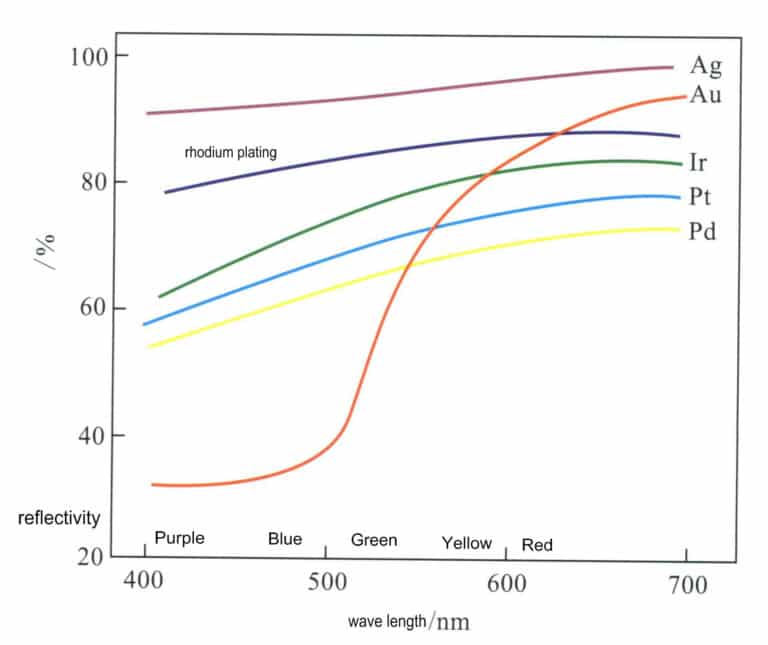
Silber ist ein Element der Gruppe IB der 5. Periode des Periodensystems, mit dem Elementsymbol Ag, der Ordnungszahl 47 und der relativen Atommasse 107,870. Silber hat ein sehr hohes Reflexionsvermögen für sichtbares Licht, das mit 92%-96% im Wellenlängenbereich von 380-780 nm das höchste aller metallischen Elemente ist und deutlich über dem anderer Edelmetallelemente liegt (Abbildung 4-1). Daher erscheint Silber hell
Die wichtigsten physikalischen Eigenschaften von Silber sind in Tabelle 4-1 aufgeführt. Bei Raumtemperatur beträgt die Dichte von Silber 10,49 g/cm3und mit zunehmender Temperatur nimmt die Dichte von Silber ab und sinkt auf 9,35 g/cm3 kurz bevor es schmilzt. Silber ist unter allen Metallen der beste Strom- und Wärmeleiter, was den 3D-Druck und das Laserschweißen erschwert, da die lokal aufgebrachte Wärme schnell in die Umgebung geleitet wird und sich die Wärme nur schwer konzentrieren lässt.
Tabelle 4-1 Physikalische Haupteigenschaften und Indexwerte von Silber
| Physikalische Eigenschaften | Index-Werte | Physikalische Eigenschaften | Index-Werte |
|---|---|---|---|
| Farbkoordinaten | L* = 95,8, a* =-0,7, b* = 5,3 | Linearer Ausdehnungskoeffizient (0-100℃) | 19.2 x 10-6/℃ |
| Dichte (20℃) | 10,49 g/cm3 | Widerstandswert (25℃) | 1.59 x 10-6Ω⸳cm |
| Schmelzpunkt | 961.78 | Spezifische Wärmekapazität (25℃) | 25,41 J/(mol⸳K) |
| Siedepunkt | 2177 | Schmelzwärme | 11,30 kJ/mol |
| Dampfdruck ( Schmelzen ) | 0,38 Pa | Wärme der Verdampfung | 284,6 kJ/mol |
| Wärmeleitfähigkeit (25℃) | 433 W/(m⸳K) | Debye-Temperatur ϴd | 215 K |
| Temperaturleitfähigkeit (0℃) | 1.75 m2/s | Magnetische Suszeptibilität | -0.15 x 10-6 cm3/g |
2. Chemische Eigenschaften von Silber
Die chemischen Eigenschaften von Silber sind nicht reaktiv, und seine chemische Stabilität ist besser als die von Metallen wie Eisen und Kupfer. Bei Raumtemperatur reagiert es nicht mit Sauerstoff, Wasserstoff, Inertgasen und organischen Gasen, und auch bei hohen Temperaturen reagiert es nicht mit Wasserstoff oder Inertgasen, was es anfällig für Korrosion und Verfärbung macht.
Silber hat eine starke Affinität zu Schwefel, und in Atmosphären, die schädliche Stoffe wie H2S, SO2COS (Carbonylsulfid), und in wässrigen Lösungen, die Sulfide enthalten, ist es korrosionsanfällig und bildet unlösliches schwarzes Ag2S-Verbindungen auf seiner Oberfläche, und das Korrosionsverhalten weist meist elektrochemische Eigenschaften auf. Wird Silber an der Luft belassen, bildet seine Oberfläche allmählich schwarzes Ag2S, wodurch Schmuck stumpf wird und sich verfärbt. Diese Eigenschaft von Silber beeinträchtigt seinen Wert als Edelmetall erheblich. Ag2S kann sich in metallisches Silber und SO2 bei Erwärmung an der Luft.
Bei Raumtemperatur löst sich Silber in Salpetersäure und konzentrierter Schwefelsäure, ist aber in Salzsäure und verdünnter Schwefelsäure unlöslich. Beim Erhitzen löst es sich in Salzsäure, Schwefelsäure, Salpetersäure und Königswasser. Wie Gold reagiert auch Silber leicht mit Königswasser und gesättigten Chlorsäuren; Silber bildet einen AgCl-Niederschlag, der zur Trennung von Gold und Silber verwendet werden kann.
Wie Gold weist auch Silber eine gute Korrosionsbeständigkeit in Laugen und geschmolzenen Alkalimetallen auf, weshalb es häufig als Tiegelmaterial für geschmolzenes NaOH und KOH verwendet wird.
Bei Raumtemperatur verbindet sich Silber nur langsam mit Halogenen, unter Wärmeeinwirkung kann Silber jedoch sehr schnell mit Halogenen zu Silberhalogeniden reagieren. Silber löst sich in bestimmten Komplexbildnern, die mit Luft gesättigt sind (z. B. Cyanide von Alkalimetallen der Gruppe ⅠA und Erdalkalimetalle der Gruppe ⅡA, sauerstoffhaltige Cyanidlösungen und saure Fe3+ -haltige Thioharnstofflösungen), die stabile Komplexe bilden (Tabelle 4-2).
Tabelle 4-2 Verhalten von Silber in verschiedenen korrosiven Medien
| Ätzende Medien | Mittlerer Zustand | Temperatur | Der Grad der Korrosion von Silber | |||
|---|---|---|---|---|---|---|
| Ätzende Medien | Mittlerer Zustand | Temperatur | Fast keine Korrosion | Leichte Korrosion | Mäßige Korrosion | Starke Korrosion |
| Schwefelsäure | 98% | 18℃ | Ja | |||
| Schwefelsäure | 98% | 100℃ | Ja | |||
| Salpetersäure | 0,1 mol/L | Raumtemperatur | Ja | |||
| Salpetersäure | 70% | Raumtemperatur | Ja | |||
| Salpetersäure | Rauch (>90%) | Raumtemperatur | Ja | |||
| Chlorwasserstoffsäure | 36% | 18℃ | Ja | |||
| Chlorwasserstoffsäure | 36% | 100℃ | Ja | |||
| Fluorwasserstoffsäure | 40% | Raumtemperatur | Ja | |||
| Königswasser | 75%HCl + 25%HNO3 | Raumtemperatur | Ja | |||
| Schwefelwasserstoff | Luftfeuchtigkeit | Raumtemperatur | Ja | |||
| Phosphorsäure | > 90% | Raumtemperatur-100℃ | Ja | |||
| Chlor | Trockenes Chlor | Raumtemperatur | Ja | |||
| Chlor | Nasses Chlor | Raumtemperatur | Ja | |||
| Zitronensäure | Raumtemperatur-100℃ | Ja | ||||
| Quecksilber | Raumtemperatur | Ja | ||||
| Eisen(I II)-chlorid-Lösung | Raumtemperatur | Ja | ||||
| Natriumhydroxidlösung | Raumtemperatur | Ja | ||||
| Ammoniaklösung | Raumtemperatur | Ja | ||||
| Kaliumcyanidlösung | Raumtemperatur ~ 100℃ | Ja | ||||
| Geschmolzenes Natriumhydroxid | 350℃ | Ja | ||||
| Geschmolzenes Natriumperoxid | 350℃ | Ja | ||||
| Geschmolzenes Natriumsulfat | 350℃ | Ja | ||||
Silber kann mit verschiedenen Stoffen Verbindungen eingehen und liegt in diesen Verbindungen in Form von einwertigen Ionen vor, z. B. AgNO3, Ag2O, AgCl, AgBr, AgCN, Ag2SO4, usw. AgNO3 wird in der Regel als Hauptsalz für die cyanidfreie Versilberung verwendet und ist eine Quelle für Silberionen. Silbernitratlösung enthält eine große Anzahl von Silberionen, wodurch sie stark oxidativ ist, sich unter Lichteinwirkung leicht zersetzt, Eiweißgerinnung verursachen kann und gewisse ätzende Wirkungen auf die Haut hat, weshalb sie in braunen Flaschen gelagert werden sollte. Ag2O ist ein schwarz-braunes Pulver mit geringer thermischer Stabilität, das sich beim Erhitzen in Silber und Sauerstoff zersetzt. AgCl ist unlöslich in Wasser, aber leicht löslich in KCN, NaCN und anderen Substanzen. In verdünnter Schwefelsäure suspendiertes AgCl kann durch negativ geladene Metalle wie Zink, Eisen usw. leicht zu Silber reduziert werden, und diese einfache Methode ist für die Raffination von Silber weit verbreitet.
Die Eigenschaften von AgBr ähneln denen von AgCl, es löst sich in Ammoniumsalzen, Thiosulfaten, Sulfiten und Cyanidlösungen und kann leicht zu metallischem Silber reduziert werden. Die lichtempfindlichen Eigenschaften der Silberhalogenide sind die wichtigsten Merkmale; unter Lichteinwirkung zerfallen sie in Silber und freie Halogene. Diese Eigenschaft der Silberhalogenide wird zur Herstellung von Fotofilmen, Fotopapier und sensibilisierten Membranen genutzt.
3. Mechanische Eigenschaften
Die wichtigsten mechanischen Eigenschaften von reinem Silber sind in Tabelle 4-3 aufgeführt. Reines Silber ist sehr weich, hat eine gute Duktilität und Formbarkeit, die nur von Gold übertroffen wird. Es kann in dünne Bleche gepresst und zu feinen Drähten gezogen werden; 1 Gramm Silber kann zu einem 1800 m langen Draht gezogen und zu einer Folie mit einer Dicke von 10 μm gewalzt werden. Wenn Silber jedoch geringe Mengen an Verunreinigungen wie Sb, Bi und Pb enthält, wird es spröde, und die Duktilität nimmt deutlich ab, wobei der Effekt von Pb am stärksten ausgeprägt ist.
Tabelle 4-3 zeigt die wichtigsten mechanischen Eigenschaften von geglühtem Reinsilber.
| Mechanische Eigenschaften | Index-Werte | Mechanische Eigenschaften | Index-Werte |
|---|---|---|---|
| Brinell-Härte HB/N/mm2 | 25 | Schrumpfungsrate im Querschnitt /% | 80 ~ 95 |
| Zugfestigkeit /MPa | 140 ~ 160 | Elastizitätsmodul E/GPa | 82 |
| Streckgrenze /MPa | 20 ~ 25 | Schermodul G/GPa | 28 |
| Dehnungsrate /% | 40 ~ 50 | Elastizitätsmodul B/GPa | 101.8 |
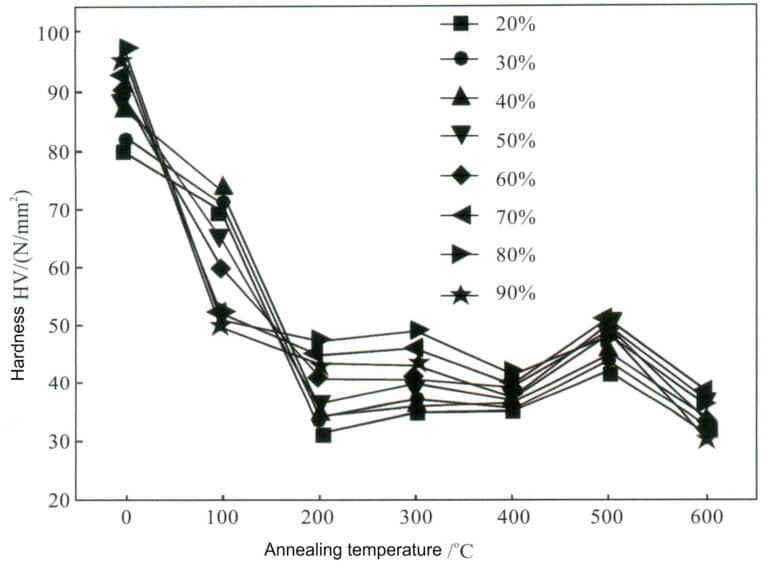
Reines Silber kann durch Kaltverformung verfestigt werden Abbildung 4-2. Die Verarbeitungsgeschwindigkeit beeinflusst die mechanischen Eigenschaften von Silber. Die erste Verarbeitungsrate von geglühtem Reinsilber kann 99% erreichen. Mit zunehmender Verarbeitungsrate steigen die Härte, die Zugfestigkeit und die Streckgrenze von Silber, während die Dehnungsrate rasch abnimmt und die Kaltverfestigung zunächst schnell und dann langsam verläuft. Aufgrund der geringen Stapelfehlerenergie von reinem Silber ist der Effekt der Kaltverfestigung jedoch nicht signifikant, und die Festigkeit und Härte bleiben nach der Verarbeitung sehr gering, was es schwierig macht, die Festigkeitsanforderungen für die Schmuckherstellung zu erfüllen.
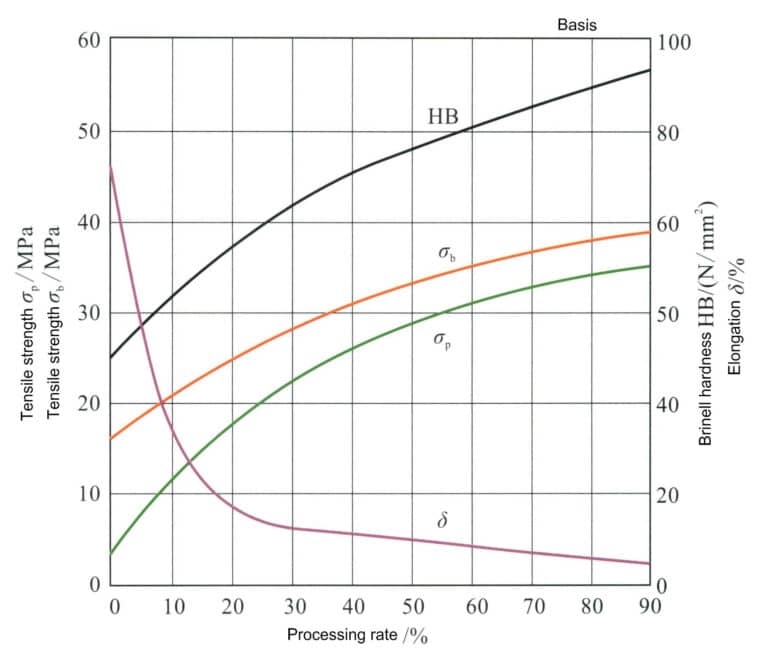
Die niedrige Stapelfehlerenergie von reinem Silber bedeutet, dass seine Kaltverfestigungswirkung nicht signifikant ist und die Festigkeit und Härte nach der Verarbeitung sehr niedrig bleiben, was es schwierig macht, die Festigkeitsanforderungen für die Schmuckherstellung zu erfüllen. Die mechanischen Eigenschaften von Silber im verarbeiteten, gehärteten Zustand ändern sich nach einer Glühbehandlung rasch. Mit zunehmender Glühtemperatur nimmt die Härte von reinem Silber bei verschiedenen Verarbeitungsgeschwindigkeiten allmählich ab, aber die Abnahmerate muss gleichmäßiger sein. Bei einer Verarbeitungsgeschwindigkeit von unter 50% nimmt die Härte bei einer Glühtemperatur von 200℃ am schnellsten ab; bei einer Verarbeitungsgeschwindigkeit von über 70% nimmt die Härte bei einer Glühtemperatur von 100℃ am schnellsten ab (Abbildung 4-3).
Eine weitere Eigenschaft von reinem Silber im verarbeiteten Zustand ist, dass es zu einer "natürlichen Alterungserweichung" neigt, was bedeutet, dass die Festigkeit und Härte des verarbeiteten Profils oder Produkts während der natürlichen Lagerung allmählich abnimmt, was für das Tragen von Schmuck ungünstig ist. Die Erweichung von reinem Silber während der natürlichen Alterung wird in Wirklichkeit durch die Erholung oder sogar die Bildung von rekristallisierten Strukturen verursacht. Untersuchungen zeigen, dass die Veränderung der Festigkeit von reinem Silber nach einer Kaltverformung mit der Materialreinheit, dem Ausmaß der Verformung, der Alterungstemperatur und der Einlagerungszeit zusammenhängt. Polykristallines Reinsilber kann sogar bei Temperaturen unter 20 °C eine natürliche Alterungserweichung erfahren; die Erweichungsrate hängt von der Verformung und dem Gehalt an Verunreinigungen im Reinsilber ab. Auch das Ausmaß der Verformung bei der Verarbeitung wirkt sich stark auf die Alterungserweichung aus. Silber mit einer Reinheit von 99,999% beginnt zu erweichen, nachdem es um 99% verformt und 10 Stunden lang bei 20℃ gehalten wurde, während es nach einer Verformung von 50% 100 Stunden lang bei 20℃ gehalten werden kann, bevor es zu erweichen beginnt.
4. Prozessleistung
Silber hat einen relativ niedrigen Schmelzpunkt und kann durch Flammenerwärmung, Induktionserwärmung und Widerstandserwärmung geschmolzen werden. Beim Schmelzen von Silber kommt es jedoch häufig zu einem Phänomen, das als "Silberregen" bezeichnet wird und durch Metallspritzer gekennzeichnet ist, was zu erheblichen Verlusten führt. Beim Schmelzen von Silber in einer Umgebung mit schlechten atmosphärischen oder Vakuumbedingungen ist die Flüchtigkeit von Silber relativ hoch, und sie ist in einer oxidierenden Atmosphäre noch höher als in einer reduzierenden Atmosphäre.
Silber ist anfällig für die Bildung von Porositäten während des Gießens, und das Prinzip ihrer Bildung hängt eng mit den Eigenschaften von Silber zusammen. Nach der Theorie der Porenbildung beim Gießen liegt der Hauptgrund für die Entstehung von Poren darin, dass während des Erstarrungsprozesses die Gaslöslichkeit in der Metallschmelze mit sinkender Temperatur abnimmt, was zu Gasübersättigung, Ausfällung und Blasenbildung führt, die nicht rechtzeitig ausgestoßen werden, wodurch Poren entstehen. Die Poren in Silbergussstücken hängen mit dem vom geschmolzenen Metall absorbierten Sauerstoff zusammen. Aus dem binären Phasendiagramm Ag-O (Abbildung 4-4) geht hervor, dass die Erstarrung der sauerstoffgesättigten Silberschmelze bei etwa 951℃ unterhalb des Silberschmelzpunkts (961,78℃) beginnt und bei etwa 931℃ abgeschlossen ist.
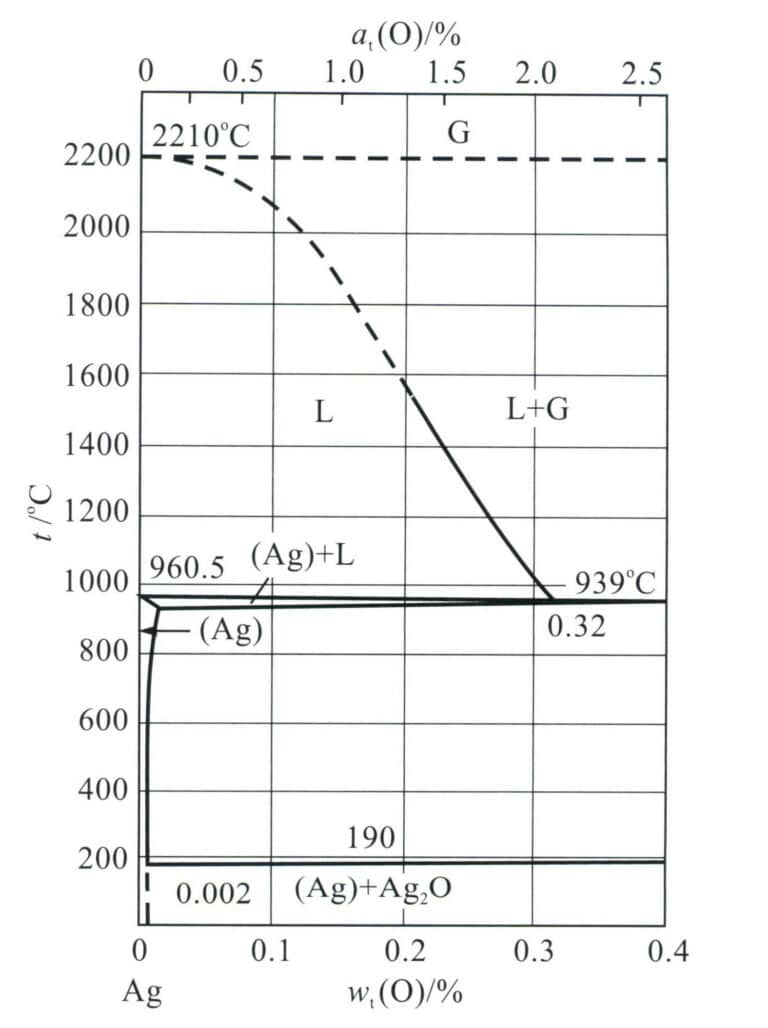
Anmerkung: G steht für die Gasphase; (Ag) +L steht für die fest-flüssig Zweiphasenregion,
wobei (Ag) für die feste Lösung auf Silberbasis und L für die flüssige Phase steht.
Tabelle 4-4 zeigt die Löslichkeit von Sauerstoff, der in Form von Atomen in Silber in einer Sauerstoffatmosphäre bei 1 atm gelöst ist. Die Löslichkeit von Sauerstoff in geschmolzenem Silber kurz über dem Schmelzpunkt ist am höchsten, etwa 3200 x 10-6und erreicht das 21-fache seines eigenen Volumens. Mit zunehmender Temperatur steigt der Überhitzungsgrad der Silberflüssigkeit und die Löslichkeit des Sauerstoffs nimmt ab.
Wenn die Silberflüssigkeit erstarrt, nimmt die Löslichkeit von Sauerstoff in festem Silber deutlich ab. Die Löslichkeit von Sauerstoff in festem Silber erreicht bei 931℃ ihr Maximum, etwa 60 x10-6. Mit sinkender Temperatur nimmt die Löslichkeit von Sauerstoff in festem Silber rasch ab, und bei Raumtemperatur kann Silber kaum noch Sauerstoff aufnehmen. Die Löslichkeit von Sauerstoff hängt nicht nur von der Temperatur, sondern auch vom Partialdruck des Sauerstoffs ab. Wenn der Sauerstoffpartialdruck steigt, nimmt die Löslichkeit zu, und auch die Reaktion zwischen Silber und Sauerstoff ändert sich.
Tabelle 4-4 zeigt die Löslichkeit von Sauerstoff in Silber in einer Sauerstoffatmosphäre bei 1 Atmosphäre.
| Temperatur /℃ | Temperatur /℃ | 200 | 400 | 600 | 800 | 973 | 1024 | 1075 | 1125 |
|---|---|---|---|---|---|---|---|---|---|
| Sauerstoffgehalt | x10-6 | 0.03 | 1.4 | 10.6 | 38.1 | 3050 | 2950 | 2770 | 2640 |
| Sauerstoffgehalt | mm3/g | - | - | - | - | 2135 | 2056 | 1939 | 1849 |
Während der Erstarrung werden die in der Silberflüssigkeit gelösten Stoffe wie O, N und H an die Fest-Flüssig-Grenzfläche verdrängt. Sobald ihre Sättigungslöslichkeit überschritten ist, werden sie freigesetzt. Die Bildung von Gasporen besteht aus zwei Phasen: Keimbildung und Wachstum. Die Keimbildung muss die kombinierten Auswirkungen des atmosphärischen Drucks, des statischen Drucks des Metalls und des zusätzlichen Drucks aufgrund der Oberflächenspannung überwinden. Erst wenn der Druck des auszuscheidenden Gases den Gesamtwert der äußeren Drücke übersteigt, kann sich ein Blasenkern bilden. Die Blase wächst weiter, und wenn sie groß genug ist, erhöht sich der auf sie wirkende Auftrieb, so dass sie aufsteigt und sich ablöst. Wenn der Benetzungswinkel der Blase mit der Oberfläche der festen Phase ϴ> 90 ist, kann sie sich leicht ablösen; wenn ϴ< 90 ist, kann sie sich nicht leicht ablösen. Wenn die Wachstumsrate der Dendriten während der Erstarrung größer ist als die Steiggeschwindigkeit, schließen die wachsenden Dendriten die Blasen vollständig ein und bilden Gasporen.
Silber hat eine weiche Textur und eignet sich daher gut für handgefertigten Schmuck. In der traditionellen Silberschmuckherstellung wird reines Silber in großem Umfang zur Herstellung von filigranem und gewebtem Schmuck verwendet, wobei häufig Techniken wie Hämmern und Gravieren eingesetzt werden, um dekorative Muster auf der Oberfläche des Schmucks zu erzeugen. In der modernen Schmuckherstellung sind Kaltverarbeitungstechniken wie Walzen, Ziehen, Stanzen und hydraulisches Pressen ebenfalls weit verbreitet, um Silberschmuck zu verarbeiten, wobei die hervorragende Duktilität von reinem Silber genutzt wird. Techniken wie Schleudern, Tiefziehen und Tiefprägen werden häufig zur Herstellung von Silberschalen, Silberbechern und anderem Kunsthandwerk verwendet.
Abschnitt II Die Reinheit und Klassifizierung von Silberschmuck
1. Reinheitskennzeichnung von Silberschmuck
Bei Silberschmuck wird der Feingehalt durch eine Kombination aus dem Tausendstel Feingehalt und Silber, Ag oder S angegeben (S ist die Abkürzung für Silber im Englischen). Zum Beispiel kann Silberschmuck mit einem Gehalt von 92,5% mit einem Reinheitsetikett wie 925 Silber, 925Ag, 925 S oder 925 gekennzeichnet werden. Bei Silberschmuck mit einem Reinheitsgrad von mindestens 99% wird das Reinheitsetikett als Feinsilber, 990 Silber, 990 Ag oder S 990 gekennzeichnet. Das im Handel übliche Tausendstel Silber (mit einem Silbergehalt von mindestens 99,9%) wird einheitlich als reines Silber gekennzeichnet.
2. Klassifizierung von Silberschmuck Reinheit
Silber wird häufig für die Herstellung von Schmuck, Kunsthandwerk und anderen dekorativen Gegenständen verwendet. Je nach Reinheit des Silbers kann es in hochreines Schmucksilber und normales Schmucksilber unterteilt werden.
2.1 Hochreines Schmucksilber
Wie der Name schon sagt, handelt es sich bei hochreinem Schmucksilber um Silber mit einem hohen Reinheitsgrad, das weiter unterteilt werden kann in:
(1) Reines Silber.
Theoretisch sollte der Silbergehalt 100% betragen. Doch so wie "Gold nicht völlig rein ist", ist es auch Silber nicht. Selbst mit dem heutigen wissenschaftlichen und technologischen Stand ist es sehr schwierig, Silber mit einem Reinheitsgrad von 100% zu schmelzen, und man kann sich diesem Reinheitswert nur annähernd nähern. Reines Silber wird auch als "Feinsilber" bezeichnet und hat seinen Namen von den einzigartigen Mustern, die sich während des Schmelz-, Raffinierungs- und Kondensierungsprozesses auf der Oberfläche bilden. In Bezug auf Schmuckmaterialien ist ein übermäßiges Streben nach dem Reinheitsgrad von Silber weder notwendig noch praktisch. Daher wird Silber mit einem Reinheitsgrad von mindestens 99,6% in der Industrie allgemein als Feinsilber eingestuft. Silber mit einem Gehalt von nicht weniger als 99,9% wird als reines Silber bezeichnet.
(2) 990 Feinsilber.
Der Silbergehalt muss mindestens 990‰ betragen. 990 Feinsilber wurde in der Vergangenheit häufig als Standardsilber für den Umlauf und den Handel verwendet. Es kann als Sicherheit für Immobilien, als Silberdeckung von Firmenkonsortien und als Tauschmittel verwendet werden.
Reines Silber und 990er Silber sind von höherer Qualität und haben eine weichere Textur. Sie werden im Allgemeinen nur für unverzierten Silberschmuck verwendet, wobei Silberschmuck im traditionellen Stil am häufigsten vorkommt.
2.2 Gewöhnlich reines Schmucksilber
Gewöhnlich reines Schmucksilber wird durch Zugabe einer geringen Menge anderer Metalle zu reinem Silber oder Sterlingsilber hergestellt, was zu einer härteren Struktur des Silbers führt. Diese Arten von Silber basieren in der Regel auf Ag-Cu-Legierungen, da die physikalischen und chemischen Eigenschaften von Kupfer denen von Silber ähneln, wodurch Farbsilber Zähigkeit und gute Duktilität erhalten kann. Außerdem können einige Legierungselemente die stumpf machende Wirkung von Luft auf Silberschmuck bis zu einem gewissen Grad unterdrücken. Daher ist der Oberflächenglanz vieler farbiger Silberschmuckstücke im Vergleich zu reinem Silber und Sterlingsilber weniger anfällig für Veränderungen. Gewöhnlich reines Schmucksilber umfasst hauptsächlich die folgenden Kategorien:
(1) 980 Silber.
Gibt einen Silbergehalt von 98% an, mit einer Feingehaltsangabe von 980 S. Dieses gefärbte Silber ist etwas härter als reines Silber und Sterlingsilber und wird meist zur Herstellung von wertbeständigem Schmuck verwendet.
(2) 958 Silber.
Es hat einen Silbergehalt von 95,8%, die zweite Standard-Silberschmucklegierung im England des 12. Jahrhunderts, bekannt als Britannia-Silber. Es hat eine geringere Härte und ist nicht für die Fassung von Edelsteinen geeignet.
(3) 925er Silber.
Bezeichnet einen Silbergehalt von 92,5%, bekannt als "Sterlingsilber", wenn nur Cu als Legierungselement verwendet wird. Dies ist die erste Standard-Silberlegierung für Schmuck im England des 12. Jahrhunderts, die auch heute noch verwendet wird und auf eine über 800-jährige Geschichte zurückblicken kann und weltweit akzeptiert und verwendet wird. Dieses Silber hat eine gewisse Härte und Zähigkeit, wodurch es sich für die Herstellung von Ringen, Halsketten, Broschen, Haarnadeln und anderem Schmuck eignet und sich gut zum Fassen von Edelsteinen eignet.
(4) 900 Silber.
Der Silbergehalt beträgt 90%, mit guter Festigkeit und Härte. Ursprünglich wurde es hauptsächlich für die Herstellung von Silbermünzen entwickelt, ist aber auch als Münzsilber bekannt und wird später für die Schmuckherstellung verwendet.
(5) 800 Silber.
Gibt einen Silbergehalt von 80% an; dieses Silber hat eine hohe Härte und gute Elastizität und eignet sich daher für die Herstellung von Handglocken, Kragenspangen und anderen Schmuckstücken.
Es gibt Silbersorten mit geringerem Reinheitsgrad, z. B. 700er Silber, 600er Silber und 500er Silber. Es ist zu beachten, dass die chemischen Eigenschaften von Silber nicht so stabil sind wie die von Gold, insbesondere wenn es der Luft ausgesetzt ist, wodurch es anlaufen und seinen Glanz verlieren kann. Aus diesem Grund hatte Silber bei Edelmetallschmuck schon immer einen geringen Stellenwert und wurde als minderwertiger Edelmetallschmuck eingestuft, der einen geringeren Wert als Platin und Gold hat.
Abschnitt III Die Legierung von reinem Silber und Silber
1. Dekoratives Reinsilber
Die Kultur des traditionellen handgefertigten Silberschmucks hat eine jahrtausendealte Geschichte. Bei traditionellem Silberschmuck werden hauptsächlich handwerkliche Techniken wie Hämmern, Gießen, Filigranisieren und Gravieren angewandt, die weiche und leicht zu formende Materialien erfordern. Daher besteht das Material hauptsächlich aus reinem Silber, und die Formen und Muster zeigen vor allem Ranken, Blumen, glücksverheißende Tiere und Zeichen des Glücks. Diese traditionelle Handwerkskultur ist bis heute überliefert und hat immer noch einen gewissen Markt (Abbildung 4-5).

Schmuckhersteller kaufen im Allgemeinen reine Silberkörner oder reine Silberbarren als Rohmaterial für die Herstellung von Silberschmuck (Abbildung 4-6. Abbildung 4-7).


Um die Qualität von Reinsilberprodukten zu gewährleisten, ist es notwendig, bereits bei der Herkunft der Rohstoffe anzusetzen. Reines Silber wird aufgrund seiner chemischen Zusammensetzung in drei Qualitäten eingeteilt: IC-Ag99.99, IC-Ag99.95 und IC-Ag99.90. Der Industriestandard Silbergranulat" (YS/T 856-2012) legt die Anforderungen an die Spezifikationen von Silbergranulat mit einer Partikelgröße von 1-15 mm fest, und die chemische Zusammensetzung muss den internationalen Standardanforderungen für Silberbarren entsprechen. In der internationalen Norm "Silberbarren" sind die chemische Zusammensetzung und der Gehalt an Verunreinigungen für diese drei Sorten von reinen Silberbarren eindeutig festgelegt (siehe Tabelle 4-5).
Tabelle 4-5 Anforderungen an die chemische Zusammensetzung von Reinsilberbarren
| Klasse | wt (Ag) (≥)% | Gehalt an Verunreinigungen (wt≤)/% | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Klasse | wt (Ag) (≥)% | Cu | Pb | Fe | Sb | Se | Te | Bi | Pd | Verunreinigungen insgesamt |
| IC-Ag99.99 | 99.99 | 0.0025 | 0.001 | 0.001 | 0.001 | 0.0005 | 0.0008 | 0.0008 | 0.001 | 0.01 |
| IC-Ag99.95 | 99.95 | 0.0250 | 0.015 | 0.002 | 0.002 | - | - | 0.001 | - | 0.05 |
| IC-Ag99. 90 | 99.90 | 0.0500 | 0.025 | 0.002 | - | - | - | 0.002 | - | 0.10 |
Wie bereits erwähnt, sind die Festigkeit und die Härte von traditionellem reinem Silberschmuck sehr gering. Selbst bei der Kaltverarbeitung könnte der Grad der Kaltverfestigung höher sein, da Silber ein Metall mit geringer Stapelfehlerenergie ist. Außerdem neigt reines Silber im kaltverfestigten Zustand zu natürlicher Alterungserweichung, wodurch es sich beim täglichen Tragen leicht verformt und abnutzt. Aufgrund seiner geringen Festigkeit eignet es sich auch nicht zum Fassen von Edelsteinen, was die Herstellung von Designs mit dreidimensionaler Wirkung erschwert. Außerdem neigt reines Silber dazu, an der Luft stumpf zu werden und sich zu verfärben.
Um die Unzulänglichkeiten von reinem Silbermaterial zu verbessern, muss es durch Legierung oder spezielle Verarbeitungstechniken so modifiziert werden, dass das modifizierte Material die entsprechenden Farbstandards für Schmuck erfüllt und gleichzeitig eine gute Gesamtleistung in physikalischer, chemischer, mechanischer und verarbeitungstechnischer Hinsicht aufweist.
2. Mikro-legiertes Silber
Die Industrie hat durch Mikrolegierungsverfahren hochreines Silber entwickelt, das der natürlichen Alterung, dem Erweichen und dem Stumpfwerden widersteht, oder durch spezielle Verarbeitungstechniken hochharten, hochreinen Silberschmuck geschaffen.
2.1 Mikro-legiertes Silber
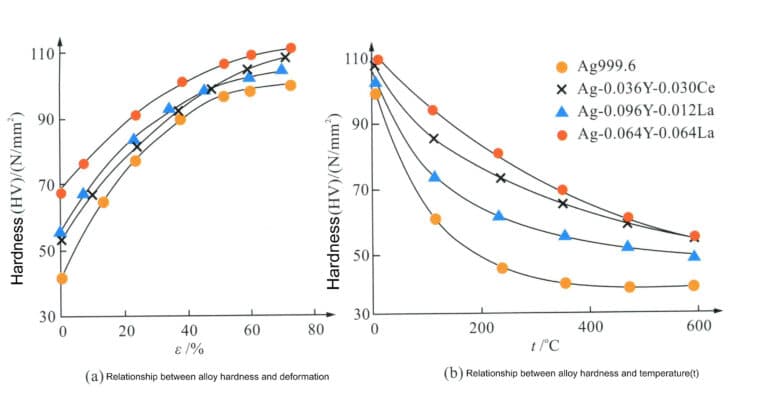
Die Forschung hat herausgefunden, dass die Zugabe von Spurenlegierungselementen zu reinem Silber dessen Festigkeit und Härtungsrate verbessern, den Erholungsprozess bis zu einem gewissen Grad unterdrücken, die Rekristallisationstemperatur erhöhen und die Härtungseigenschaften der Legierung sowie die Widerstandsfähigkeit gegen natürliche Alterungserweichung verbessern kann. Beispielsweise führt die Zugabe von Seltenen Erden (Y, La, Ce) zu reinem Silber mit einem Reinheitsgrad von 99,96% in Mengen von weniger als 0,11% zu einer Silberlöt-Mischkristall-Legierung, die im Vergleich zu reinem Silber eine bessere Korrosionsbeständigkeit und eine höhere Beständigkeit gegen Alterungserweichung aufweist, wodurch sie sich als Material für Silberschmuck eignet (Abbildung 4-8).
In ähnlicher Weise führt die Zugabe von 0,01 % Mn zu gewöhnlichem reinem Silber mit einer Verarbeitungsrate von 97 % zu einer Zugfestigkeit von 340 MPa und einer Härte von HV103 für Mn-mikrolegiertes reines Silber, das 365 Tage lang bei 25 % stabil bleiben kann, während gewöhnliches reines Silber in weniger als 30 Tagen zu seiner Festigkeit und Härte vor der Verformung zurückkehrt, wobei seine Festigkeit und Härte im Wesentlichen auf das Niveau vor der Verformung zurückgeführt werden (Abbildung 4-9). Die Zugabe von Mn kann die Körnung von Silber effektiv verfeinern, die Anzahl der Korngrenzen erhöhen, die Verformungsbeständigkeit verbessern und eine Rolle bei der Stärkung und Stabilisierung der mechanischen Eigenschaften spielen.
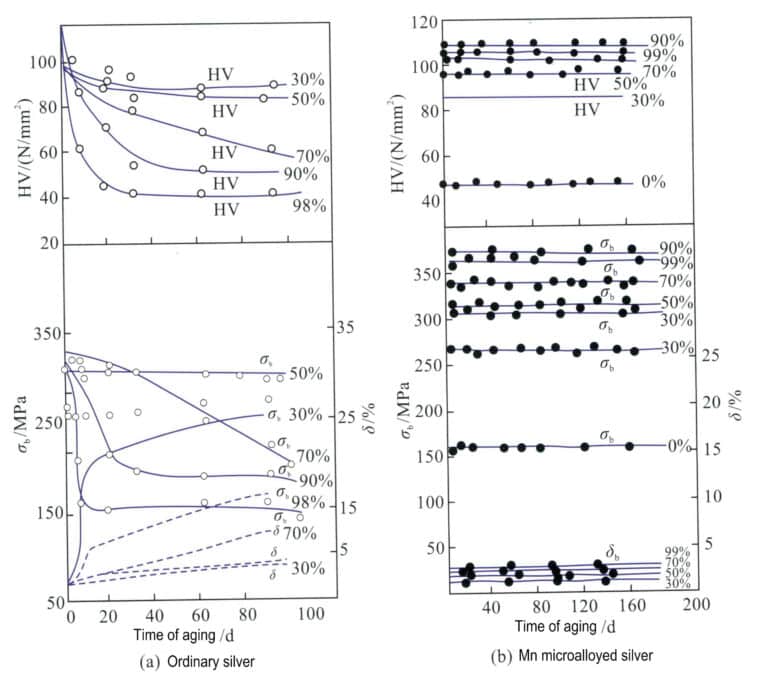
σb. Zugfestigkeit; δ. Dehnung; HV. Mikro-Vickers-Härte; Normales Reinsilber; Mn mikrolegiertes Reinsilber
2.2 Galvanisch geformtes hartes Sterlingsilber
Das Elektroforming-Verfahren für Hartsilber 999 ist eine Technik zur Herstellung von Schmuck, die auf dem Prinzip der elektrochemischen Abscheidung beruht. Durch die Verbesserung der Formulierung der Galvanoforming-Lösung und von Parametern wie pH-Wert, Arbeitstemperatur, Gehalt an organischen Aufhellern und Rührgeschwindigkeit wird die innere Struktur des Silbers verbessert, so dass eine dichte, nanokristallähnliche Struktur entsteht, die die Festigkeit und Härte des Silbers deutlich erhöht. Dies stellt einen Durchbruch und eine Innovation bei traditionellem Sterlingsilberschmuck dar.
Der Silbergehalt von elektrogeformtem 999er Hartsilber liegt bei mindestens 99,9% und entspricht damit dem Qualitätsstandard für 999er Silber, aber seine Härte ist mehr als dreimal so hoch wie die von gewöhnlichem 999er Silberschmuck. Seine Härte ist mit der von 925er Silber vergleichbar, was die Verformungs- und Verschleißfestigkeit von reinem Silberschmuck erheblich verbessert und die Anforderungen für Edelsteineinlagen erfüllt. Außerdem ist das Volumen des Schmucks aufgrund des hohlen Innenraums viermal so groß wie das von gewöhnlichem reinem Silberschmuck bei gleichem Gewicht, was die Schaffung dreidimensionaler und lebendiger Formen ermöglicht. Das Produkt hat einen guten dreidimensionalen Effekt und zeichnet sich durch die Kombination von Reinsilberqualität, 925er Silberhärte und traditionellem Silberschmuck mit 1/3 Gewicht aus (Abbildung 4-10).

3. Silberlegierungssysteme für Schmuck
Die Festigkeit von mikrolegiertem Silber hängt weitgehend von der Kaltverformungshärtung ab. Sobald Schmuckstücke jedoch bei Prozessen wie Schweißen und Polieren Hitze ausgesetzt werden, nimmt ihre Härte schnell ab, was es schwierig macht, die Produktions- und Nutzungsanforderungen zu erfüllen. Daher ist die angemessene Verringerung des Feingehalts von Silber durch Legieren, um eine Silberlegierung mit guter Gesamtleistung zu erhalten, der wichtigste Ansatz auf dem Silberschmuckmarkt, wobei Silberlegierungen mit einem Gehalt von 92,5% am häufigsten verwendet werden. Theoretisch können alle Elemente, die sich in Silber auflösen können, eine verstärkende Wirkung haben, aber der Grad der Verstärkung variiert zwischen den verschiedenen Legierungselementen. Außerdem neigen viele Elemente dazu, sich an den Korngrenzen des Silbers zu entmischen. Bei der Mikrolegierung zur Verstärkung von Silber ist die zugesetzte Menge sehr gering und kann als nützliches Legierungselement dienen. Sobald ihr Gehalt jedoch die Löslichkeitsgrenze überschreitet, kann dies zur Versprödung des Silbers führen. Zu den üblicherweise verwendeten Legierungselementen für Silberlegierungen gehören hauptsächlich Cu, Zn, Pd, Pt, Sn, In, Si, Ge und andere.
3.1 Ag-Cu-Legierung
Das Phasendiagramm der binären Legierung Ag-Cu ist in Abbildung 4-11 dargestellt. Die Ag-Cu-Legierung ist eine eutektische Legierung mit einem Kupfergehalt am eutektischen Punkt von 28,1%, der bei 779℃ liegt. Die maximale Löslichkeit von Kupfer in Silber beträgt 8,8%. Innerhalb dieses Bereichs sinkt der Schmelzpunkt der Legierung mit zunehmendem Kupfergehalt, bis er die eutektische Temperatur der Legierung erreicht. Daher verbessert die Zugabe von Kupfer zu Silber die Gießleistung. Nach der Erstarrung bildet die Ag-Cu-Legierung nicht mischbare silber- und kupferreiche Mischkristalle, was die Festigkeit der Legierung deutlich erhöht. Eine Alterungsbehandlung der Mischkristalllegierung bei niedrigen Temperaturen kann eine weitere Ausscheidungshärtung bewirken. So kann Kupfer einen spürbaren Verstärkungseffekt bei Silber bewirken und dessen Rekristallisationstemperatur erhöhen.
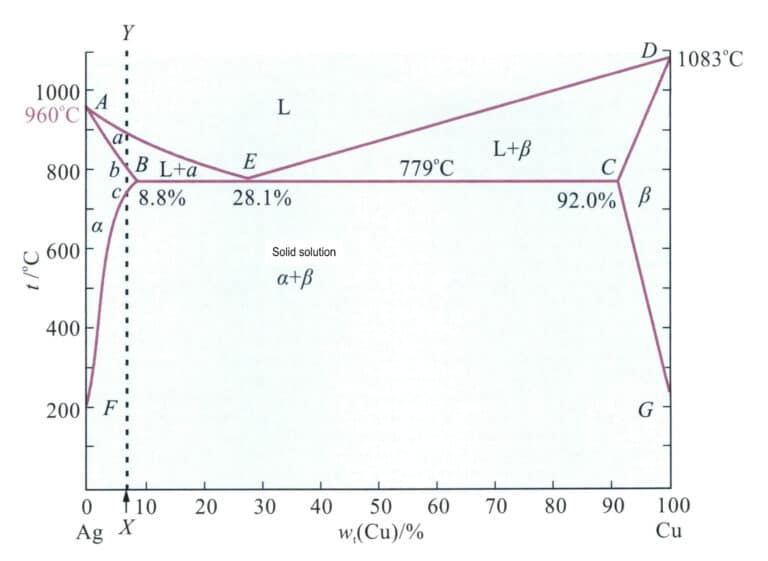
Anmerkung: 960℃ ist der Schmelzpunkt von reinem Silber; 1083℃ ist der Schmelzpunkt von reinem Kupfer; 8,8% ist die maximale Löslichkeit von Kupfer in Silber; 28,1% ist der Kupfergehalt am eutektischen Punkt; 779℃ ist die eutektische Temperatur; 92.0% gibt an, dass die maximale Löslichkeit von Silber in Kupfer 100%-92,0% = 8,0% beträgt; Punkt A Punkt E stellt die Liquiduslinie dar; a ist der Silber-Mischkristall; 0 ist der Kupfer-Mischkristall; G stellt die Temperatur dar, bei der die Löslichkeit von Silber in Kupfer unter Gleichgewichtsbedingungen auf 0 abfällt.
Die wichtigsten mechanischen Eigenschaften der Legierung sind in Tabelle 4-6 aufgeführt. Mit steigendem Cu-Gehalt verbessern sich die Festigkeit und die Härte der Ag-Cu-Legierung, während die Dehnung entsprechend abnimmt.
Tabelle 4-6 zeigt die wichtigsten mechanischen Eigenschaften der Ag-Cu-Legierung.
| Legierungsgrad | Härte HB/(N/mm2) | Zugfestigkeit/MPa | Dehnung/% | |||
|---|---|---|---|---|---|---|
| Legierungsgrad | Annea führte Staat | Verarbeiteter Zustand | Geglühter Zustand | Verarbeiteter Zustand | Annea führte Staat | Verarbeiteter Zustand |
| 95%Ag-5%Cu | 50 | 119 | 240 | 450 | 43 | 5 |
| 92,5%Ag-7,5%Cu | 57 | 118 | 260 | 470 | 41 | 4 |
| 90%Ag-10%Cu | 64 | 125 | 270 | 450 | 35 | 4 |
| 87,5%Ag-12,5%Cu | 70 | 127 | 260 | - | 38 | 4 |
| 80%Ag-20%Cu | 79 | 134 | 310 | 500 | 35 | 4 |
| 75%Ag-25%Cu | 82 | 135 | 320 | 540 | 33 | 4 |
Nach der Zugabe von Cu zu Silber hat dessen Farbe eine gewisse Auswirkung. Mit zunehmendem Cu-Gehalt nimmt das Reflexionsvermögen der Ag-Cu-Legierung für sichtbares Licht allmählich ab (Abbildung 4-12), und die Farbe der Legierung ändert sich allmählich von silberweiß zu hellrosa, rosa und sogar rot.
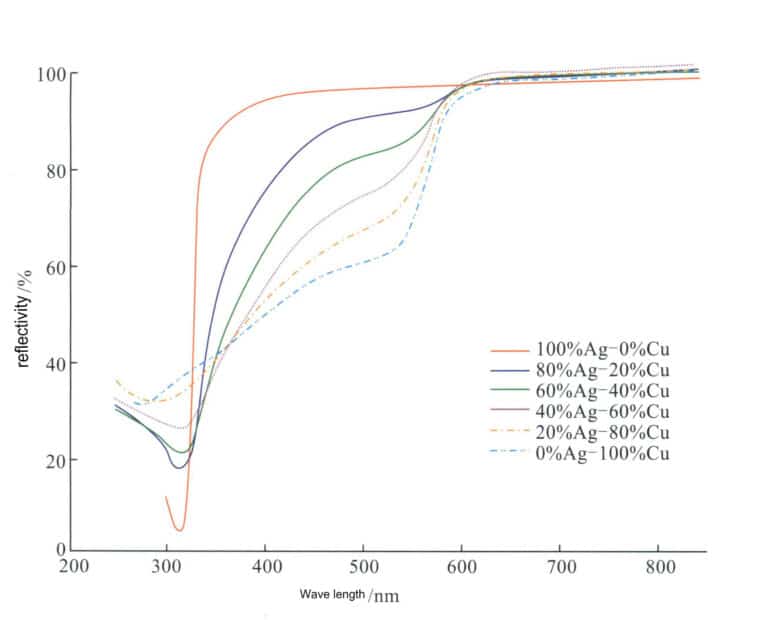
Cu ist das am häufigsten verwendete Legierungselement in Ag, und die traditionelle Silberfarbe ist eine binäre Legierung mit Cu als Legierungselement, mit den Hauptqualitäten 980 Silber, 925 Silber, 900 Silber und 800 Silber. Die derzeit auf dem Markt erhältlichen Silberlegierungen basieren ebenfalls auf der Ag-Cu-Legierung als Grundlegende Legierung. Kupfer kann zwar die Festigkeit, die Härte und die Gießfähigkeit von Silber verbessern, nicht aber die Beständigkeit gegen Nachdunkeln und Verfärben. Außerdem kommt es aufgrund der Zweiphasenstruktur der Legierung in korrosiven Umgebungen zu einem Korrosionsmikrobatterieeffekt, wodurch die Korrosionsbeständigkeit schlechter ist als bei einem einphasigen Silbermischkristall.
3.2 Ag-Pd-Legierung
Die Forschung zeigt, dass die Beimischung einer bestimmten Menge von Edelmetallen zu Silber dessen Beständigkeit gegen Nachdunkeln und Verfärben wirksam verbessert. Pd ist das bevorzugte Edelmetallelement von Silber, und Abbildung 4-13 zeigt das Phasendiagramm der binären Legierung Ag-Pd.
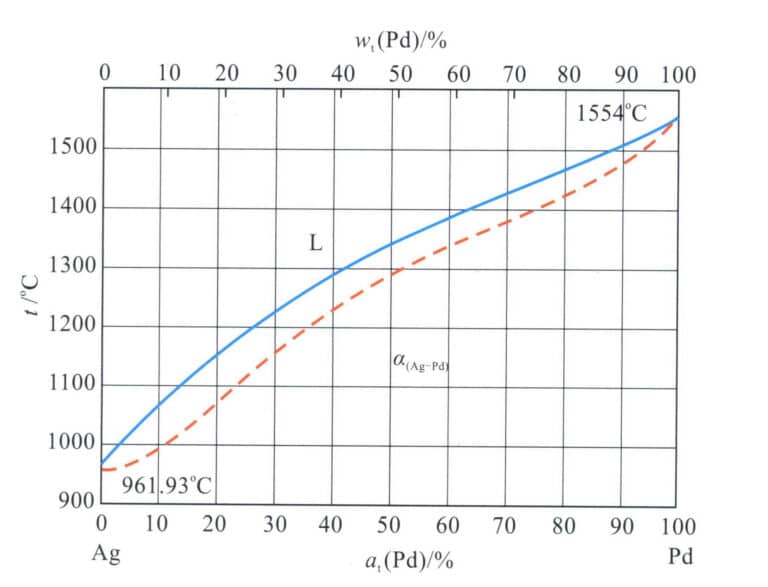
Die Legierung ist in flüssiger und fester Phase unbegrenzt löslich und bildet eine kontinuierliche feste Lösung. Daher ist die verstärkende Wirkung von Palladium auf Silber im Allgemeinen bescheiden, wie in Tabelle 4-7 dargestellt. Die Kaltverformung kann die Festigkeit und Härte der Legierung bis zu einem gewissen Grad verbessern. Sie kann jedoch die Festigkeitsanforderungen für eingebetteten Schmuck nicht vollständig erfüllen, so dass die Zugabe anderer Legierungselemente zur weiteren Verstärkung erforderlich ist.
Tabelle 4-7 Haupteigenschaften der geglühten Legierung
| Legierungsgrad | Schmelztemperatur /℃ | Dichte /(g/cm3) | Härte HV/(N/mm)2) | Zugfestigkeit /MPa | Wärmeleitfähigkeit /[W/(cm⸳K)] |
|---|---|---|---|---|---|
| 95%Ag - 5%Pd | 980 ~ 1020 | 10.5 | 28 | 170 | 2.20 |
| 90%Ag - 10%Pd | 1000 ~ 1060 | 10.6 | 35 | 210 | 1.42 |
| 80%Ag - 20%Pd | 1070 ~ 1150 | 10.7 | 45 | 260 | 0.92 |
Palladium verbessert wirksam die Widerstandsfähigkeit des Silbers gegen das Anlaufen durch Sulfide. Mit steigendem Palladiumgehalt nimmt die Neigung des Silbers zum Anlaufen und Verfärben durch Sulfide deutlich ab. Allerdings erhöht sich der Schmelzpunkt der Legierung, das Kristallisationsintervall vergrößert sich ebenfalls, und Palladium neigt zur Gasabsorption während des Schmelzens, was die Schwierigkeiten beim Schmelzen und Gießen erhöht und ein Schmelzen unter Vakuum oder Schutzgas erfordert.
Aufgrund des kontinuierlichen Anstiegs des Palladiumpreises erhöht der Zusatz von Palladium die Kosten von Silberlegierungen erheblich. Daher ist die Verwendung von Palladium in Silber in den letzten Jahren stark zurückgegangen, und die bestehenden Verwendungen beruhen hauptsächlich auf geringen Zusätzen.
Copywrite @ Sobling.Jewelry - Hersteller von kundenspezifischem Schmuck, OEM- und ODM-Schmuckfabrik
Abschnitt IV Sterlingsilber und seine Modifikationen
Sterling ist der Name eines deutschen Münzherstellers, der Easterlings, aus dem 12. Jahrhundert. Er brachte während der Herrschaft Heinrichs II. fortschrittliche Techniken zur Herstellung von Silbermünzen und Silberlegierungen nach England und schuf eine Silberlegierung, die aus 92,5 % Ag und 7,5 % Cu bestand. Diese Legierung war weit verbreitet und wurde im England des 12. Jahrhunderts zum ersten Markenzeichen für Silberlegierungen. Zu Ehren dieses Münzherstellers wurde die Legierung Sterlingsilber genannt. Ursprünglich bezog sich Sterlingsilber speziell auf die Legierung 92,5%Ag-7,5%Cu, doch später wurde die Palette der Legierungen erweitert und zu einem allgemeinen Begriff für das gesamte 925er Silber. Seit dem 12. Jahrhundert wird Sterlingsilber in großem Umfang für Tafelsilber und Silberschmuck verwendet, wobei es durchweg als Standardlegierung dient und die älteste dekorative Silberlegierung der Geschichte ist.
1. Merkmale von Sterlingsilber
1.1 Mechanische Eigenschaften
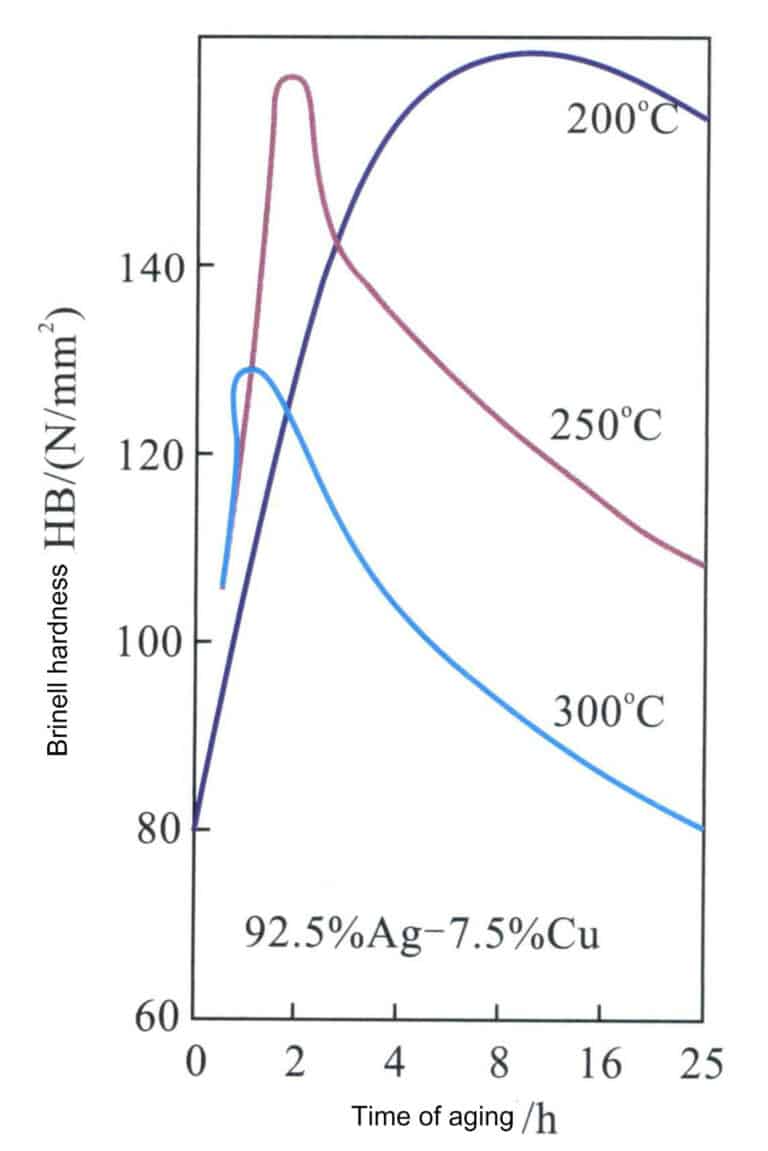
Nach Abbildung 4-11 entspricht die Zusammensetzung der Sterlingsilberlegierung der gestrichelten Linie XY, und die Schnittpunkte mit der Phasengrenze sind A, B, C. Der Bereich von Punkt B bis Punkt C ist ein einziger Mischkristall, und nach langsamer Abkühlung unter Punkt C scheidet sich eine kupferreiche Mischkristallphase aus dem Mischkristall aus. Das Erhitzen von Sterlingsilber auf 800℃ zur Mischkristallbehandlung führt zu einem einzigen Mischkristall, der der Legierung eine ausgezeichnete Duktilität und Verarbeitbarkeit verleihen kann. Tabelle 4-6 zeigt, dass die Festigkeit und die Härte des Mischkristalls in Sterlingsilber deutlich höher sind als die von reinem Silber. Durch Kaltverformung des Sterlingsilbers aus Mischkristall lässt sich eine gute Kaltverfestigung erzielen (Abbildung 4-14).
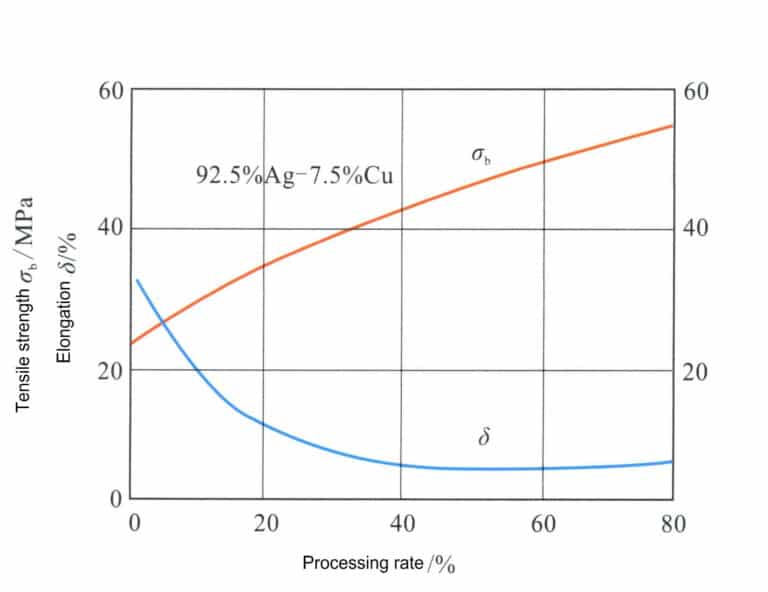
Ein herausragendes Merkmal der Sterlingsilberlegierung ist ihre hervorragende Aushärtung, die durch eine Alterungsbehandlung verändert werden kann (Abbildung 4-15). Der Sterlingsilber-Mischkristall wird einer Alterungsbehandlung bei 200-300℃ unterzogen, und bei einer Alterungstemperatur von 200℃ wird eine Höchsthärte nahe HV160 erreicht, die mit der von 18K-Goldlegierungen vergleichbar ist; es ist jedoch eine längere Alterungszeit erforderlich, um diesen Spitzenwert zu erreichen. Mit zunehmender Alterungstemperatur verkürzt sich die Zeit bis zum Erreichen der Spitzenhärte erheblich, aber auch die Spitzenhärte nimmt entsprechend ab. Wenn die Alterungstemperatur 300℃ erreicht, hat die Wirkung der Alterungshärtung deutlich nachgelassen.
1.2 Merkmale des Gusses
Die Liquidustemperatur von Sterlingsilber beträgt 898℃, und die Legierung hat einen niedrigen Schmelzpunkt, so dass sie sich zum Schmelzen in einem Graphittiegel eignet.
Sterlingsilber absorbiert jedoch im geschmolzenen Zustand eine große Menge Sauerstoff, was beim Schmelzen und Gießen Probleme bereitet. Diese Eigenschaft macht die Legierung anfällig für Verflüchtigung bei hohen Temperaturen oder verursacht erhebliche Verluste während des Hochtemperaturabkühlungsprozesses durch Spritzer. Bei Sterlingsilber kann sich ohne ausreichenden Desoxidationsmittelschutz beim Schmelzen leicht Sauerstoff ansammeln, was zur Oxidation des Kupfers führt, und die Gussstücke sind anfällig für Defekte wie Porosität und oxidierte Einschlüsse. Das oxidierte Kupfer in den Gussstücken kann zwei Arten von Problemen verursachen: (1) das gesamte Gussstück kann oxidierte Kupfereinschlüsse aufweisen, die harte Flecken bilden, wenn sich die Einschlüsse in der Nähe der Oberfläche befinden und auf der polierten Oberfläche hervorstehen; (2) oxidierte Kupfereinschlüsse in der Nähe von Lunkerstellen erscheinen als gesprenkelte wolkige Flecken auf der polierten Oberfläche, die tief sind und sich nur schwer entfernen lassen. Angenommen, die Sterlingsilberschmelze wird stark überhitzt oder über einen längeren Zeitraum nicht geschützt. In diesem Fall oxidiert das Kupfer stark und bildet eine zähflüssige Oberfläche, wodurch die Fließfähigkeit des geschmolzenen Metalls verringert wird, was zu einer unvollständigen Füllung in einigen kleinen Bereichen des Gussstücks und oft zu einer Unterfüllung führt. Die Oberfläche in der Nähe des Gussbereichs erscheint rot. Darüber hinaus ist das Kristallisationsintervall von Sterlingsilber mit bis zu 90℃ relativ groß und weist erhebliche Unterschiede zwischen den Komponenten der flüssigen und der festen Phase auf, die zu einer pastenartigen Erstarrung mit starkem dendritischem Wachstum neigen, während die Fließfähigkeit geringer ist, was zu einer größeren Tendenz zur Schrumpfporosität führt.
Um die Anreicherung von Sauerstoff in der Sterlingsilberschmelze zu verhindern, ist es entscheidend, den Kontakt zwischen dem geschmolzenen Metall und der Atmosphäre während des Schmelz- oder Gießprozesses so weit wie möglich zu vermeiden. Daher sollten die folgenden Punkte beachtet werden.
(1) Beim Schmelzen in Elektroöfen wird ein Vakuumschutz verwendet, oder es werden Inertgase wie Argon oder Stickstoff zum Schutz eingesetzt, die den Sauerstoff in der Schmelzkammer eliminieren und die Oxidation des geschmolzenen Metalls verringern können.
(2) Bei der Verwendung einer Feuerpistole zum Schmelzen sollte die Flamme auf eine reduzierende gelbe Flamme eingestellt werden, die die gesamte Flüssigkeitsoberfläche bedeckt, um zu verhindern, dass das geschmolzene Metall Sauerstoff aufnimmt. Beim Schmelzen in Elektroöfen kann manchmal eine reduzierende Flamme an der Tiegelmündung hinzugefügt werden, um das geschmolzene Metall zu bedecken.
(3) Streuen Sie Holzkohle oder wasserfreie Borsäure auf die Oberfläche des geschmolzenen Metalls; sie schwimmen auf der Oberfläche der Silberflüssigkeit und können die Silberflüssigkeit auf zwei Arten schützen: a. Sie bilden eine Barriere zwischen dem geschmolzenen Metall und der Luft; b. Sie reduzieren Kupferoxid. Diese Methode ist für Schleudergießmaschinen ungeeignet, funktioniert aber sehr gut auf manuell betriebenen Vakuumgießmaschinen.
(4) Bei der oben genannten Methode ist es auch wichtig, den Schutz des geschmolzenen Metalls während des Gießprozesses zu verstärken. Insbesondere bei der Verwendung einer Vakuumgießmaschine zum Gießen ist es notwendig, den Fluss des geschmolzenen Metalls zu schützen, da es sich um ein manuelles Gießen unter Vakuumbedingungen handelt. Normalerweise wird eine Reduktionsflamme verwendet; wenn die Gipsform eingesetzt wird, wird die Flamme entzündet, und die Flamme muss den Gusskanal der Form abdecken, wodurch die Luft im Inneren der Form eliminiert werden kann.
1.3 Das Phänomen des "roten Flecks" beim Polieren
Sterlingsilber bildet beim Polieren häufig dunkelrote Flecken auf der Oberfläche, was den Glanz und die Ästhetik der polierten Oberfläche sowie die Haftung der galvanischen Schicht stark beeinträchtigt. Dieses Phänomen ist auf den Oberflächen von Produkten, die einer thermischen Bearbeitung, wie Glühen und Schweißen, unterzogen wurden, stärker ausgeprägt.
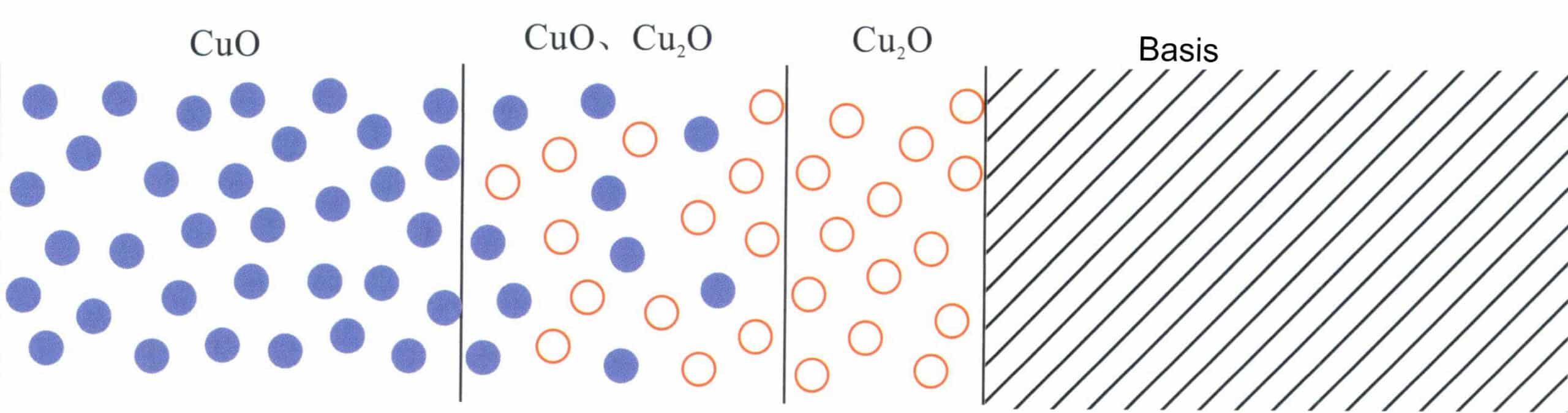
Nach dem Erhitzen des Sterlingsilberblocks auf 700℃ für 1,5 Stunden wurde der Oxidationszustand unter dem Mikroskop beobachtet. Dabei zeigte sich, dass die Legierung nicht nur an der Oberfläche eine Oxidschicht bildete, sondern auch eine innere Oxidationszone unter der Oberfläche entstand (Abbildung 4-16).

Sterlingsilber gehört zu den Ag-Cu-Legierungen. Wenn die Legierung bei hohen Temperaturen mit Luftsauerstoff in Berührung kommt, tritt die selektive Oxidation von Cu erst ab einer Temperatur von über 400 K auf. Wenn die Probe in verdünnte Schwefelsäure getaucht wird, kann die Oberflächenschicht aus Kupferoxid entfernt werden. Daher kann die Probe nach leichtem Polieren eine silberweiße Farbe aufweisen. Nach weiterem Polieren erscheinen jedoch dunkelrote Flecken auf der polierten Oberfläche, die die Reflexionseigenschaften der polierten Silberoberfläche beeinträchtigen (Abbildung 4-17), was darauf hindeutet, dass in diesem Bereich noch Oxidationsprodukte von Cu vorhanden sind.

Wenn Kupfer bei hohen Temperaturen mit Luftsauerstoff in Berührung kommt, wie z. B. beim Warmwalzen, Glühen oder Schweißen, oxidiert die Oberfläche des Kupferwerkstücks zunächst und bildet rotes Cu2O und oxidiert dann weiter zu schwarzem CuO. Die Oxidation von Kupfer ist nicht auf die Oberfläche von Silberlegierungen beschränkt, sondern kann bis zu einer gewissen Tiefe vordringen (Abbildung 4-18). Nach der Theorie der Hochtemperaturoxidationskinetik von Legierungen muss es, wenn zwei gleichzeitig mit Cu diffundieren, zu einer Anreicherung des Cu2O-Ausscheidungsphase in der inneren Oxidationszone, und die Legierung, die keine innere Oxidation an der inneren Oxidationsfront durchlaufen hat, zeigt eine Verarmung an Cu. Ag hat eine starke Fähigkeit, Sauerstoff zu absorbieren und bei hohen Temperaturen in das Innere des Metalls zu transportieren. Daher ist die Sauerstoffdiffusion vorherrschend, und seine Permeabilität ist viel höher als die von Cu. Daher kann Sauerstoff in die Unterschicht der Legierungsoberfläche eindringen und interne Oxidausscheidungen erzeugen. Es muss ein direkter Weg vom Oxid zur Legierungsoberfläche bestehen, um das Kupferoxid der Unterschicht durch saures Ätzen zu entfernen. Der Kupfergehalt in Sterlingsilber beträgt nur 7,5%, und seine Struktur ist eine zweiphasige feste Lösung ohne Bildung eines Oxidnetzwerks, was bedeutet, dass es beim Eintauchen in Säure keinen direkten Weg ins Innere gibt, so dass das innere Cu2O intakt zu bleiben. Infolgedessen weist die Oberfläche der oxidierten Sterlingsilberprobe immer noch schwarze und unregelmäßige Flecken auf, die als "rote Flecken" bekannt sind.
Untersuchungen haben ergeben, dass die Schwere der roten Flecken auf der Oberfläche von Sterlingsilber eng mit der Erhitzungstemperatur und der Erhitzungszeit zusammenhängt (Abbildung 4-19). Je höher die Erhitzungstemperatur und je länger die Erhitzungszeit, desto dicker wird die Oxidschicht an der Oberfläche und desto tiefer dringt die innere Oxidschicht in das Substrat ein, so dass sie mit herkömmlichen Poliermethoden nur schwer zu entfernen ist.

1.4 Nachdunkelndes Farbwechselphänomen
Silber selbst neigt zum Nachdunkeln und Verfärben. Der Zusatz von Cu-Elementen in Sterlingsilber verbessert die Verfärbungsneigung der Legierung nicht. Außerdem weist die Sterlingsilberlegierung sowohl im gegossenen als auch im gealterten Zustand eine zweiphasige Struktur auf, die aus einem silberreichen Mischkristall und einem kupferreichen Mischkristall besteht, zwei inkompatible Phasen. Der Potenzialunterschied zwischen diesen beiden Phasen führt zu lokalen Mikro-Batteriereaktionen, die die elektrochemische Korrosionsleistung der Sterlingsilberlegierung erhöhen und ihre Korrosionsbeständigkeit verringern. Daher ist Silberschmuck aus Sterlingsilber anfällig für Korrosion und Verfärbung, was die Qualität des Aussehens von Silberschmuck stark beeinträchtigt.
2. Der Einfluss von Legierungselementen auf Sterlingsilber
Da Sterlingsilber dazu neigt, beim Polieren rote Flecken und stumpfe Verfärbungen zu entwickeln, und beim Schmelzen zu metallurgischen und gießtechnischen Defekten neigt, ist eine Modifikationsbehandlung erforderlich. Dabei wird das Silber legiert, um seine Gesamtleistung zu verbessern und gleichzeitig seine guten mechanischen Eigenschaften zu erhalten. Zu den üblichen Legierungselementen gehören Si, Zn, Sn, Ce, Ge und andere.
2.1 Der Einfluss von Silizium (Si) auf Sterlingsilber
Herkömmliche Sterlingsilberlegierungen neigen dazu, während des Schmelzens und Gießens Gas aufzunehmen, was sie anfällig für Oxidation macht und zu größeren Gasporen in den Gussstücken führt. An der Oberseite befinden sich Gasaustrittskanäle aufgrund der Gasabsorption bei der Erstarrung, begleitet von oxidierten Einschlüssen, und auch innerhalb der Gussstücke gibt es Einschlüsse. Die Zugabe einer geringen Menge Silizium zu Sterlingsilber kann die Gasabsorptionstendenz und die Oxidationsbeständigkeit wirksam verbessern, was zu einer besseren Gussqualität, einer geringeren Anzahl von Gasporen und Einschlüssen und einer besseren Oberflächenqualität nach dem Polieren führt. Aus thermodynamischer Sicht ist der Wert der freien Gibbs-Energie für siliziumbildende Oxide höher als der für Kupferoxide. Daher reagiert das Silizium in der Metallschmelze nach Zugabe einer angemessenen Menge an Silizium bevorzugt mit Sauerstoff, wodurch Gasporendefekte reduziert werden. Aufgrund der geringen Dichte und der hohen Viskosität von Siliziumdioxid kann es mit Hilfe von Flussmitteln von der Oberfläche des geschmolzenen Metalls entfernt werden, sobald es an der Oberfläche schwimmt. Das dem Sterlingsilber zugesetzte Silizium trägt auch dazu bei, die Beständigkeit der Legierung gegen Oxidation und Sulfidverfärbung zu verbessern.
Mit steigendem Si-Gehalt wird die Kornstruktur allmählich gröber, was die Polierwirkung der Oberfläche verschlechtert und zum Auftreten eines "Orangenschaleneffekts" auf der Oberfläche führt. Wenn der Siliziumgehalt einen bestimmten Wert übersteigt, nimmt die Sprödigkeit der Legierung erheblich zu, so dass sie bei der Verarbeitung anfällig für Risse wird.
2.2 Der Einfluss von Zink (Zn) auf Sterlingsilber
Zn kann den Schmelzpunkt von Sterlingsilber senken, die Fließfähigkeit der Schmelze erhöhen, Schrumpfungsdefekte verringern und die Gussstruktur dichter machen, hat aber keine nennenswerte Auswirkung auf die Korngröße. Als sauerstoffaktives Element reagiert Zn, wenn es Sterlingsilber zugesetzt wird, bevorzugt mit Sauerstoff in der Metallschmelze, was dazu beitragen kann, die Oxidation des geschmolzenen Metalls durch absorbierten Sauerstoff zu verringern. Ist der Zinkgehalt jedoch zu hoch, kann es leicht zu einer Zunahme der oxidierten Einschlüsse im geschmolzenen Metall kommen.
Der atomare Größenunterschied zwischen Zn und Ag beträgt 7,76%, Cu, und der atomare Größenunterschied zu Ag beträgt 11,50%, Zn. Die verstärkende Wirkung von Ag ist weniger stark als die von Cu. Wenn Zn teilweise Cu in Sterlingsilber ersetzt, werden die Guss- und Glühhärte reduziert. Bei einem Zn-Gehalt von mehr als 3,36% liegt die Gusshärte von Sterlingsilber nur noch bei etwa HV50, was es schwierig macht, die Anforderungen an Schmuckeinlagen und Verschleißfestigkeit zu erfüllen. Zn wirkt sich nachteilig auf die Verarbeitungseigenschaften der Legierung aus, da es ihre Plastizität verringert. Ein zu hoher Zn-Gehalt führt zu Problemen wie Delaminierung, Verzunderung und Rissbildung während der Verarbeitung.
Das Elektrodenpotential von Zn ist niedriger als das von Ag und Cu, und auf der Oberfläche von Sterling Silber bildet sich spontan ein Passivierungsfilm, der die elektrochemische Korrosion verlangsamt und die Beständigkeit der Legierung gegen Sulfidverfärbung und Oxidation verbessert. Mit steigendem Zn-Gehalt nimmt Sterling Silber. Die Dicke der Oxidschicht nimmt allmählich ab. Wenn der Zn-Gehalt jedoch 3,5% übersteigt, ist Sterling Silber anfälliger für Oxidationseinschlüsse, was sich nachteilig auf die elektrochemische Korrosionsbeständigkeit und die Antisulfidverfärbungsleistung auswirkt.
2.3 Die Wirkung von Stannum(Sn) auf Sterlingsilber
Die Zugabe von Sn zu Sterlingsilber kann den Schmelzpunkt der Legierung senken, die Fließfähigkeit der Schmelze erhöhen und die Schrumpfung der Legierung verringern, was zu einer dichteren Gussstruktur führt. Eine geringe Menge Sn kann auch das Gefüge der Legierung verfeinern; wenn der Sn-Gehalt jedoch 2% übersteigt, vergröbert sich das Gefüge der Legierung merklich und es bilden sich relativ große Dendriten sowie Schrumpfung und Entmischung.
Bei Sterlingsilberlegierungen verbessert der teilweise Ersatz von Cu durch Sn im Allgemeinen die Anfangshärte der Legierung im Gusszustand. Mit zunehmendem Sn-Gehalt steigt die Härte der Legierung zunächst an und nimmt dann ab. Wenn sich der Sn-Gehalt 1% nähert, erreicht die Härte ihren Höchstwert; allerdings wird die Duktilität der Legierung erheblich beeinträchtigt, was zu Rissen bei der Kaltbearbeitung führen kann.
Sn ist auch ein sauerstoffaktives Element. Eine bestimmte Menge Sn kann eine dichte Oxidschicht auf der Oberfläche der Legierung bilden und das Substrat schützen. Sn kann die elektrochemische Korrosionsbeständigkeit von Sterlingsilber verbessern. Je höher der Sn-Gehalt ist, desto besser ist die elektrochemische Korrosionsbeständigkeit der Legierung. Wenn der Sn-Gehalt 2% übersteigt, werden die Sulfidverfärbung und die Oxidationsbeständigkeit der Legierung erheblich verbessert.
2.4 Der Einfluss von Cerium (Ce) auf Sterlingsilber
Der Zusatz des Seltenerdelements Ce zu Sterlingsilber hat erhebliche Auswirkungen auf dessen Struktur. Ce kann die Metallflüssigkeit wirksam reinigen und den Gasgehalt reduzieren. Wenn der Ce-Gehalt unter 0,05% liegt, kann es die Kornstruktur verfeinern, vor allem weil Ce während des Erstarrungsprozesses der Metallflüssigkeit als Kornverfeinerer wirkt, den Grad der Schrumpfungsporosität verringert und die Dichte während des Glühens verbessert; Ce kann auch die Korngrenzenwanderung behindern und so eine feine Kornstruktur erhalten.
Spuren von Ce können die mechanischen Eigenschaften von Sterlingsilber verbessern, indem sie seine Festigkeit und Härte erhöhen, die Duktilität steigern und die Kaltverfestigung der Legierung verbessern. Wenn der Ce-Gehalt weiter erhöht wird, neigt es zur Entmischung an den Korngrenzen, was die Verarbeitungsleistung der Legierung verschlechtert und sie anfälliger für Oxidationseinschlüsse macht.
Nach Zugabe von Spuren von Ce können die elektrochemische Korrosionsbeständigkeit, die Oxidationsfleckenbeständigkeit und die Sulfidverfärbungsbeständigkeit von Sterlingsilber erheblich verbessert werden. Wenn der Ce-Gehalt 0,075% überschreitet, nimmt die Korrosionsbeständigkeit von Sterlingsilber ab.
2.5 Der Einfluss von Ge auf Sterlingsilber
Wenn Ge zu Sterlingsilber hinzugefügt wird und sein Gehalt zwischen 0,2% und 0,8% liegt, ist die Gusshärte von Sterlingsilber höher, und seine Kaltverfestigungsleistung, elektrochemische Korrosionsbeständigkeit und Verfärbungsbeständigkeit sind alle im Vergleich zu Sterlingsilber verbessert, was eine bessere Gesamtleistung widerspiegelt. Wenn der Ge-Gehalt zu niedrig ist, ist die Leistungsverbesserung von Sterlingsilber nicht signifikant; wenn der Gehalt jedoch zu hoch ist, kann es leicht zu einer Kornvergröberung der Legierung kommen, was zu einer Verschlechterung der Gesamtleistung der Legierung führt.
Abschnitt V Die Verfärbung und der Schutz von Silber
Silber und seine Legierungen sind in der Schmuckindustrie weit verbreitet, und sie haben eine wichtige Eigenschaft: Sie laufen leicht an und verfärben sich. Wenn sich Silberlegierungen verfärben, nimmt der Oberflächenglanz stark ab, was die Qualität des Aussehens des Schmucks stark beeinträchtigt und die Verarbeitung der Legierung erschwert.
1. Der Grund für das Anlaufen von Silber
Das chemische Potenzial von reinem Silber beträgt +0,799 V, was im Vergleich zum Standardpotenzial von Wasserstoff relativ hoch ist und es als inertes Metall klassifiziert. Unter normalen Bedingungen reagiert es chemisch nicht mit Säuren oder Basen, sondern nur mit stark oxidierenden konzentrierten Säuren (wie konzentrierter Salpetersäure und heißer konzentrierter Schwefelsäure). Silberschmuck läuft jedoch allmählich an, wenn er einige Zeit getragen wird oder sogar, wenn er für eine gewisse Zeit in einer Aufbewahrungsbox aufbewahrt wird, und traditionelles Sterlingsilber ist besonders anfällig für das Anlaufen. Die Gründe für das Anlaufen von Silber lassen sich wie folgt zusammenfassen.
1.1 Silbersulfid-Verfärbung
Silber und seine Legierungen sind anfällig für Korrosion und Verfärbung in Umgebungen, die H2S, SO2und COS. Silber ist sehr empfindlich gegenüber H2S-Gas, und wenn die Konzentration von H2S in der Atmosphäre erreicht 0,2 x 10-9 (Volumenanteil) reicht aus, um Silber zu korrodieren, was zur Bildung von schwarzem Ag2S führt, nämlich:
4Ag + 2 H2S + O2 = 2Ag2S + 2H2O
Die Geschwindigkeit der Silbersulfidverfärbung in der Atmosphäre von H2S folgt dem kinetischen Mechanismus der Wagner-Diffusion, und wenn der Gehalt an H2S zunimmt oder wenn H2S koexistiert mit anderen Gasen wie NO2, O2wird die Verfärbungsrate von Silbersulfid verstärkt. Die SO2 in der Luft kann auch in S umgewandelt werden2-zur Bildung von Ag2S, was zu einer Silberverfärbung führt. Die Empfindlichkeit von SO2 ist nicht so hoch wie die von H2S, aber wenn SO2 koexistiert mit anderen Gasen wie NO2 und O2wird sich auch die Sulfidverfärbung verstärken.
Silber ist sehr empfindlich gegenüber sauerstoffhaltigen Sulfidlösungen. Die Verfärbung tritt langsam auf, wenn Silber in eine sauerstofffreie Na2S-Lösung getaucht wird. Wenn die Probe jedoch herausgenommen wird und die an der Silberoberfläche anhaftende Natriumsulfidlösung mit Sauerstoff in Berührung kommt, zeigt die Silberprobe schnell eine deutliche Verfärbung. Je länger sie der Luft ausgesetzt ist, desto stärker wird die Verfärbung. Die Reihenfolge der Farbveränderungen ist Silber, weiß → gelb → braun → blau. Dies liegt daran, dass das Standardelektrodenpotenzial von Ag (0,779 V) niedriger ist als das von O mit 1,229 V. Ag ist in Gegenwart von Sauerstoff thermodynamisch instabil, zunächst durch O2 wird zu Ag oxidiert+ und anschließende Kombination mit Ag+ und S2-zur Bildung einer unlöslichen Verbindung Ag2S. Je höher die Konzentration der Sulfide ist, desto stärker ist die Verfärbung. Die chemische Reaktion von Silber in sauerstoffhaltiger wässriger Na2S-Lösung ist:
4Ag + 2H2O + O2 + 2S2-= 2Ag2S↓+4OH–
Ag-Cu-Legierungen sind anfälliger für Sulfidbildung und erzeugen schwarzes Cu2 S, da Cu leichter sulfidiert als Ag; daher verfärben sie sich leichter als reines Silber.
1.2 Elektrochemische Korrosion in feuchter Umgebung
In feuchten Umgebungen können die Unebenheiten der Silberoberfläche (ungleichmäßige Legierungszusammensetzung oder physikalische Zustände wie innere Spannungen, Oberflächenglätte usw.) zu unterschiedlichen Potenzialen in verschiedenen Bereichen der Metalloberfläche unter dem Wasserfilm führen, wodurch ein Potenzialunterschied zwischen diesen Bereichen entsteht. Zwei benachbarte Bereiche mit unterschiedlichen Potenzialen werden miteinander verbunden, wobei der Wasserfilm als Elektrolyt für den Ionentransport und das Metall als Leiter für den Elektronentransport fungiert und einen elektrischen Kreislauf bildet. Auf diese Weise entsteht der Effekt einer Kurzschlussbatterie, die viele korrodierende Mikrobatterien auf der Metalloberfläche bildet. Das Gussgefüge von Sterlingsilber besteht im Allgemeinen aus einer zweiphasigen Struktur, die sich aus silberreichem Mischkristall und kupferreichem Mischkristall zusammensetzt. In feuchter Umgebung wird die kupferreiche Mischkristallphase zur Anode der Korrosionsmikrobatterie, wodurch die Legierung anfälliger für Korrosion und Verfärbung wird. Auch höherwertiges Silber kann aufgrund von Verunreinigungen elektrochemisch korrodieren, und in feuchten, salzhaltigen Umgebungen verwandelt sich die Silberoberfläche oft in Silberchlorid, eine graubraune, klebrige Substanz, die an Erde erinnert.
1.3 Die Wirkung von ultraviolettem Licht auf die Silberverfärbung
Licht als externe Energiequelle kann die Ionisierung von Metallionen fördern und dadurch die Reaktion zwischen Silber und dem korrosiven Medium beschleunigen, d. h. die Verfärbungsreaktion von Silber beschleunigen. Wenn die Oberfläche der versilberten Schicht mit Licht verschiedener Wellenlängen bestrahlt wird, sind die Ergebnisse in Tabelle 4-8 dargestellt. Es ist zu erkennen, dass die versilberte Schicht nach der Absorption von ultraviolettem Licht zur Verfärbung neigt, und die Fähigkeit der Wellenlänge des eingestrahlten Lichts, eine Verfärbung zu verursachen, nimmt mit abnehmender Wellenlänge zu.
Tabelle 4-8 Der Einfluss der Wellenlänge des eingestrahlten Lichts und der Bestrahlungszeit auf die Verfärbung der versilberten Schicht
| Wellenlänge des eingestrahlten Lichts/nm | Bestrahlungszeit /Stunden | ||||
|---|---|---|---|---|---|
| Wellenlänge des eingestrahlten Lichts/nm | 6 | 12 | 18 | 24 | 48 |
| 253.7 | Unverändert | Fokale Makula | Gelbbraun | Braun-Schwarz | Ganz schwarz |
| 365.0 | Unverändert | Unverändert | Unverändert | Gelb | - |
| Sonnenlicht | Unverändert | Unverändert | Unverändert | Lokalisierte Makula | - |
Den Ergebnissen der Röntgenphotoelektronenspektroskopie und der Auger-Spektroskopie zufolge besteht die Farbänderung der versilberten Schicht unter ultraviolettem Licht hauptsächlich aus Ag2O, AgO, AgCl und entsprechende Silberverbindungen.
2. Wege zur Vermeidung von Silberverfärbungen
Im Hinblick auf die Verfärbung von Silber und seinen Legierungen wurden sowohl im Inland als auch international umfangreiche Forschungsarbeiten zur Verbesserung der Verfärbungsbeständigkeit von Silber durchgeführt. Unter dem Gesichtspunkt der Förderung der Verfärbungsbeständigkeit lassen sie sich in zwei Hauptkategorien zusammenfassen: die Behandlung der Oberflächenmodifikation von Silberlegierungen und die Entwicklung verfärbungsbeständiger Silberlegierungen.
2.1 Oberflächenmodifikationstechnologie zur Vermeidung von Silberverfärbungen
Bei der Oberflächenmodifizierung wird mit chemischen oder physikalischen Methoden ein inerter Film auf der Oberfläche von Silberschmuck gebildet, der das Silbersubstrat von korrosiven Medien in der Umgebung isoliert, die Reaktionen zwischen Licht, Oxidationsmitteln, korrosiven Medien und Silber blockiert und das Auftreten von Verfärbungen verhindert. Je nach Art des gebildeten Films kann die Oberflächenmodifikation in mehrere Haupttypen eingeteilt werden: Galvanisierung, Immersion, chemische Passivierung, elektrochemische Passivierung, organische Adsorptionspassivierung, Harzbeschichtung und selbstorganisierte Filme.
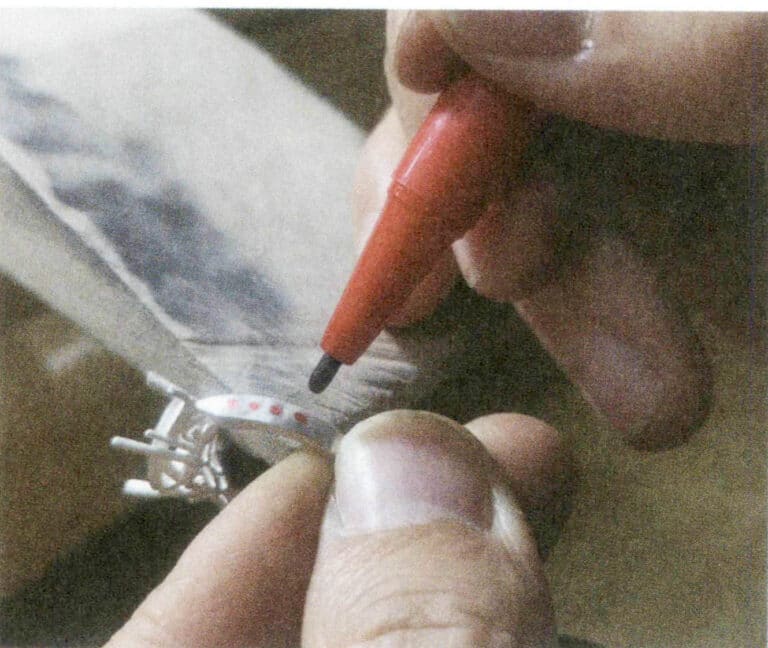
Die Rhodinierung ist die am weitesten verbreitete Methode zur Oberflächenveredelung von Sterlingsilberschmuck. Durch das Aufbringen einer dünnen Rhodiumschicht auf die Oberfläche des Schmucks kann ein glänzendes, spiegelähnliches Aussehen erzielt werden. Die Rhodiumschicht hat eine hohe Härte und eine gute chemische Stabilität, was die Verschleißfestigkeit und die Beständigkeit gegen Verfärbungen von Silberschmuck verbessern kann. Aufgrund der Produktionskosten und des Oberflächenglanzeffekts ist die Rhodiumschicht auf Schmuckstücken jedoch in der Regel sehr dünn und kann sich während des Gebrauchs leicht abnutzen, wodurch sie ihre Schutzwirkung verliert.
Chemische Passivierungsverfahren oder elektrochemische Passivierungsverfahren können eine anorganische Passivierungsschicht auf der Oberfläche von Silber bilden. Die Chromatpassivierung ist eine häufig angewandte chemische Passivierungsmethode für handwerklichen Silberschmuck, bei der eine Schicht aus Silberoxid und Silberchromat in einer sauren oder alkalischen Lösung erzeugt wird, die sechswertige Chromverbindungen enthält. Bei der elektrochemischen Passivierung wird nach dem Prinzip der kathodischen Reduktion eine Schicht aus Silberchromat, Chromsäure, basischem Silberchromat und basischer Chromsäure auf der Silberoberfläche erzeugt. Diese Filmschichten haben eine gute Passivierungswirkung, können die freie Energie der Legierungsoberfläche verringern und dienen dazu, Verfärbungen zu verhindern, ohne das Aussehen des Silberhandwerks wesentlich zu beeinträchtigen. Problematisch sind jedoch die geringe Dichte der Schicht, die geringe mechanische Stabilität, die komplexe Struktur, die Schwierigkeit, Kanten zu bedecken, und die Auswirkungen auf die Umwelt.
Die Anwendung von Methoden wie Tauchen, Sprühen und Beschichten zur Bildung eines organischen Schutzfilms auf der Oberfläche von Silber kann dessen Anlaufschutz verbessern, und auf diesem Gebiet wurden sowohl im Inland als auch international beträchtliche Forschungsarbeiten durchgeführt. Benzotriazol, Tetrazolium und verschiedene schwefelhaltige Verbindungen können auf Silber Komplexe bilden. Zusammengesetzte Filme können gebildet werden, und einige wasserlösliche Polymere werden hinzugefügt, um Filmmittel zu schaffen, aber die resultierende Filmschicht muss dichter sein, und die Anti-Anlaufwirkung könnte besser sein. Einige Schutzmittel sind öllösliche Anlaufschutzmittel auf der Basis von Paraffin und langkettigen quaternären Ammoniumsalzen, die eine feste Schmierschicht auf der Silberoberfläche bilden können und eine gute Anlaufschutzwirkung haben. Ihre Beständigkeit gegen Lösungskorrosion ist jedoch gering, und die Verwendung von heißem Benzin als Lösungsmittel birgt erhebliche Risiken. Außerdem werden nach dem Auftragen einer Wachsschicht auf der Oberfläche der Glanz und das Reflexionsvermögen der Legierung stark verringert. Das Aufsprühen von Acryllacken, Polyurethanlacken und transparenten organischen Silikonlacken auf die Oberfläche von Silberlegierungen kann deren Anlaufschutz verbessern. Allerdings muss die Beschichtung ausreichend dick sein, um eine gewisse Anlaufschutzwirkung zu erzielen, was sich auch auf das Aussehen von Silberschmuck auswirken kann.
Herkömmliche Schutzmittel sind für den Schutz von Silberschmuck nicht geeignet, während molekulare Selbstorganisationssysteme wie Alkylthiole, Organsilane und Schiffsbasen Schutzfilme auf der Oberfläche von Silberschmuck bilden können. Diese Filme haben Eigenschaften wie eine dichte und einheitliche Struktur, die nicht von der Form der Substratoberfläche beeinflusst wird, frei von metallischen Verunreinigungen ist und das Aussehen des Substrats nicht beeinträchtigt. Sie zeigen eine ausgezeichnete Anti-Anlauffähigkeit für Silber und sind damit eines der vielversprechendsten Verfahren zur Oberflächenbehandlung von angelaufenem Silberschmuck.
Insgesamt zeichnen sich die Verfahren zur Oberflächenmodifizierung durch niedrige Kosten, einfache und praktische Verfahren und eine gewisse Anlaufschutzwirkung aus. Aufgrund der geringen Dicke des erzeugten Films kommt das freiliegende Silbersubstrat jedoch weiterhin mit korrosiven Medien in Kontakt und läuft an, sobald es zerkratzt wird.
2.2 Anlaufhemmende Silberlegierungen durch Gesamtlegierung
Bereits 1927 stellte das National Bureau of Standards in den Vereinigten Staaten nach Untersuchungen fest, dass es keine andere Möglichkeit gibt, die Sulfidierungsreaktion von Silber vollständig zu verhindern, es sei denn, es wird mit anderen Edelmetallelementen legiert. Um die Bildung von Silbersulfiden zu unterdrücken, ist es notwendig, Legierungen mit 40% Palladium, 70% Gold oder 60% Platin zu bilden. Es ist jedoch unbestreitbar, dass die Verbesserung der Anlaufbeständigkeit von Silberlegierungen durch Legieren immer noch eine notwendige und wirksame Methode ist. Viele Länder weltweit bemühen sich nach wie vor um die Entwicklung neuer Arten von anlaufbeständigen Silberlegierungen und haben dabei einige Forschungsergebnisse erzielt. Die wichtigsten Legierungselemente, die anlaufbeständige Silberlegierungen bilden, lassen sich in drei Kategorien einteilen.
(1) Legierung mit Edelmetallen.
Unter allen Edelmetallelementen hat Silber relativ aktive chemische Eigenschaften. Die Zugabe von Edelmetallelementen mit höheren chemischen Potenzialen, wie Au, Pd und Pt, kann das Elektrodenpotenzial von Silberlegierungen und ihre Anlaufbeständigkeit verbessern. So wurde beispielsweise durch den Zusatz von 5% Pd zu Sterlingsilber die Anlaufbeständigkeit der Silberlegierung erheblich verbessert, die nach zehn Tagen in einer Chlor- oder Ammoniakatmosphäre keine nennenswerte Verfärbung oder Korrosion aufwies. Die Dehnung der Legierung liegt zwischen 15%-26%, und sie kann mit herkömmlichen Guss- und mechanischen Umformverfahren hergestellt werden. In ähnlicher Weise ist in der Reihe der anlaufbeständigen platinhaltigen Silberlegierungen bei einem Pt-Gehalt von 1% die Anlaufbeständigkeit mehr als dreimal so hoch wie die von Sterlingsilber; bei einem Pt-Gehalt von 3,5% ist die Anlaufbeständigkeit mehr als sechsmal so hoch wie die von Sterlingsilber; bei einem Pt-Gehalt von 5% ist die Anlaufbeständigkeit mehr als achtmal so hoch wie die von Sterlingsilber. Platinhaltige Silberlegierungen können die Korngröße erheblich verfeinern und gleichzeitig die Härte erhöhen; die Legierung weist außerdem eine ausgezeichnete Plastizität auf; sie erhöht den Glanz der Legierung, nähert sich der Farbe von Platin an und verhindert das Auftreten von roten Flecken. Durch die Legierung mit Edelmetallen erhöhen sich die Materialkosten für anlaufgeschütztes Silber erheblich, so dass die Anwendung auf dem Markt relativ begrenzt ist.
(2) Legierung mit Seltenerdmetallen.
Viele Studien haben gezeigt, dass der Zusatz von Spuren von Seltenen Erden zu Silber oder Silberlegierungen die Beständigkeit der Legierung gegen Sulfidierungsverfärbung verbessert. Zu den am häufigsten verwendeten Seltenen Erden gehören Yttrium (Y), Cer (Ce), Lanthan (La) usw. Wenn zum Beispiel Seltene Erden zu reinem Silber hinzugefügt werden und der Gehalt an Seltenen Erden unter 0,11% liegt, kann es eine bessere Beständigkeit gegen Sulfidierungsverfärbung aufweisen als reines Silber. Der Zusatz von Seltenen Erden verfeinert die Korngröße der kaltverformten Rekristallisationsstruktur, und die dispergierte zweite Phase der Silber-Seltene Erden-Verbindung, die durch Fragmentierung und Reaggregation gebildet wird, stärkt die Silberlegierung effektiv und verbessert die thermische Stabilität der Legierung, die eine hohe Beständigkeit gegen Alterungserweichung aufweist. Bei den meisten im Inland entwickelten anlaufbeständigen Silbersorten wurden Seltene Erden als Legierungselemente verwendet.
(3) Legierung mit anderen sauerstoffaktiven Elementen.
Die Zugabe von sauerstoffaktiven Elementen wie Zn, Si, Sn, In und Ge zur Ag-Cu-Legierung kann die Sulfidierungs- und Oxidationsverfärbungsbeständigkeit von Silberlegierungen verbessern. Dies ist derzeit die häufigste Art von anlaufbeständigen Silberlegierungen auf dem Markt. Italien, die Vereinigten Staaten, Deutschland und andere Länder haben verschiedene anlaufbeständige Silberlegierungen entwickelt, die eine mehr als fünfmal so hohe Sulfidierungs- und Oxidationsbeständigkeit wie Sterlingsilber aufweisen. Das Prinzip der Anlaufbeständigkeit: Diese Elemente gehören zu den sauerstoffaktiven Elementen, und ihre Oxide haben eine niedrigere freie Energie als Kupferoxide, mit einer stärkeren Affinität zu Sauerstoff, was die Bildung stabilerer Oxide ermöglicht. Vor der Bildung von Ag2S bilden diese Oxide eine dichte Schutzschicht, die als Barriere zum Schutz der Silbermatrix dient.
Abschnitt VI Leistungsbewertung und allgemeine Probleme mit anlaufgeschütztem Silber
1. Leistungsbewertung von Anti-Anlaufsilber
Auf dem Markt sind verschiedene Füllungsmaterialien mit Silber als Verfärbungsschutz aufgetaucht, deren Leistung stark variiert. Es ist notwendig, geeignete Methoden zur Bewertung ihrer Leistung anzuwenden, um eine Grundlage für die Auswahl geeigneter Füllungsmaterialien zu schaffen.
1.1 Bewertungsmethoden für die Anti-Discoloration-Leistung
Die Verfärbungsbeständigkeit ist einer der wichtigsten Leistungsindikatoren für Silberlegierungen und umfasst vor allem die Beständigkeit gegen Sulfidverfärbungen und oxidative rote Flecken, die experimentell geprüft werden muss.
1.1.1 Bewertungsmethode für die Beständigkeit gegen Sulfidverfärbung
Je nach den Versuchsbedingungen und -orten wird zwischen Freiland- und Labortestverfahren unterschieden.
(1) Testverfahren im Freien
Bei der Prüfung im Freien werden Proben von Silberlegierungen in einer realen Umgebung platziert, um die Zeit, in der die Farbe der Proben unverändert bleibt, und die spezifischen Phänomene der Farbänderung zu beobachten, die auftreten, um die Beständigkeit der Legierung gegen Farbänderungen zu bewerten. Diese Methode kann die Beständigkeit der Legierung gegen Farbveränderungen genauer widerspiegeln, hat aber ihre eigenen Nachteile: (1) Die Zeit, um Testergebnisse zu erhalten, ist relativ lang; in bestimmten Umgebungen kann es beispielsweise bei Legierungen mit guter Korrosionsbeständigkeit Jahre dauern, bis Ergebnisse vorliegen; (2) die Reproduzierbarkeit der Ergebnisse ist gering. Aufgrund von regionalen und zeitlichen Unterschieden variiert die natürliche Umgebung bis zu einem gewissen Grad. Daher werden die Ergebnisse der gleichen Legierung, die in verschiedenen Regionen getestet wurde, erheblich voneinander abweichen; selbst in derselben Region zu verschiedenen Zeiten werden die Testergebnisse ebenfalls variieren.
Wegen der langen Prüfdauer in natürlicher Umgebung werden manchmal beschleunigte Korrosionsverfahren eingesetzt, um schneller Ergebnisse zu erhalten. Dabei wird die Legierung beispielsweise in rauen Umgebungen wie in der Nähe von Galvanikbetrieben oder Kesselabgasen gelagert oder in der Atmosphäre ultravioletter Strahlung ausgesetzt. Diese Methoden werden jedoch leicht durch Umweltverschmutzung und andere Faktoren beeinträchtigt, was zu erheblichen Unterschieden im Grad der Ähnlichkeit, Authentizität und Reproduzierbarkeit der Prüfergebnisse im Vergleich zur natürlichen Korrosionsfarbveränderung führt. Daher sind sie nicht ratsam.
(2) Laborprüfverfahren
Je nach den in den Labortests verwendeten korrosiven Medien können zwei Methoden unterschieden werden: Flüssigphasentests und Gasphasentests.
(2.1) Prüfverfahren in der Flüssigphase.
Die am häufigsten verwendeten Methoden sind die Sulfidlösung und die Immersionsmethode mit künstlichem Schweiß. Bei der ersten Methode wird die Probe in eine Natriumsulfid- oder Ammoniumsulfidlösung mit einer bestimmten Konzentration getaucht, wobei die Tuccillo-Nielsen-Methode verwendet wird, die recht allgemein ist. Die Probe wird auf einem rotierenden Rad befestigt und periodisch in eine Lösung der Konzentration 0,5% oder 2% Na getaucht.2S-Lösung bei einer Geschwindigkeit von 1r/min. Damit lässt sich die Verfärbungsbeständigkeit von Silberlegierungen unter Einwirkung von sauerstoffhaltiger Natriumsulfidlösung wirksam nachweisen. Bei letzterem wird künstlicher Schweiß entsprechend den einschlägigen Normen hergestellt und die Probe in Schweiß mit einem bestimmten pH-Wert und einer bestimmten Temperatur, in der Regel um pH 6,5, bei einer Temperatur von 30 oder 37 °C eingetaucht. Während des Immersionstests muss die Temperatur der Lösung stabil gehalten werden, und die Probe und die Vergleichsprobe sollten unter denselben Bedingungen getestet werden. Die Farbveränderungen der Vergleichsprobe nach verschiedenen Immersionszeiten können mit einem Kolorimeter genau gemessen werden, um den Grad der Verfärbung der Probe zu bestimmen.
(2.2) Gasphasenprüfverfahren.
Die Anwendung von Gasphasentests zur Untersuchung der Verfärbungsbeständigkeit von Silberlegierungen und Silberbeschichtungen ist inzwischen weit verbreitet und hat internationale und nationale Normen hervorgebracht. Gasphasentests können in statischem oder strömendem Gas durchgeführt werden. Das Gas enthält Substanzen, die eine Verfärbung von Silberlegierungen verursachen können, wie z. B. H2S, SO2, Cl2und NO2Das Gas kann ein einzelnes Gas oder ein Gemisch aus zwei oder mehr Gasen sein; das Gas kann eingeführt oder durch chemische Reaktionen erzeugt werden. Zu den gängigen Gasphasentestverfahren gehören hauptsächlich:
A. H2S-Testverfahren. Bei dieser Methode wird H2S zur Durchführung von beschleunigten Korrosionstests, die in der Elektronikindustrie zur Bewertung der Verfärbungsbeständigkeit von elektronischen Bauteilen und elektrischen Kontaktmaterialien weit verbreitet sind, mit mehreren internationalen und nationalen Normen. Zu diesen Normen gehören diejenigen, die hochkonzentriertes H2S-Atmosphären als auch niedrig konzentrierte Atmosphären. Es gibt jedoch keine spezifische Prüfnorm für die Verfärbungsbeständigkeit in der Schmuckindustrie, was zu verschiedenen Praktiken führt, von denen sich einige auf die Normen der Elektronikindustrie für die Prüfung beziehen, während andere ihre Prüfbedingungen selbst wählen. Eine typische Prüfmethode ist die Thioacetamid (TAA)-Methode, die ein strenger Standard für die Messung von Silberschmuck ist und der internationalen Norm Metallic Coatings-Thioacetamide corrosion test (TAA test) (BS EN ISO 4538-1995) entspricht. Aufgrund der hohen Konzentration von H2S-Atmosphäre neigen einige Silberlegierungsoberflächen zur Verfärbung, und die Korrosionsfilmschicht kann sich lösen und abblättern, was die Genauigkeit und Reproduzierbarkeit der Ergebnisse bis zu einem gewissen Grad beeinträchtigen kann. Die Verfärbungsbedingungen der verschiedenen Arten von Silberlegierungen nach H2S-Korrosion für 3 Stunden verglichen, wie in Abbildung 4-20 dargestellt, wobei die H2S-Konzentration 13 x 10-6die relative Luftfeuchtigkeit beträgt 75% und die Temperatur 30℃.

B. SO2 Prüfverfahren. SO2 Kann die Korrosion von Silberlegierungen beschleunigen, typische Methoden sind die "Korrosionsprüfung von Metallen und anderen anorganischen Beschichtungen unter Kondensationsbedingungen von Schwefeldioxid", die ein bestimmtes Volumen verwendet, beheizte geschlossene Acryl-Testkammer, die Einführung einer bestimmten Konzentration von SO2 Gas, getestet über drei Zyklen (nicht-kontinuierliche Exposition). Unter Verwendung eines einzigen SO2 Gas für Korrosionsprüfungen hat einen längeren Prüfzyklus, und die Bewertung der Korrosionsergebnisse zwischen den Proben ist etwas schwierig.
C. Mischgas-Testmethode. Die Korrosionsprodukte dieser Methode kommen den tatsächlichen Bedingungen relativ nahe, und die Testergebnisse sind relativ stabil. Diese Methode wird in einer speziell entwickelten Testumgebung durchgeführt, mit einer Luftfeuchtigkeit von 75%, einer Temperatur von 25℃, H2S, und Konzentrationen von 0,8mg/L, SO2und 3mg/L, dreimal pro Stunde aktualisiert. In Japan wurde eine beschleunigte Mischgas-Korrosionsmethode zur Prüfung des Korrosionsstatus von Silberlegierungen in elektronischen Geräten entwickelt, die aus Luft, H2S, und NO2, wobei H2S ist der Hauptfaktor für die Verfärbung, und NO2 wirkt als Katalysator und beschleunigt die Reaktion zwischen Silber und H2S, was die Bildung von Korrosionsprodukten in kürzerer Zeit ermöglicht.
1.1.2 Bewertungsmethode für die Leistung des roten Flecks bei Oxidation
Im Allgemeinen gibt es zwei Methoden, um die Oxidationsbeständigkeit von Silberlegierungen zu beurteilen. (1) Legen Sie die Probe zum Erhitzen in einen Elektroofen, wobei Sie die Atmosphäre, die Erhitzungstemperatur und die Isolationszeit kontrollieren, und nehmen Sie dann einen Querschnitt der Probe, um den Oxidationsfilm unter dem Mikroskop zu beobachten (Abbildung 4-21). Polieren Sie die Probe und beobachten Sie den Zustand der roten Flecken auf der polierten Oberfläche. Mit dieser Methode können die Testbedingungen stabil kontrolliert werden, und die Testgenauigkeit ist relativ gut. (2) Erhitzen Sie die Probe mit einem Brenner auf eine bestimmte Temperatur, beenden Sie dann die Erhitzung und lassen Sie die Probe auf natürliche Weise auf Raumtemperatur abkühlen, wiederholen Sie den obigen Vorgang mehrmals, nehmen Sie einen Querschnitt der Probe, um den Zustand des Oxidationsfilms zu beobachten, und polieren Sie die Probe, um den Zustand des roten Flecks auf der Probenoberfläche zu beobachten.

1.2 Bewertung der Prozessleistung
Silberlegierungen, die für die Herstellung von Schmuck verwendet werden, müssen eine gute Beständigkeit gegen Sulfidverfärbungen und Oxidationsflecken aufweisen und gute mechanische und verfahrenstechnische Eigenschaften besitzen, was bei der Entwicklung von Verbindungen oft zu Widersprüchen führt. Einige Legierungselemente sind für die Verfärbungsbeständigkeit von Vorteil. Wenn ihr Gehalt jedoch ein bestimmtes Niveau erreicht, können sie sich negativ auf die Guss- und Verarbeitungseigenschaften der Legierung auswirken, was zu einer Verschlechterung der Gesamtleistung der Legierung führt; im Gegensatz dazu können einige Legierungselemente die mechanischen Eigenschaften von Silber verbessern, sie sind jedoch nicht unbedingt günstig für seine Verfärbungsbeständigkeit. Bei der Auswahl verfärbungsbeständiger Silberlegierungen ist es daher notwendig, ihre Verfärbungsbeständigkeit zu bewerten und gleichzeitig die Leistungsanforderungen der Legierung für verschiedene Verarbeitungstechniken vollständig zu berücksichtigen. So kann zum Beispiel das Schmelzverfahren die Oxidationsbeständigkeit der Legierung beeinflussen; dieselbe Legierung kann unterschiedliche Ergebnisse liefern, wenn sie mit einem Brenner, durch Induktionserwärmung an der Atmosphäre oder unter Schutzatmosphäre oder im Vakuum geschmolzen wird; in ähnlicher Weise können bei der Schmuckherstellung Gießverfahren, Stanzverfahren oder Schweißverfahren angewandt werden, die jeweils einen anderen Schwerpunkt auf die Anforderungen an die Prozessleistung der Legierung legen, so dass separate Bewertungen unter den Gesichtspunkten der Gießbarkeit, der Kaltverformungsleistung, der Schweißleistung usw. erforderlich sind, und die Prozessfähigkeit der Legierung in vollem Umfang zu berücksichtigen, um Betriebsprobleme zu vermeiden, die durch einen zu engen Prozessbereich entstehen können.
1.3 Bewertung der Sicherheit und der Kostenwirksamkeit
Die für Schmuck verwendete Silberlegierung muss den Sicherheitsanforderungen entsprechen, und der Gehalt an toxischen und schädlichen Verunreinigungen darf die internationalen Normen nicht überschreiten. Darüber hinaus sollten die umfassende Leistung und die Materialkosten der Silberlegierung unter dem Gesichtspunkt der Kosteneffizienz bewertet werden.
2. Häufige Probleme mit Anti-Anlauf Silber für Schmuck
Zu den Problemen mit anlaufgeschütztem Silber für Schmuck auf dem Markt gehören hauptsächlich die folgenden Aspekte.
2.1 Unzureichende Anti-Anlaufeigenschaften
Wenn Schmuckunternehmen über das Geschäft mit Silberschmuck sprechen, ist die direkteste Frage der Kunden, wie lange der Silberschmuck ungetrübt bleiben kann. Viele Kunden verlangen, dass er mindestens ein Jahr lang anlaufgeschützt bleibt, aber die Unternehmen brauchen Hilfe, um dies zu garantieren. Neben dem Einfluss von Gebrauchsumgebung und Lagerungsmethoden ist ein wesentlicher Grund dafür, dass die Anlaufschutzleistung der Legierung selbst nicht hervorragend ist. Silberlegierungen, die Edelmetallelemente wie Pd und Pt enthalten, haben eine bessere Anlaufschutzleistung, aber ihre relativ hohen Preise schrecken viele Unternehmen ab, da die Kunden die Verwendung solcher Legierungen oft spezifizieren oder extra dafür bezahlen müssen. Der Markt wird überwiegend von Silberlegierungen mit anlaufgeschützter Wirkung beherrscht, die mit sauerstoffaktiven Elementen legiert sind. Theoretisch sollte die von diesen Elementen gebildete dichte Oxidschicht verhindern, dass das innere Metall weiter sulfidiert und oxidiert, wodurch die Beständigkeit der Silberlegierung gegen Sulfid und oxidative Verfärbung verbessert wird. Es ist jedoch zu beachten, dass die Mikrostruktur der Basislegierung, die Verteilung der Legierungselemente in der Basis sowie die Struktur und die mechanischen Eigenschaften der Oberflächenoxidschicht die Struktur der Oxidschicht erheblich beeinflussen können. Ist die gebildete Oxidschicht der Legierung ungleichmäßig verteilt, locker und grob oder weist sie Mikrorisse auf, bietet sie keinen wirksamen Schutz. Mit anderen Worten: Verschiedene Legierungen mit unterschiedlichen Komponentenverhältnissen führen zu unterschiedlichen Ergebnissen beim Anlaufschutz. Selbst wenn ein und derselbe Legierungshersteller die gleiche Legierungsformel verwendet, können die Ergebnisse unterschiedlich ausfallen, wenn sich das Unternehmen bei der Herstellung nicht streng an die vorgegebenen Standards für Schmelz- und Gießverfahren hält.
2.2 Das Problem der unzureichenden Härte
Viele Unternehmen haben berichtet, dass die Härte von anlaufgeschützten Silberlegierungen viel geringer ist als die von Sterlingsilber, so dass sie sich relativ leicht verformen lassen und die Anforderungen für den Formenbau, elastische Teile usw. nicht erfüllen. Dies ist in der Tat der Fall. Bei Silberlegierungen, die die Anlaufbeständigkeit mit den Edelmetallelementen Pd und Pt verbessern, ist die Verstärkungswirkung aufgrund ihrer ähnlichen Kristallstruktur wie Silber und ihrer hohen Löslichkeit gering, und die Anfangshärte ist im Allgemeinen niedrig. Zn wird üblicherweise als Hauptlegierungselement für anlaufbeständige Silberlegierungen verwendet, die mit anderen Elementen legiert sind, und die Verstärkungswirkung könnte besser sein. Daher haben die meisten anlaufbeständigen Silberlegierungen eine niedrige Gusshärte, in der Regel unter HV60, was für Schmuckprodukte mit bestimmten Festigkeitsanforderungen unzureichend ist. Zwar kann die Härte von Legierungen durch Verformung erhöht werden, doch kommen für die Herstellung der meisten Schmuckstücke nur Gussverfahren in Frage, so dass Verformungsmethoden nicht geeignet sind. Natürlich können einige Legierungen die Härte durch eine Alterungsbehandlung erhöhen, aber sie werden in der tatsächlichen Produktion oft nicht oder falsch eingesetzt, weil die Schmuckherstellung ein Handwerk mit mehreren Prozessen ist. Während der Herstellung der Formen, der Fassung der Edelsteine und sogar während des Polierens kann das Werkstück geschweißt oder erhitzt werden, was in der Regel durch Flammenerhitzung geschieht, wobei die Erhitzungstemperatur, die Erhitzungszeit und die Abkühlgeschwindigkeit recht willkürlich sind, so dass es im Allgemeinen schwierig ist, die von den Legierungslieferanten erwarteten Effekte zu erzielen. Sobald der Schmuck mit Edelsteinen besetzt ist, ist es außerdem nicht mehr möglich, eine Alterungsbehandlung zur Erhöhung der Härte durchzuführen, da die Edelsteine durch das Abschrecken bei hohen Temperaturen leicht beschädigt werden können.
Aus der Sicht der praktischen Anwendung ist es daher notwendig, die Härte der Legierungen im Guss- und Glühzustand zu verbessern. Im Hinblick auf Chinas Ressourcenvorteile sind Seltene Erden eine Überlegung wert.
2.3 Fragen im Zusammenhang mit dem Gießen
Die überwiegende Mehrheit der Schmuckstücke wird durch Gießen hergestellt, und mehrere Schmuckunternehmen haben eigene Gussabteilungen eingerichtet. Die Unternehmen kaufen in der Regel nur Füllstoffe von Legierungslieferanten und dann reines Silber, um die erforderliche Silberlegierung herzustellen. Während des Gießprozesses haben viele Unternehmen mit verschiedenen Problemen wie Porosität, Sandlöchern, Schrumpfung, Einschlüssen und Rissen zu kämpfen, die den normalen Produktionsablauf beeinträchtigen und die Produktionskosten erhöhen.
Sterlingsilber mit Cu als Hauptlegierungselement ist anfällig für Defekte wie Porosität und oxidierte Einschlüsse, wenn es nicht während des Schmelzens geschützt wird, wodurch die Viskosität des geschmolzenen Metalls erhöht wird. Der oxidierte Film, der sich an der Vorderseite des geschmolzenen Metalls bildet, erhöht die Oberflächenspannung, was zu einem erhöhten Füllwiderstand führt und die Umformleistung beeinträchtigt. Die daraus resultierenden Defekte, wie Porosität und Einschlüsse, erhöhen die Schwierigkeit des nachfolgenden Polierens erheblich.
Silberlegierungen, die hauptsächlich aus Pd, Pt und anderen Edelmetallelementen bestehen, haben einen höheren Schmelzpunkt, was die Wahrscheinlichkeit von Porosität erhöht. Dies liegt daran, dass für Schmuck hauptsächlich Gipsformen verwendet werden, und Gips hat eine schlechte thermische Stabilität; je höher der Schmelzpunkt der Legierung ist, desto größer ist die Möglichkeit der thermischen Zersetzung des Gipses, was zu Porosität in den Gussstücken führt.
Verschiedene Silberlegierungen mit Anlaufschutz enthalten unterschiedliche Arten und Mengen sauerstoffaktiver Elemente, die unterschiedliche Gießleistungen aufweisen. Si-Oxid hat eine niedrige Dichte und eine hohe Viskosität, so dass es leicht an der Oberfläche des geschmolzenen Metalls aufschwimmt und mit Hilfe von Flussmittel entfernt werden kann, was für die Fließfähigkeit und die Füllleistung von Vorteil ist. Zu viel Si kann jedoch zu thermischer Rissbildung und Polierproblemen führen; die Entfernung von Zn- und Sn-Oxiden ist schwieriger. Bei Silberlegierungen mit einem hohen Anteil an sauerstoffaktiven Elementen mit niedrigem Schmelzpunkt (z. B. Zn, Sn, In ) kann es beim Schmelzen mit dem Brenner leicht zu flüchtigen Bestandteilen und oxidierten Einschlüssen kommen, und auch die Induktionserwärmung kann aufgrund von Überhitzung zu ähnlichen Problemen führen. Ein geringer Zusatz von Seltenen Erden kann die Fülleigenschaften verbessern. Die Menge der Seltenen Erden nimmt jedoch bis zu einem gewissen Grad zu. In diesem Fall erhöhen die gebildeten Seltenerdoxide die Viskosität des geschmolzenen Metalls, was der reinigenden Wirkung der Seltenen Erden entgegenwirkt und die Gießleistung negativ beeinflusst.
Unter den oben genannten Problemen ist die Porosität eines der größten Probleme. Die Entstehung von Porosität ist eng mit den Eigenschaften der Silberlegierung selbst verbunden. Wie bereits erwähnt, hat Silber die typische Eigenschaft, im geschmolzenen Zustand eine große Menge an Sauerstoff zu absorbieren, was dazu führt, dass das geschmolzene Metall bei hohen Temperaturen spritzt, was leicht zu erheblichen Verlusten führt. Während des Erstarrungsprozesses beim Gießen nimmt die Gaslöslichkeit im geschmolzenen Metall mit sinkender Temperatur ab, was zu Gasübersättigung, Ausfällung und Vergrößerung führt, wodurch sich Blasen bilden, die nicht rechtzeitig entladen werden können, was zu Porosität führt (Abbildung 4-22).

Aus dem Mechanismus der Porenbildung geht hervor, dass es hauptsächlich zwei Ansätze zur Verringerung oder Vermeidung von Porendefekten gibt: (1) Minimierung der Gasmenge, die in die Metallschmelze gelangt; (2) Maßnahmen zur Freisetzung des Gases in der Metallschmelze vor dem Gießen.
(1) Verringern Sie den Gaseintritt in die Metallschmelze.
Zunächst muss die Qualität der Rohstoffe kontrolliert werden. Die Rohstoffe sollten trocken und sauber sein, nicht feucht oder ölig. Die gekauften Reinsilbermaterialien gibt es in Form von Granulat, Barren und Platten, wobei Granulat am häufigsten vorkommt. Da Granalien durch schnelles Abkühlen von Metalltropfen in Wasser entstehen, können sie manchmal hohl sein und sogar Wasser enthalten, wodurch beim Schmelzen eine große Menge an Gas entstehen kann. Sie müssen vor der Verwendung gründlich getrocknet oder zu Blöcken vorgeschmolzen werden. Wenn die Oberfläche des Rohmaterials Öl oder andere organische Verunreinigungen aufweist, kommt es ebenfalls zur Gasbildung, insbesondere bei der Wiederverwendung von Schrott aus gestanztem Schmuck, an dem oft Öl haftet. Sie sollten vor der Verwendung gründlich entfettet und gereinigt werden. Das Verhältnis von neuen und wiederverwendeten Materialien sollte beim Mischen der Materialien angemessen kontrolliert werden. Jedes Mal, wenn die Rohmaterialien geschmolzen und gegossen werden, werden sie verunreinigt, einschließlich Gasabsorption, Reaktion mit Gipsformen und Resteinschlüssen. Daher sollte die Menge der wiederverwendeten Materialien im Allgemeinen innerhalb von 50% kontrolliert werden.
Zweitens sollten beim Schmelzen wirksame Schutzmaßnahmen getroffen werden. In verschiedenen Unternehmen herrschen unterschiedliche Produktionsbedingungen, und auch die verwendeten Schmelzverfahren variieren. Zu den gängigen Schmelzverfahren gehören die Gas-Sauerstoff-Flamme, die Acetylen-Sauerstoff-Flamme, der Hochfrequenz-Induktionsofen und der Mittelfrequenz-Induktionsofen. Beim Schmelzen unter freiem Himmel nimmt das geschmolzene Metall unweigerlich Gas auf; je größer die Flüssigkeitsoberfläche und je länger die Kontaktzeit, desto größer ist die Tendenz, Gas, vor allem Luftsauerstoff, aufzunehmen. Beim Flammschmelzen kommt noch der von der oxidierenden Flamme eingebrachte Sauerstoff hinzu. Daher sollten während des Schmelzvorgangs Schutzmaßnahmen ergriffen werden, um die Gasabsorption zu verringern, wenn Silber in der Atmosphäre schmilzt; zerkleinerte Holzkohle, Graphitplatten oder dehydrierter Borax können als Abdeckung verwendet werden. Beim Flammenschmelzen sollte die Flamme auf eine orange-gelbe Reduktionsflamme eingestellt werden, und die Schmelzdauer sollte überschaubar sein. Wenn die Bedingungen es zulassen, sollte dem Vakuum-Induktionsschmelzen der Vorzug gegeben werden, das unter niedrigem Vakuum und Schutzgas durchgeführt werden kann. Dabei wird die Schmelzkammer zunächst evakuiert, dann mit Stickstoff oder Argon als Schutzgas aufgefüllt und anschließend erhitzt und geschmolzen. Stickstoff ist billiger, hat aber eine gewisse Löslichkeit in Silber, was die Gefahr der Porenbildung birgt; Argon ist teurer, aber stabiler in Silber und sollte daher bevorzugt werden.
(2) Förderung der Gasfreisetzung in der Metallschmelze vor dem Gießen.
Unter atmosphärischen Bedingungen nimmt geschmolzenes Silber unweigerlich Gas auf. Um die Bildung von Gasporen zu vermeiden, sollte das geschmolzene Metall vor dem Gießen einer Entgasungsbehandlung unterzogen werden, damit so viel in der Silberflüssigkeit gelöstes Gas wie möglich freigesetzt werden kann. Dabei können zwei Methoden angewandt werden:
A. Verwendung von schwebenden Gasblasen zur Entgasung. Durch Einblasen feiner, dichter Argonblasen in den Boden der Metallschmelze unter Verwendung eines atmungsaktiven Stopfens reagiert das Argon nicht mit der Metallschmelze und wird zu schwebenden Gasblasen. Die Blasen dienen als Vakuumraum für die in der Metallschmelze gelösten Gase, so dass die gelösten Gase in die schwebenden Blasen diffundieren und zu gasförmigen Molekülen werden, die mit den Blasen aufsteigen. Wenn die schwebenden Blasen an die Oberfläche des geschmolzenen Metalls aufsteigen, entweicht das Gas in den Blasen in die Atmosphäre, wodurch das Ziel der Reduzierung des Gasgehalts im geschmolzenen Metall erreicht wird.
B. Verwendung der Kondensationsmethode zur Entgasung. Die Silberflüssigkeit wird langsam auf die Erstarrungstemperatur abgekühlt, wodurch der größte Teil des gelösten Sauerstoffs und anderer Gase aufgrund der mit der Temperatursenkung abnehmenden Löslichkeit ausfällt und somit der Zweck der Entgasung erreicht wird. Anschließend wird sie zum Gießen schnell wieder auf die Gießtemperatur erwärmt. Bei Silberflüssigkeiten mit schlechter Rohstoffqualität und hohem Gasgehalt können mehrere Zyklen der Kondensation und des Umschmelzens durchgeführt werden, um ihre Qualität zu verbessern.
2.4 Probleme bei der Kaltverarbeitung
Probleme bei der kalten Verarbeitung in der Produktion von Silber-Schmuck, gemeinsame kalte Verformung Verarbeitungstechniken gehören kalten Volumen Schmieden wie Kaltstauchen, Kaltfließpressen, Stanzen, etc. und Blech Stanzen wie Stretching, Schneiden, Schneiden, Stanzen, etc. Materialwalzen, wie Kaltwalzen, Walzprofilieren usw., und die folgenden Probleme treten bei der Verarbeitung häufig auf.
(1) Oberflächen-Sandlöcher von Profilen.
Die Oberflächenqualität von Profilen hängt nicht nur von der Oberflächenqualität des Blocks ab, sondern ist auch eng mit der Oberflächenqualität der Walzen verbunden. Wenn die Walzenoberfläche Kratzer oder lokale Beschädigungen aufweist, werden diese auf der Profiloberfläche reproduziert; wenn sich Staub oder andere Verunreinigungen auf der Walzenoberfläche ansammeln, werden sie in die Profiloberfläche gepresst, wodurch sich die Oberflächenqualität des Profils verschlechtert (Abbildung 4-23). Daher sollte die Walzenoberfläche während der Produktion häufig abgewischt werden, um zu verhindern, dass sich Staub und andere Verunreinigungen ansammeln und die Walzen verkratzen oder in die Bandoberfläche gedrückt werden. Die Walzen sollten abgedeckt werden, wenn sie nicht in Gebrauch sind, um die Oberfläche zu schützen. Der Durchmesser der Walzen des Endprodukts sollte klein und hochglanzpoliert oder galvanisch beschichtet sein, um einen Spiegeleffekt zu erzielen.

(2) Glühfehler.
Dazu gehören Blasenbildung, abnormales Kornwachstum und unvollständiges Glühen.
A. Blasenbildung. Die Blasenbildung auf der Oberfläche von Blechen und Bändern wird durch Gaslöcher im Barren oder durch Reaktionen zwischen dem Barren und der Atmosphäre während des Glühens verursacht. Der Druck steigt, wenn die Blasen erhitzt werden, wodurch sich das die Blase umgebende Metall ausdehnt und Blasen bildet (Abbildung 4-24). Dieses Problem lässt sich in der Regel durch Steuerung der Gieß- oder Glühbedingungen vermeiden. So wird beispielsweise die Desoxidation während des Schmelzvorgangs verbessert, der Gehalt an gelöstem Sauerstoff und die Oxidation im geschmolzenen Metall verringert, die Glühtemperatur kontrolliert und die Verwendung wasserstoffreicher Glühatmosphären vermieden.
B. Abnormales Kornwachstum. Silber weist ein erhebliches Kornwachstum auf, wenn die Glühtemperatur zu hoch ist oder die Glühzeit bei hoher Temperatur zu lang ist (Abbildung 4-25). Übermäßig grobe Körner beeinträchtigen die mechanischen Eigenschaften und wirken sich stark auf die Oberflächenqualität des verarbeiteten Schmucks aus. Daher sollte das Glühverfahren in Abhängigkeit von der Größe und Qualität des Profils sinnvoll gestaltet werden.
Abbildung 4-24 Blasenbildung auf der Oberfläche von Silberprofilen nach dem Glühen

Abbildung 4-25 Abnormales Kornwachstum, verursacht durch unsachgemäßes Glühen von Silber
C. Unvollständiges Glühen. Verschiedene Silberlegierungen haben unterschiedliche Rekristallisationstemperaturen. Wenn die Glühtemperatur zu niedrig ist, die in den Ofen eingebrachte Menge zu groß ist oder eine ungleichmäßige Erwärmung mit einem Brenner erfolgt, kann es zu unvollständigem Glühen kommen. In diesem Fall verbleiben Eigenspannungen im Profil, die die nachfolgende Verarbeitung beeinträchtigen und zu Fehlern wie Rissen führen.
2.5 Fragen im Zusammenhang mit dem Polieren
Schmuck stellt hohe Anforderungen an die Oberflächenqualität, und die meisten Schmuckstücke müssen poliert werden, um eine spiegelglatte Oberfläche zu erhalten. Beim Polieren von anlaufgeschützten Silberlegierungen treten häufig mehrere typische Probleme auf, wie Orangenhaut, Dellen, Kratzer und Kometenschweife. Wenn die Körnung der Legierung grob ist, neigt sie zur Bildung einer Orangenhautoberfläche; wenn Schrumpfungs- oder Porositätsfehler in der Legierung vorhanden sind, ist die Bildung von Polierdellen wahrscheinlich; wenn segregierte Phasen oder Einschlüsse mit hoher Härte in der Kornstruktur der Legierung auftreten, bilden sich leicht Polierkratzer und Kometenschweife.
Um einen guten Oberflächenpoliereffekt zu erzielen, müssen nicht nur die Poliervorgänge korrekt ausgeführt werden, sondern auch die Eigenschaften der Legierung selbst haben einen wichtigen Einfluss. Die Kornfeinung und die Verbesserung der Gussleistung sind die wichtigsten Möglichkeiten zur Verbesserung der Polierleistung.