Hur man förhindrar silverfläckning och applicerar elektrolös silverplätering
Silverplätering och antifärglösningar för smycken
Inledning:
Den här artikeln förklarar hur man förhindrar att silver och silverpläterade föremål missfärgas, ett vanligt problem där ytor mörknar på grund av reaktioner med svavel eller ljus. Den beskriver olika antifärgbehandlingar, inklusive oorganiska metoder som kromat- eller tennelektrolys, organiska föreningar som blötläggs och ytaktiva applikationer. Texten täcker också vad elektrolös silverplätering är, och utforskar både förskjutningsplätering för substrat som kopparkretsar och reduktionsplätering med hjälp av medel som formaldehyd eller hydrazin. Slutligen beskrivs varför och hur man analyserar nyckelkomponenter i cyanidsilverpläteringslösningar, såsom silverjoner och fri cyanid.

Innehållsförteckning
Avsnitt I Behandling för att förhindra silverfläckar
På grund av den höga reaktiviteten hos Ag-pläteringsytan är den silverpläterade ytan benägen att missfärgas vid kontakt med korrosiva medier (t.ex. H2S, SO2). Ljus ger också överskottsenergi till pläteringsytan, vilket främjar joniseringen av Ag och reaktionen mellan Ag och det korrosiva mediet.
Tabell 2-28 visar effekterna av ljusvåglängd och exponeringstid på missfärgningen av Ag. Tabell 2-29 visar effekterna av exponeringstid på färg och kemisk sammansättning.
Tabell 2-28 Effekt av ljusvåglängd och exponeringstid på färgförändringen av Ag
| Ray | Exponeringstid/h | ||||
|---|---|---|---|---|---|
| 6 | 12 | 18 | 24 | 48 | |
| 2527Å | Ingen förändring i färg | Gula fläckar | Gulaktigt brun | Brunaktigt svart | Brun |
| 3650Å | Ingen förändring i färg | Ingen förändring i färg | Ingen förändring i färg | Gul | - |
| Solljus | Ingen förändring i färg | Ingen förändring i färg | Ingen förändring i färg | Gula fläckar | - |
Tabell 2-29 Exponeringstidens inverkan på färg och kemisk sammansättning hos den silverpläterade ytan
| 2537Å Exponeringsfärg för ljus/h | 6 | 12 | 18 | 24 | 48 |
|---|---|---|---|---|---|
| Färg | Silver | Gul | Gulaktigt brun | Brunaktigt svart | Svart |
| Huvudsaklig kemisk sammansättning | Ag (metall) | Ag2O+AgO | Ag2O+AgO | AgO+Ag (Superfina) | Ag (Superfine) |
Från dessa resultat kan man se att missfärgningsprodukterna är silversulfider, oxider, klorider eller silverpartiklar. Färgen på Ag-pläteringen efter missfärgning varierar beroende på den kemiska sammansättningen. Denna typ av färgförändring påverkar inte bara silverpläteringens dekorativa utseende utan ökar också det elektriska motståndet hos Ag-pläteringen, vilket är skadligt för silverpläteringens elektriska egenskaper.
Av dessa missfärgningsmekanismer hos Ag-pläteringsskiktet framgår att det bara är nödvändigt att undvika kontakt mellan pläteringsytan och syre, ljus och korrosiva medier för att förhindra missfärgning av silverpläteringsskiktet. Samtidigt bör bildandet av ett tätt ämne (filmskikt) på ytan som kan absorbera ultravioletta strålar ha en hämmande effekt på missfärgningen av pläteringsskiktet.
Bland de traditionella metoderna för att förhindra missfärgning av Ag-pläteringsskikt finns metoder med oorganiska föreningar, metoder med organiska föreningar, metoder med ytaktiva ämnen och kombinerad användning av dessa metoder.
1. Metod för behandling av oorganiska föreningar
För att jämföra effekterna av olika antifärgbehandlingar pläterades provbitarna med 2~3μm Ag och blötlades sedan i en koncentration av 0,2% ammoniumpolysulfidlösning [(NH4)2SX] under en viss period. Visuell inspektion användes för utvärdering. När visuell inspektion var omöjlig användes en digital glansmätare för att mäta den spekulära reflektansen, och skillnaden △ före och efter blötläggning i ammoniumpolysulfidlösningen beräknades. Samtidigt användes också en glansmätare för mätning vid exponeringstester inomhus.
Som antifärgbehandling för Ag testades metallfilmer eller metalloxidfilmer med samma ton som Ag, t.ex. In, Zn, Cd, Cr, Pd, Rh, Sn, Be, Al, Th och Zr. Bland dem uppvisade den elektrolytiska behandlingen av kromat den mest enastående antifärgfunktionen och tillämpades i stor utsträckning. För det andra finns Rh och Be också bland alternativen.
(1) Behandling av ädelmetaller
Elektroplätering av Rh- och Pd-legeringar utfördes under optimala förhållanden, följt av experiment med tonförändringar och missfärgningsbeständighet. Resultaten visas i tabell 2-30. Spegelreflektansen för Rh är 70%, medan spegelreflektansen för legeringen (Pd80:Ni20) är ca 57%. Även om pläteringstjocklekarna skiljer sig åt kan det finnas en viss korrelation. Pläteringstjockleken på Rh är 0,1 μm och pläteringstjockleken på Pd-Ni är 0,3 μm. När pläteringstjockleken på andra metaller på Ag ökar försvinner silverfärgen på det underliggande silverskiktet. Genom att visuellt jämföra ton, ljusstyrka och relativa värden för spekulär reflektans fann man emellertid att när den spekulära reflektansen är 80% blir skillnaden från silverfärgen uppenbar och 70% är dess gräns. Under detta försvinner silverfärgen och ändras till en annan metallfärg. Därför, ur tonperspektivet, är en Rh-pläteringstjocklek under 0,1 μm mer lämplig. Ändå är dess missfärgningsbeständighet otillräcklig, medan Pd-Ni-legeringens pläteringsskikt är tjockare och har god missfärgningsbeständighet. Att använda ädelmetaller innebär ökade kostnader, men de erbjuder bra läkemedels- och slitstyrka. Ju bättre missfärgningsbeständighet, desto mer försvinner den ursprungliga silverfärgen. Det är därför mycket svårt att förbättra missfärgningsmotståndet utan att ändra silverpläteringens ton och ljusstyrka.
(2) Behandling av tenn och tennlegeringar
Legeringar av Cu och Sn kallas spegellegeringar. När Sn-innehållet är över 60% är deras färg silvervit och den spekulära reflektansen är också hög med god korrosionsbeständighet. Därför har de studerats sedan urminnes tider och använts som spegelytor i reflekterande teleskop. När de används som silveranti-tjärningsbeläggningar fungerar de ganska bra mot tjärning i 5 ~ 6 timmar. Den spekulära reflektansen sjunker dock till ca 65% och förlorar tydligt silverfärgen. Spegellegeringarnas användbarhet beror på graden av färgton. Även om de är billigare än ädelmetaller uppstår en potentialskillnad mellan ädelmetallen Ag och Cu-Sn-legeringen när filmtjockleken ökar till flera tusen angström, vilket kan orsaka problem med korrosionsbeständigheten.
Förutom Sn-legeringsplätering kan Sn-metall eller Sn-föreningar som fälls ut genom elektrolytiska eller blötläggningsbehandlingar på 50 ~ 100Å också ha missfärgningsbeständighet och förbättrad väderbeständighet. Som en tjärbehandling kan den upprätthålla stabiliteten i kontaktmotståndet hos kontakter under lång tid.
Försöksresultaten visas i tabell 2-30. Jämfört med alkaliska och sura lösningar har delar som behandlats med sura lösningar en dimmig vit fällning och kan inte användas för dekorativa ändamål. Delar som behandlats med alkaliska lösningar och elektrolytiska behandlingar uppvisar däremot inga problem på kort sikt.
Tabell 2-30 Oorganiska föreningars motståndskraft mot missfärgning på silverpläterade ytor
| Serienummer | Lösningens sammansättning | Villkor för bearbetning | Villkor för förekomsten av skenbar färg | Notera |
|---|---|---|---|---|
| 1 |
PNP (Nissin Kasei, Japan) Pd-Ni-legeringsbeläggning |
DK lA/dm2 Rumstemperatur 1 minut
|
Över 6 timmar | Förlust av silverfärg, dålig CN- motstånd |
| 2 |
Tenn(Daiya Shokai) Plätering av Cu-Sn-legering
|
3V 55℃ 40s
|
Över 6 timmar | Förlust av silverfärg |
| 3 |
Na2Cu(CN)3 24 g/L Na2SnO3 90 g/L Fri NaCN 16g/L NaOH
|
Dk 2A/dm2 60℃ 30s
|
Över 6 timmar | Förlust av silverfärg, bättre än silverfärgen på 1 och 2. |
| 4 |
Na2SnO3 90 g/L CH3COONa 0g/L,5g/L,10g/L
|
DK 0. 5 A/dm2 Rumstemperatur 15〜90s
|
10 〜20s | Lägga till CH3COONa kan stabilisera lösningen, och ju längre elektrolystiden är, desto stabilare är den, men den kommer att förlora sin silverfärg. |
| 5 |
SnCl2 20 g/L 0. 025NHCl 50mL/L
|
Rumstemperatur 1 minut
|
10 minuter | |
| 6 |
SnCl2 20 g/L 0,025NHCl 50mL/L
|
DK 0. 1 〜 2A/dm2 Rumstemperatur, 10 sekunder
|
10 minuter | Vit |
|
Rumstemperatur ,1min, 10min |
Något gulnad | |||
| 7 | Tennfluoroborat 3% |
DK 0. 1 ~ 2 A/dm2 Rumstemperatur , 10s
|
- | Vit |
| Rumstemperatur ,1min, 10min | 10 minuter | Något gul | ||
| 8 |
Stannsulfat 20g/L Jodsyra 30mL/L
|
DK 0. 1 〜 2 A/dm2 Rumstemperatur ,10s
|
- | Vit |
| 9 |
Stannous fluoroborate 20mL/L Fluorvätesyra 30mL/L Fluoroborsyra 20g/L
|
Rumstemperatur , 1min, 10min DK 0. 1 〜2 A/dm2 Rumstemperatur ,10s |
10 minuter - |
Svagt gulaktig Vit
|
| Rumstemperatur, 1min, 10min | 10 minuter | Något gul | ||
| 10 |
BeSO4 , 4H2O 2g/L pH = 5,7〜5. 8
|
DK 0. 007 A/dm2 Rumstemperatur 3〜10min
|
Över 1 timme | |
| 11 |
BeSO4 , 4H2O 2g/L pH = 5,8
|
1 〜2. 4V 20s~4min
|
20 minuter | |
| 12 | EverShine S (Tamura Chemical) |
6.5V Rumstemperatur 90s
|
15 minuter | |
| 13 |
K2CrO4 15 g/L NaOH 30g/L
|
2〜6V Rumstemperatur 15〜120s
|
10 〜30s | Ju längre elektrolys, desto bättre |
| 14 |
K2CrO4 30 g/L NaOH 40g/L
|
DK 4A/dm2 Rumstemperatur 30〜40s
|
Vit dimma Ingen silverfärg
|
|
| 15 |
K2CrO4 30 g/L NaOH 40g/L Uppvärmning 20h
|
Vit dimma Ingen silverfärg
|
||
| 16 |
Al2(SO4)3 4g/L Ammoniumoxalat 2g/L pH = 5,8
|
DK 0,06A/dm2 Rumstemperatur 30s〜1min
|
20 〜30s | Samma tid som utan behandling |
| 17 | Natriumkarbonat | |||
| 18 |
Na2SnO3 8. 5 g/L CH3COONa 5g/L (nr 4)
|
DK 0. 5A/dm2 15 〜30s Rumstemperatur
|
Över 6 timmar | |
|
K2CrO4 15 g/L KOH 30g/L (nr 13)
|
2〜3V 30s Rumstemperatur
|
|||
| 19 |
K2CrO4 15 g/L KOH 30g/L K2CO3 50 g/L
|
6V 15 〜60s
|
10 〜30min |
(3) Behandling av beryllium
Att fästa en berylliumoxidfilm på Au, Cu och mässing som en färgförändrande behandling kan uppnå god effekt. Principen som används av denna metod är: den isoelektriska punkten för berylliumhydroxid är pH = 5,8, och följande elektrolytiska reaktion kan inträffa:
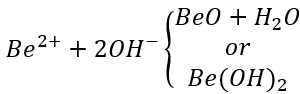
(4) Behandling av aluminium
Det finns rapporter om oxidfilmsbildning som liknar Be; ytterligare experiment visade ingen skillnad mellan behandlade och obehandlade prover, och oxidfilm kunde inte bildas.
(5) Kromatbehandling
Silverplätering är den vanligaste metoden för antifärgbehandling av mässingsplätering. Det finns två kromatbehandlingsmetoder: katodisk elektrolys och blötläggning, men den katodiska elektrolysmetoden är mycket överlägsen.
Additiv som används i kromatelektrolyter inkluderar: K2CO3, Na2CO3, KCN, NaS2O3, KCNS, NaCl, KI, EDTA, etc. Bland dem är K2CO3 experimentella resultat visade att det också kan fungera som ett ledande salt och därmed förkorta elektrolysens behandlingstid jämfört med när det inte tillsätts. Effekterna av de andra tillsatserna visade inga signifikanta skillnader.
Nackdelen med kromatelektrolysbehandling är att filmen har dålig UV-beständighet och blir brun efter att ha legat under lång tid.
2. Behandling med organiska föreningar och ytaktiva ämnen
Tabell 2-31 Experiment med organiska föreningar för att motverka missfärgning
| Kategorisering | Serienummer | Organiska föreningar | Fysikaliska egenskaper | Löslighet | Villkor för bearbetning | Utseende | Hydrofobicitet | Anti-missfärgningseffekt |
|---|---|---|---|---|---|---|---|---|
| Alifatisk amin | 1 |
Etylamin (70% vattenlösning) CH3CH2NH2
|
Mw 45. 09 d15 0. 6892 Smältpunkt 83,3℃ Kokpunkt 16℃ |
(Vattenhaltiga) alkoholer Eter
|
0. 1mol/L (0,65mL/L) 0. 01mol/L (6,5 mL/L) Rumstemperatur,20min,60min |
pH 10〜11 Färglös Transparent O |
X | X |
| 2 |
Dodecylamin CH2(CH2)11NH2 |
Mw 18. 5 Smältpunkt 25℃ Kokpunkt 247℃ |
Aceton (Etanol) |
0. 1mol/L (18,5g/L) Rumstemperatur, 20 minuter,60 minuter |
Färglös Transparent Vattenfläck |
X | X | |
| 3 |
Tributylamin (CH3CH2CH2CH2)3N |
Mw 185 d 0. 7782 Kokpunkt 216,5 ℃ |
(Etanol) Eter
|
0. 1mol/L (24mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent O |
X | X | |
| Aromatiska aminer | 4 | O-Toluidin |
Mw 107. 16 d20 0. 9989 Kokpunkt 199. 7℃ |
Vatten 1. 5 (25) (Etanol) Eter |
0. 1mol/L (24mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Rödbrun transparent O |
X | X |
| 5 | Difenylamin |
Mw 169.23 d 1.159 Kokpunkt 302℃ |
(Etanol) 56 Eter |
0. 1mol/L (17g/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös transparent Vattenfläck |
X | X | |
| Diaminer, polyaminer | 6 | H2N(CH2)2NH2 |
Mw 45.09 d35 0.892 Smältpunkt 8,5 ℃ Kokpunkt 117℃ |
(vatten) Etanol |
0,1mol/L (6,7mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 10〜11 O |
X | X |
| Diaminer, polyaminer | 7 |
Dietylentriamin H2 N(CH2 )2 NH(CH2 )2 NH2 |
Mw 103 Kokpunkt 208℃ |
(vatten) Etanol |
0. 1mol/L (10mL/L) Rumstemperatur, 20min,60min |
Färglös Transparent pH 10〜11 O |
X | X |
| 8 |
Trietylentetramin H2 N(CH2 )2 NH(CH2 )2 NH2 (CH2 )2 NH2 |
Mw 146 Smältpunkt 208℃ Kokpunkt 174℃ |
(vatten) |
0,1mol/L (15mL/L) Rumstemperatur, 20 minuter,60 minuter |
Färglös Transparent pH 10〜11 O |
X | X | |
| Aminoalkoholer | 9 |
Trietylentetramin H2N(CH2)2NH(CH2)2 NH(CH2)2NH2 |
Mw 189 | (vatten) |
0. 1mol/L (19mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 10〜11 O |
X | X |
| 10 |
Etanolamin HO(CH2)2NH2 |
Mw 61.09 d27 1.0111 Kokpunkt 171℃ |
(vatten) Etanol |
0. 01mol/L (0,61mL/L) 0,1 mol/L (6,1 ml/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 9〜10 O |
X | X | |
| 11 |
Dietanolamin (HOCH2CH2)2NH |
Mw 105.14 d20 1.0916 Smältpunkt 28℃ Kokpunkt 268℃ |
(vatten) Etanol |
0. 01mol/L (0,96mL/L) 0,1mol/L (9,6mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 9〜10 O |
O | X | |
| 12 |
Trietanolamin (HOCH2CH2)3NH |
Mw 149.19 d20 1.124 Smältpunkt 21,2℃ Kokpunkt 227℃ |
(vatten) Etanol |
0. 01mol/L (1,3 ml/L) 0,1mol/L (13mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 9〜10 O |
O | X | |
| 13 |
2N-dietylamin (CH2)2NCH2CH2OH |
Mw 93.1 Kokpunkt 39,5 ℃ |
(vatten) |
0. 1mol/L (0,89mL/L) 0. 01mol/L (8,9mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 9〜10 O |
O | X | |
| 14 | 2-Amino-2-ethyl-1,3-propanediol | Mw 105 | (vatten) |
0,01mol/L (1,1g/L) 0. 1mol/L (11g/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 9〜10 O |
O | X | |
| Amid | 15 | Acetamid |
Mw 59.07 d 1.159 Smältpunkt 52,62℃ Kokpunkt 221℃
|
(vatten) Etanol |
0. 1mol/L(5,1mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent O |
△ | X |
| 16 | Akrylamid |
Mw 71.1 d 1.122 Smältpunkt 85℃ |
(vatten) Etanol Eter Triklormetan
|
0. 1mol/L(7,1mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent O |
△ | X | |
| 17 | Bensylamin |
Mw 121.14 d 1.341 Smältpunkt 128℃ Kokpunkt 290℃ |
(vatten) Etanol
|
0. 1mol/L(12g/L) 30℃ Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent O |
O | X | |
| Oxime | 18 | Butanedionoxim |
Mw116.12 Smältpunkt 240℃ |
(Etanol) Eter (Vatten) |
0. 01mol/L (0,12g/L) 0. 001mol/L (1,2gmL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent O |
X | X |
| 19 | Benzohydrinoxim |
Mw227 Smältpunkt 154℃ |
(Etanol) (Ammoniak)
|
0,01mol/L (0,23g/L) 0. 001mol/L (2,3g/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent △ |
X | X | |
| Pyridin | 20 | Pyridin |
Mw 79.10 d20 0.977 Kokpunkt 115,5℃ |
(vatten) Etanol |
0. 001mol/L (0,1mL/L) 0,1mol/L (8mL/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent O |
X | X |
| Kinolin | 21 | Kinolin |
Mw 127.16 d20 0.938 Smältpunkt -15℃ Kokpunkt 238℃ |
Varmt vatten, utspädd syra, etanol, eter, koldisulfid (6mol/L HCl) 2~20mol/L |
0,1% (1g/L) 1% (10 g/L) Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 2~4 O |
O | X |
| 22 | Karboxykinolin |
Mw 145 Smältpunkt 75~76℃ |
Etanol, aceton, triklormetan, bensen (6mol/L HCl) 2~20mol/L |
0,1% (1g/L) 1% (10 g/L) Rumstemperatur, 20 minuter, 60 minuter |
Gul Transparent pH 2~4 O |
X | X | |
| Kinolin | 23 | Butanedionoxim | Mw 256 |
Oorganisk syra (6mol/L HCl) 40mol/L Etanol |
0,1% (1g/L) 1% (10 g/L) Rumstemperatur, 20 minuter, 60 minuter |
Gul Transparent pH 10~11 O |
X | X |
| Diazoföreningar | 24 | p-Etoxi-2,4-diaminoazobensen | Mw 256 |
Oorganisk syra (6mol/L HCl) 40mol/L Etanol |
0,1% (1g/L) 1% (10 g/L) Rumstemperatur, 20 minuter, 60 minuter |
Röd Transparent O |
O | X |
| Hydroxikarboxylsyra | 25 | Garvsyra | Gulaktigt vit, ljus färg, pulver |
(vatten) Etanol Aceton |
0.1% 0.1% 5% |
Färglös Transparent pH 6 Gul transparent pH-värde 4 Gulaktigt brun transparent pH 2 |
X | X |
| Tiourea | 26 | 1-Acetyl-2-tiourea |
Mw 118.16 Smältpunkt 165℃ |
(vatten) Alkohol |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 7 O |
O | X |
| Tiourea | 27 | Aminothioureas |
Mw 95.6 Smältpunkt 81~183℃ |
(6mol/L HCl) 50mL/L |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 1 O |
X | X |
| 28 | Ditizon | Mw 256 |
(Triklormetan) Koltetraklorid |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Blå vattenfläck Blir gul |
O | X | |
| Monosackarid | 29 | Askorbinsyra (C-vitamin) |
Mw 176 Smältpunkt 190~192℃ |
(vatten) |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 1 O |
X | X |
| Imidazoler | 30 | 1-Acetyl-2-tiourea |
Mw 155 Nedbrytning 287~288℃ |
Metanol Vatten 45mL
|
1g/L, 10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 1 O |
X | X |
| 31 | 2-Heptadecylimidazol |
Metanol 55mL Vatten 45mL Upplösning Alkohol, syra |
1g/L, 10g/L Rumstemperatur, 20 minuter, 60 minuter |
Vit upphängning Ojämn Vit vidhäftning |
O | O | ||
| Benzimidazoler | 32 | 2-merkaptopyridin |
Mw 150 Smältpunkt 301~302℃ |
Metanol 15mL Vatten 45mL Varmvatten Etanol NaOH |
1g/L, 10g/L Rumstemperatur, 60 ℃ 20 minuter, 60 minuter |
Färglös transparent O |
O | X |
| Triazoler | 33 | 3-Amino-1,2,3-triazole |
Mw 159 Smältpunkt 159℃ |
(vatten) Etanol Triklormetan |
Rumstemperatur, 60 ℃ 1min, 10min, 60min |
O | - | X |
| Bensotriazol | 34 | Bensotriazol |
Mw 119.13 Smältpunkt 99℃ |
Varmvatten Alkohol |
12g/L, pH 6 60℃ 1min, 3min, 10min
|
Färglös Transparent O |
- | X |
| Triazin | 35 | Trietylendiamin |
Mw 140 Sublimering över 230°C |
(vatten) Återfuktar (CN2)2N Triklormetan Alkohol |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 8 O |
X | X |
| Oxazol | 36 | 2-Oxobenzazol |
Mw 1151 Smältpunkt 143,2℃ |
Ammoniak 6mol/L ammoniak 200mL/L Ättiksyra Eter |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 10 O |
O | X |
| (Oxo)zines | 37 | Morfolin |
Mw 87.12 d13 1.0007 Kokpunkt 128℃ |
(vatten) Alkohol Eter |
10g/L Rumstemperatur, 20 minuter, 60 minuter |
Färglös Transparent pH 9~10 O |
X | X |
| Tiazol | 38 | Ortanin |
Mw 264 Smältpunkt 200~246℃ (Nedbrytning) Röda nålliknande kristaller
|
Starka syror Tät Triklormetan Eter Bensen (aceton)
|
1g/L Rumstemperatur, 20 minuter, 60 minuter |
Röd transparent (Röd fällning) Brun vattenfläck |
O | X |
| Benzothiazole | 39 | Benzothiazole |
Mw 135.39 d12 1.2349 Kokpunkt 231℃ |
(Etanol) Etyleter |
1g/L Rumstemperatur, 3 minuter, 60 minuter |
Rödaktigt brun Transparent O |
△ | X |
| 40 | 2-Hydrofobisk bensotiazol |
Mw 167 Smältpunkt 177℃ |
Etanol Etyleter Bensen Ättiksyra Kaliumkarbonat Kaliumhydroxid Natriumhydroxid 2g/L |
1g/L Rumstemperatur, 3 minuter, 60 minuter |
Vit grumlig pH 10 O |
X | O | |
| Naftalener | 41 | Naftalenbesparande medel |
Mw 217 Smältpunkt 109,5 ℃ |
Vatten (20℃) 0,01 g/L |
0,2 g/L (nederbörd) Rumstemperatur, 2 minuter, 10 minuter, 30 minuter |
O | - | X |
| Isoaceton |
10g/L Rumstemperatur, 10 minuter, 60 minuter |
Gul transparent Vattenfläck
|
O | O | ||||
|
Isoaceton 50% Vatten 50% |
5 g/L Rumstemperatur, 10 minuter, 60 minuter |
Gul transparent Vattenfläck
|
O | O |
Tabell 2-32 Experiment med ytaktiva ämnen för att motverka missfärgning
| Serienummer | Namn (företagets namn) | Status | Koncentration | Villkor för bearbetning | Utseende | Hydrofobicitet | Inhiberande effekt | Anmärkningar |
|---|---|---|---|---|---|---|---|---|
| 1 | Rostförebyggande medel MC- 501 (Japan Lion Grease) |
Ljusröd transparent,d 1,06 pH 8. 0〜8. 5 |
2%,10% | Rumstemperatur 20min, 60min | O | O | Ag:x | |
| 2% | Rumstemperatur 15s, 10 minuter | O | O | Cu:Tappvatten nedsänkning X, exponeringstest △ | 15s bättre | |||
| 2 | Enajiko-ru CNS (Japan Lion Grease) |
Amfoterisk pH 8〜9 |
1% | Rumstemperatur 20 min, 60 min (Ag)15s, 10 min (Cu) | O | O | Ag:x Cu:Tappvatten nedsänkning X, exponeringstest: | 1% 15s bra |
|
15% Natriumbensensulfonat 15% (neutral)
|
Rumstemperatur 20min,60min (Ag)15s, 10min(Cu) | Brun, vit fällning vidhäftning | O | |||||
|
10% Kaliumpyrofosfat 5% (alkalisk) |
Rumstemperatur 20min,60min (Ag) 15s, 10min (Cu) |
Vit grumlighet O |
O | |||||
| 3 | Ripa-ru OH- 104P (Japan Lion grease) | 0.1% | Rumstemperatur 20min,60min |
Färglös och transparent O Gulaktigt vit grumlig O
|
O △
|
Ag:x | ||
| 1% | ||||||||
| 10% | ||||||||
| 4 | Dyuomin CD (Japan Lion Grease) | 0.1% | Rumstemperatur 20min,60min |
Vitt molnigt O Gula leriga strimmor O
|
O | Ag:x | ||
| 1% | ||||||||
| 10% | ||||||||
| 5 | Dyuomin CDA-50 (Lion Grease, Japan) | 0.1% | Rumstemperatur 20min,60min |
Färglös och transparent O
|
△ O
|
Ag:x | Något bättre vid 60 min | |
| 1% | ||||||||
| 10% |
Grumligt gul O |
|||||||
| 6 | FC-98 (Kanto Chemical, Japan) | Anjoniskt vitt pulver innehållande fluor |
0.1% 1%
|
Rumstemperatur 20min,60min |
Färglös och transparent pH 5~7 Fläckiga märken
|
O | ×(Ag) | |
| 7 | FC-134 (Kanto Chemical, Japan) | Fluoridinnehållande syrejon te-brunt pulver |
0.1% 1% (Etanol) |
Rumstemperatur 20min, 60min 5 minuter, 30 sekunder |
Gul transparent, Transparent gulbrun pH 6 Fläckiga märken
|
O | ○(Ag) | Märkena försvinner när temperaturen sänks |
| 8 | Soft-data-jento W (Japan Lion grease) | Katjoniskt Vitt pulver | 1% | Rumstemperatur 20 min |
Vit grumlig pH 7 O
|
X | X |
OH RCH2CH(CH2)nSO3Na (MIX) α-Allylsulfonat
|
| 9 | Ripomin COH (Japan Lion Grease) | Amfoterisk vätska | 1% | Rumstemperatur 20 min |
Vit grumlig pH 8 O
|
O | X | Imidazolyl |
| 10 | Perettex TR (Kao, Japan) |
Katjonisk Färglös transparent
|
1% | Rumstemperatur 20 min |
Vit grumlig pH 10 O
|
O | X |
RODC-CH-SO3N4R-OOC-CH3 Natriumdipropylsulfosuccinat
|
| 11 | Ema-ru 20C (Kao, Japan) |
Katjonisk Ljusgul vätska
|
1% | Rumstemperatur 20 min |
Färglös grumlighet pH 7 O
|
X | X |
R-O(CH2 OH)nSO3Na Polyoxietylenalkylsyror
|
| 12 | Koutamin 24P (Kao, Japan) |
Anjonisk Vit fast substans
|
1% |
Färglös och transparent pH 7 O
|
O | X | Trimetylamin | |
| 13 | Perettex # 1222 (Kao, Japan) | Icke-jonisk | 1% | Rumstemperatur 20 min |
Vitt molnigt O
|
O | X | |
| 14 | Perettex # 1265 (Kao, Japan) | Icke-jonisk | 1% | Rumstemperatur 20 min |
Färglös och transparent O
|
O | X | |
| 15 | Soft-kurin QA-1 (Miyoshi, Japan) |
Amfoterisk Vit Solid
|
1% | Rumstemperatur 20 min |
Färglös grumlighet pH 7 O
|
O | X | β-alanin typ |
| 16 | Soft-kurin MA-3-70 (Miyoshi, Japan) | Amfoterisk | 1% | Rumstemperatur 20 min |
Färglös och transparent pH 8 O
|
O | X | |
| 17 | Marusenokku AgT (Japan Ma-ruseru) | Anti-tarnish-medel för silver |
3 ml/L 30mL/L
|
Rumstemperatur 30 sekunder, 60 minuter |
Vitt molnigt pH 8 Adhesion
|
O | △ | Se bruksanvisningen |
| 18 | Dainshiruba-SS (Yamato Kasei, Japan) | Anti-tarnish-medel för silver |
10% Isopropyl Keton 50% Vatten 10%
|
25~30℃ 4 minuter, 20 minuter, 60 minuter
|
Färglös och transparent pH 8 O
|
O | X | Se bruksanvisningen |
| 19 | T611 (Uemura Kogyo, Japan) | Anti-tarnish-medel för silver |
Vätska 10% 90%
|
Rumstemperatur 30 sekunder, 2 minuter, 10 minuter, 60 minuter | Färglösa genomskinliga fläckar | O | O | Se bruksanvisningen |
| 20 | Roukorinsu- eido (Aikorouko, Japan) | Anti-tarnish-medel för silver | 1% | Rumstemperatur 31min, 5min, 30min |
Vitt molnigt pH 7 O
|
O | X | För användning i elektronikfabriker |
Bland organiska föreningar är de med en anti-Ag-missfärgningseffekt när de blötläggs i 0,2% ammoniumpolysulfidlösning 2-17 alkanimidazol, 2-merkaptobenzimidazol och komplexbildare.
Organiska föreningar med dessa anti-missfärgningseffekter har följande egenskaper:
① Behandlingen utförs i en alkalisk region nära pH 7.
② Innehåller hydrofoba grupper (långkedjiga alkyl- och fenylgrupper).
③ Innehåller dimetylamingrupper eller -SH-grupper eller innehåller dubbelbindningar.
④ Olöslig i vatten.
⑤ Färglös, nära fast form.
Vissa fall uppfyller emellertid ovanstående villkor men har inte anti-diskolorationseffekter, såsom 2-merkapto benzimidazole och 2-thiazolyl benzimidazole.
Det ömsesidiga förhållandet mellan dem är fortfarande inte helt klart.
Effekterna av FC-134 och T611 har bekräftats när det gäller ytaktiva ämnens effekt mot missfärgning. Samtidigt utfördes experiment med den kombinerade effekten av organiska föreningar och ytaktiva ämnen (FC-134), och ingen signifikant effekt hittades (tabell 2-33). Missfärgningsbeständigheten hos 0,2% polysulfidammoniumlösning varar bara cirka 10 minuter som mest. Under tiden är lösningsmedelsmotståndet (utspädningsmedel) också relativt svagt. För missfärgningsbeständighet hos dekorativa föremål på grund av förekomst av fläckar, med beaktande av dessa frågor på ett heltäckande sätt, är den enda möjliga användningen 2-merkaptobensimidazol med FC-134 (se tabell 2-34).
Tabell 2-33 Kombinerade effekter av organiska föreningar och ytaktiva ämnen för att motverka missfärgning av silverpläterade skikt
| Serienummer | Sammansättning | Villkor för bearbetning | Utseende | Hydrofobicitet | Anti-färgförändringsegenskaper | Anmärkningar |
|---|---|---|---|---|---|---|
| 1 |
2-Heptadecamidazolelg/L FC-134 1g/L EtOH : H2O = 1 :1 |
Rumstemperatur 1min, 60min |
Vit fällning pH 7 Vidhäftning | O |
O Mindre effektiv än när den används ensam
|
|
| 2 |
2-Mercaptobenzimidazole 1g/L FC-134 1g/L NaOH 2g/L
|
Rumstemperatur 1min, 60min |
O | X |
O Bättre än när den används ensam |
Reducerad skumningseffekt, ju längre desto bättre |
| 3 |
Mercaptone 5g/L FC-134 0,5 g/L Isoaceton : H2O = 1 :1 |
Rumstemperatur 1min, 60min |
O |
O Bättre än när den används ensam
|
Reducerad skumningseffekt, ju längre desto bättre |
Tabell 2-34 Lösningsmedlens effekt på filmen mot missfärgning
| Organiska föreningar | Villkor för bearbetning | Lösningsmedel | Utseende | Anti-missfärgningseffekt |
|---|---|---|---|---|
| 2-Heptadecamidazole |
1g/L (C2H5OH : HO = 1 : 1) 20 minuter
|
Fläckar | O | |
|
Utspädningsmedel (5 minuter)
|
Fläcken försvinner O
|
X | ||
|
Alkohol (5 min)
|
Fläcken försvinner O
|
X | ||
| Grov spray | Skrapa |
O Endast den repade delen är missfärgad
|
||
| 2-Merkaptobenzimidazol |
10g/L NaOH 2g/L Rumstemperatur 20 minuter
|
O | O | |
|
Tunnare (5 minuter)
|
O | X | ||
|
Alkohol (5 minuter)
|
O | △ | ||
| Grov spray | Skrapa |
O Endast den repade delen är missfärgad
|
Ovanstående experimentella resultat sammanfattas enligt följande.
① Det är svårt att säkerställa att Ag:s unika ton och lyster inte skadas när man applicerar andra ädelmetaller på Ag för antifärgbehandling.
② Med Sn- eller Sn-legeringsmetoder, när Sn-tjockleken är 50 ~ 10Å, kan anti-tarniseffekten uppnås, men effekten av denna metod ensam är begränsad.
③ Behandlingar med Be och Al har liten effekt.
④ Klassiska behandlingar som kromatbehandlingar har relativt goda effekter. Den största nackdelen är dock att den behandlade filmen har ett svagt UV-motstånd och kan bli brun vid långtidsskydd.
⑤ Bland organiska föreningar med egenskaper mot missfärgning finns 2-heptadecylimidazol, 2-alkylbensimidazol och merkapto-naftalenmedel. Andra organiska föreningar med samma struktur har dock inte nödvändigtvis samma förmåga att motverka missfärgning.
⑥ FC-134:s effektivitet i ytaktiva ämnen som säljs på marknaden har bekräftats.
3. Anti-missfärgningseffekt av kombinerad behandling med tennelektrolys och kromsyraelektrolys
(1) Test för främjande av missfärgning och dess mätmetod för missfärgning
Förhållandena för missfärgningstestet visas i tabell 2-35.
Tabell 2-35 Förhållanden för test av främjande av missfärgning
| Lösning |
Ammoniumsulfidlösning (gul) (Showa Chemical) (NH4)2Sx(2%) |
| Temperatur | 20℃ |
| Blötläggningstid | 2h |
△(%) = L1 - L2 (2-1)
I formeln,
L1- reflektans före färgförändringstestet, %;
L2- reflektans före färgförändringstestet, %.
(2) Tennelektrolyt
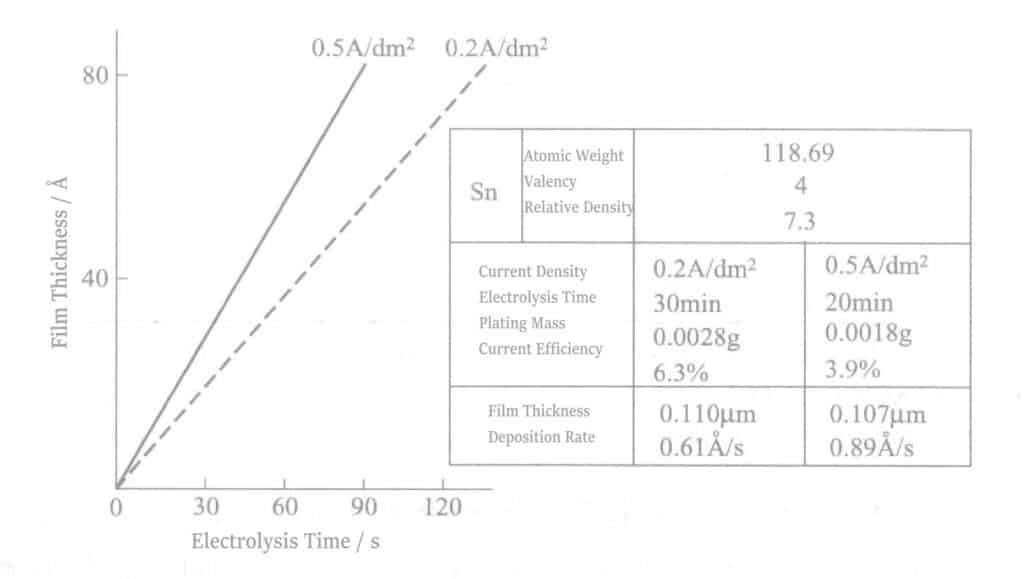
Genom experiment med effekterna av behandlingsförhållandena för tennelektrolyten fastställdes att koncentrationen av natriumstannat, elektrolystid, strömtäthet och behandlingstemperatur kunde ignoreras när det gäller deras inverkan på missfärgningsbeständighetsegenskaperna. Samtidigt tillsattes natriumacetat som en stabilisator i den alkaliska Sn-pläteringen. Sammansättningen och de optimala förhållandena för Sn-elektrolys visas i tabell 2-36.
Tabell 2-36 Sammansättning och optimala förhållanden för sn-elektrolys
| Sammansättning av pläteringslösning |
NaSnO3 - 3H2O 8. 5 g/L CH3COONa ・ 3H2O 5g/L |
| Villkor för behandling |
Strömtäthet 0,5A/dm2 Elektrolystid 15 s (10〜30 s) Temperatur 20℃ (7〜30℃) Anodmaterial Plåt av rostfritt stål |
(3) Förhållandet mellan emissivitet och elektrolystid
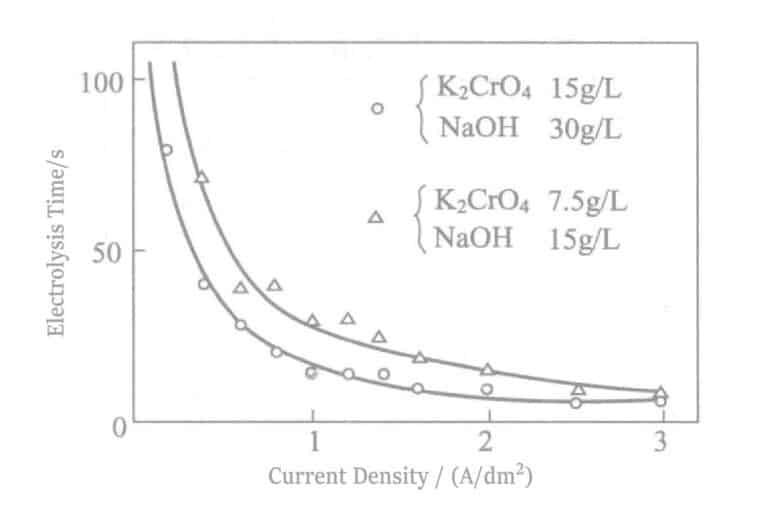
Förhållandet mellan reflektivitet och elektrolystid visas i figur 2-8. När elektrolystiden ökar minskar reflektionsförmågan kraftigt, vilket försämrar Ag:s nyans. En elektrolystid på cirka 90 sekunder visar en tennvit färg, och vid cirka 180 sekunders elektrolys visas ljusbruna ränder på ytan. Samtidigt, när elektrolystiden överstiger 60 sekunder, försämras också de elektriska egenskaperna. De experimentella resultat som erhållits enligt ekvation (2-1) visas i figur 2-9. När elektrolystiden ökar minskar △-värdet.
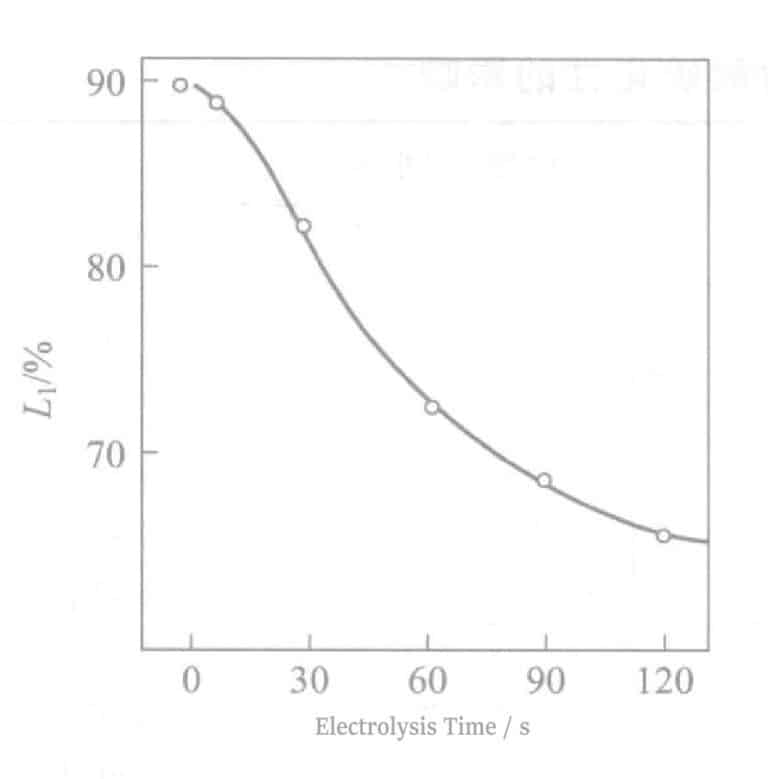
Figur 2-8 Förhållandet mellan reflektivitet och elektrolystid
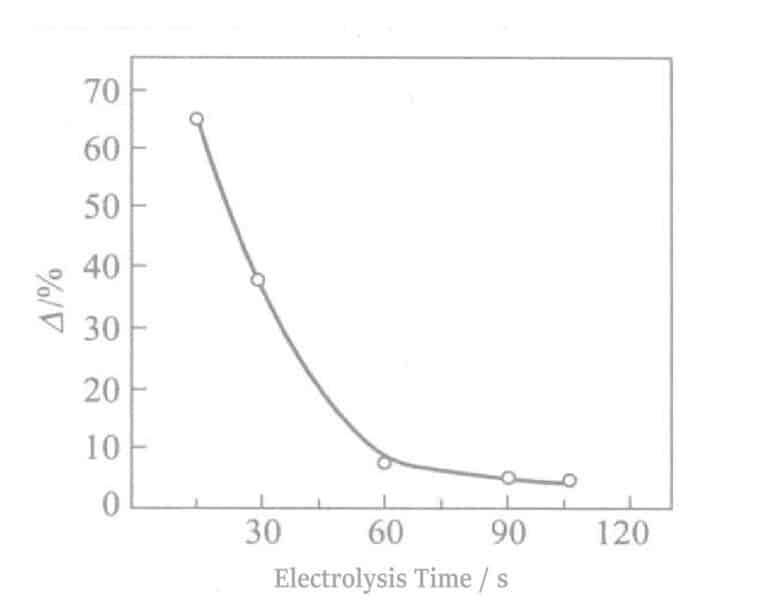
Figur 2-9 Elektrolystid och motståndskraft mot missfärgning
(4) Elektrolytisk tennfilmtjocklek och elektrolys
Med tanke på katodströmmens effektivitet enligt Faradays lag visas förhållandet mellan elektrolystid och filmtjocklek i figur 2-10. Tenntjockleken är ungefär flera tiotals angström.
(5) Påverkan av föroreningar
Effekterna av möjliga föroreningar (CN, Ag, Cu, Ni, etc.) som kan blandas i elektrolyten i tabell 2-36 på utseendet och sulfidresistensen hos det elektrolytiska membranet bekräftades genom experiment. Resultaten visas i tabell 2-37.
Tabell 2-37 Föroreningars inverkan på svavelresistens
| Föroreningar | Koncentration/×10-6 | Elektrolystid /s | ||
|---|---|---|---|---|
| 30 | 60 | 120 | ||
| Ingen | 0 | O | O | △(vit) |
| CN |
20 200 2000 20000 |
O O O △ , vit |
O △ , vit △ , vit △ , vit |
△ , vit △ , vit △ , vit △ , vit |
| Ag |
20 50 100 150 200 400 |
O O △ X X X |
O △ , röd X, röd-svart X,röd-svart X,röd-svart X, svart |
△ , röd △ , röd-svart X, röd-svart X, röd-svart X, svart X, svart |
| Cu |
20 200 300 400 500 600 1000 |
O O O △ , röd △ , röd x,röd x,röd |
O O △ , vit △ , röd X,röd X,röd X,röd |
△ , vit △ , vit △ , röd △ , röd X,röd X,röd X,röd |
| Ni |
20 200 1000 |
O O O |
O O O |
O O O |
|
Anm: 1. Föreningar som används: CN-NaCN;Ag-KAg(CN)2;Cu-KCu(CN)2; Ni-Ni (CN)2 - 2KCN - 2H2O. 2. Grad av färgförändring: ○ ingen utseendeförändring; △ liten färgförändring; × färgförändring.
|
||||
(6) Kromatelektrolys
Förutom kromat kan oorganiska salter i elektrolyten, såsom (Na2CO2, KCN, KI, Na2S2O3, etc.), används som tillsatser. Dessa vattenlösningar har länge rapporterats som antifärgmedel för silver. Elektrolytens grundsammansättning framgår av tabell 2-38.
Tabell 2-38 Villkor för Cr-elektrolytisk process
| Elektrolytens sammansättning |
K2 CrO4 15 g/L NaOH 30g/L |
| Används efter 30 timmars uppvärmning och mognadsprocess | |
| Villkor för behandling |
Spänning 6V (2 〜 6V) Elektrolystid 15s (60s) Temperatur 20 ℃ Anodmaterial Plåt av rostfritt stål |
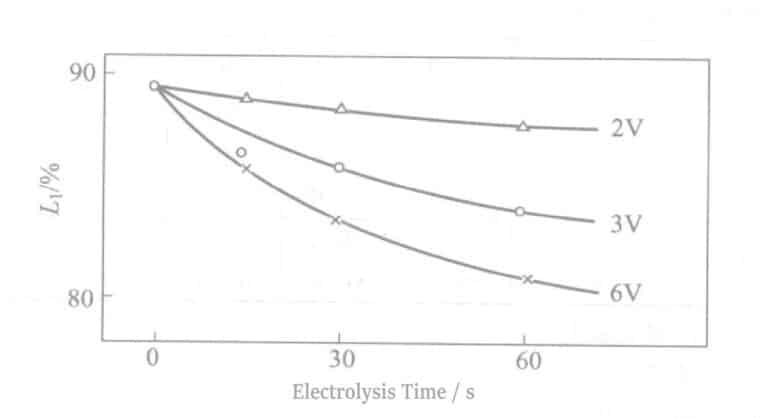
(7) Förhållandet mellan reflektionsförmåga och elektrolystid
Förhållandet mellan reflektiviteten vid en spänning på 2~6V och elektrolystiden visas i figur 2-11. När spänningen ökar ökar Cr-filmens tjocklek medan reflektiviteten minskar. Till skillnad från fallet med Sn-elektrolyt, under samma spänningsförhållanden, påverkar inte ökningen av elektrolystiden reflektiviteten.
7. Förhållandet mellan reflektionsförmåga och elektrolystid
Förhållandet mellan reflektiviteten vid en spänning på 2~6V och elektrolystiden visas i figur 2-11. När spänningen ökar ökar Cr-filmens tjocklek medan reflektiviteten minskar. Till skillnad från fallet med Sn-elektrolyt, under samma spänningsförhållanden, påverkar inte ökningen av elektrolystiden reflektiviteten.
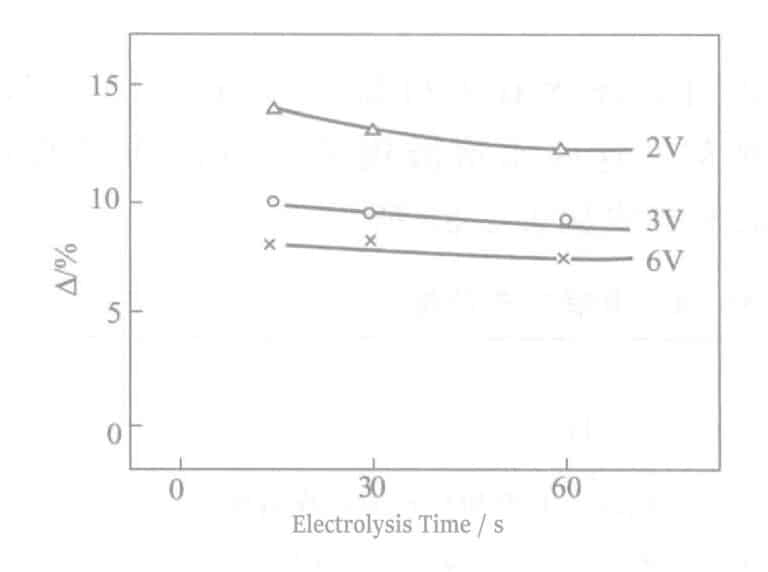
(8) Sulfidbeständighet
Jämförelsen △ resultat under förutsättning av blötläggning i 0,2% (NH4)2Sx lösning under 2 timmar visas i figur 2-12. Ju högre spänning, desto bättre svavelresistens, främst på grund av förtjockningen av kromoxidfilmen. Om elektrolystiden förlängs utan förbättring beror det på att det finns för många pinholes i den elektrolytiska filmen, vilket resulterar i en ökning av kromsyra som blandas in i pinholesna.
(9) Missfärgning Orsakas av ultraviolett ljus
Resultaten för missfärgning och svavelresistens hos Cr-elektropläterade filmer orsakade av ultraviolett bestrålning visas i tabell 2-39 (Cr-elektropläteringsförhållanden: 6V, 30s). Efter ultraviolett bestrålning är den Cr-elektropläterade filmen helt skadad och blir rödlila och blålila. Samtidigt minskar svavelmotståndet också kraftigt och sjunker till samma nivå som utan anti-diskoloreringsbehandling. Det är liten skillnad mellan de missfärgningsbehandlade proverna och de som utsätts för solljus på grund av skillnaden i ultraviolett intensitet jämfört med allmänna ultravioletta bestrålningsexperiment.
Tabell 2-39 Färgförändring orsakad av ultraviolett bestrålning
| Serienummer | Ultraviolett | L1/% | L2/% | L3/% | △1/% | △2/% | Anmärkningar | |
|---|---|---|---|---|---|---|---|---|
| 1 | - | - | 86. 3 | - | 84. 8 | 0 | 1.5 | (Blir gul) |
|
2 3 4 |
UV① |
0.5 1 3 |
86. 0 86. 2 86. 5 |
86. 0 83. 2 58〜65 |
67 53 - |
0 3 21〜28 |
19 33 - |
Blå - Violett |
|
5 6 |
Solljus② |
3 6 |
86.6 86.4 |
86.6 86.4 |
85.6 85.5 |
0 0 |
0.8 0.9 |
(Blir gul) - |
|
① Den fotoelektriska glansmätaren använder ett väteurladdningsrör. ② Exponering utomhus under dagtid: L1 -- Reflektans före bestrålning; L2 -- Reflektans efter bestrålning; L3 -- Reflektans efter blötläggning i 0. 2% (NH4 )2 Sx under 30 minuter efter bestrålningen. △1 =L1 - L2 △2 =L1 - L3
|
||||||||
Copywrite @ Sobling.smycken - Anpassad smyckestillverkare, OEM och ODM smyckesfabrik
(10) Inverkan av föroreningar
Testresultaten av föroreningseffekter i grundkompositionen visas i tabell 2-40.
Tabell 2-40 Effekter av föroreningar
| Föroreningar | Koncentration /×10-6 | Utseende |
|---|---|---|
| CN |
200 400 600 800 1000
|
O O O O O |
| Ag |
10 20 30 40 50 |
O O O X (svart) X (svart) |
| Sn |
200 400 600 800 1000
|
O O O O O |
(11) Sn elektrolysbehandling plus Cr svavelresistens under elektrolysbehandling
De metoder som beskrivs ovan har alla för- och nackdelar och kan inte betraktas som fullständiga metoder mot missfärgning. Därför övervägs följande tillvägagångssätt: omedelbart utföra elektrolytisk Sn-behandling efter plätering av Ag, följt av elektrolytisk Cr-behandling.
Under konstanta strömförhållanden ( DK = 0,5A/dm2 ) ändrades elektrolystiden för Sn, och under den efterföljande elektrolysbehandlingen av Cr varierades dess spänning och elektrolystid. Resultaten visas i figur 2-13. Reflektivitetsminskningen under varje villkor orsakas av förändringar i Sn-elektrolysens tid. Elektrolystiden måste hållas inom 30 sekunder för att bibehålla silvertonen.
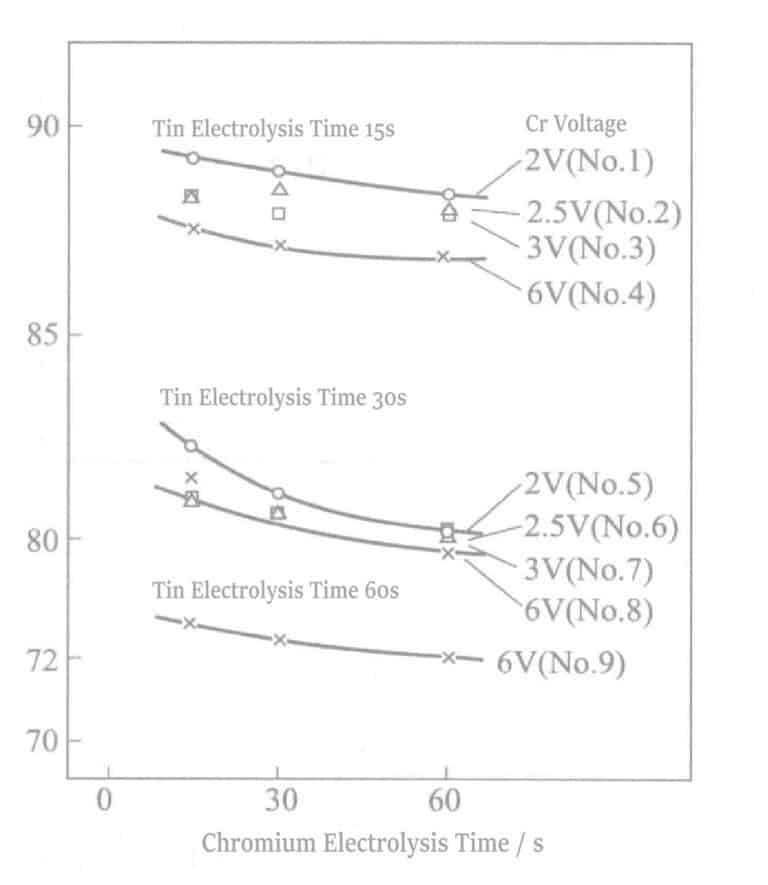
När man befinner sig i samma Sn-elektrolysbehandlingstidstillstånd orsakar förlängning av Cr-elektrolystiden att färgen på Cr underliggande Sn visar sig, vilket resulterar i ett vitt eller grått ojämnt tillstånd. Samtidigt, när Cr-elektrolys är vid en hög spänning (6V), uppträder detta fenomen tidigare; vid 6V kan det ses på 5 sekunder, medan det vid 2V kan pågå i mer än 60 sekunder. Förlängningen av Sn-elektrolystiden visar samma tendens. Ju längre elektrolystiden är, desto mer sannolikt är det att blekning sker.
Detta fenomen uppträder när laddningen som passerar under Cr-behandlingen av ett visst Sn-elektropläterat skikt når ett visst värde. Redoxreaktionen under Cr-elektroplätering spelar en viss roll på det Sn-elektropläterade skiktet, vilket orsakar förändringar i Sn:s kristallisationsmorfologi eller orsakar förändringar i kontrasten mellan det Sn-elektropläterade skiktet och det Cr-elektropläterade skiktet.
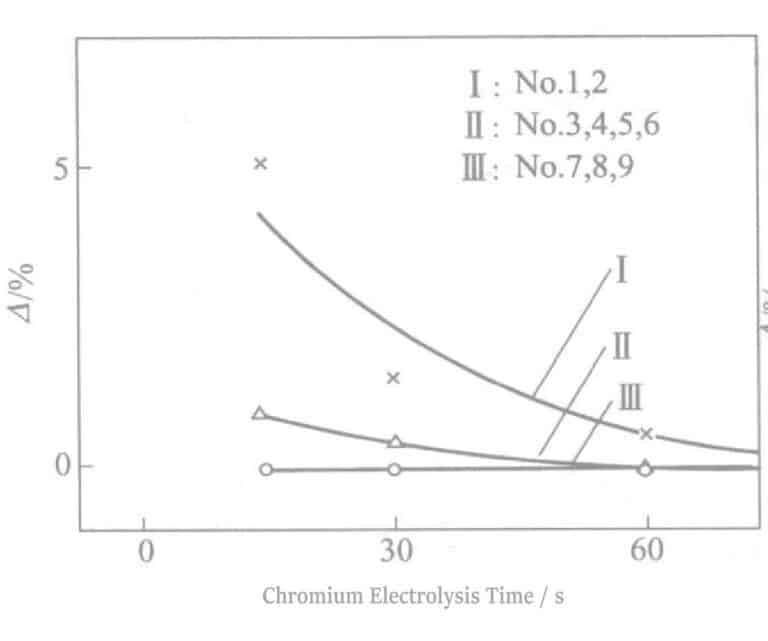
När ingen färgförändring inträffar är det relaterat till förlängningen av Sn-elektrolystiden. Elektrolystiden är 15 ~ 30s + elektrolystid över 30 sekunder har särskilt god svavelbeständighet, men det kommer att finnas utseendeproblem. Kombinationen av Sn-elektrolys vid 0,5A/dm2 under 15~30s, plus Cr-elektrolys vid 2~3V under 30s var det optimala tillståndet.
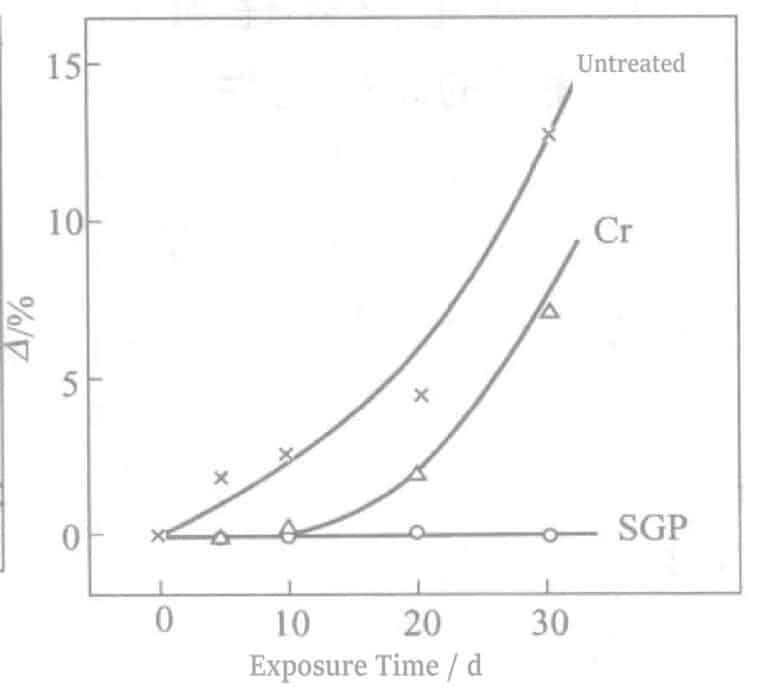
Resultaten av exponeringstestet inomhus visas i figur 2-15. Gulfärgning efter 1~2d för obehandlade och 7~10d för Cr-elektrolytisk behandling. Däremot började de delar som behandlats med Sn-elektrolys följt av Cr-elektrolys att delvis bli gråa först efter 60-100 d, vilket visar på god effektivitet. Blötläggningen utfördes med en 0,2% (NH4)2Sx lösning motsvarande en månads testning av exponering inomhus. Sn-elektrolysbehandlingen som följs av Cr-behandlingen förkortas SGP (silver guard process).
① Effekten av olika tennsalter på svavelresistens
Testresultaten av effekterna av olika tennsaltytaktivatorer i SGP-metoden visas i tabell 2-41 och figur 2-16.
Tabell 2-41 Jämförelse av effekterna av olika tennsalter
| Serienummer | Sammansättning och dess processförhållanden | Sn elektrolystid /s | Cr Elektrolystid/s | L1/% | △/% | Anmärkningar |
|---|---|---|---|---|---|---|
| 1 |
SnCl2 4g/L HCl 0,025mol/L (immersion) |
13 30 60 |
15 |
90. 2 89. 8 89. 2 |
5. 4 4. 8 5. 8 |
Gulfärgning Gulfärgning Gulfärgning |
| 2 |
Na2SnO3 -3H2O 8. 5 g/L CH3COONa-3H2O 5g/L 3. 5V (0,1A/dm)2) |
15 30 60 |
15 |
89. 7 87. 3 85. 2 |
0. 7 0. 1 0
|
Partiell gulfärgning - Tennfärg |
| 3 |
Nr 2 plus Peretekkusu# 1232① 0. 1g/L 3. 5V (0,15A/dm)2) |
15 30 60 |
15 |
87. 4 85.0 76. 6
|
0 0. 1 0 |
- - Tennfärg |
| 4 |
K2SnO3-3H2O 8. 5 g/L CH3COONa-3H2O 5g/L 3. 5V (0,1A/dm)2) |
15 30 60 |
15 |
89. 6 88. 9 85. 4 |
0. 9 0 0 |
Partiell gulfärgning - Tennfärg |
|
① Peretekkusu# 1232 är en produkt från Miyoshi Oil & Fat i Japan. Anmärkning: Cr-elektrolyt 3 V.
|
||||||
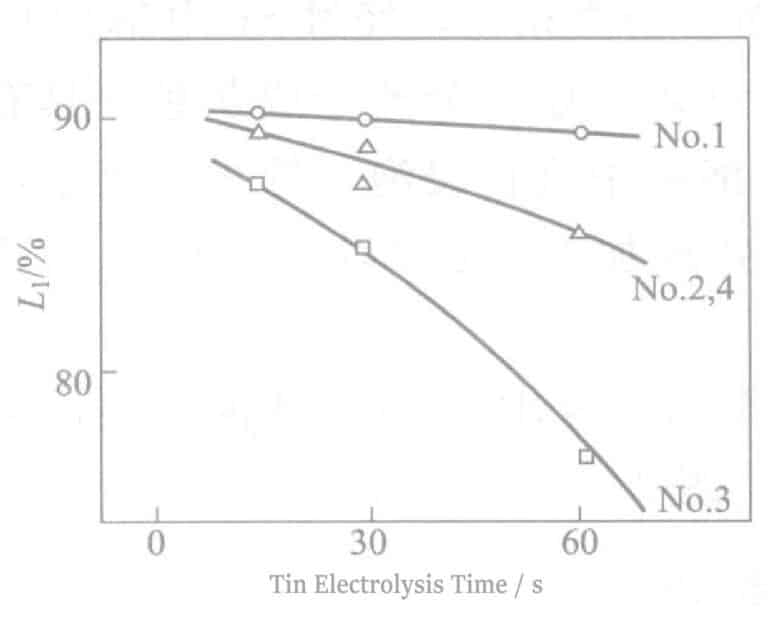
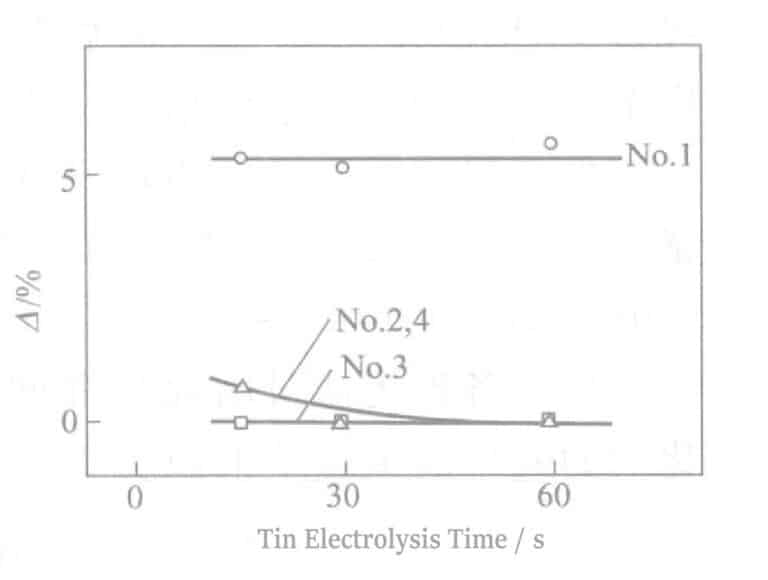
Genom att tillsätta ett icke-joniskt ytaktivt ämne (nr 3) till natriumstannatelektrolyten förbättras strömeffektiviteten avsevärt, elektrolyshastigheten (nr 2) accelereras, reflektionsförmågan minskas och svavelresistensen förbättras.
Även om resultaten av kaliumstannatelektrolyten (nr 4) är desamma som för natriumstannatelektrolyten, finns det vissa skillnader mellan effekterna av natrium- och kaliumsalter i alkaliska tennpläteringslösningar.
② Effekten av kromelektrolyt på svavelresistens studerades huvudsakligen utifrån aspekter som elektrolytkoncentration, effekten av ytaktiva ämnen och inverkan av strömtäthet på utseendet efter behandling.
Tabell 2-42 Koncentrationens effekt på svavelresistens
| Koncentration /(g/L) | Elektrolystid /s | Strömvärde vid konstant spänning (6V)/A | ||
|---|---|---|---|---|
| 5 | 15 | 30 | ||
|
K2CrO4 15 NaOH 30 |
X | X | X |
4. 0 (40A/dm2) |
|
K2CrO4 7.5 NaOH 15 |
O | X | X |
2.4 (24A/dm2) |
|
K2CrO4 1.5 NaOH 3,0 |
O | O | X |
0.6 (6A/dm2) |
|
Obs: O betyder ingen förändring av utseendet; × indikerar en förändring av utseendet (blekning).
|
||||
- Effekt av koncentration: Standardlösningen späddes till 1/2, 1/10 och den elektrolystid vid vilken en tennfärg uppträdde under elektrolys vid 6 V undersöktes. Resultaten visas i tabell 2-42.
- Effekt av ytaktiva ämnen: Standardlösningar av ytaktivt ämne (Perettekusu#1265, en produkt från Miyo-shi Oils and Fats Co., Ltd., Japan) tillsattes med joniskt ytaktivt ämne i koncentrationerna 1/1 och 1/2, och elektrolystiden undersöktes vid den tidpunkt då den började visa en tennfärg. Resultaten visas i tabell 2-43. Jämfört med ingen tillsats var effekten bättre vid hög strömtäthet när ytaktiva ämnen tillsattes. Vid låg strömtäthet var det liten skillnad från fallet utan tillsats, men gas hindrade elektrolysens förlopp. När ytaktiva ämnen fanns närvarande påverkade deras koncentration och strömtäthet tiden för blekning att starta, vilket ökade hanteringssvårigheterna. Samtidigt uppstod bubblor på grund av den stora mängden vätgas som genererades. Det var lättare att hantera utan tillsats.
Tabell 2-43 Effekter av ytaktiva ämnen
| Koncentration/(g/L) | Perettekusu# 1265/(mL/L) | Spänning/V | DK/(A/dm2 | Elektrolys tid/s | ||
|---|---|---|---|---|---|---|
| 5 | 10 | 15 | ||||
|
K2CrO4 15 NaOH 30
|
0 |
6 5 6 3 |
40 29 19 7 |
X X X X |
X X X X |
X X X X |
| 0.01 |
6 5 6 3 |
40 29 19 7 |
O O O O |
X X O O |
X X X X |
|
| 0.1 |
6 5 6 3 |
40 29 19 7 |
O O O O |
O O O X |
X X X X |
|
| 1 | 6 | 40 | O | X | X | |
|
K2CrO4 7.5 NaOH 15
|
0 |
6 5 6 3 |
24 17 10 3 |
X X X O |
X X X O |
X X X X |
| 0.01 |
6 5 6 3 |
24 17 10 3 |
O O O O |
O O X X |
X X X X |
|
- Påverkan av ström: Densitet Den tidpunkt då tennfärgen först framträder vid olika strömtätheter under elektrolys visas i figur 2-18. Samtidigt visas E-I-kurvan i figur 2-19. Strömdensiteten är mer lämplig när elektrolystiden är 0,5A/dm2 cirka 30 sekunder. Under tiden påverkas tiden utan att tennfärgen uppträder också av elektrolytkoncentration, anodströmdensitet, elektrodavstånd och andra faktorer. Koncentrationshantering görs genom att beräkna tankens storlek, och det är möjligt att härleda den inneboende kraften i tanken som inte verkar tennfärgad vid en viss spänning, för att underlätta hanteringen.
Figur 2-18 Förhållandet mellan strömtäthet och elektrolystid
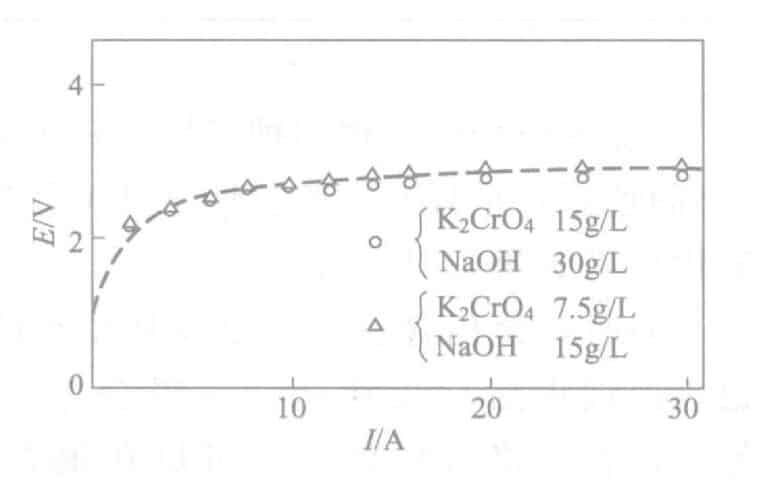
Figur 2-19 E-I-kurva för elektrolytlösningen
Figur 2-20 Process för behandling av kromelektrolyt

Figur 2-21 Jämförelse av svavelresistens hos olika behandlingsmetoder
Samtidigt kan användning av rengöringsmedel (tensider) som innehåller α-diketon och dess salter för att tvätta eller blötlägga silver (eller silverpläterade föremål) och dess legeringar (tennlegering, zinklegering, indiumlegering, palladiumlegering etc.) kraftigt hämma ytmissfärgning eller korrosion.
Den grundläggande strukturen för dess tillsats visas i figur 2-22.
Tabell 2-44 Formuleringsexempel för Diketo Surfactants för förebyggande av silverfläckar
| Sammansättning | Nr 1 | Nr 2 | Nr 3 | Nr 4 | Nr 5 | Nr 6 | Nr 7 | Nr 8 |
|---|---|---|---|---|---|---|---|---|
| Klorovanillinsyra | 10 | |||||||
| Polyoxietylenalkyleter | 0.5 | |||||||
| Natriumdihydrogenfosfat | 5 | |||||||
| Polyetylenglykol | 1 | |||||||
| Tretinoin | 5 | |||||||
| Pyrazolklorid | 5 | |||||||
| Natriumvätekarbonat | 5 | |||||||
| Proteas | 1 | |||||||
| Kaliumjodid | 0.05 | |||||||
| Tetrahydroxi-1,4-bensokinon | 0.5 | |||||||
| 2-Alkyl-N-karboximetyl-N-hydroximetylimidazolin | 10 | |||||||
| Tiourea | 0.5 | |||||||
| Glycerol | 1 | |||||||
| Natrium 3-etyl-2-hydroxi--2-cyklopentan-1-karboxylat | 0.05 | |||||||
| Kaliumalkylsulfonat | 5 | |||||||
| Isocyanuron salt | 5 | |||||||
| N-acylerade aminer | 1 | |||||||
| 3-Hydroxy-2-methyl-4-pyrone | 20 | |||||||
| Citronsyra | 5 | |||||||
| Natriumbensoat | 5 | |||||||
| Mentol | 0.1 | |||||||
| Kalcium rosmarinsyra | 2 | |||||||
| 3-Metyl-1,2-cyklopentanaminium | 20 | |||||||
| Polyoxietylen ricinolja | 5 | |||||||
| Steroidala glykosider | 1 | |||||||
| 3-Hydroxi-1,2-dimetyl-4(1H)-pyridin | 6 | |||||||
| Mercaptoalanin | 2 | |||||||
| Glukoamylas | 5 | |||||||
| Sorbitol | 1 | |||||||
| 2,5-Dihydroxi-1,4-bensokinon | 10 | |||||||
| Alkyl-bensyl-ammoniumklorid | 30 | |||||||
| Kaliumnatriumtartrat | 5 | |||||||
| Papain | 1 |
Avsnitt II Elektrolös silverplätering
Eftersom silver har låg resistivitet och är mycket billigare än andra ädelmetaller används silverplätering i stor utsträckning inom elektronikområdet.
Som ädelmetall har silver en mer positiv redoxpotential än andra metaller, vilket gör att det kan förskjutas och avsättas på metaller som koppar, järn och zink och bilda ett silverpläteringsskikt på dessa metaller. Det kommer senare att nämnas att denna typ av reaktion används på kretskort för att ersätta koppar med silver så att kopparmönstret täcks av ett lager silver, vilket ökar lödbarheten och minskar kontaktmotståndet. Denna förskjutningsdeponering resulterar emellertid i allmänhet i ett relativt tunt pläteringsskikt, cirka 2 μm eller mindre. Däremot kan det pläteringsskikt som erhålls genom en reduktionsreaktion vara något tjockare.
Vid tillämpningen av silverplätering bör den mest kända vara silverspegelsreaktionen. Silverspegelsreaktionen utvecklades av Drayton 1830 och tillämpades på spegeltillverkningsindustrin. Dessutom används kemisk silverplätering (särskilt reduktion av silverplätering) i stor utsträckning inom elektronik, vilket utvidgar de industriella tillämpningarna av silverplätering. Kemisk silverplätering kan appliceras inte bara på metaller utan också på icke-metaller.
1. Förskjutning av silverplätering och dess tillämpningar
Förskjutningssilverbeläggning utnyttjar potentialskillnaden mellan basmetallen och silvret.
Ledarmönstren på kretskort är vanligtvis tillverkade av koppar, men under lagring, innan komponenterna monteras, bildas en oxidfilm på kopparytan. Denna oxidfilm påverkar kretskortets lödbarhet. Avancerade produkter eller till och med Ni/Au-, Ni/Pd-, Ni/Pa/Au-plätering används vanligtvis för att förbättra lödningsförmågan hos kopparkretsar, vilket naturligtvis ökar kostnaden. Sn-plätering saknar dock tillräcklig rostbeständighet. Silverplätering ligger nära Sn i pris och förhindrar inte bara rost och är lämplig för lödning utan kan också användas för metalltrådsanslutningar, vilket innebär att silver kan ersättas med silverplätering på kopparkretsar. Tjockleken måste dock ökas för att kompensera om silver pläteras direkt på koppar på grund av ojämn plätering. Detta gör att pläteringen inte klarar tejptestet, eftersom pläteringen lätt lossnar, särskilt efter lagring. Detta problem kan dock lösas genom tvåstegsplätering. Metoden går ut på att först plätera ett metallskikt, som är dyrare än koppar, på kopparn och därefter en silverplätering. Det första metallskiktet kan vara Pd eller Ag. Tjockleken är så tunn, i storleksordningen nanometer (dvs. flera nanometer tjockt), att pläteringen inte kan ses med blotta ögat. Förskjutningsreaktionen är:
Lösningen för silverförskjutning måste också innehålla ett komplexbildande medel för monovalent koppar för att stabilisera de förskjutna kopparjonerna. När den första beläggningen är förskjutningssilver måste dess förskjutningshastighet vara mycket långsammare än för det andra Ag-pläteringsskiktet, vilket motsvarar mindre än 15% av dess hastighet. Om det är för snabbt är det lätt att orsaka en minskning av beläggningsadhesionen, vilket resulterar i beläggningsskalning under tejptestet. Följande är ett exempel på silverplätering.
När det första pläteringsskiktet är Pd, är Pd-pläteringslösningen
PdSO4 50mg/L (räknat som Pd)
H2SO4 5%
Temperatur Rumstemperatur
Tidpunkt Omkring 30-talet
Tabell 2-45 Sammansättning och process för förskjutningssilverplätering (första pläteringsskiktet)
| Sammansättning och processförhållanden | Formulering och komponent | Sammansättning och processförhållanden | Formulering och komponent |
|---|---|---|---|
| Silvermetansulfonat (som Ag) | 1g/L | Lurotex A25 | 20 mg/L |
| NaBr | 320 g/L | pH-värde | 5.5 |
| Dietylentriamin pentylenfosfonsyra | 30mL/L | Temperatur | 50℃ |
| Polyetylenglykol 400 | 80mL/L | Tid | 5 minuter |
| 2,2'-Bipyridin | 90 mg/L |
Efter plätering genomgår de pläterade delarna värmebehandling vid 150 ℃ i 4 timmar, följt av ett vätbarhetstest, som är kvalificerat.
När det första pläteringsskiktet är Ag visas pläteringslösningen och dess process i tabell 2-46.
Tabell 2-46 Sammansättning och process för förskjutningssilverplätering (andra beläggningen)
| Sammansättning och processförhållanden | Formulering och komponent | Sammansättning och processförhållanden | Formulering och komponent |
|---|---|---|---|
| Silvermetansulfonat (som Ag) | 1g/L | Polyetylenglykol 400 | 80mL/L |
| NaBr | 320 g/L | 2,2'-Bipyridin | 90 mg/L |
| Dietylentriamin pentylenfosfonsyra | 30mL/L | pH-värde | 5.5 |
Pläteringslösningen för det första och det andra pläteringsskiktet kan ha samma sammansättning, men temperaturen och nedsänkningstiden skiljer sig åt. Förhållandena för det första pläteringsskiktet är följande: 25℃, 30s. Förhållandena för det andra pläteringsskiktet är följande: 50 ℃, 6 minuter. De resulterande pläteringsskikten är enhetliga, silverljusa och har god lödningssvetsbarhet.
Hutchinson et al. föreslog en pläteringslösningsmetod med användning av alkylpolyetylenglykoleter som ljusmedel, etylendiamin och 1-hydroxietylen-1,1-difosfonsyra som kopparkomplexbildare, och det erhållna pläteringsskiktet kan uppfylla lödningsförhållandena för kretskort.
ITO (en transparent indiumtennoxid) används ofta i vätskekristall- och plasmaskärmar. Eftersom storleken på flytande kristallskärmar och plasmaskärmar har ökat under de senaste åren har ITO-motståndet i sig blivit relativt högt. För att lösa detta problem kan ett silverskikt med lägre ledningsförmåga läggas till ITO. Detta kan inte genomföras genom direkt silverelektroplätering eftersom det är svårt att direkt deponera katalytiskt aktiva metaller på ITO. Därför deponeras först ett tennskikt på ITO, följt av en katalytiskt aktiv metalldeposition och slutligen silverplätering. Sammansättningen av pläteringslösningen och processförhållandena för silverplätering på ITO visas i tabell 2-47.
Tabell 2-47 Pläteringslösningens sammansättning och processbetingelser för silverplätering på ITO
| Nedsänkning Tennvätska |
SnCl2 HCl
|
70 g/L 230mL/L |
| Aktiveringsvätska | AgNO3 | 10g/L |
| Lösning för silverplätering |
AgNO3 NH4OH (NH4)2SO4 Co(SO4)2 Mg(OH)2 Ag-tjocklek Specifikt motstånd Specifikt motstånd (250 ℃, 30 minuter efter behandling) |
0. 03〜0. 08mol/L 7〜10mol/L 0. 3〜0. 8mol/L 0. 1〜0. 2mol/L 0. 01〜0. 05mol/L 2900〜3200Å 3〜3. 5μΩ- cm 1. 6〜2. 5μΩ- cm |
2. Reducering av silverplätering och dess tillämpningar
Sammansättningen av den reducerande silverpläteringslösningen liknar den för allmän kemisk plätering, med huvudkomponenterna följande: Ag-salt, komplexbildare, reduktionsmedel, pH-justerare, stabilisator etc. Reduktionsmedlen för silver inkluderar glukos, sackarin, glyoxal, askorbinsyra, glukonsyra, sorbitol, hydrazin, HCHO, KBH4, NaBH4, DMAB och andra.
Reaktionerna för några representativa silverreducerande medel är följande.
(1) HCHO (vid användning av ammoniaklösning som komplexbildare)
2AgNO3 + 2NH4OH → Ag2O + 2NH4NEJ3 + H2O
Ag2O + 4NH4OH → 2[Ag(NH3)2]OH + 3H2O
2[Ag(NH3)2]OH + HCHO → 2Ag + 4NH3 + HCOOH + H2O
4AgNO3 + 4NH3 + C4H4O6NaK + H2O → 4Ag + 4NH4NEJ3 + C3H2O6NaK + CO2
4[Ag(NH3)2]NEJ3 + N2H4 → 4Ag + 4NH4NEJ3 + 4NH3 + N2
N2H4BH3 + 3Ag+ + 4OH– → 3Ag + N2H4 + B(OH)4–+ 3/2H2
Tabell 2-48 Formuleringar som använder organiska lösningsmedel för elektrolös silverplätering
| Ingredienser och deras processförhållanden | Nr 1 | Nr 2 |
|---|---|---|
|
Dimetylsulfoxid/mL Etylenglykol/ml Etanol/mL d-(+)glukos/mL Trietylamin/mL Temperatur/°C Tid/min Pläteringsmaterial |
300 200 - - 15 70 20 Al2O3 pulver |
200 - 300 5g 2. 5 ml/min 60 10 Nylonduk
|
Bland dem används dioler och glukos som reduktionsmedel. Eftersom dimetylsulfoxid har en lätt reducerande förmåga kräver pläteringslösningen inte åldringsbehandling. De resulterande pläterade delarna har silverliknande metallisk lyster.
Organiska föreningar som innehåller två monotiolgrupper används som komplexbildare, med strukturformeln enligt följande:
I formeln är R1 och R2 är alkylengrupper som innehåller 1~5 kolatomer; R3 är en alkylengrupp som innehåller 2-8 kolatomer X och Y kan vara karboxyl-, sulfonsyra-, amino-, alkylgrupper etc.
Reduktionsmedlen omfattar aldehyder, hydraziner, borhydridföreningar, askorbinsyra etc. Tabell 2-49 visar exempel på användning av denna serie.
Tabell 2-49 Processbetingelser för silverreducerande pläteringslösning med två organiska monotiolföreningar som komplexbildare
| Sammansättning och dess processförhållanden | Nr 1 | Nr 2 | Nr 3 |
|---|---|---|---|
|
Silvernitrat/(g/L) 1,2-Bis(2-karboxietyltio)etan/(g/L) 1,4-bis(2-karboxietyltio)butan/(g/L) 1,2,2'-(Etyltiio)dietylmerkaptan/(g/L) Hydrazinhydrat/(g/L) Formalin/(g/L) Natriumhypofosfit/(g/L) pH (justerat med NaOH) Temperatur/°C |
0. 17 10 - - 8 - - 10 35 |
0. 31 - 15 - - 4 - 11 50 |
0. 34 - - 20 - - 10 10. 5 50 |
Avsnitt III Analys av cyanidlösning för silverplätering
1. Analys av silver
Tabell 2-50 Silverjonanalysmetod för silverpläteringslösning
| Arbetssekvens | Anteckningar och instruktioner |
|---|---|
|
(1) Ta 5ml pläteringslösning i 300 bägare, tillsätt 20mL svavelsyra och 5mL salpetersyra medan du observerar. (2) Värm tills vit rök bildas (3) Tillsätt 100 ml vatten och 3 ml 10% ammoniumjärnsulfat. (4) Titrera med 0,1 mol/L kaliumtiocyanat. Beräkningsformel: Ag(g/L) = mL × 2. 158× f AgCN(g/L) = Ag(g/L) ×1. 2402 I formeln, mL--0. 1mol/L titer av kaliumtiocyanat; f--0. Koefficient för 1mol/L kaliumtiocyanatlösning |
På grund av den giftiga cyanvätegasen som bildas är det nödvändigt att arbeta i ett område med lokal ventilation. Byt från brun rök till vit rök Titreringens slutpunkt: ljusröd färg 0. 1mol/L KCNS 1mL = 0,01079g Ag |
2. Metoder för analys av fri cyanid
Tabell 2-51 Analysmetoder för fri cyanid
| Arbetssekvens | Anteckningar och instruktioner |
|---|---|
|
(1) Ta 5 ml pläteringslösning i 300m bägare, tillsätt vatten 50mL (2) Tillsätt 10% kaliumjodidlösning 1~2mL (3)Titrera med 0,1mol/1 silvernitratlösning Beräkningsformel. Fri KCN (g/L) = mL×2,60×f Fri NaCN (g/L) = mL×1,96× f I formeln är f - koefficienten för 0,1mol/L silvernitratlösning |
Titreringens slutpunkt: ljusröd färg 0. 1mol/L AgNO3 1mL = 0,0130g KCN = 0,0098 g NaCN |