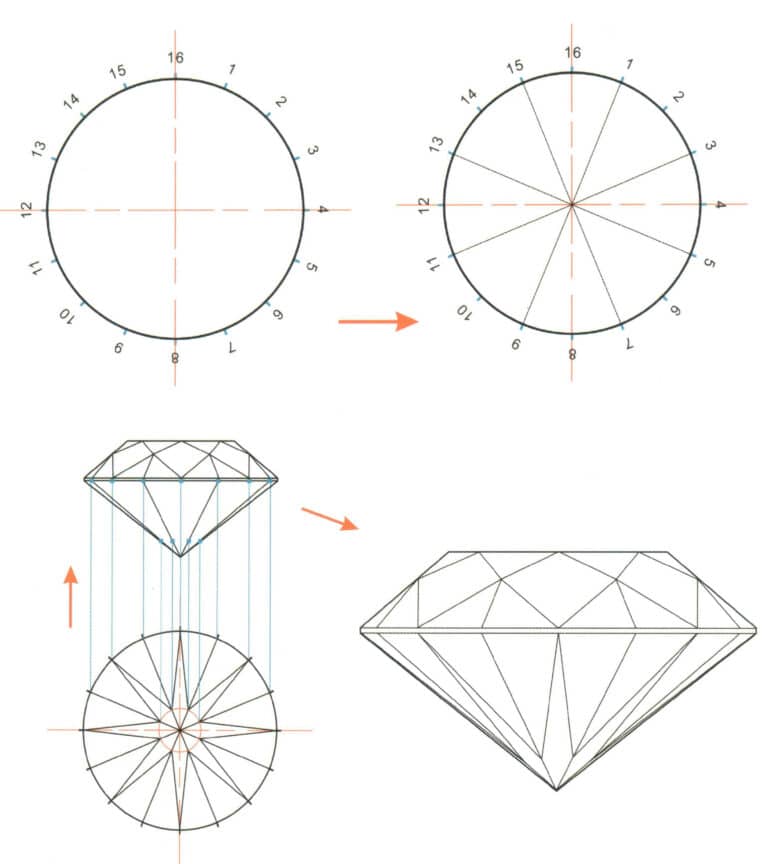
Как улучшить ювелирные изделия с помощью методов обработки поверхности
Mastering Surface Treatments for Jewelry: От полировки до нанонапыления
Процесс обработки поверхности ювелирных изделий - это техническая обработка, которая с помощью различных методов, таких как физические, химические, электрохимические и механические, позволяет изменить текстуру, цвет и ощущение поверхности аксессуара, предотвратить коррозию, украсить его и продлить срок службы. Это значительно обогащает декоративный эффект аксессуаров, расширяет возможности дизайна аксессуаров, представляет более яркий и разнообразный стиль украшений и предоставляет потребителям более персонализированный выбор. Значительно улучшает эффект поверхности, срок службы и экономическую добавленную стоимость аксессуаров.
Существует множество видов обработки поверхности современных популярных ювелирных изделий, среди которых обычно используются полировка, гальваническое покрытие, химическое покрытие, химические электрохимические конверсионные пленки, физическое осаждение паров, эмаль, эпоксидная смола и поверхностное нано-напыление.

Варианты цвета плавательного покрытия
Оглавление
Раздел I Технология полировки
1. Механическая полировка
Механическая полировка - это обработка поверхности ювелирных изделий с помощью полировальных машин и абразивных средств. К распространенным методам механической полировки относятся следующие категории.
(1) Полировальный круг из сукна
Полировка с использованием тканевого круга осуществляется с помощью полировального круга, установленного на станке. На рабочую поверхность полировального круга периодически наносится полировальная паста. При этом поверхность обрабатываемой детали с силой прижимается к рабочей поверхности полировального круга, находящегося в состоянии высокоскоростного вращения. С помощью волокон полировального круга и полировальной пасты поверхность обрабатываемой детали приобретает зеркальный вид (рис. 11-1). В настоящее время принято считать, что принцип работы полировальных машин с матерчатым кругом заключается в том, что высокая температура, возникающая при трении между высокоскоростным вращающимся полировальным кругом и поверхностью обрабатываемой заготовки, вызывает пластическую деформацию поверхности заготовки, заполняя микроскопические углубления на поверхности обрабатываемой заготовки; в то же время высокая температура, возникающая при полировке, может быстро образовать очень тонкий слой оксидной пленки на поверхности обрабатываемой заготовки. При удалении этого слоя оксидной пленки обнаженная поверхность подложки снова окисляется. Процесс продолжается до тех пор, пока полировка не будет завершена, в результате чего получается ровная и гладкая поверхность.
(2) Вибрационная полировка
В виброшлифовальной машине установлен вибромотор в вибродиске, а вибродиск соединен с основанием через вибропружины. Когда виброшлифовальная машина включается, вибромотор генерирует сильное возбуждающее усилие, приводящее шлифовальный материал в вибродиске в движение в трех направлениях: вертикальная вибрация, переворот изнутри наружу и спиральное вращение по часовой стрелке, тем самым создавая шлифовальный эффект на поверхности ювелирных изделий для достижения полировки (рис. 11-2 ).

Рисунок 11-1 Полировка с помощью круга из ткани

Рисунок 11-2 Вибрационная полировка
(3) Полировка валиком
Принцип его работы заключается в следующем: Четыре шестигранных ролика равномерно установлены по окружности вращающегося корпуса. Ролики вращаются вместе с вращающимся корпусом, одновременно вращаясь вокруг своей оси под действием системы звездочек (в противоположном направлении). Планетарное движение роликов приводит к тому, что материал внутри роликов под действием центробежной силы всегда остается по одну сторону от внешней стенки роликов, создавая на поверхности слой потока. В этом слое потока шлифовальные камни и заготовки совершают относительное движение, осуществляя тонкое резание и прижим к поверхности заготовки, что позволяет получить полированную поверхность заготовки (рис. 11-3).
(4) Вихревая полировка
Принцип работы: под действием центробежной силы, возникающей при высокоскоростном вращении нижнего поворотного стола, между заготовкой и абразивом возникает сильное трение под действием фиксированной канавки, образующей спиральный вихрь, вызывающий высокоскоростное вращательное трение и спиральное переворачивание заготовки и абразива. Это позволяет за очень короткое время удалить заусенцы и равномерно отполировать ювелирное изделие, добившись идеального эффекта полировки. Основа полировальной машины - вращающийся диск внутри контейнера, верхняя часть которого открыта, а стенки контейнера не вращаются. Зазор между контейнером и диском может составлять менее 0,05 мм, что позволяет использовать самые мелкие частицы скорлупы грецкого ореха (рис. 11-4).

Рисунок 11-3 Полировка валиком

Рисунок 11-4 Вихревая полировка
(5) Полировка волочением
При работе заготовка перемещается по полировальной среде, не двигаясь при этом. Каждая заготовка имеет свою собственную опорную позицию, поверхности между заготовками не соприкасаются, что предотвращает повреждение поверхности. По сравнению с традиционными методами полировки, он создает большее относительное движение и более сильное усилие обработки, что значительно сокращает время обработки. Он имеет большие преимущества при работе с тяжелыми заготовками. Метод полировки волочением особенно подходит для тяжелых колец, застежек и часовых корпусов, а также для многих других заготовок, которые можно подвесить на неподвижных кронштейнах (рис. 11-5).

Таблица 11-1 Характеристики различных процессов полировки
| Методы полировки | Средство для полировки | Средство для измельчения | Преимущества | Недостатки | Подходящая заготовка |
|---|---|---|---|---|---|
| Вибрационная полировка | Древесная стружка, кусочки фарфора, частицы скорлупы грецкого ореха, кукурузная мука, стальные шарики | Керамика, пластик | Дешевые, крупные изделия, штампованные детали | Длительное время обработки, низкое давление, вмятины и плохой эффект разглаживания делают невозможным достижение идеальных результатов при сухой обработке. | Малая цепь, механическая цепь |
| Полировка ствола | Деревянный кубик, деревянная игла, частицы скорлупы грецкого ореха, кукурузная мука, стальной шарик | Керамика, пластик | Дешевые | Длительное время обработки, неудобная обработка, поверхность покрыта пылью, поверхность вдавлена | Различные ювелирные украшения |
| Вихревая полировка | Частицы скорлупы грецкого ореха, кусочки фарфора, пластик | Керамика, пластик | Благодаря высокой эффективности и короткому времени обработки, станок 70% выполняет весь объем работы. Меньшее количество процессов, чистые украшения, простота в обращении, высокое качество поверхности. | Он может работать только с легкими заготовками (не более 20 г) и не может обрабатывать небольшие цепочки с драгоценными камнями. | Большинство ювелирных изделий, промышленных товаров и корпусов для часов |
| Полировка волочения | Частицы скорлупы грецкого ореха | Гранулы из скорлупы грецкого ореха | Он может полировать большие и тяжелые заготовки без ударов и столкновений, с коротким временем обработки, простым обращением и высоким качеством поверхности. | Без мокрого измельчения | Различные украшения, которые можно закрепить на полке |
2. Химическая полировка
3. Электрохимическая полировка
Раздел II Гальванический процесс
1. Базовые знания о гальванических покрытиях для ювелирных изделий
(1) Виды гальванических покрытий для ювелирных изделий
В зависимости от назначения покрытия гальванические покрытия для ювелирных изделий можно разделить на защитные и декоративные.
- Защитные покрытия. Основная цель - предотвратить коррозию металла. К этой категории относятся такие широко используемые покрытия, как оцинкованные и оловянные слои. Черные металлы обычно защищаются оцинкованными слоями в общих атмосферных условиях, в то время как оловянные слои обычно используются для защиты черных металлов, контактирующих с органическими кислотами.
- Декоративные покрытия. В первую очередь для декоративных целей, но также с определенным уровнем защиты. Композитные покрытия чаще всего состоят из нескольких слоев, поскольку трудно найти одно покрытие, отвечающее требованиям, предъявляемым к декоративным покрытиям. Как правило, сначала на подложку наносится базовый слой, затем поверхностный, а иногда и промежуточный. Например, гальваническое покрытие драгоценных металлов и имитация гальванического покрытия золота широко используются, особенно в некоторых ценных ювелирных изделиях и мелкой фурнитуре, с относительно высоким использованием и объемом производства. В основном это гальванические покрытия драгоценных металлов и различных сплавов.
В соответствии с электрохимическими отношениями между покрытием и металлом подложки во время коррозии, декоративные гальванические покрытия можно разделить на анодные и катодные.
- Анодное покрытие. Относится к покрытию, которое выступает в качестве анода и растворяется первым при образовании коррозионной микробатареи с металлом подложки, например, цинковое покрытие на железе. Этот тип покрытия обеспечивает не только механическую защиту подложки, но и химическую.
- Катодное покрытие. Относится к покрытию, действующему как катод, когда оно образует коррозионную микробатарею с металлом подложки. Например, оловянное покрытие на железе. Этот тип покрытия может обеспечить только механическую защиту подложки; как только покрытие повреждается, оно перестает защищать подложку и ускоряет скорость ее коррозии.
(2) Основной процесс нанесения металлических гальванических покрытий
Электроосаждение - это электрохимический и окислительно-восстановительный процесс. При электроосаждении металлический компонент выступает в качестве катода, металл или сплав, на который наносится покрытие, - в качестве растворимого анода, а в качестве нерастворимого анода используется титановая сетка, подключенная к отрицательной и положительной клеммам источника питания и погруженная в электролит, содержащий компоненты покрытия. Под действием тока на поверхности орнамента образуется слой осаждения (рис. 11-7).
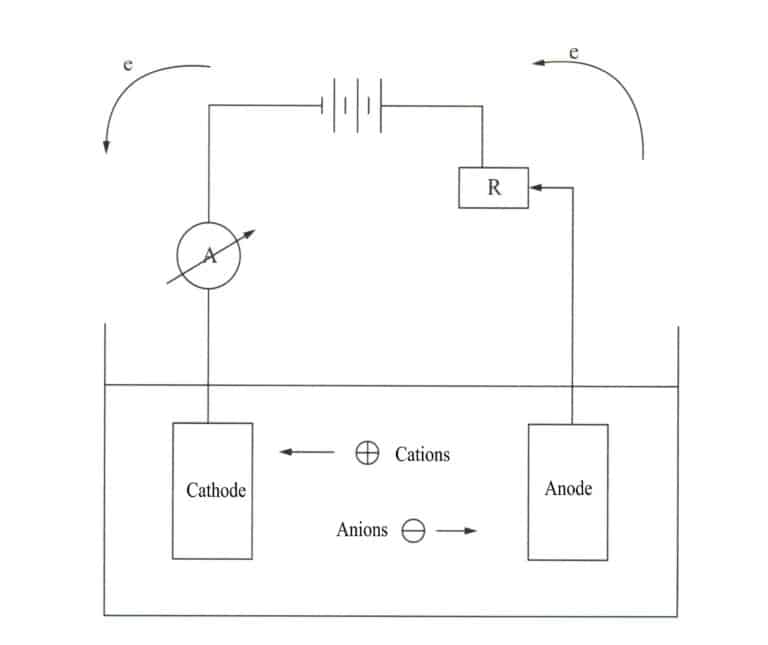
В процессе гальванизации металла металл или его комплексные ионы превращаются в металл на катоде. Поскольку металл, на который наносится покрытие, имеет кристаллическую структуру, как и обычные металлы, процесс гальванизации также известен как процесс электрокристаллизации. Он включает в себя следующие три этапа.
- Процесс массопереноса. Ионы металлов или их комплексы непрерывно переносятся к поверхности электрода из электролита посредством таких процессов, как диффузия, конвекция и электромиграция.
- Электрохимический процесс. Ионы металлов или их комплексы обезвоживаются и адсорбируются на поверхности катода, выделяя электричество и восстанавливаясь до металлических атомов.
- Процесс кристаллизации. Атомы металла располагаются на катоде, образуя металлические кристаллы определенной формы, причем кристаллизация обычно происходит в процессе зарождения и роста.
Тонкость кристаллов определяется скоростью зарождения и скоростью роста. Если скорость зарождения превышает скорость роста, образуется больше кристаллов, что приводит к образованию более мелких и плотных зерен; и наоборот, зерна будут более крупными.
2. Гальваническое покрытие меди и медных сплавов
Медное покрытие розовое, однородное и нежное, с различными оттенками в зависимости от процесса. В гальванике широко используется медное покрытие, в основном в качестве основного и промежуточного слоя, а также может использоваться в качестве поверхностного слоя, например, для имитации золотого покрытия.
Используемые в настоящее время процессы меднения в основном включают цианирование, кислотное сульфатное и пирофосфатное меднение. Среди них цианистый раствор для медного покрытия является высокотоксичным, сильно загрязняет окружающую среду, вредит здоровью человека и был внесен в список процессов, подлежащих ликвидации. Кроме того, в последние годы получили развитие и применение аминосульфонатное медное покрытие, органическое аминное медное покрытие, цитратно-тартратное медное покрытие и медное покрытие HEDP.
В 1970-х годах исследования были направлены на замену цианистого гальванического покрытия на нецианистое, что привело к появлению пирофосфатного и сульфатного медного покрытия. Однако их нельзя было наносить непосредственно на стальные подложки в качестве базового слоя.
2.1 Покрытие меди сульфатом
Медное покрытие с сульфатом широко используется в защитно-декоративном гальваническом покрытии, пластиковом гальваническом покрытии и толстом медном покрытии для гальванопластики печатных плат. Его можно разделить на два типа: один - раствор с высоким содержанием меди и низким содержанием кислоты, используемый для гальванизации деталей, который имеет гладкое и яркое покрытие с хорошей прочностью; другой - раствор с высоким содержанием кислоты и низким содержанием меди, используемый для гальванизации печатных плат, который имеет отличную дисперсию и способность покрытия, что делает его очень подходящим для гальванизации отверстий, с равномерным и тонким покрытием.
(1) Основные компоненты раствора для нанесения покрытия
① Медный купорос. Это основная соль, которая обеспечивает необходимый уровень Cu2+ для электроосаждения. Слишком низкая концентрация снижает верхний предел плотности тока, уменьшает скорость осаждения и влияет на яркость покрытия. При слишком высокой концентрации снижается дисперсионная способность раствора, а из-за предела растворимости медного купороса кристаллы медного купороса выпадают в осадок, при этом концентрация 180~220 г/л является оптимальной.
② Серная кислота. Его основная функция - повышение проводимости раствора. Если концентрация слишком мала, это приводит к неполному окислению анодной меди, в результате чего образуется Cu2O, что приводит к образованию "медного порошка" или заусенцев в покрытии. В то же время снижается диспергирующая способность раствора для нанесения покрытия. При соответствующей концентрации серной кислоты диапазон плотности тока в покрытии широк, покрытие яркое, а способность к выравниванию достигает оптимальных результатов. Если концентрация серной кислоты слишком высока, это влияет на яркость и выравнивание покрытия.
③ Хлорид-ионы. Они являются активаторами анода, которые могут помочь аноду нормально раствориться, подавить производство Cu+Улучшение яркости и выравнивающей способности покрытия, а также снижение внутреннего напряжения в покрытии. Если концентрация хлорид-ионов слишком низкая, это приводит к образованию дендритных покрытий, при этом область сильного тока склонна к выгоранию, а в покрытии могут появиться ямки или проколы. Если концентрация хлорид-ионов слишком высока, на поверхности анода образуется белый гелеобразный слой пленки, и сколько бы отбеливателя ни было добавлено, покрытие не будет ярким. Подходящая концентрация хлорид-ионов составляет 40~100 мл/л.
④ Добавки. Отличное сочетание добавок позволяет получить стабильные растворы для нанесения покрытий, высокую степень квалификации изделий и высокую эффективность работы. В настоящее время разработано множество добавок и материалов на их основе. Требования к добавкам зависят от типа покрытия. Например, при нанесении декоративных покрытий большее внимание уделяется яркости, скорости и выравниванию покрытия; при нанесении защитно-декоративных покрытий - выравниванию и гибкости покрытия; при нанесении покрытий на печатные платы требуется превосходная работа в зоне слабого тока, равномерное распределение покрытия, пластичность покрытия и т.д. Добавки для медного покрытия в основном состоят из четырех частей: носителей, отбеливателей, выравнивателей и смачивателей.
- Носитель: Хороший носитель может максимально повысить эффективность осветляющих и выравнивающих средств. Носители в основном создаются на основе поверхностно-активных веществ, и невозможно достичь наилучшего эффекта с помощью одного материала, например, полиэфирных соединений, тетраэфирных анионных соединений этилендиамина и т.д.
- Осветляющие и выравнивающие средства: Органические полисульфидные соединения, органические полисульфиды, полисульфидные органические сульфонаты, органические красители и т.д. обладают осветляющим и выравнивающим эффектами в сочетании с носителями. Оба эффекта могут проявляться в одном и том же материале, причем красители в большей степени проявляют выравнивающую способность.
- Смачивающие агенты: могут улучшить смачиваемость раствора для нанесения покрытия. Обычно используются неионные или анионные поверхностно-активные вещества, такие как полиэтиленгликоль, эмульгаторы OP и т. д. Для яркой кислотной меди используется воздушное перемешивание, поэтому можно выбирать только низкопенные смачивающие агенты.
(2) Электродная реакция медного покрытия с серной кислотой
Катод: Cu2+ + 2e=Cu φ0Cu2+/Cu = +0.34V
Cu2+ + e=Cu+ φ0Cu2+/Cu+ = +0.17V
Cu+ + e=Cu φ0Cu+/Cu = +0.51V
Благодаря стандартному электродному потенциалу Cu2+ будучи гораздо более положительным, чем водород, водородный газ не будет выделяться на катоде, но при недостаточном восстановлении будет появляться Cu+. С точки зрения стандартного электродного потенциала, более вероятна реакция восстановления до Cu, а восстановление Cu приведет к образованию грубого покрытия, которого следует избегать.
Анод: Медный анод в сернокислом растворе подвергается анодному растворению, обеспечивая ионы меди, необходимые в гальваническом растворе, а именно: Cu-2e=Cu2+.
Одновременно с Cu2+ генерируется, то неизбежно генерируется Cu+, а именно: Cu-e=Cu+. Когда Cu+ Появляется и переходит в раствор; если в растворе достаточно серной кислоты и воздуха, то Cu+ могут быть окислены, а именно:4Cu++O2+4H+=4Cu2++2H2O, Когда концентрация серной кислоты в растворе недостаточна, Cu+ гидролизуется, а именно:2Cu++2H2O=2CuOH+2H+=Cu2O+H2O. В это время Cu2O оседает на катоде в результате электрофореза, образуя заусенцы. Из-за нестабильности Cu+Также могут происходить реакции диспропорционирования, а именно:2Cu+=Cu2++Cu, и образовавшаяся Cu также оседает на покрытии путем электрофореза, образуя медный порошок, заусенцы и шероховатости. Поэтому в процессе нанесения гальванического покрытия появление Cu+ следует по возможности избегать; использование фосфорсодержащих медных анодов и перемешивание раствора для гальванопокрытий с воздухом может решить проблему.
2.2 Пирофосфатное медное покрытие
Медное покрытие с пирофосфатом не может быть нанесено непосредственно на железные и цинковые подложки. В основном его используют на подложках из цинковых сплавов перед нанесением медного покрытия из сульфатной кислоты, чтобы защитить подложку от сильной кислотной коррозии и обеспечить качество покрытия. Он также используется в гальванических процессах металлизации пластика, но его применение в гальванике оборудования ограничено.
Яркие кристаллы фосфорнокислого медного покрытия обладают хорошей дисперсией и способностью к покрытию. Эффективность катодного тока высока, но длительное использование может привести к накоплению фосфатов, что снижает скорость осаждения.
(1) Основные компоненты раствора для нанесения покрытия
- Пирофосфат меди. Это основная соль гальванического раствора, обеспечивающая ионы меди. При слишком низком содержании меди снижается плотность тока, что приводит к плохому блеску и выравниванию покрытия; при слишком высоком содержании меди снижается катодная поляризация, что приводит к шероховатости покрытия. Содержание меди в гальваническом растворе должно поддерживаться в определенном соотношении с пирофосфатом калия.
- Пирофосфат калия. Он является основным комплексообразователем, и когда значение pH равно 8, основной формой комплекса является [Cu(P2O7)2]6-, поддерживая [P2O74-]:[Cu2+]=7~8 в гальваническом растворе является относительно подходящим; если соотношение слишком велико, это приводит к снижению эффективности тока, появлению точечных отверстий в покрытии и склонности гальванического раствора к помутнению.
- Амин с лимонной кислотой. Является вспомогательным комплексообразователем и деполяризатором анода. Он может улучшить растворение анода, повысить дисперсионную способность гальванического раствора и увеличить яркость покрытия. При слишком низком содержании анод будет плохо растворяться, диспергирующая способность гальванического раствора снизится, и будет образовываться "медный порошок". Как правило, оптимальное содержание составляет около 10~30 г/л.
(2) Электродная реакция медного покрытия с пирофосфатом
Катодная реакция:[Cu(P2O7)2]6- + 2e6- = Cu + 2P2O74-
2H2O + e = H2 + 2OH–
Анодная реакция: Cu + 2P2O74- -2e = [Cu(P2O7)2]6-
Когда анод пассивируется, выделяется кислород:4OH– - 4e = O2 + 2H2O
Когда анодное окисление не завершено, Cu + происходит: Cu - e = Cu+
Последние две реакции необходимо тщательно контролировать, чтобы предотвратить их возникновение.
2.3 Имитация золотого гальванического покрытия
В последние годы, в связи с развитием декоративного гальванического покрытия в строительстве, производстве фурнитуры, освещения и украшений, имитация золотого покрытия получила широкое распространение.
(1) Основные категории имитации золотого гальванического покрытия
Имитация золотого покрытия может быть выполнена из медно-цинковых, медно-оловянных или медно-оловянно-цинковых сплавов, а также из медно-цинковых сплавов с последующей обработкой для создания реалистичного эффекта золота. Эффект имитации золота может достигать таких цветов, как 18К, 4К и розовое золото. Медно-оловянные сплавы (бронзы) можно разделить на три категории по содержанию олова: низкооловянные бронзы с содержанием олова 5%~15%, которые выглядят от розового до золотисто-желтого; среднеоловянные бронзы с содержанием олова 15%~40%, которые выглядят желтыми; и высокооловянные бронзы с содержанием олова 40%~50%, которые выглядят серебристо-белыми.
Золотоподобное покрытие имеет очень короткое время гальванизации, и его блеск в основном зависит от нижележащего слоя для поддержки, обычно покрытого ярким никелевым слоем или другим белым и блестящим покрытием. Латунное покрытие также может служить основой для декоративного тонкого золотого слоя, а также защитным и смазывающим слоем. Латунь склонна к обесцвечиванию на воздухе, поэтому при использовании в качестве поверхностного слоя или основы тонкого золотого слоя она должна проходить антидисколяционную обработку, например, напыление органического покрытия или покрытие катодной электрофоретической краской. В последние годы для предотвращения кожной аллергии на никель в ювелирном деле белый медно-цинковый сплав может использоваться в качестве низкосортного заменителя никелевого покрытия, а также служить основой для хрома и для белых и требуемых белых покрытий в металлических украшениях игрушек.
Ключ к получению сплава путем одновременного совместного осаждения двух металлов заключается в том, что их потенциалы осаждения должны быть близки, а катодная поляризация должна обеспечивать осаждение двух металлов в необходимом соотношении. Комплексные ионы, присутствующие в цианистом растворе, в основном представляют собой Cu(CN)32- и Zn(CN)42-. Стабильность цианид-ионов меди намного выше, чем цианид-ионов цинка, а катодная поляризация меди намного больше, чем цинка. Поэтому, чтобы получить покрытие, соответствующее требованиям, необходимо строго контролировать общее содержание цианида, свободного цианида, соотношение меди и цинка, значение pH, а также такие факторы, как температура, плотность тока и перемешивание.
(2) Технологический процесс нанесения гальванического покрытия из имитированного золота
При нанесении золотого покрытия на медный сплав существует две основные проблемы: первая - как сохранить блеск покрытия и предотвратить обесцвечивание покрытия из медного сплава; вторая - как добиться реалистичного эффекта. Поэтому разумный процесс нанесения гальванического покрытия и последующая обработка приобретают решающее значение. Обычно используется следующий процесс нанесения гальванического покрытия имитацией золота:
- Прежде чем покрыть заготовку ярким никелем, она должна пройти предварительную обработку. В конечном итоге покрытие из блестящего никеля имеет беловатый оттенок, который может усилить блеск слоя имитации золота.
- Активация никеля направлена на удаление пассивирующего слоя на поверхности блестящего никеля для улучшения прочности сцепления с поверхностным слоем. Метод включает катодную обработку в электрообезжиривающем растворе в течение 3~5 минут, затем активацию серной кислотой 5% после промывки водой и тщательное ополаскивание перед поступлением в резервуар для имитации золотого покрытия.
- После нанесения гальванического покрытия имитацией золота поверхность заготовки очищается горячей водой и промывается в противотоке.
- Обработка против обесцвечивания, направленная на предотвращение обесцвечивания покрытия после промывки. Обычные процессы пассивации включают дихромат калия или бензотриазол.
- Катодный электрофорез обрабатывается акриловой краской для катодного электрофореза или прозрачными покрытиями, такими как акриловый лак, а также распылением или погружением с органическими кремниевыми прозрачными покрытиями.
- Лак или краска для окрашивания. Чтобы создать реалистичный эффект имитации золота во внешнем виде и компенсировать недостатки тона имитации золотого покрытия, можно нанести прозрачное покрытие золотого цвета.
3. Гальванический никель
3.1 Светлый никель
Яркий никель - одно из наиболее широко используемых сегодня покрытий. В его основе лежит ватный никель с добавлением присадок для получения яркого и гладкого никелевого покрытия.
(1) Основные компоненты раствора для нанесения покрытия
① Никель. Источниками ионов никеля могут быть сульфат никеля, хлорид никеля, аминосульфонат никеля и т.д. Ионы никеля являются основным компонентом гальванического раствора, обычно их содержание составляет 52~70 г/л. Высокая концентрация ионов никеля позволяет увеличить плотность тока. Это улучшает скорость осаждения, но если концентрация слишком высока, диспергирующая способность гальванического раствора снижается, что может привести к отсутствию осаждения в зонах со слабым током. Если концентрация ионов никеля слишком низкая, скорость осаждения снижается, а в тяжелых случаях область с высоким током может подгореть.
② Буфер. Борная кислота является лучшим буфером в растворе для никелирования, и ее минимальная эффективная концентрация составляет не менее 30 г/л; обычно в раствор для никелирования берут 40~.50 г/л. Борная кислота также может усилить катодную поляризацию, улучшить проводимость раствора и механические свойства покрытия.
③ Смачивающие вещества. Во время процесса гальванизации на катоде выделяется водород. Смачивающие агенты могут снижать поверхностное натяжение гальванического раствора, увеличивая смачивающий эффект раствора на поверхности заготовки, затрудняя пребывание пузырьков водорода, образующихся в процессе гальванизации, на поверхности катода, тем самым предотвращая образование проколов и дефектов. Смачивающие агенты состоят из поверхностно-активных веществ, которые можно разделить на высокопенные и низкопенные смачивающие агенты. К высокопенным смачивающим агентам относится додецилсульфат натрия, а к низкопенным - диэтилгексилсульфат натрия.
④ Осветляющие вещества. Включая первичные осветляющие агенты, вторичные осветляющие агенты и вспомогательные осветляющие агенты.
- Первичный отбеливатель: Его основной функцией является уточнение размера зерна и уменьшение чувствительности раствора покрытия к металлическим примесям, с общей дозировкой примерно 1~10 г/л, слой никелевого покрытия содержит примерно 0,03%S. Типичные первичные отбеливатели включают сахарин, дифенилсульфоний аммония (BB1), толуолсульфоний аммония, бензенсульфоновую кислоту, 1,3,6-нафталинсульфоновую кислоту, бензолсульфоновую кислоту и бензолсульфоновый натрий (BSS) и т.д.
- Вторичные отбеливатели придают покрытию заметный блеск, но при этом вызывают напряжение и хрупкость покрытия, а также чувствительность к загрязнениям. Дозировка должна строго контролироваться, а при использовании в сочетании с первичными отбеливателями они могут создавать полностью яркое покрытие. Типичные вторичные отбеливатели включают 1,4-бутандиол, пропаргиловый спирт, гексанол, пиридин, тиомочевину и т. д.
- Вспомогательные отбеливатели: Они способствуют осветлению покрытия, улучшают укрывистость покрытия и снижают чувствительность гальванического раствора к металлическим примесям. Типичные вспомогательные отбеливатели включают аллилсульфонат натрия, винилсульфонат натрия, пропаргилсульфонат натрия и т.д.
⑤ Никелированные товарные добавки. Различные промежуточные продукты комбинируются в зависимости от их эксплуатационных характеристик, в результате чего получается несколько типов.
- Стартер для ванны (смягчающий агент): в основном состоит из основного и вспомогательного осветляющих агентов.
- Осветляющий агент (основной осветляющий агент): Состоит из одного или нескольких соединений, главным из которых является вторичный осветляющий агент, дополненный другими компонентами.
- Поверхностно-активные вещества: Существует два типа: низкопенный и высокопенный.
- Продувочные агенты: например, средства для удаления железа, средства для удаления меди, средства для удаления цинка, средства для позиционирования в низких зонах и т.д.
(2) Реакция на электродах
Катод: Ni2+ + 2e = Ni 2H+ + 2e = H2
Анод: Ni = Ni2+ + 2e 4OH– = 2H2O + O2 + 4e
3.2 Черный никель с гальваническим покрытием и сатин Gunmetal
Черное и оружейное никелевое (черный перламутр) покрытие используется в основном для оптических покрытий и декоративных антикварных покрытий, как правило, наносится на блестящие никелевые, медные, бронзовые и цинковые покрытия, толщина которых не превышает 2 мкм. Этот тип покрытия является твердым и хрупким, с плохой коррозионной стойкостью, и поверхность покрытия необходимо защищать лаком.
Появление черного и металлического цветов обусловлено различием чернящих материалов в гальваническом растворе. Слой черного никелирования содержит большее количество неметаллических фаз, например, цинксодержащее черное никелирование, которое обычно имеет массовую долю никеля 40%~60%, цинка 20%~30%, серы 10%~15% и органического вещества около 10%, что делает его смесью никеля, цинка, сульфида никеля, сульфида цинка и органического вещества.
Рабочая температура раствора для нанесения покрытия, значение pH и плотность тока влияют на темноту покрытия. Если покрытие не темное, имеет цвета или кажется желтым, сначала проверьте проводимость, затем проверьте, слишком ли высок или слишком низок ток; если температура слишком высока, проверьте, недостаточна ли концентрация тиоцианата, сульфата цинка, молибдата аммония и т. д. в гальваническом растворе.
3.3 Никель с гальваническим покрытием
Жемчужный никель (сатинированный никель) имеет мелкую кристаллизацию, низкую пористость, низкое внутреннее напряжение, хорошую коррозионную стойкость и мягкий тон. Он не оставляет следов при прикосновении рукой, ценится и любим в декоративном гальванопокрытии, широко используется в качестве базового слоя хрома, серебра и золота, а также может применяться непосредственно для нанесения поверхностных слоев, особенно в таких областях, как часы и ювелирные изделия.
Основной процесс гальванического покрытия сатинированным никелем заключается в добавлении в гальванический раствор определенных органических веществ, таких как анионы и амфотерные вещества, которые в условиях электролиза образуют осадки диаметром, подобным диаметру коллоидных частиц. Эти осадки совместно с никелем осаждаются на катоде, образуя атласное никелевое покрытие с перламутровым блеском. Выбирая типы и концентрацию добавок, можно регулировать диаметр преципитатов. Процесс перламутрового никелирования практически полностью состоит из запатентованных коммерческих добавок.
Дефект, часто встречающийся в перламутровом никеле, - это "яркие пятна", которые можно устранить, удалив загрязнения и тщательно перемешав раствор для нанесения покрытия перед использованием.
4. Гальваническое покрытие из серебра и серебряных сплавов
Символ элемента серебра - Ag, относительная атомная масса - 107,9; стандартный электродный потенциал - 0,799 В, электрохимический эквивалент - 4,025/(A.h).
Покрытия из серебра и серебряных сплавов обладают отличной проводимостью, низким контактным сопротивлением, паяемостью, а также сильными отражающими и декоративными свойствами. Они широко используются в качестве декоративных покрытий в посуде, музыкальных инструментах, ювелирных изделиях и т. д.
Посеребренный слой вступает в реакцию с серой в воздухе, образуя оксид серебра и черный сульфид серебра. Он также может легко почернеть при контакте с серосодержащими материалами, такими как пластмассы и резина, а кислород в воздухе способствует потемнению. Обесцвечивание посеребренного слоя сильно ухудшает внешний вид компонентов и влияет на паяемость и электрические характеристики покрытия.
Решения для серебряного покрытия по-прежнему основаны в основном на цианистом серебрении, которое дает тонкий, чистый белый слой с хорошей дисперсией и способностью к покрытию, а сам процесс относительно стабилен. Однако в нем содержится большое количество цианида, и он очень токсичен. В стране и за рубежом проводились исследования процессов нецианистого серебрения, и в настоящее время имеются коммерческие предложения, такие как серебрение NS, серебрение ниацином, серебрение тиосульфатом, серебрение дибутирил-имидом, серебрение имидазол-сульфокислотой и другие. Нецианистое серебрение развивается медленно из-за менее деликатного внешнего вида, чем цианистое, менее удобного обслуживания и нестабильности поставок сырья.
4.1 Цианистое серебрение
Начиная с первого патента на серебряное покрытие в 1840 году и до наших дней, цианистое серебряное покрытие имеет более чем 160-летнюю историю. Цианистое серебрение всегда было доминирующим в генерации серебряных покрытий. Развитие цианистого серебрения в 1970-х годах привело к появлению осветлителей, которые непосредственно наносили яркий серебряный слой из раствора, устраняя процесс полировки, повышая эффективность и экономя большое количество серебра. Яркое серебряное покрытие стало основным направлением цианистого серебряного покрытия.
(1) Основные компоненты раствора для цианистого серебрения
① Серебро. Это основная соль в гальваническом растворе, существующая в виде комплексных ионов цианида серебра. Источником серебра может быть AgNO3, AgCl, AgCN, KAg(CN)2, но AgNO3 а AgCl лучше всего превращается в AgCN или KAg(CN)2Затем добавляется в раствор для нанесения покрытия. Содержание Ag в гальваническом растворе поддерживается на уровне 20~40 г/л. Если концентрация серебра слишком высока, покрытие кристаллизуется и приобретает желтый цвет; если концентрация серебра слишком низка, диапазон плотности тока слишком узок, и скорость осаждения снижается.
② Цианид калия. Это комплексообразующий агент; в дополнение к комплексообразованию с Ag, определенное количество свободного цианида калия благоприятно сказывается на стабильности гальванического раствора, нормальном растворении анода и диспергирующей способности гальванического раствора. Данные, в общем, в основном относятся к свободному KCN. Если его концентрация слишком высока, скорость осаждения в растворе медленная; если концентрация слишком низкая, слой покрытия склонен к пожелтению, а серебряный анод легко пассивируется, что приводит к медленной скорости осаждения.
③ Гидроксид калия, карбонат калия. Он может улучшить проводимость гальванического раствора, помочь дисперсионной способности гальванического раствора и повысить яркость покрытия.
④ Тартрат натрия. Он может уменьшить поляризацию анода, предотвратить пассивацию и способствовать растворению серебряного анода.
⑤ Осветляющие средства. Добавление отбеливателей позволяет получить полностью яркое покрытие и расширить диапазон плотности тока, но для серебряных покрытий, используемых в разных целях, необходимо подбирать подходящие отбеливатели. Для декоративных покрытий требования к толщине невелики, но требования к цвету покрытия (белизне и яркости) особенно высоки, что делает нецелесообразным использование добавок, содержащих металлы. Для функциональных покрытий, используемых в электротехнике и электронике, требования к толщине покрытия и электрическим характеристикам выше, а некоторые могут учитывать требования к твердости покрытия, что позволяет добавлять соли металлов, такие как антимонат калия.
Неметаллические отбеливатели часто содержат серу, которая позволяет получить яркое белое серебряное покрытие, но срок их службы недостаточно велик. Они разлагаются, если их своевременно не использовать в растворе для нанесения покрытия. Металлические отбеливатели, такие как сурьма, селен, теллур, кобальт и никель, могут улучшить яркость покрытия и повысить твердость, что делает их более подходящими для твердого серебра.
(2) Реакция электродов при цианистом серебрении
Катод:
Комплексный ион цианида серебра непосредственно восстанавливается на катоде: Ag(CN)2- + e = Ag + 2CN–
Побочная реакция: 2H2O + 2e = H2 + 2OH–
Анод:
Использование растворимого серебряного анода: Ag + 2CN– = Ag(CN)2- + e
При использовании нерастворимых анодов:4OH– = 2H2O + O2 + 4e
Эффективность по току при цианистом серебрении высока, причем как катодная, так и анодная эффективность по току близка к 100%.
4.2 Обесцвечивание серебряного покрытия
Посеребренные украшения, находящиеся на воздухе или используемые в течение некоторого времени, вступают в контакт с вредными газами или веществами, содержащими серу в воздухе, что приводит к коррозии и обесцвечиванию покрытия, серьезно ухудшая внешний вид украшения. Основные причины этого следующие.
- Сам посеребренный слой может легко вступить в реакцию и пожелтеть во влажной атмосфере, содержащей сульфиды, а в тяжелых случаях - почернеть.
- Неправильная эксплуатация процесса нанесения серебряного покрытия. Недостаточная очистка после нанесения покрытия оставляет на поверхности следы солей серебра, и это ионизированное серебро склонно к обесцвечиванию. Загрязненный или недостаточно чистый раствор для нанесения покрытия содержит ионы таких металлов, как медь, железо и цинк, что приводит к низкой чистоте слоя покрытия. Неправильная работа приводит к образованию шероховатого слоя покрытия с высокой пористостью. Поверхности с высокой пористостью склонны к накоплению влаги и коррозионных сред.
- Неправильная упаковка и хранение после нанесения серебряного покрытия. Причины обесцвечивания в основном следующие: во-первых, ювелирные изделия с серебряным покрытием подвергаются прямому воздействию света, в результате чего атомы серебра подвергаются воздействию ультрафиолетовых лучей, превращаясь в ионы серебра, что ускоряет скорость обесцвечивания; во-вторых, хранение во влажной и высокотемпературной среде чревато обесцвечиванием; в-третьих, плохая герметичность упаковки может привести к реакции упаковочных материалов с серебряным покрытием.
4.3 Процесс обработки слоя с серебряным напылением против обесцвечивания
Для предотвращения обесцвечивания серебряного слоя в производстве часто используются процессы пассивации серебряного слоя, которые обычно включают следующие методы: химическая пассивация, электрохимическая пассивация, погружение в антидисколорирующие агенты, гальваническое покрытие драгоценными металлами и погружение в органические защитные пленки.
(1) Химическая пассивация
После тщательной промывки водой следует немедленно обработать хромовой кислотой те детали, на которые было нанесено неяркое серебряное покрытие.
- Обработка хромовой кислотой. Хромовый ангидрид: 80~85 г/л; хлорид натрия: 15~20 г/л; температура: комнатная температура; время: 5~15 секунд. После обработки хромовой кислотой на поверхности серебряного покрытия образуется относительно рыхлая желтая пленка.
- Процесс зачистки. Аммиачная вода: 300~500 мл/л; комнатная температура; время: 20~30 секунд.
- Идэмицу. Азотная или соляная кислота массовой долей 5%~10%; комнатная температура; время: 5~20 секунд. После того как слой серебряного покрытия проходит все вышеперечисленные процессы, его подвергают химическому пассивированию для достижения лучших результатов. Слой химической пассивирующей пленки очень тонкий, что практически не влияет на контактное сопротивление. Тем не менее, структура пассивирующей пленки недостаточно плотная, и ее способность предотвращать обесцвечивание невелика, поэтому далее может быть проведено электрохимическое пассивирование.
(2) Электрохимическая пассивация
Это может быть сделано после химического пассивирования или непосредственно после блестящего серебрения. В качестве катода используется слой серебряного покрытия, а в качестве анода - нержавеющая сталь. В результате электролиза на поверхности серебряного слоя образуется относительно плотная игольчатая пленка, которая обладает большей устойчивостью к обесцвечиванию, чем пленка химической пассивации. Если химическая пассивация сочетается с электролизом, эффект будет еще лучше.
(3) Защитное средство от электрического контакта при погружении
Растворите защитное средство в органическом растворителе и замочите его на 1~2 минуты при определенной температуре, что оказывает защитное действие на поверхность.
(4) Гальваническое покрытие драгоценных металлов
Гальваническое покрытие из золота, родия, палладия, палладиево-никелевого сплава (80%), толщина 0,1~0,2 мкм.
(5) Органическая защитная пленка
Толщина обычно превышает 5 мкм, а защитный эффект лучше. Прозрачные защитные покрытия на основе акрила или силикона могут быть нанесены погружением (распылением) или катодной электрофоретической акриловой электрофоретической краской. Требования к органической защитной пленке в основном включают хорошую плотность покрытия, высокую прозрачность, твердость покрытия не ниже HV4 и хорошую адгезию к подложке.
5. Гальваническое покрытие из золота и золотых сплавов
Относительная атомная масса золота составляет 197, стандартный электродный потенциал моновалентного золота равен +1,68 В, электрохимический эквивалент трехвалентного золота составляет +1,5 В, а электрохимический эквивалент Au+ составляет 7,357 г/(А.ч), а электрохимический эквивалент Au3+ составляет 2,44977 г/(А.ч).
Золото обладает чрезвычайно высокой химической устойчивостью, его не разъедают соляная, серная, азотная, фтористоводородная кислоты и щелочи. По электропроводности золото уступает только серебру и меди. Теплопроводность золота составляет 70% от теплопроводности серебра, и золото обладает отличной пластичностью. Благодаря химической стабильности, электропроводности и хорошей паяемости золото широко используется в декоративной промышленности.
Декоративное золотое покрытие обычно используется для изготовления ювелирных изделий, требующих от покрытия хорошего цвета, блеска, износостойкости и отсутствия обесцвечивания. По чистоте покрытие можно разделить на чистое золото и золото K, при этом чистое золото имеет содержание золота выше 99,9%, а широко используемые типы золота K, включая 22K, 18K и 14K. По толщине покрытия можно разделить на тонкое и толстое золото, причем тонкое золото можно наносить непосредственно на такие подложки, как никель, медь и бронза, а толстое золото требует предварительного нанесения базового слоя.
Золотое покрытие началось в начале XIX века, когда в конце 1840-х годов появились патенты на применение золотых покрытий, основанных на щелочных растворах на основе цианидов. В связи с чрезвычайной токсичностью цианида, как в стране, так и за рубежом, ведутся исследования по разработке нецианистых и малоцианистых растворов для золотого покрытия, что привело к появлению кислотного чистого золотого покрытия, кислотного твердого золотого покрытия, нейтрального золотого покрытия и нецианистого золотого покрытия. Растворы для золочения можно разделить на четыре типа: щелочной цианистый, кислотный малоцианистый, нейтральный малоцианистый и нецианистый. В целом, малоцианистые и бесцианистые растворы для золотого покрытия все еще имеют определенные недостатки в стабильности и эффекте покрытия по сравнению с щелочными цианистыми растворами для золотого покрытия.
5.1 Цианистое золотое покрытие
(1) Щелочное цианистое золотое покрытие
① Основные компоненты щелочного цианистого раствора для золотого покрытия. Щелочной цианистый раствор для золотого покрытия обладает хорошей диспергирующей способностью, является стабильным раствором, прост в эксплуатации и обслуживании, в него можно легко добавлять различные элементы сплава, такие как Cu, Ni, Co, Ag, Cd и т.д. для получения золотых сплавов различных оттенков. Например, добавление никеля позволяет получить слегка белый цвет золота, добавление Cu и Cd - розовое золото, а добавление Ag - светло-зеленое золотое покрытие. Контролируя концентрацию элементов сплава в растворе и условия работы, можно получить практически любой желаемый оттенок золотого покрытия. Пористость цианистого золотого покрытия относительно высока, а его износостойкость и коррозионная стойкость низки. Из-за высокого содержания цианида в золотом покрытии его использование в последние годы значительно сократилось, однако в ювелирной промышленности цианистое золотое покрытие остается наиболее распространенным типом. Основные компоненты щелочного цианистого раствора для золотого покрытия следующие.
- Цианид золота калия (содержит 68,3% золота). Это основная соль в гальваническом растворе и источник золота в гальваническом слое. При слишком низком содержании Au слой покрытия будет выглядеть красным и шероховатым. Качество цианистого калия очень важно, поэтому при его выборе и использовании следует соблюдать осторожность. Цианид золота-калия следует растворить в деионизированной воде перед добавлением в гальванический раствор.
- Цианид калия (цианид натрия). Это комплексообразующий агент, который стабилизирует раствор для нанесения покрытия и позволяет нормально протекать электродному процессу. При слишком низком содержании раствор становится нестабильным, что приводит к образованию грубого покрытия с плохим цветом.
- Фосфат. Это буфер, который стабилизирует гальванический раствор и улучшает блеск покрытия.
- Карбонат. Это проводящая соль, которая может улучшить проводимость раствора для нанесения покрытия и повысить его диспергирующую способность. Однако если карбонат не добавить при открытии бака, а раствор будет щелочным, со временем в нем появится CO2 из воздуха будут накапливаться в растворе для нанесения покрытия. При чрезмерном накоплении карбонатов это может привести к шероховатости покрытия и образованию пятен.
- В состав сплавов Cu, Ni, Co, Ag и Cd в основном добавляют цианистые соли, а также соли EDTA. Для получения покрытий из сплавов 14К, 16К, 18К и 23К в различных пропорциях необходимо правильно регулировать их концентрацию. Кроме того, золото-серебряные покрытия 16К и золото-медь-кадмиевые покрытия 18К могут использоваться в качестве промежуточных слоев в комбинациях толстого золотого покрытия и покрываться до необходимой толщины.
② Электродная реакция щелочного цианистого золотого покрытия. Основной солью в цианистом растворе для золотого покрытия является цианистый калий KAu(CN).2. Цианидный комплексный ион Au(CN)2– находится в растворе и разряжается на катоде, образуя слой золотого покрытия.
Катод: [Au(CN)2]– + e = Au + 2CN–
Побочная реакция:2H+ + 2e = H2
Анод:
Использование растворимого серебряного анода: Au + 2CN– - e = [Au(CN)2]–
При использовании нерастворимых анодов:2H2O - 4e = 4H+ + O2
Часть CN– оставшийся в растворе, окисляется кислородом исходной экосистемы, и возможными продуктами являются CNO–ГЛАВНЫЙ ОПЕРАЦИОННЫЙ ДИРЕКТОР–, CO32-, NH3, (CN)2и т.д., которые накапливаются в растворе и становятся загрязнителями.
(2) Кислотно-цианистый процесс золотого покрытия
Основой для создания кислого микроцианидного раствора для золотого покрытия является то, что комплексные ионы цианида золота не разлагаются при pH 3,1. pH кислого раствора для золотого покрытия составляет 3,5~5,5. Чистое золотое покрытие яркое, однородное, тонкое, имеет желтовато-красный оттенок. Добавление в раствор легирующих элементов Co, Ni, Sb, Cu, Cd и других позволяет получать сплавы золота, отвечающие требованиям декоративной промышленности к различным оттенкам, например, 22,5~23,5 слоев золотого покрытия 1N14, 2N18, 3N.
В производстве кислотное золотое покрытие в основном делится на два типа: тонкое золото и толстое золото. Тонкое золотое покрытие включает в себя предварительное золотое покрытие и декоративное золотое покрытие. Предварительное золочение требует отличной адгезии к подложке и слою золота, а раствор для предварительного золочения предотвращает загрязнение раствора для толстого золочения. Декоративное золото может быть чистым золотом или золотым сплавом, в зависимости от требований к внешнему виду. Растворы для толстого золотого покрытия включают обычные и высокоскоростные растворы для золотого покрытия. При необходимости раствор может быть покрыт до требуемой толщины. Основные компоненты кислотного цианистого раствора для золотого покрытия следующие:
- Цианид калия. При достаточном содержании основной соли можно получить яркое, мелкокристаллическое золотое покрытие. Недостаточное содержание приводит к узкому диапазону плотности тока, при этом покрытие выглядит красным, шероховатым и имеет высокую пористость.
- Цитрат. Оказывает комплексообразующее, ассоциирующее и буферное действие. При слишком высокой концентрации снижается эффективность тока и раствор подвержен старению; при слишком низкой концентрации ухудшается диспергирующая способность раствора для нанесения покрытия.
- Фосфат. Буферный агент, который стабилизирует раствор для нанесения покрытия и улучшает блеск покрытия.
- Кобальт, никель, сурьма, медь, кадмий, серебро и т.д. являются легирующими элементами, которые могут улучшить твердость и внешний вид покрытия, и их концентрация должна строго контролироваться.
5.2 Нецианистое золотое покрытие
В 1960-х годах в производстве использовалось безцианидное золотое покрытие, а также растворы, содержащие сульфиты, тиосульфаты, галогениды, янтарную кислоту и т.д., но наиболее широко применялся раствор сульфитного покрытия с [Au(SO3)2]3- в качестве комплексного аниона.
Характеристики сульфитного гальванического раствора: гальванический раствор имеет хорошую дисперсию и покрывающую способность, гальванический слой имеет хорошее выравнивание и пластичность (удлинение может достигать 70%~90%), может достигать зеркального блеска, чистота гальванического слоя высокая, хорошая свариваемость. Быстрая скорость осаждения, мало пор. Покрытие имеет хорошую адгезию к никелю, меди и серебру.
Недостатком сульфитного раствора является то, что его стабильность не так высока, как у цианистого раствора, а износостойкость твердого золота невысока. В настоящее время этот процесс занимает небольшую долю рынка, но у него есть потенциал.
6. Гальваническое покрытие родия
Родиевое покрытие имеет серебристо-белый цвет, сильный блеск поверхности, не подвержено воздействию агрессивных газов, таких как углекислый газ и сульфиды в атмосфере, обладает высокой устойчивостью к кислотам и щелочам, проявляя сильную коррозионную стойкость. Твердость родиевого покрытия в десять раз превышает твердость серебряного покрытия, оно обладает хорошей износостойкостью. Декоративный слой родия имеет слегка голубоватый оттенок белого цвета, яркий блеск, износостойкость и высокую твердость, что делает его декоративным покрытием высшего класса. Из-за высокой твердости и хрупкости родия, если покрытие слишком толстое, оно может легко отслоиться. Поэтому для модных украшений общего назначения перед родиевым покрытием обычно наносят базовый слой из серебра, палладия или никеля.
Раствор для родиевого покрытия содержит сульфаты, фосфаты или аминосульфонаты, наиболее часто используемые сульфаты. Родиевый раствор прост в обслуживании, обладает высокой эффективностью тока и высокой скоростью осаждения, что делает его пригодным для обработки ювелирных изделий.
(1) Основные компоненты раствора сульфата родия для гальванического покрытия
- Сульфат родия. Это основная соль гальванического раствора, и при соответствующем содержании родия она позволяет получить мелкокристаллическое яркое покрытие. При слишком высоком содержании покрытие не будет белым и шероховатым; при слишком низком содержании покрытие пожелтеет и будет иметь плохую яркость. Обычно содержание родия контролируется в пределах 1,6~2,2 г/л.
- Серная кислота. Ее основная функция - поддержание стабильности гальванического раствора и повышение электропроводности, а низкое содержание серной кислоты повлияет на яркость гальванического слоя.
(2) Электродная реакция при родиевом покрытии
Анодная реакция:4OH - 4e = 2H2O + O2 ↑
Катодная реакция: Rh2+ + 2e = Rh
Катодная побочная реакция:2H+ + 2e = H2 ↑
Раздел III Процесс химического осаждения
1. Характеристики химического покрытия
По сравнению с гальваническим покрытием химическое покрытие имеет следующие преимущества.
(1) Электролитическое покрытие подходит для различных материалов подложки, включая металлы, полупроводники и неметаллические материалы.
(2) Толщина химического покрытия равномерна и постоянна, независимо от формы или сложности заготовки; при условии принятия соответствующих технических мер на заготовке может быть получено равномерное покрытие.
(3) При автокаталитическом химическом осаждении можно получать покрытия любой толщины, и даже возможно электроформование. Покрытия, полученные методом химического осаждения, обладают превосходными химическими, механическими и магнитными свойствами (например, плотными покрытиями и высокой твердостью).
Однако химическое гальваническое покрытие имеет и некоторые недостатки: во-первых, срок службы раствора для химического гальванического покрытия относительно короткий; во-вторых, скорость гальванического покрытия низкая, и только ниже критической скорости гальванического покрытия можно гарантировать качество покрытия.
2. Принцип химического покрытия
Химическое осаждение - это процесс осаждения металла, при котором ионы металла восстанавливаются на металлической поверхности путем самокатализа под действием соответствующих восстановителей в растворе. Это химическая окислительно-восстановительная реакция с переносом электронов и процесс химического осаждения без внешнего источника энергии. Этот тип химического осаждения можно разделить на три категории.
(1) Сменное покрытие
Поместите металл с сильными восстановительными свойствами (подложку, заготовку для нанесения покрытия) в раствор соли другого металла с сильными окислительными свойствами. Металл подложки выступает в роли сильного восстановителя, и отданные им электроны принимаются ионами металла в растворе, осаждаясь на поверхности подложки и образуя покрытие. Этот процесс также называется иммерсионным покрытием. Например, вытеснение меди серебром, когда медная заготовка в качестве подложки вытесняет серебро из раствора, а осажденный слой серебра покрывает медную поверхность. Реакция восстановления прекращается сразу после полного покрытия, в результате чего получается очень тонкое покрытие. Поскольку реакция основана на коррозии металла подложки, прочность сцепления покрытия с подложкой относительно низкая. Существует не так много систем, подходящих для процесса иммерсионного нанесения покрытия с точки зрения подложки и раствора для нанесения покрытия, поэтому применение этого процесса ограничено.
(2) Покрытие контактов
После того как металл, подлежащий золочению, соприкасается с другим вспомогательным металлом, его погружают в раствор солей металлов, причем потенциал вспомогательного металла должен быть ниже, чем потенциал осаждаемого металла. После того как металлическая заготовка и вспомогательный металл погружены в раствор, они образуют первичную батарею, причем вспомогательный металл является анодом благодаря своей сильной активности, растворяя и высвобождая электроны. Металлическая заготовка, напротив, является катодом, где ионы металла в растворе восстанавливаются и осаждаются в виде металлического слоя на заготовке. Этот метод не имеет большого практического значения, но может быть использован для инициирования химического осаждения на некаталитически активных подложках.
(3) Метод уменьшения
Сначала раствор для химического осаждения содержит ионы металла для покрытия, а затем электроны, обеспечиваемые соответствующим восстановителем, добавляются для уменьшения ионов металла для осаждения металлического покрытия. Эта реакция химического осаждения должна быть хорошо контролируемой с точки зрения скорости, иначе осаждение по всему раствору становится бессмысленным. Метод восстановления предполагает осаждение металлического покрытия на активную поверхность с каталитической способностью. Благодаря самокаталитической способности осажденного слоя в процессе осаждения, этот метод позволяет непрерывно осаждать металл, формируя покрытие определенной толщины, имеющее практическую ценность, что и является истинным смыслом процесса "химического осаждения". Метод осаждения металла с использованием восстановителя на самокаталитическую активную поверхность является единственным процессом мокрого осаждения, который может заменить гальваническое покрытие.
3. Химическое золотое покрытие
Химическое золочение можно разделить на восстановительный и вытеснительный тип, в зависимости от того, используется ли восстановитель в растворе для золочения. Раствор для химического золочения восстановительного типа включает соль золота, комплексообразователь, восстановитель, pH-буфер и другие добавки. В ходе реакции восстановитель используется для восстановления золота, которое затем равномерно осаждается на подложку для достижения желаемой толщины. Как правило, можно осадить более толстый слой золота толщиной около 1 мкм. Химическое золотое покрытие вытеснительного типа осуществляется без внешнего восстановителя. Благодаря разности потенциалов между металлами, более активный металл может вытеснить менее активный металл из раствора в результате реакции вытеснения. Например, при вытесняющем золочении на никелевую подложку разность потенциалов между золотом и никелем позволяет никелю вытеснять золото из раствора на поверхность никелевого слоя. Стандартный потенциал золота составляет 1,68 В, в то время как стандартный потенциал никеля - всего -0,25 В, что указывает на значительную разницу потенциалов. Когда никелевая подложка погружается в раствор для нанесения золотого покрытия, происходит реакция вытеснения, и слой золота быстро заменяет поверхность никеля. Однако атомы золота имеют больший объем, что приводит к относительно неплотному расположению на поверхности никеля с множеством пор. Поэтому в последующем процессе погружения золота, по мере увеличения времени, ионы золота в растворе продолжают вступать в реакции вытеснения с атомами никеля через поры на поверхности золотого слоя.
(1) Состав и технологические условия химического раствора для золотого покрытия
Химический раствор для золотого покрытия содержит соединения ионов золота (т.е. соли золота), комплексообразователи, pH-буферы, восстановители, стабилизаторы и другие основные компоненты.
① Соли золота и комплексообразователи. Подходящие соединения ионов золота включают цианистые соли золота KAu(CN)2, KAu(CN)4, водорастворимые соединения золота HAuCl4, KAuCl4, NH4AuCl4, Na3Au(SO3)2, Na3Au(S2O3)2, и соединения золота Au(OH)3 с меньшей растворимостью. Они могут использоваться отдельно или в комбинации. Концентрация ионов золота обычно составляет 0,001~0,1 моль/л. Если концентрация ионов золота ниже 0,001моль/л, практическая скорость осаждения золота не может быть достигнута; если концентрация ионов золота выше 0,1моль/л, возможно образование осадков золота, и соединения золота не могут полностью выполнять свою роль в химическом осаждении, что приводит к отходам золота, что экономически невыгодно. Добавление комплексообразователей в гальванический раствор направлено на образование комплексов с металлическими компонентами в растворе, при этом они выступают в качестве буфера, подавляющего изменения pH гальванического раствора. Доступные комплексообразователи включают EDTA-2Na, K2SO3, Na2SO3, K2S2O3 и другие.
② Reducing agents and additives. The main reducing agents currently used in research include dimethylamine borane (DMAB), sodium hypophosphite, hydrazine, borohydrides, hydrazine borane, thiourea, sodium ascorbate, and titanium trichloride, among others.
③ Process conditions. The pH value of the plating solution is generally 5~9, with an optimal range of 6~8. A lower pH value improves the adhesion of the gold plating layer, but excessively low pH values can easily produce harmful gases and corrosion. A high pH value makes the plating solution strongly alkaline, which can dissolve the coating on the surface of the plated item. Depending on the type and concentration of gold ion compounds and complexing agents, it is appropriate to select alkaline solutions NaOH, KOH, NH4OH or inorganic acid solutions H2SO4, H3PO4, H3BO3 to adjust the pH value of the plating solution. The plating temperature is generally 50~90℃, the best being 60~85℃. A lower operating temperature is particularly suitable for items that are not heat-resistant, and it can also save energy and ensure safe operation.
(2) Cyanide-Free Chemical Gold Plating
Developing cyanide-free chemical gold plating, which replaces CN– in the gold plating solution with non-cyanide alternatives, is an important direction in chemical gold plating. It represents a significant advancement based on cyanide gold plating and has seen considerable domestic and international development in recent years. The current cyanide-free gold plating solutions mainly include sulfite gold plating, thiosulfate gold plating, halide gold plating, and thiocyanate gold plating, among which sulfite gold plating has better practical value. The following mainly introduces the sulfite gold plating system.
Sulfite system: In 1842, sulfite gold salt was first used as a gold source for cyanide-free electroplating of gold; it was later applied in chemical gold plating solutions, referred to as sulfite gold plating solutions. The reducing agents used in this gold plating solution include sodium hypophosphite, formaldehyde, hydrazine, borohydrides, DMAB, sodium ascorbate, thiourea and its derivatives, and phenyl compounds, among others. To obtain a practical cyanide-free gold plating solution, a small amount of stabilizers needs to be added to the plating solution, such as EDTA, triethanolamine, NTA, benzotriazole, 2-mercaptobenzothiazole, etc. These additives can form complex chelating agents with the monovalent gold ions in sulfite gold salt, thereby improving the stability of the plating solution.
4. Chemical Nickel Plating
The chemical nickel plating layer is independent of the coating thickness and the shape of the part and has high hardness, good wear resistance, natural lubricity, and excellent corrosion resistance, which is why it is known as the “designer’s coating.” Designers can find suitable options in the coating system based on the properties required for the parts.
Composition and Process Conditions of Chemical Nickel Plating Solution
The chemical nickel plating solution is crucial for the chemical plating process’s stability and the coating’s quality. Since the development of chemical plating, many types of plating solutions have been developed. Among them, the most commonly used solution combines nickel sulfate as the main salt and sodium hypophosphite as the reducing agent, along with appropriate additional components to adjust stability, complexation, and other properties.
(1) Nickel salts. There are mainly two types: nickel sulfate and nickel chloride. During the plating process, if the concentration of nickel salts is too low, the reaction rate is slow, making it difficult to form a plating layer. If the concentration is too high, it leads to some nickel ions being free in the plating solution, reducing the stability of the solution, which can easily result in a rough plating layer and even trigger the decomposition of the plating solution. Therefore, it is essential to maintain an appropriate content of nickel salts in the plating solution and to accurately analyze and appropriately supplement the nickel salt content during the process.
(2) Reducing agent. The common reducing agent is sodium hypophosphite. The role of the reducing agent is to catalyze dehydrogenation to provide lively primary hydrogen atoms to reduce the nickel ions to metallic nickel. The reducing agent’s content significantly impacts the deposition rate; increasing the concentration of the reducing agent can accelerate the deposition rate, but the concentration of the reducing agent should not be too high. Otherwise, the plating solution is prone to self-decomposition, which destroys the stability of the plating solution, and the deposition rate will also reach a limit value.
(3) Complexing agents. Commonly used complexing agents include glycolic acid, malic acid, tartaric acid, citric acid, and lactic acid. Adding complexing agents controls the deposition rate of nickel ions. The addition of complexing agents must consider the ability to complex all nickel ions and the deposition rate of the plating solution to maintain an appropriate ratio of the components. Complexing agents can reduce the concentration of free ions and the equilibrium potential in the solution while also adsorbing on the plated parts’ surface, enhancing the plated parts’ surface activity and accelerating the release of hydrogen ions from hypophosphite. Using composite complexing agents can effectively improve the stability of the plating solution and the deposition rate and make the surface of the coating bright and dense.
(4) pH value adjusters and buffers. The pH value of the plating solution has a significant impact on the deposition rate, reducing agent utilization and coating performance. Since H+ is a byproduct of the reduction reaction, the pH value of the plating solution will decrease as the reaction proceeds. Therefore, adjusting and controlling the pH value during chemical plating is crucial. pH value adjusters are usually NaOH, KOH or alkaline compounds such as carbonates, ammonia, etc. If it is necessary to lower the pH value, inorganic or organic acids must be added. Adding buffers prevents instability in the deposition rate caused by drastic changes in pH value during the deposition reaction. The anions of the buffer combine to form weak acid molecules with very low ionization, thus controlling the drastic changes in the pH value of the plating solution.
(5) Стабилизаторы. During the plating process, active crystalline cores inevitably form in the plating solution for various reasons, causing the solution to decompose and fail. By adding stabilizers, these active crystalline cores can be poisoned, losing their self-catalytic effect, thus preventing the decomposition of the plating solution. Stabilizers have become a technical secret in the chemical nickel plating process. Common stabilizers include lead ions, tin sulfides, etc.
(6) Promoters. The addition of complexing agents to the chemical nickel plating solution generally leads to a decrease in deposition rate. If added in excess, it can cause the deposition rate to become very slow or even unusable. Small amounts of organic acids are often added to the plating solution to increase the deposition rate, and these organic acids are referred to as promoters.
(7) Temperature. Temperature is the most important parameter affecting the deposition rate of chemical nickel plating. The catalytic reaction of chemical nickel plating generally can only be achieved under heating conditions, and many individual reaction steps of chemical nickel plating only show a significant deposition rate above 50℃. The operating temperature of the acidic plating solution for chemical nickel-phosphorus alloy is generally around 85~95℃, while general alkaline chemical plating solutions can deposit within a moderate temperature range. As the temperature increases, the deposition rate accelerates. However, raising the plating solution temperature will accelerate the increase of hypophosphite, making the plating solution unstable. During operation, the plating solution should be stirred evenly, and care should be taken to prevent local overheating of the plating solution, maintaining a stable working temperature to avoid severe self-decomposition of the plating solution and adverse consequences such as delamination of the coating.
(8) pH value. With the increase of the pH value of the plating solution, the deposition rate accelerates, and the solubility of phosphite decreases, which can easily lead to the self-decomposition of the plating solution. Suppose the pH value of the plating solution is too high. In that case, the reaction of hypophosphite oxidizing to phosphite accelerates, and the catalytic reaction turns into a spontaneous reaction, causing the plating solution to fail quickly. As the pH value increases, the phosphorus content in the coating decreases. When the pH value is too low, the reaction cannot proceed, such as in acidic plating solutions, when the pH value<3, it isn’t easy to deposit a nickel-phosphorus alloy coating.
(9) The effect of stirring. The diffusion process influences the chemical nickel plating process, and stirring the chemical plating solution helps to increase the transfer rate of reactants to the workpiece surface while also facilitating the removal of reaction products. Essentially, stirring alters the chemical composition and pH value within the diffusion layer at the workpiece/solution interface. Stirring methods include mechanical stirring, magnetic stirring, ultrasonic dispersion, and chemical dispersion methods. Additionally, when chemical nickel plating is conducted under heating conditions, the large amount of hydrogen gas released can create a “self-stirring” effect. Among these, mechanical stirring is simple and easy to implement, generally using external shear and impact forces to fully disperse particles in the medium; however, it does not effectively address the overall stirring of the plating solution, especially at the bottom of the beaker. Magnetic stirring utilizes a magnetic rotor to generate stirring through rotation in the plating solution. It is very effective for stirring the solution at the bottom, making it beneficial for composite plating solutions containing settling particles. However, magnetic stirrers typically only heat the bottom of the plating tank, and this heating method can easily cause local overheating of the bottom solution, which may adversely affect the plating solution’s stability and the coating’s performance. Ultrasonic dispersion has been widely recognized and effective in recent years, utilizing ultrasound’s high energy and cavitation effect to crush aggregated microparticles for dispersion. However, due to the immense energy of ultrasound, this dispersion should be applied intermittently during plating. Better results can be achieved if supplemented with a certain intensity of mechanical stirring.
5. Chemical Copper Plating
Chemical copper plating technology is mainly applied to non-metal surfaces such as plastics and wood in decorative items. Whether for decorative or functional plastic electroplating, most require chemical copper plating to ensure a good conductive base layer and achieve a good coating. Compared to other methods of metalizing plastic surfaces, chemical copper plating is the most economical and simplest method.
(1) Common Methods of Chemical Copper Plating
The chemical copper plating solution mainly consists of copper salts, reducing agents, complexing agents, stabilizers, adjusting agents, and other components. Currently, the widely used chemical copper plating solution uses copper sulfate as the main salt and formaldehyde as the reducing agent, mainly composed of two parts: one is a solution containing copper sulfate, potassium sodium tartrate, sodium hydroxide, sodium carbonate, and nickel chloride; the other is a solution containing the reducing agent formaldehyde. These two solutions must be prepared separately in advance and then mixed for use. In alkaline solutions, formaldehyde mainly exists as methylene glycol and its anions. During the chemical copper plating process, formaldehyde rapidly undergoes a disproportionation reaction, producing its redox products and leading to premature aging of the plating solution. Since no coordinating agents exist in the plating solution, only a small amount of these oxides can be dissolved while most continue accumulating. A typical plating solution formula and working conditions are 5g/L copper sulfate, 25g/L potassium sodium tartrate, 7g/L sodium hydroxide, 10ml/L formaldehyde, and time 20~30 seconds.
(2) Chemical Copper Plating on Non-Metallic Surfaces
With the expansion of the application field of chemical copper plating, the technology for chemical copper plating on non-metal surfaces has also gradually matured. For example, maskless producing the copper interconnection wires on ceramic substrates has been achieved by combining laser micro-etching technology with chemical plating. On this basis, a chemical copper plating method has been further established and implemented on the surfaces of non-metallic materials such as ceramics without the need for catalytic activation. This method simplifies the chemical copper plating process, has good coating performance, stable plating solution, and fast plating speed; it also saves precious metals and reduces production costs. Chemical metal plating is one of the main methods for metalizing plastic surfaces.
After the plastic is metalized, it can be further processed through chemical plating or electroplating to obtain plastic products with wear resistance, heat resistance, thermal stability, and special functions.
Chemical copper plating is also applied to the surface treatment of wooden materials, and the treated materials have better decorative and corrosion-resistant properties, which can enhance the added value of the products. Japan has made certain progress in researching wood copper plating and gold plating processes in recent years. The treatment objects are mainly wood from commonly used tree species such as Japanese cedar, and the test materials include wood chips and small square timber. The treatment process first involves ultrasonic treatment of the test materials in aqueous and organic solvent immersion solutions, degreasing and removing components that hinder the plating film, then sealing the resin channels with polyethylene glycol toluene solution, attaching the catalyst, and finally performing chemical plating, which requires several drying steps.
Despite the significant development of the chemical copper plating process, the following aspects still need further improvement: the relationship between the stability of chemical copper plating and plating speed; the kinetic study of chemical copper plating in multi-complex systems; the impact of additives on coating performance; the relationship between the microstructure of the coating and the surface morphology of the substrate; alternatives to formaldehyde, etc.
Копирайт @ Sobling.Jewelry - Пользовательские ювелирные изделия производителя, OEM и ODM ювелирный завод
6. Chemical Plating Example: Electroplating of Leaf Veins
Leaf vein electroplating, also known as leaf decoration electroplating, first selects artistic, hard, and dense-veined leaves. After removing chlorophyll to expose the leaf veins undergo surface metallization and electroplating processing.
These leaves have been shaped and processed to maintain their original, realistic appearance and reflect the elegance and luxury after electroplating (Figure 11-8).

The main processes of leaf vein decorative electroplating are divided into three parts: leaf vein treatment, surface metallization (chemical plating), and decorative electroplating.
(1) Leaf Vein Treatment
Place the freshly picked leaves in an alkaline aqueous solution for soaking to remove chlorophyll, allowing the surface to display a relatively intact natural leaf vein pattern. The soaking solution is prepared with sodium hydroxide. After soaking for several days, chlorophyll can be removed, but this method takes a long time, and the degree of corrosion is difficult to control. Adding some sodium carbonate to the sodium hydroxide solution and heating it to a boil can quickly remove chlorophyll, with the leaves changing from green to yellow-green ideal. After washing the boiled leaves, if there are still traces of chlorophyll remaining on the veins, a soft brush must gently scrub along the veins, ensuring that the veins remain intact as a standard.
(2) Surface Metallization
Surface metallization is a treatment method that makes the surface of general non-metal materials conductive, preparing for the next electroplating step, which can be achieved through sensitization, activation, reduction, and chemical plating. Chemical nickel plating makes the surface of the leaf veins conductive, with the basic formula and process conditions being 26~28g/L nickel sulfate, 35g/L sodium hypophosphite, 20g/L citric acid, and other appropriate amounts. The operating process conditions are pH value being 4.6~4.8 and temperature at 90℃.
(3) Decorative Electroplating
After bright copper plating, mid-term production can be carried out: use spot welding to configure hanging parts, such as positioning pins, hooks, and other hangers. The material for the hanging parts is generally fine purple copper wire. Before spot welding, soak the fine copper wire in an acid solution for a short time (less than 30 seconds), and then cover it with solder for spot welding.
(4) Bright Electroplated Nickel
The nickel plating process, which is mainly used to prevent the penetration of copper and gold plating, refers to the previous one.
(5) Electroplated Gold
Finally, a thick gold plating is applied to the surface.
Section IV Chemical and Electrochemical Conversion Film Process for Popular Jewelry
Chemical and electrochemical conversion film technology is a technique that uses chemical or electrochemical means to bring metal into contact with a specific chemical treatment solution, thereby forming a layer on the metal surface that has good adhesion and can protect the base metal from the effects of water and other corrosive media, can improve the adhesion and aging resistance of organic coatings, or can impart decorative properties to the surface.
In the jewelry industry, chemical and electrochemical conversion film technology has been widely applied, forming colored films or interference films through surface conversion, creating various decorative colors and surface coloring effects, improving the appearance of materials, and enhancing corrosion resistance. This includes surface coloring treatments for copper jewelry, stainless steel jewelry, titanium jewelry, aluminum jewelry, and silver jewelry.
1. Chemical Coloring Process of Copper and Copper Alloy Ornaments
Copper alloy coloring is mainly applied to craft jewelry. Most copper compounds have intense colors, and the decorative colors on the surface of copper and its alloys almost cover the entire color spectrum through chemical coloring. Currently, the ones that are accepted by the market and can be produced on an industrial scale are primarily green (copper carbonate), black (copper sulfide), blue (alkaline copper ammonia complex), black (copper oxide), and red (cuprous oxide).
(1) The Chemical Reaction Mechanism of Surface Coloring
The surface coloring of copper and its alloys is the interaction of metallic copper with the coloring solution, forming an oxide layer, sulfide layer, and other compound films on the metal surface. Different coloring effects can be achieved by selecting different coloring formulas and conditions. For example, sulfur-based solutions that can be utilized include sulfides (such as potassium sulfide, ammonium sulfide, etc.), sodium thiosulfate, polysulfides (such as potassium persulfate), etc. The coloring principle is based on the characteristic reaction of sulfur with copper to produce copper sulfide, and under different reaction conditions and the participation of other components in the formula, colors such as black, brown, dark antique copper, blue, and purple can be formed. The interaction of copper with ammonia and chromium, along with the participation of other ions in the formula, can also produce various coloring effects under different reaction conditions. The addition of oxidants in the coloring formula can promote the reaction, but excessive oxidants can affect the quality of the oxide film.
(2) Chemical Coloring Process of Copper
- The color is antique copper. Immerse pure copper or copper-plated ornaments (the thickness of the copper plating must be greater than 5μm) in the coloring solution below and shake continuously. It will quickly turn brown and deepen over time. When it reaches a certain thickness, oxygen will start to precipitate; at this point, it should be removed, cleaned, and dried for polishing, or the colored piece can be rubbed with leather scraps in a drum. The surface layer of the convex part is ground away to reveal some of the original copper color. The parts will exhibit a gradient of color from light to dark from the convex to the concave surfaces, creating an elegant antique style. This antique color tone is favored in craft ornaments on the international market. The typical process specification for achieving antique copper color is 40~120g/L basic copper carbonate, 200ml/L ammonia, reacting at room temperature for 5~15 minutes.
- Copper coloring blue. Optional copper coloring blue process scheme: 130g/L copper sulfate, 13g/L ammonium chloride, 30ml/L ammonia, and 10ml/L acetic acid react for several minutes at room temperature.
- Copper coloring green. Optional copper coloring green process schemes: 32g/L calcium chloride, 32g/L copper nitrate, 32g/L ammonium chloride, react for a few minutes under 100℃.
- Copper coloring ancient green. Optional copper coloring ancient green process specifications: 5~10g/L sulfuric acid brocade, 10~15g/L ammonium sulfate, 25~30g/L sodium thiosulfate, water 200 ml, react for several minutes under 30~50℃.
- Copper coloring brown. Optional copper coloring brown process specifications: 6g/L copper sulfate, 4g/L copper acetate, 1g/L alum, react for 10 minutes under 95~100℃.
- Copper coloring golden yellow. Optional copper coloring golden yellow process schemes: 0.8g/L potassium sulfide, 1g/L ammonium sulfide, 0.3g/L barium sulfide, 4g/L sodium sulfide, 0.13g/L potassium permanganate, and 0.7g/L hydrogen peroxide react for several minutes at room temperature.
- Copper coloring red. Optional copper red process scheme: 25g/L copper sulfate, 200g/L sodium chloride, react for 5~10 minutes under 50℃.
- Copper coloring black. Optional copper blackening process schemes: 5~12.5g/L potassium sulfide and 20~200g/L ammonium chloride, which react for several minutes at room temperature.
(3) Chemical Coloring Process of Copper Alloys
Coloring with brass is relatively simple, with copper alloys followed by bronze, aluminum, and band bronze. The chemical coloring of copper alloys is widely used in craft jewelry.
- Copper alloy coloring red. Optional copper alloy red process schemes: 2g/L iron nitrate, 2g/L sodium sulfite, react for a few minutes under 75℃.
- Copper alloy coloring orange. Optional copper alloy orange process schemes: 25g/L sodium hydroxide and 50g/L copper carbonate, which react for a few minutes under 60~75℃.
- Copper alloy coloring brown. Optional process scheme for brown copper alloy: 12.5g/L barium sulfide, reacting for several minutes under 50℃.
- Copper alloy coloring chocolate color. Optional processes for copper alloy with chocolate color: 25g/L copper sulfate, 25g/L ammonium nickel sulfate, 25g/L potassium chlorate, react for a few minutes under 100℃.
- Copper alloy coloring ancient green color. Optional processes for achieving the ancient green color of copper alloy: 350g/L ammonium chloride, 200g/L copper acetate, react for a few minutes under 100℃.
- Copper alloys coloring blue. Optional processes for blue copper alloys: 2g/L sodium sulfite, 1g/L lead acetate, react for a few minutes under 100℃.
- Copper alloy coloring black. Optional process scheme for blackening copper alloy: 25g/L copper sulfate, a small amount of ammonia, reacts for a few minutes under 80~90℃.
(4) Factors Affecting Coloring Effects
The chemical coloring of copper and copper alloy jewelry is sometimes unstable, and the main factors affecting the coloring effect are the following three.
① The influence of substrate composition. Generally speaking, substrates with a high copper content are more likely to achieve a pure and attractive appearance. As the copper content decreases, the presence of other alloying elements, which are more reactive than copper, will affect the purity of the corrosion products and the color of the copper coating. For example, the corrosion products of zinc, tin, aluminum, etc., will mix white hydroxides into the film layer, causing the film layer to appear white. In this case, the content of stabilizers can be appropriately increased. When a β phase is present in the material’s metallographic structure, due to its poor corrosion resistance, severe pitting will occur, resulting in a large accumulation of zinc hydroxide at the pit openings, leading to obvious white spots and rendering the material unusable. At this time, reducing the stabilizer content can achieve good results.
② The impact of the workpiece surface condition. For deep-drawn or deep-stretched parts, in areas of severe deformation, 80% mechanical energy is stored in the form of crystal defects such as dislocations and vacancies, which have high chemical reactivity, leading to localized color differences. Stress relief annealing can be used to eliminate these issues. Additionally, the consistency of the surface roughness of the parts also has a certain impact on color consistency.
③ The impact of special climatic conditions. The coloring of copper alloy jewelry after applying the coloring solution may experience instability due to changes in climate during the color development reaction in the air. There may be insufficient or excessive reaction time for special climates, which requires appropriate control of the coloring time to resolve.
2. The Coloring Process of Silver and its Alloy Jewelry
The coloring treatment of silver and its alloys is mainly used for decorative craft jewelry, forming sulfides on its surface, which can create shades of black, blue-black, light gray, dark gray-green, gray-green, ancient silver, yellow-brown, green-blue, and so on.
(1) Silver Coloring Ancient Silver Color
Selectable silver alloy antique silver color process scheme: 25g/L potassium sulfide, 38g/L ammonium chloride, and 2g/L barium sulfide react at room temperature until the desired tone is reached.
(2) Silver Coloring Black
Selectable silver alloy with black process scheme: 15g/L potassium sulfide, 40g/L ammonium chloride, and a small amount of ammonia water react under 80℃ until the desired tone is reached.
(3) Silver Coloring Blue-Black
Selectable silver alloy with blue-black color process scheme: 2g/L potassium sulfide, 6g/L ammonium chloride, reacting under 60~80℃ until the desired hue is reached.
(4) Silver Coloring Blue and Yellow
Selectable silver alloy with blue-yellow process scheme: 1.5g/L potassium sulfide, reacting under 80℃ until the desired hue is reached.
(5) Silver Coloring Green
Selectable silver alloy with blue-green process scheme: 300g/L hydrochloric acid and 100g/L iodine react at room temperature until the desired hue is reached.
(6) Silver Coloring Yellow-Brown
Selectable silver alloy yellow-brown process scheme: 5g/L barium sulfide reacts at room temperature until the desired hue is reached.
3. Coloring Process of Zinc and its Alloy Jewelry
The surface conversion film formed by chromate passivation treatment of zinc and its alloys also has coloring functions, generally resulting in various colors such as rainbow, grass green, brownish yellow, green, military green, and black.
(1) Zinc Coloring Black
Selectable zinc blackening process: For 10~15 minutes, 40~50g/L copper sulfate and 30~40g/L potassium chloride react at room temperature.
(2) Zinc turns red
Selectable zinc red process scheme: copper sulfate, tartaric acid, and ammonia react at room temperature for minutes.
(3) Zinc Coloring Red
Selectable zinc coloring red craft scheme: 60g/L copper sulfate, 80g/L sodium carbonate, 60ml/L potassium bitartrate, react at room temperature for 3~5 minutes.
(4) Zinc Alloy Coloring Gray
Selectable zinc alloy gray coating process scheme: 20~25g/L copper sulfate, 50ml/L ammonia, 30g/L ammonium chloride, react for 3~5 minutes under 20~25℃.
(5) Zinc Alloy Coloring Green
Selectable zinc alloy green process scheme: 80~100g/L potassium dichromate, 25~30g/L sulfuric acid, 150g/L hydrochloric acid, react for 0.5~1 minutes under 30~40℃.
(6) Zinc Alloy Coloring Black
Selectable zinc alloy blackening process: 140~160g/L copper sulfate and 80~90g/L potassium chlorate react for 3~5 minutes under 20~25℃.
4. The Oxidation Coloring Process of Stainless Steel Jewelry
Stainless steel anodizing refers to forming an anodized color layer on the surface of stainless steel. It utilizes the colorless and transparent oxide film to create color through light interference, resulting in a durable hue formed by this film layer.
Typical methods for coloring stainless steel through oxidation include chemical and oxidation coloring methods. Chemical coloring methods include the Inco method and the Acheson method. The Inco method involves immersing the steel in a high-temperature sulfuric acid solution for coloring. In contrast, the Acheson method involves electrolysis in a medium-temperature solution to form a thin oxide film on the stainless steel surface, with color controlled by changing the thickness of the oxide film. The oxidation coloring method involves heating in the atmosphere or a controlled atmosphere to form an oxide film; this method is simple, but it is difficult to control the color, so it is limited to small stainless steel ornaments.
(1) Inco Method
In 1972, Inco established the color management and color-enhancing film technology for the acidic solution oxidation method, and its processing steps are as follows:
Pre-treatment → Water washing→Color development treatment→Water washing→Hard film treatment→Water washing→Drying
After pretreatment, the stainless steel plate is immersed in a 80~85℃ mixed solution of chromic acid and sulfuric acid. This treatment can form a chromium-based oxide film on the surface of the stainless steel, which can vary in thickness from hundreds to thousands depending on the treatment time. Due to light interference, colors can appear in the order of tea color: blue, gold, purple, green, etc. The growth of the oxide film, that is, the color change, can alter the immersion potential of the stainless steel, mastering this potential change for color management is the first feature of the Inco method (color development process). However, the color development film is porous at this stage and has poor wear resistance. Therefore, cathodic electrolysis should continue in a mixed aqueous chromic acid and phosphoric acid solution to strengthen the color development film. This treatment can seal the pores of the porous color development film, significantly improving wear and corrosion resistance. This is the second characteristic of the Inco process (hard film treatment).
Due to some issues with the process, the color in this technology is difficult to control, and the management requirements for raw materials are strict.
(2) Acheson Method
In 1985, Kawasaki Steel successfully developed the alternating current electrolysis method, also known as the Acheson method. This method involves electrolyzing stainless steel in a mixed solution of chromic acid and sulfuric acid below 60℃, forming an oxide film on the surface. Due to the repeated alternating anode electrolysis for a specified number of times, coloration and film hardening can occur simultaneously. Color control can be achieved by controlling the total electric charge. Stainless steel colored using the Acheson method has bright colors and can display unique colors such as bronze and yellow.
The color of the stainless steel surface mainly depends on factors such as the chemical composition of the surface film, its microstructure, surface smoothness, film thickness, and the angle of incident light. Generally, thin oxide films display blue or brown, medium thickness films show golden yellow or red, thick films appear green, and the thickest ones appear black. Overall, the coloring process of stainless steel is relatively difficult, with high process requirements, and its color uniformity is not easy to control.
5. Anodizing Treatment of Aluminum Alloy Jewelry
Aluminum alloy jewelry are widely colored using the anodizing method. Aluminum is one of the easiest metals to color. Through anodizing treatment, a thick and dense oxide film layer is formed on the aluminum surface, significantly changing the corrosion resistance of the aluminum alloy and improving hardness, wear resistance, and decorative performance. The methods for coloring aluminum oxide films mainly include electrolytic coloring, chemical dyeing, and electrolytic dyeing.
(1) Electrolytic Coloring Method
Electrolytic coloring is the process of anodizing and coloring completed in the same solution, directly forming a colored oxide film on aluminum alloys. Therefore, the electrolytic coloring method is also known as the one-step electrode coloring method. Electrolytic coloring is caused by the selective absorption of certain wavelengths of light by the film layer while the remaining wavelengths are reflected. The selective absorption is related to the oxidation state of the alloying elements in the film layer or the state of the electrolyte composition combined with the substances in the oxide film.
(2) Chemical Coloring Method
The anodic oxide film of aluminum jewelry can be impregnated and colored with inorganic or organic dyes. The coloring agents are deposited in the upper part of the pores of the oxide film. The most suitable oxide film for coloring is obtained through sulfuric acid anodization.
(3) Electrolytic Coloring Method (Two-Step Electrolytic Coloring Method)
After anodizing aluminum or aluminum alloys, they are immersed in a solution of more expensive metal salts, and coloring is achieved by using alternating current for polarization or direct current for cathodic polarization. Under the action of the electric field, metal ions are reduced and deposited at the bottom of the pores in the oxide film, resulting in the coloring of aluminum and its alloys.
Section V Physical Vapor Deposition Process
Physical Vapor Deposition is abbreviated as PVD. Physical Vapor Deposition is a physical vapor reaction growth method, and the deposition process occurs under vacuum or low-pressure gas discharge conditions. The source of the deposited material is a solid material, which, after “evaporation or sputtering,” generates a new solid material deposition layer on the surface of the part that is completely different in performance from the substrate.
Physical vapor deposition technology is increasingly applied to jewelry, with surface decorative coatings for crafts. The colors of the coatings are diverse, including deep gold, light gold, coffee, antique bronze, gray, black, gray-black, and multicolored, which can significantly improve the appearance color of craft jewelry and enhance characteristics such as wear resistance and corrosion resistance.
1. Classification of Physical Vapor Deposition Processes
Physical vapor deposition processes are divided into several types, including vacuum evaporation coating, ion plating, and magnetron sputtering coating, with the latter two belonging to the category of plasma vapor deposition. The deposition of the film layer occurs under low-pressure plasma gas discharge conditions, where the film layer particles gain higher energy in the electric field, resulting in significant improvements in the organization, structure, and adhesion of the film layer compared to vacuum evaporation coating. With the development of high technology, various new technologies for ion plating and magnetron sputtering coating have gradually matured and are continuously promoted and applied in various fields.
(1) Vacuum Evaporation Coating
Vacuum evaporation coating (evaporation) is vaporizing and evaporating the coating material through high-temperature heating under vacuum conditions and depositing it on the substrate surface to form a solid thin film. Evaporation technology is one of the earlier developed technologies in vacuum coating technology. Compared to sputtering and ion plating, the evaporation method is relatively simple, but under appropriate process conditions, it can produce very pure, thin film coatings with specific structures and properties. Therefore, evaporation technology still plays an important role in optics, semiconductor devices, and plastic metallization fields.
The vacuum evaporation coating has the following technical characteristics:
- The vacuum evaporation coating process includes the evaporation of the coating material, the transport of vapor atoms, and the nucleation and growth of vapor atoms on the substrate surface, which consists of evaporation, transport, and deposition.
- The deposition vacuum of vacuum evaporation coating is high, generally at 10-3~10-5Pa. The film layer particles hardly collide with gas molecules or other metal vapor atoms, reaching the workpiece directly.
- The energy of the film layer particles reaching the workpiece is the thermal energy carried during evaporation. Since the workpiece is not biased in vacuum evaporation coating, the metal atoms rely solely on the vaporization heat during evaporation, which is approximately 0.1~0.2eV. Therefore, the energy of the film layer particles is low, the bonding strength between the film layer and the substrate is small, and it isn’t easy to form compound coatings.
- The vacuum evaporation coating layer is formed under a high vacuum, and the layer particles in the vapor are atoms state, forming small cores on the surface of the workpiece, growing into a dense structure.
- The vacuum evaporation coating layer is obtained under high vacuum conditions. Generally, the coating can only be deposited on the side of the workpiece facing the evaporation source. In contrast, the side and back of the workpiece hardly receive any coating, resulting in poor coating quality.
(2) Magnetron Sputtering Coating
Under certain vacuum conditions, bombarding the surface of a material with charged particles of tens of electron volts or higher kinetic energy allows the atoms of the bombarded material to gain enough energy to escape the binding of the original material lattice and enter the gas phase. This technology is called sputtering technology. The sputtered gas phase elements are used for deposition to form a film, and this deposition process is referred to as sputter coating, as shown in Figure 11-9. When depositing hard coatings, the workpiece needs to be connected to a negative bias power supply called magnetron sputtering ion plating or bias sputtering.
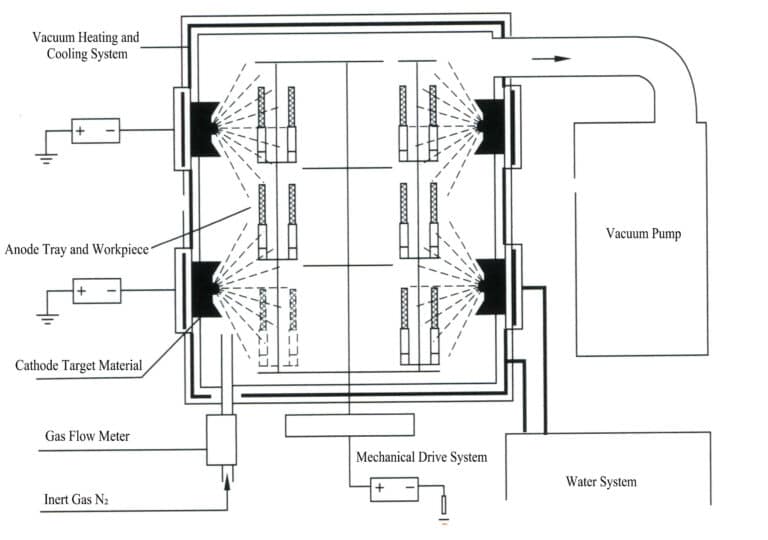
Sputter coating is currently the most widely used coating technology in PVD technology, with the following advantages:
- The quality of the sputtered coating is good, and the adhesion to the substrate is very strong.
- The application range of sputter coating is wide and suitable for various materials, and high melting point materials can also be easily sputtered.
- The thickness distribution of the sputter-coated film is relatively uniform.
- The sputtering coating process has good repeatability, is easy to achieve process control automation, and can be produced continuously on a large scale.
(3) Ion Plating
Ion plating is a process that takes place under vacuum conditions, using gas discharge to partially ionize gas or evaporated materials. While the gas ions or ions of the evaporated materials bombard the surface, the evaporated material or its reaction products are deposited onto the substrate.
In the following aspects, Ion plating combines the fast deposition rate of evaporation plating with the surface cleaning characteristics of ion bombardment in sputtering plating.
- The film layer has good adhesion to the substrate and dense film structure.
- It can improve the film’s ability to cover complex shaped surfaces, also known as the diffraction capability during the film deposition process.
- The controllable parameters of the film layer organization are numerous, the overall energy of the film layer particles is high, and it is easy to perform reactive deposition, allowing for the acquisition of compound coatings at lower temperatures.
2. The Application of PVD Coating Technology in the Jewelry Industry
2.1 Zirconium Nitride Decorative Coating
(1) Pre-Treatment for Coating
The vacuum coating process requires a high level of cleanliness for the sample surface and the vacuum furnace chamber, which is necessary for obtaining high-quality film layers. Therefore, the samples must be cleaned, and the vacuum furnace must be cleaned before coating.
Cleaning the sample surface is key to film formation. The sample surface must be clean and free of rust spots and oil stains, so the sample should be strictly cleaned before entering the furnace to remove oil, dirt, rust, and moisture. The cleaned sample should not be touched by hand to prevent secondary contamination.
The pre-treatment process flow for workpiece coating is as follows:
- Ultrasonic cleaning (1% metal cleaning agent), temperature: 50℃, time: 3 minutes.
- Ultrasonic cleaning (5% metal cleaning agent), temperature: 50℃, time: 2 minutes.
- Hot water cleaning, temperature: 50℃, time: 30 seconds.
- Rinse with cold water at room temperature for 30 seconds.
- Rinse with deionized water at room temperature for 20 seconds.
- Alcohol dehydration.
- Drying or air drying.
- Cleaning of the vacuum furnace. Wipe the dirt, attachments, and deposits inside the vacuum furnace with a dry cloth, and use a scraper to remove attachments from the corners.
(2) Coating Process Flow
① Pre-evacuation. After the sample is placed in the vacuum chamber, close the furnace door, turn on the mechanical pump for rough pumping, and when the vacuum reaches 0.1 Pa, turn on the oil diffusion pump for fine pumping. The vacuum process ends when the vacuum in the chamber reaches 6.5×10-3Па.
② Glow discharge cleaning. The function of glow discharge cleaning involves many electrons moving toward the anode during the cleaning process. The high-speed movement of electrons ionizes the argon gas in the vacuum chamber, creating a glow phenomenon and generating softer argon ion movement. The moving argon ions, under the influence of the biased electric field, bombard the surface of the workpiece, colliding and removing the adsorbed gases and impurity atoms from the surface, exposing a clean surface of the workpiece material. At the same time, it increases the micro-roughness of the workpiece surface, which is beneficial for enhancing the bonding strength between the film layer and the workpiece. After introducing a certain argon gas flow to raise the pressure to 4×100Pa in the furnace, the bias power supply applied to the workpiece is turned on (the voltage and pulse duty cycle are adjustable). Here, the bias value is positive, and argon ions are used to clean the furnace wall, target surface, workpiece, and turntable. The cleaning time is determined based on the material and cleanliness of the workpiece.
③ Main bombardment. The role of the main bombardment is to apply a negative bias to the workpiece, which accelerates a large number of target material ions that are sputtered out. Positively charged target material ions move towards the workpiece under the influence of the negative bias, forming high-speed ion clusters with considerable energy. These ion clusters perform a certain degree of cleaning, activation, and implantation on the workpiece. The effect of the main bombardment: a large number of metal ions are implanted into the surface of the workpiece, and the implanted ions cause lattice restructuring with the substrate. Some metal ions with slightly lower energy levels produce a diffusion layer due to smaller implantation forces. Ions moving toward the workpiece may collide with it, and some will sputter and eject due to lower energy levels or differing incident angles. These ions will then collide with the next moving ions, forming secondary energy-level ions that ultimately deposit on the surface of the workpiece.
After cleaning, the vacuum chamber continues to evacuate to achieve 6.5×10-3Pa. Then, a certain flow rate of argon gas is introduced to achieve a total pressure of 0.3 Pa in the furnace; the values of pulse bias and duty cycle are adjusted (specific values depend on the requirements of the film layer); the power (voltage, current) of the cathode target’s intermediate frequency power supply is set to a certain value; the sample is subjected to main bombardment, with the bombardment time determined by process requirements.
④ Adding nitrogen gas for deposition coloring. At the end of the main bombardment process, an appropriate flow of reaction gas N2 will be introduced (at this time, the vacuum degree will slightly decrease). Manually adjust the nitrogen flow meter’s potentiometer to control the nitrogen flow based on the partial pressure of nitrogen (percentage) displayed by the mass spectrometer. At this time, the pulse bias, duty cycle, and the power (voltage, current) values of the cathode target’s intermediate frequency power supply can be adjusted according to process requirements; the sample is subjected to deposition coloring, and the deposition time is determined based on process requirements. In this way, metal ions will move towards the workpiece under appropriate bias, and during the movement, they will collide with the reaction gas to form a metallic compound film. At the same time, the movement speed will also decrease and deposit on the surface of the workpiece.
⑤ Passivation. The role of passivation is that the freshly coated film layer is a relatively active structure with a certain temperature. If it comes into contact with the atmosphere immediately, it will react again, causing a color change. Therefore, after the coating is completed, it should be cooled down, and a suitable amount of argon gas should be introduced, which protects the surface film layer of the workpiece with inert gas, allowing the film layer to be more stable with the temperature decreasing; on the other hand, it allows the target surface to absorb a large amount of argon gas and become saturated, thereby maintaining a fresh target surface and preventing the target surface from absorbing other gases after being filled with atmosphere, thus protecting the sputtering target surface from contamination. The maximum argon gas flow during the filling process is about 2 minutes.
⑥ Inflatable cooling. When the temperature of the vacuum chamber drops to 120℃, it introduces air to atmospheric pressure.
⑦ Opening the furnace and take out the sample. Open the furnace door, put on clean gloves to remove the sample, and seal the sample for color measurement, film thickness measurement, and Auger semi-quantitative analysis.
(3) Color Control of Zirconium Nitride Film
As a decorative ZrN gold-like film, the color of the film layer is particularly crucial. Due to the numerous process parameters of the medium-frequency reactive magnetron sputtering technology, many factors affect the film’s color. Under certain other process parameters, the nitrogen partial pressure and sputtering power are vital in the film’s color. As the nitrogen partial pressure increases, the color of the ZrN film changes from silver-white→light yellow→gold yellow→reddish gold→deep red. As the sputtering power increases, the color of the ZrN film changes from deep yellow→gold yellow →light yellow. By comparing the colors of ZrN films with those of gold and gold alloys, the desired gold yellow can be obtained by adjusting the nitrogen partial pressure during deposition.
2.2 Titanium Nitride Decorative Coating
(1) Magnetron Sputtering Technology for the Deposition of Titanium Nitride Process
① Install the workpiece. After installing the workpiece on the workpiece fixture, close the coating chamber.
② Vacuum extraction. Start the vacuum pump, and when the vacuum degree reaches 6 Pa, open the diffusion high spring and extract the vacuum to achieve 6×10-3Па.
③ Baking heating. Turn on the baking heating power supply to heat the workpiece to the predetermined temperature.
④ Bombardment purification. Introduce working gas into the coating chamber, maintain a vacuum degree of 1~3Pa, bombardment voltage of 1000~3000 V, the workpiece generates glow discharge, argon ions bombard and purify the workpiece, bombardment for 10~20 minutes.
⑤ Titanium nitride deposition. First, deposit the base layer, reduce the workpiece bias to about 500 V, introduce argon gas, and adjust the vacuum to 0.3~0.5Pa. Turn on the magnetron sputtering target power supply. A glow discharge occurs on the target surface, and a high-density flow of argon ions ejects titanium atoms from the target surface. Next, deposit the titanium nitride coating, requiring the introduction of nitrogen gas, with the vacuum maintained within the range of 0.5~0.7Pa. Due to the balanced metal ionization rate of the magnetron sputtering being only 5%~10%, the reactivity of the metal is relatively low, resulting in a narrow process range (nitrogen content) for obtaining nitrogenized needle-like compounds coating. Compared to glow discharge, to achieve high-quality titanium nitride coatings, it is essential to strictly control the amount of titanium sputtering and the argon-nitrogen ratio. Otherwise, the deposition rate will be very low, and the color will be difficult to control.
⑥ Remove the workpiece. When the film thickness reaches the specified requirements, inflate the coating chamber, open the coating chamber, and remove the workpiece.
(2) The Effect of Process Parameters on the Properties of Titanium Nitride Films
① The effect of deposition temperature on the properties of nitride thin films. The deposition temperature affects the hardness and structure of TiN coatings; the hardness and adhesion of the TiN film deposited near 500℃ are the highest. Excessive and high temperatures are detrimental to the surface hardness of the TiN film. If the deposition temperature is too low, it reflects a short pre-sputtering time or low sputtering energy, affecting the film’s density, leading to insufficient nucleation of the TiN film and coarsening of the structure, resulting in a decrease in hardness. Conversely, if the deposition temperature is too high, it can cause overheating on the sample surface. Suppose the deposition temperature exceeds the tempering temperature of the substrate material. In that case, it will reduce substrate hardness, preventing a good bond with the film and causing a decrease in film hardness. Therefore, increasing the deposition temperature is beneficial for improving the hardness of the TiN film, provided that the sample surface does not overheat.
② The effect of deposition voltage on the properties of titanium nitride films. As the deposition voltage increases, the fracture morphology of the prepared TiN films becomes finer, and the microhardness and the deposition rate of the films increases. Increasing the discharge voltage under the same deposition conditions also means enhancing the plasma intensity, which promotes the chemical reactions in a direction favorable for product formation. Therefore, increasing the deposition voltage can increase the deposition rate of TiN films.
③ The effect of the workpiece on the performance of titanium nitride films. The quality of the film’s performance on the workpiece is not only related to the properties of the film itself but also to the properties of the workpiece material, especially the hardness of the workpiece material. Hard films exhibit their superior wear resistance only on relatively hard substrate materials. If the hardness of the substrate material varies, the bonding strength between the TiN film and the substrate will also differ. The greater the substrate hardness, the better the bonding between the TiN film and the substrate. In practical applications, efforts should be made to maintain a high hardness of the substrate material under certain deposition temperature conditions to improve the quality of the film. The smaller the surface roughness of the substrate, the higher the bonding strength between the titanium nitride film and the substrate, with polishing being the best for substrate surface roughness.
Section VI Enamel Craftsmanship
Enamel is a beautiful and colorful craft art made by attaching various colored glazes to a metal base (using materials such as gold, silver, copper, titanium, etc.) and firing it at high temperatures. Enamel colors are vibrant, have a gem-like luster and texture, resist corrosion, wear, and high temperatures, are waterproof and moisture-proof, are hard and solid, and do not age or deteriorate. Enamel has a long history of application in craft jewelry; in ancient centuries, it was used in the design of various decorative items for jewelry boxes, and by the 15th century, watchmakers incorporated it into watchmaking, adding bright colors to watches. The meticulous firing methods of enamel are intriguing, and its rich color expressiveness has pushed it to the forefront of fashion trends. Enamel jewelry wins with color and often attracts the attention of jewelry designers, especially when enamel is used for surface decoration on metal jewelry, greatly enhancing the artistic expressiveness of the pieces.
Enamel is commonly known as “Shaoqing” in southern China, “Shaolan” in northern China, and “shippō-yaki” in Japan.
The processing methods of jewelry enamel are divided into three types: painted enamel, champlevé enamel, and cloisonné enamel.
(1) Painted Enamel
The enamel painting craft originated in Western Europe and France and was brought to Guangdong by European merchants and missionaries during the Kangxi period of the Qing Dynasty. The art of painted enamel was first manufactured in Guangdong, where it is commonly referred to as “Shaoqing,” “Guang enamel,” or “Foreign enamel.” The emperor and ministers quickly appreciated and valued this exceptionally exquisite craft upon its arrival in China. During the Qing Dynasty, Emperors Kangxi, Yongzheng, and Qianlong established enamel workshops in both the Beijing Imperial Palace and Guangdong, and they frequently selected outstanding enamel painters from Guangdong to serve in the capital, producing large quantities of enamelware and enamel jewelry for royal use.
Painted enamel is the most difficult of the three main types of enamel techniques. The biggest advantage of painting directly on metal is that the patterns and lines can be richer, allowing for more detailed and complex designs that are unrestrained. However, omitting the step of using metal wire to outline will greatly increase the difficulty of firing the enamel. First, there is the issue of color mixing between different colors; without metal wire to separate the different colors, if the enamel materials are not mixed properly, it can lead to a chaotic situation of color bleeding.
Making painted enamel involves applying several layers of white glaze, or porcelain white, onto a metal base. Porcelain white is a white solid that must be ground into powder and mixed with appropriate water. A small brush can be applied evenly on the metal base. The firing temperature for porcelain is generally between 720~820℃. After sintering, a white base plate is obtained, and various colors of enamel are painted on this base plate, intricately depicting patterns like in oil painting. The biggest issue is color mixing; if the colors are mixed too much, the patterns will become blurred after sintering, ruining the artwork. Therefore, after depicting a section, it must be sintered first. The next section can be painted, followed by another sintering, which must be repeated until the work is completed. Sometimes, it requires dozens of repetitions of sintering, and if it gets damaged at any point, the entire piece will be ruined, making the craft of painted enamel highly valuable.

(2) Cloisonné Enamel
The cloisonné enamel technique is relatively complex, yet it is the most familiar and proudest enamel craft for the Chinese, with the famous “Jingtai Blue” being a type of cloisonné enamel. Its characteristic is that metal wires are first used on a metal base to outline the pattern, fixed with a natural adhesive, and then welded onto the metal base. Different colors of enamel glaze are then filled into the outlined contours made from finely ground minerals and metal oxides. The metal pieces are placed in a special furnace at a temperature of 800℃ for firing, causing the glaze to change color due to the high temperature. Since different metal oxides require different temperatures to change color, the enamel pieces may undergo multiple firings. Finally, the metal wires are smoothed, and a colorless transparent protective agent is applied for protection.

(3) Champlevé Enamel
The technique is similar to cloisonné enamel. The surface patterns of metal ornaments are formed using techniques such as engraving, stamping, or etching. First, patterns are carved on the metal base, leaving grooves within the carved outlines. To create vivid patterns with lines of varying thickness, the enamel painter grinds the enamel paint into a powder, mixes it with a small amount of water, and then fills the grooves with enamel, brushing a thin layer of painted patterns. Once completed, it is left to air dry and then placed in a high-temperature kiln above for firing, with each layer of paint needing to be fired for 40~60 seconds in the high-temperature kiln of 800℃. After multiple repetitions of filling with enamel and firing and polishing, a smooth and lustrous work is ultimately formed.

Section VII Resin Casting Process
The resin casting process is widely used in popular jewelry. According to the nature of the resin, it is divided into two main categories: soft resin and hard resin. Soft resin has a lower hardness and is not suitable for grinding and polishing but can be used for surface coating of craft jewelry; hard resin has a high hardness and can be processed by grinding and polishing to achieve a smooth and shiny effect.
Generally, epoxy resin crystal drop glue is used, which is composed of high-purity epoxy resin, curing agents, and other substances. Its cured product has the characteristics of being water-resistant, chemically resistant, and crystal clear. In addition to providing good protection for the surface of craft ornaments, this crystal drop glue can also enhance the surface gloss and brightness. Adding various pigments to the glue can form a rich color series, further enhancing the surface decorative effect, making it suitable for surface decoration and protection of crafts made from materials such as metal, ceramics, glass, and acrylic.
Epoxy resin has a surface effect similar to enamel and is often used as a faux enamel product, sometimes referred to as “soft enamel.” However, there are significant differences between the two. Enamel is made from enamel pigments fired at high temperatures; it is very hard and stable, has good durability, and does not age or deteriorate, but is prone to metal oxidation and softening, making it unsuitable to use for ornaments inlaid with gemstones; resin belongs to the category of organic compounds made from plastic. Products of this type of plastic resin do not need to be sintered in a high-temperature furnace to achieve color. It is sufficient to apply liquid color resin on the metal and let it air dry naturally or dry it in a baking box, making the production simple and not harmful to the metal, suitable for the final treatment of inlaid gemstone jewelry. However, due to the material properties of the resin, it is not durable, not heat-resistant, and is prone to corrosion and wear. After a certain period, it is likely to show aging, fading, and loss of luster. It is of lower grade and does not retain value. The basic process of resin is as follows.
- First, prepare the necessary tools and equipment, such as weighing instruments, glue adjusting tools, workpiece carriers, drying equipment, and the workpieces for the dripping glue operation.
- Place or adjust the balance scale (electronic scale), oven, workpiece carrier, and workbench level.
- Weigh A glue using a dry and clean wide-mouth flat container while proportionally weighing B glue (generally at a weight ratio of 3:1)
- Use a round glass rod (or round wooden stick) to stir the AB mixture to the left, right, or in a clockwise or counterclockwise direction. At the same time, the container (vessel) is preferably tilted at an angle of 45° and continuously rotated, stirring for about 1~2 minutes.
- Pour the mixed AB glue into a soft plastic bottle with a pointed nozzle for dripping, and drop the glue onto the desired accessory position.
- When the area of the resin drop is slightly larger, or the amount of resin is relatively more, to accelerate the elimination of bubbles in the glue, a gas torch fueled by liquefied gas can be used to promote defoaming. During defoaming, the torch’s flame should be adjusted to a complete combustion state, and the flame should ideally be kept about 25 cm away from the surface of the workpiece. The movement speed of the torch should not be too fast or too slow; a moderate speed should be maintained.
- After the bubbles are eliminated, the workpiece can be placed horizontally in the oven for heating and curing. The temperature should first be adjusted to 40℃ around 30 minutes and then raised to 60~70℃ until the glue is fully cured.

Section VIII Etching Technology
Etching is the process of removing unwanted metal to a certain depth using chemical methods. Its principle is similar to the production of circuit boards, where the metal parts to be retained are covered with an acid-resistant coating, and then an acidic solution is used to etch away the unwanted metal parts; the processing of negative patterns is exactly the opposite of that of positive patterns.
The etching process is suitable for the processing and producing antique-style crafts and jewelry with special surface style requirements. In recent years, the export volume of metal paintings, crafts, and hollow art pieces processed by etching methods in our country has greatly increased, becoming a new branch of craft jewelry.
Etching processes can be divided into chemical etching, electrolytic etching, laser etching, and ultrasonic etching.
1. Chemical Etching Process
Cover the areas that need not be etched with a corrosion-resistant coating, then immerse the workpiece in a special etching solution. The formula for the solution is shown in the table 11-2. Ensure that the areas to be etched are in full contact with the solution, and if necessary, heating and stirring can be applied. Control the etching time based on the required etching depth and the etching rate obtained from experiments to achieve the desired etching result.
Table 11-2 Partial Metal Etching Solution Formulas
| Ingredients and process conditions | Etching stainless steel | Etching copper alloy | Etching aluminum |
|---|---|---|---|
| Ferric chloride | 600 ~ 800 | 600 ~ 650 | 450 ~ 550 |
| Hydrochloric acid/(g・L -1) | 80 ~ 120 | ||
| Phosphoric acid/(g・L -1) | 20 ~ 30 | ||
| Copper sulfate/(g・L -1) | 200 ~ 300 | ||
| Sulfuric acid/(g・L -1) | 90 ~ 100 | 10 ~ 20 | |
| Nitric acid/(g・L -1) | 8 ~ 12 | ||
| Etching accelerator/(g・L -1) | 80 ~ 100 | ||
| Температура/℃ | 10 ~ 45 | 15 ~ 50 | 20 ~ 40 |
| Время/мин | 15 ~ 20 | 10 ~ 15 | 10 ~ 20 |
2. Electrolytic Etching
Section IX Nano ~ Spraying Plating Technology

1. The Principle of Nano ~ Spraying and Plating
2. Characteristics of Nano ~ Spraying Plating
(1) Green and environmentally friendly. No three waste emissions, non ~ toxic and harmless, no harmful heavy metals.
(2) Low investment and low cost. Compared to electroplating, the equipment investment is small, and there is no need to equip a wastewater treatment system.
(3) The operation is both safe and simple, with high efficiency. There will be no harm if the operator accidentally sprays it on their hands or other body parts. There is no need for water electroplating treatment and complex preliminary conductive layer treatment.
(4) It can be positioned for spray plating and can spray plate in different colors on the same product. Various colors at will.
(5) The processed parts are not limited by size and shape, are not restricted by various materials, can be recycled, and save resources.
(6) The application range of color diversity is extensive. The sprayed products can be coated with gold, silver, chrome, nickel, or sand ~ colored mirror effects. They can also be coated with various other colors, such as golden yellow, brass color, antique gold yellow, cannon copper color (red, yellow, purple, green, blue), and other high ~ gloss effects. It can be sprayed on various materials such as metal, resin, plastic, glass, ceramics, acrylic, and wood, and can be widely used in various surface decoration industries such as crafts and jewelry.
(7) Products made with nano ~ spraying have excellent adhesion, impact resistance, corrosion resistance, weather resistance, wear resistance, scratch resistance, and good rust prevention capabilities.