Mengapa Batu Permata memiliki banyak Warna?
Pengenalan Teori Medan Kristal & Teori Orbital Molekul & Teori Pita Energi
Warna-warna batu permata sangat kaya dan bervariasi, memiliki pesona unik yang selalu disukai orang. Kualitas batu permata sangat bergantung pada warnanya. Warna batu permata merupakan indikator penting dalam evaluasi batu permata, dan sebagian besar perawatan optimalisasi untuk batu permata melibatkan perubahan atau peningkatan warnanya. Oleh karena itu, memahami penyebab warna batu permata merupakan prasyarat penting untuk perawatan optimalisasi batu permata. Hanya dengan menguasai bagaimana batu permata memperoleh warnanya, seseorang dapat menentukan apakah batu permata dapat dioptimalkan, skema optimasi mana yang akan diadopsi, dan rencana eksperimental mana yang akan dibuat. Ada lima teori umum tentang pewarnaan batu permata: teori mineralogi klasik, teori medan kristal, teori orbital molekuler, teori pita energi, dan efek optik fisik. Teori-teori ini merupakan teori warna batu permata alami yang umum, dan berikut ini adalah pengantar singkat untuk kelima teori warna ini.
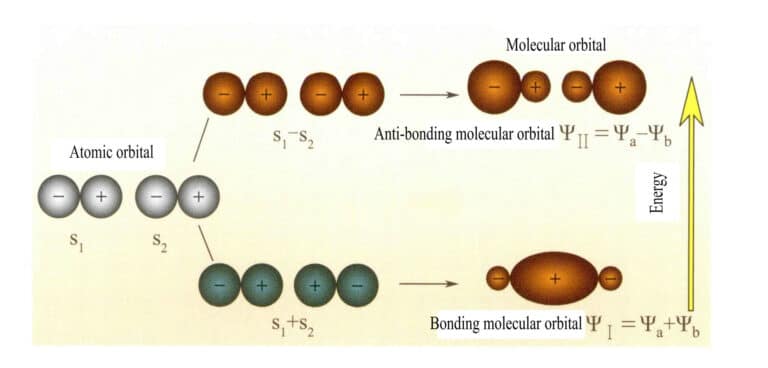
Orbital molekul yang dibentuk oleh dua orbital atom s
Daftar Isi
Bagian I Teori Medan Kristal
Para ilmuwan pada tahun 1930-an mengusulkan teori medan kristal untuk menjelaskan sifat-sifat kristal. Teori medan kristal adalah teori yang mempelajari ikatan kimia elemen transisi (kompleks). Teori ini menjelaskan sifat fisik dan kimia elemen transisi dan elemen lantanida dengan menggabungkan beberapa sudut pandang teori elektrostatik, mekanika kuantum, dan teori grup (teori yang mempelajari simetri materi), dengan fokus pada pengaruh ligan pada orbital d dan f ion pusat. Pada tahun 1950-an, orang menerapkan teori medan kristal pada kompleks dan mengusulkan teori medan ligan. Teori medan ligan merupakan kemajuan dari teori medan kristal; teori ini mempertimbangkan pengaruh medan listrik ligan pada ion pusat dan efek pengisian elektron ligan pada ion pusat, sehingga lebih lengkap daripada teori medan kristal. Namun, tidak ada perbedaan mendasar antara keduanya, dan umumnya tidak dibedakan dalam studi mineral anorganik.
1. Konsep Dasar Teori Medan Kristal
Ion-ion logam transisi berada dalam medan kristal anion atau molekul dipol di sekitarnya. Teori medan kristal adalah model elektrostatik yang memandang kristal sebagai interaksi elektrostatik antara ion positif dan negatif, di mana kation bermuatan positif disebut ion pusat, dan anion bermuatan negatif disebut ligan.
Menerapkan teori medan kristal untuk menjelaskan warna mineral batu permata terutama melibatkan elektron d atau energi elektron f dari ion elemen transisi. Sebagai contoh, orbital d memiliki lima jenis: dxy, dxz, dyz, d, d, dan d. Kelima orbital d ini memiliki distribusi spasial yang berbeda dalam keadaan ion bebas tetapi memiliki energi yang sama. Namun, mereka mengalami perubahan yang signifikan di bawah pengaruh medan ligan. Kelima orbital d yang mengalami penurunan energi dari atom pusat terpecah di bawah pengaruh medan listrik negatif yang dibentuk oleh ligan di sekitarnya. Beberapa orbital d mengalami peningkatan energi, sementara yang lain mengalami penurunan energi. Karena pemisahan tingkat energi orbital d, elektron-elektron dalam orbital d atom pusat akan mengatur ulang, lebih memilih menempati orbital energi yang lebih rendah, sehingga mengurangi energi total sistem dan membuat kompleks menjadi lebih stabil.
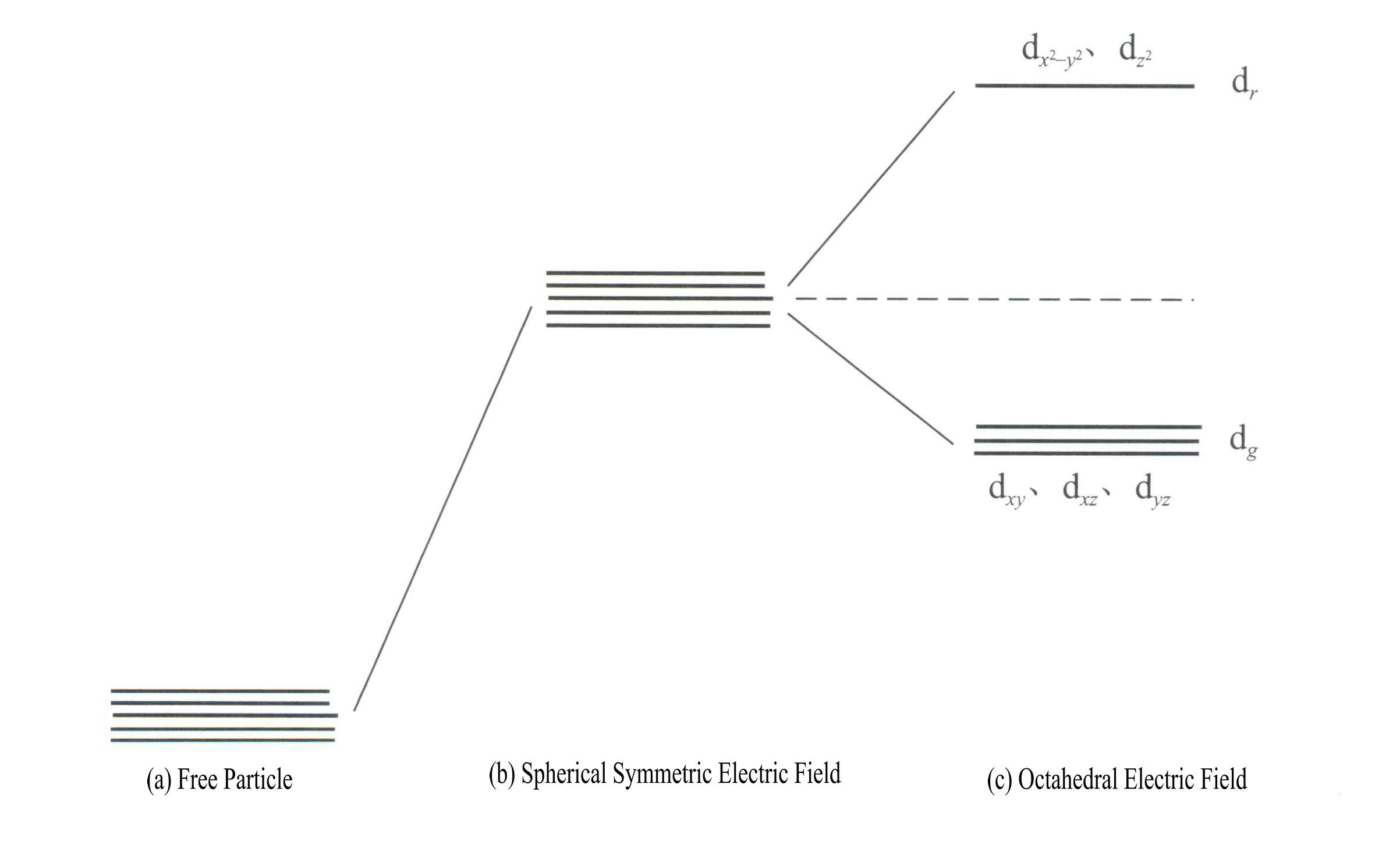
Energi orbital d adalah sama ketika tidak ada medan listrik [Gambar 3-19 (a)]; di bawah medan elektrostatik simetris bola, orbital d memiliki energi yang meningkat tetapi tidak akan terpecah [Gambar 3-19 (b)]; ketika medan ligan berbentuk oktahedral, maka akan terpecah menjadi dr dan dg. Dari jumlah tersebut, dr orbital terdiri dari d dan d , dengan energi yang lebih tinggi; d yang berenergi lebih rendahg orbital terdiri dari dxy, dxz, dyz.
Ion-ion logam transisi berada dalam medan kristal anion atau molekul dipol di sekitarnya. Teori medan kristal adalah model elektrostatik yang memandang kristal sebagai interaksi elektrostatik antara ion positif dan negatif, di mana kation bermuatan positif disebut ion pusat, dan anion bermuatan negatif disebut ligan.
Menerapkan teori medan kristal untuk menjelaskan warna mineral batu permata terutama melibatkan elektron d atau energi elektron f dari ion elemen transisi. Sebagai contoh, orbital d memiliki lima jenis: dxy, dxz, dyz, d, d, dan d. Kelima orbital d ini memiliki distribusi spasial yang berbeda dalam keadaan ion bebas tetapi memiliki energi yang sama. Namun, mereka mengalami perubahan yang signifikan di bawah pengaruh medan ligan. Kelima orbital d yang mengalami penurunan energi dari atom pusat terpecah di bawah pengaruh medan listrik negatif yang dibentuk oleh ligan di sekitarnya. Beberapa orbital d mengalami peningkatan energi, sementara yang lain mengalami penurunan energi. Karena pemisahan tingkat energi orbital d, elektron-elektron dalam orbital d atom pusat akan mengatur ulang, lebih memilih menempati orbital energi yang lebih rendah, sehingga mengurangi energi total sistem dan membuat kompleks menjadi lebih stabil.
Energi orbital d adalah sama ketika tidak ada medan listrik [Gambar 3-19 (a)]; di bawah medan elektrostatik simetris bola, orbital d memiliki energi yang meningkat tetapi tidak akan terpecah [Gambar 3-19 (b)]; ketika medan ligan berbentuk oktahedral, maka akan terpecah menjadi dr dan dg. Dari jumlah tersebut, dr orbital terdiri dari dx2- y2 dan dz2
, dengan energi yang lebih tinggi; energi yang lebih rendah dg orbital terdiri dari dxy, dxz, dyz. [Gambar 3-19 (c)]
Perbedaan antara tingkat energi tertinggi dan terendah setelah pemisahan orbital d disebut energi pemisahan △ . Energi pemisahan yang dihasilkan oleh konfigurasi medan ligan yang berbeda tidaklah sama (Gambar 3-20). Urutan energinya adalah:
Bidang persegi > Bidang oktahedral > Bidang tetrahedral

Bahkan untuk bidang dengan konfigurasi yang sama, mungkin juga berbeda karena perbedaan ligan dan ion pusat; semakin besar, semakin stabil kristalnya. Tiga faktor berikut ini terutama menentukan ukuran energi pemisahan kristal:
(1) Kristal yang dibentuk oleh elemen transisi yang sama; ketika ligan sama, semakin tinggi muatan ion pusat, semakin besar energi pemisahan △. Semakin tinggi muatan positif ion pusat, semakin besar daya tariknya terhadap ligan, menghasilkan jarak yang lebih kecil antara ion pusat dan inti ligan, dan semakin besar gaya tolak medan kristal yang dihasilkan oleh ligan pada elektron, semakin besar pula energi pemisahannya. .
(2) Untuk kristal yang dibentuk oleh ion yang berbeda dengan muatan positif yang sama dan ligan yang sama, semakin besar jari-jari ion pusat, semakin jauh orbital d dari nukleus, dan semakin besar energi pemisahan △ .
(3) Untuk kristal yang dibentuk oleh ion pusat yang sama dan ligan yang berbeda, energi pemisahan bervariasi karena perbedaan kekuatan medan kristal ligan. Ligan yang berbeda memiliki kekuatan medan yang berbeda, dan energi pemisahan △ bervariasi dengan kekuatan medan ligan.
Energi pemisahan digunakan untuk menjelaskan stabilitas kristal secara kualitatif; tidak perlu mendapatkan nilai absolut △, karena mengetahui nilai relatif kristal dalam kondisi yang berbeda sudah cukup.
Berdasarkan energi relatif orbital d yang terbelah, energi total ion logam transisi dalam orbital d dapat dihitung. Energi ini lebih rendah daripada sebelum pemisahan, sehingga memberikan energi tambahan pada kristal, yang dikenal sebagai energi stabilisasi medan kristal, yang diwakili oleh simbol CFSE. Tabel 3-10 mencantumkan energi stabilisasi ion yang mengandung dn elektron dalam kondisi yang berbeda.
Tabel 3-10 Energi Stabilisasi Medan Kristal di bawah Ligan yang Berbeda (Wu Ruihua, 1994)
| dn | Bidang Lemah | Bidang yang kuat | ||||
|---|---|---|---|---|---|---|
| dn | Persegi | Octahedron biasa | Tetrahedron Biasa | Persegi | Octahedron biasa | Tetrahedron Biasa |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Karakteristik Warna Ion Logam Transisi
Pada batu permata berwarna, warna sebagian besar batu permata disebabkan oleh ion logam transisi, dan warna batu permata terkait dengan apakah ion pewarnaan mengandung elektron tak berpasangan dalam orbital d atau f. Karakteristik pewarnaan ion logam transisi terutama mencakup aspek-aspek berikut ini:
(1) Warna ion logam transisi terkait dengan kondisi elektronik orbital d atau orbital f. Apabila elektron orbital d atau orbital f terisi atau kosong, maka batu permata tidak akan menunjukkan warna. Sebagai contoh, Cr6+, Ce4+, dan Cu+.
(2) Ion pewarna yang berbeda menunjukkan warna yang berbeda pada bahan batu permata yang sama. Karena energi pemisahan yang berbeda dari ion pewarna yang berbeda, mereka dapat menampilkan warna yang berbeda bahkan dalam bahan yang sama. Misalnya, Fe2+ menghasilkan warna biru agak keabu-abuan pada spinel, sedangkan Cr3+ menghasilkan warna merah.
(3) Ion warna dari unsur yang sama dalam keadaan valensi yang berbeda, sering kali menunjukkan warna yang berbeda pada bahan batu permata yang sama. Karena energi yang diperlukan untuk transisi elektron-d dari ion pusat berbeda, maka, panjang gelombang cahaya yang diserap pun berbeda, dan menghasilkan warna yang berbeda. Sebagai contoh, kastrum yang mengandung Mn2+ menghadirkan rona merah muda yang lembut, sementara beryl yang mengandung Mn2+ menghadirkan warna merah cerah, yang dikenal sebagai red beryl.
(4) Ion-ion pewarna dari unsur yang sama dalam keadaan valensi yang sama sering kali menunjukkan warna yang berbeda ketika berada dalam konfigurasi ligan yang berbeda. Sebagai contoh, Co2+ dalam konfigurasi tetrahedral spinel menunjukkan warna “biru berlian” yang khas, sedangkan dalam konfigurasi oktahedral kalsit, tampak berwarna merah muda. Fe2+ pada olivin terkoordinasi oktahedral menunjukkan karakteristik hijau zaitun, sedangkan pada almandine terkoordinasi kubik yang terdistorsi, tampak berwarna merah tua.
(5) Jenis ion berwarna yang sama memiliki keadaan valensi dan geometri koordinasi yang sama, tetapi atom-atom koordinasi yang berbeda yang berdekatan menunjukkan warna yang berbeda. Sebagai contoh, dalam koordinasi tetrahedral Co2+, dalam sphalerite, Co2+ terhubung ke belerang, menunjukkan warna hijau, sedangkan pada spinel, Co2+ terhubung ke oksigen, menunjukkan warna biru.
(6) Jenis ion berwarna yang sama dengan kondisi valensi, geometri koordinasi, dan atom yang berdekatan menunjukkan warna yang berbeda pada batu permata yang berbeda. Distorsi geometri koordinasi yang disebabkan oleh komposisi kimia yang berbeda dari batu permata mengubah sifat ikatan kimia antara ion pusat dan ligan koordinasi, mengubah energi transisi elektron d. Sebagai contoh, Cr3+ tampak merah pada ruby, hijau pada zamrud, dan menunjukkan warna yang bervariasi pada alexandrite. Alasan untuk perubahan tersebut dalam Cr3+ terkait dengan karakteristiknya dan ligan koordinator yang berdekatan, dengan analisis fitur spesifik sebagai berikut.
① Cr3+ Karakteristik:
Cr3+ memiliki struktur kulit elektron terluar 3s23p63d3, dengan 11 elektron di kulit terluar, termasuk dalam struktur kulit elektron tak beraturan (8-18).
Struktur ini memiliki efek perisai yang lebih kecil pada nukleus daripada struktur cangkang 8-elektron, sehingga menghasilkan Cr3+ memiliki muatan positif efektif yang lebih tinggi, sementara jari-jari ionnya juga lebih kecil, yang membentuk karakteristik dasar Cr3+medan listrik positif yang kuat dan orbital d yang kosong. Cr3+ dapat menyediakan enam orbital kosong untuk mengakomodasi enam ligan koordinasi, dengan konfigurasi spasial oktahedral, milik d2sp3 hibridisasi (Gambar 3-21).
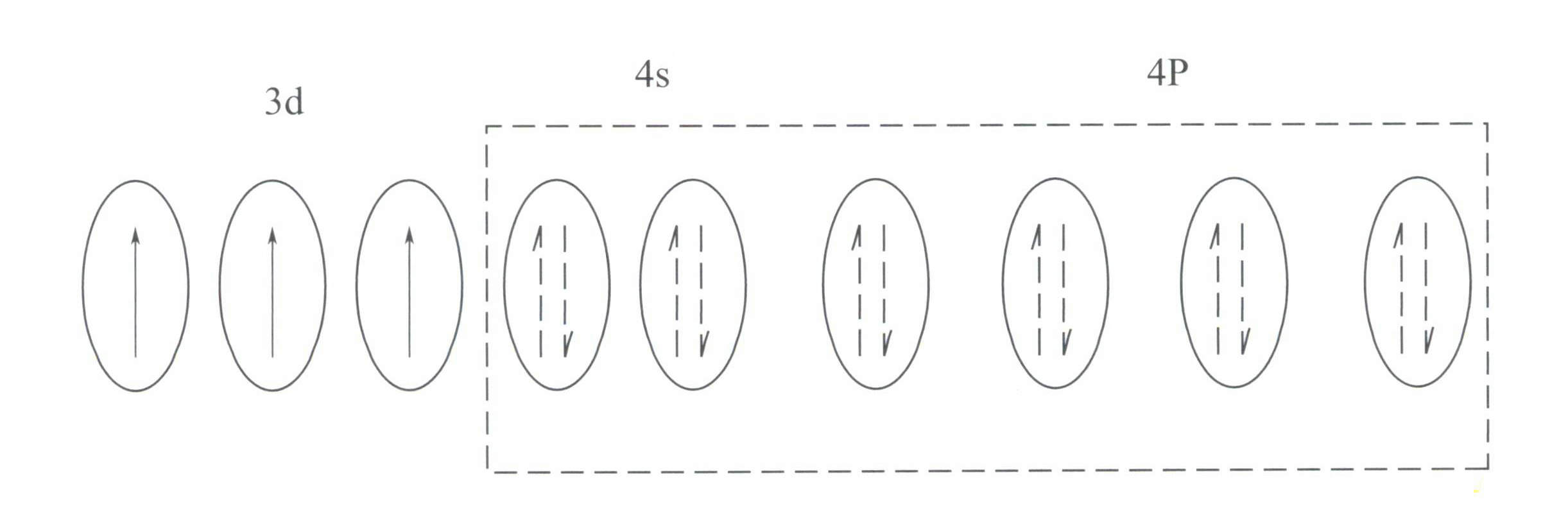
Menurut teori medan kristal, dalam medan oktahedral, orbital d dari Cr3+ dapat terpecah menjadi energi yang lebih rendah dƐ orbit dan energi yang lebih tinggi dr orbit. Karena tiga elektron d dari Cr3+ semuanya ada di dƐ orbital dan semuanya merupakan elektron tunggal, transisi d-d dapat terjadi di bawah cahaya tampak, menyebabkan permata yang mengandung Cr3+ untuk menunjukkan warna.
② Mekanisme pewarnaan Cr3+:
Dalam ruby Komponen kimia utama ruby adalah Al2O3. Ketika beberapa persen dari Cr3+ menggantikan Al3+, menghasilkan warna merah terang. Dalam struktur ruby, karena jari-jari yang lebih besar dari Cr3+ dibandingkan dengan jari-jari Al3+, Cr3+ memasuki kisi korundum, mengurangi simetri di sekitar aluminium oksida.
Orbital d dari Cr3+ terbelah, dan ketika elektron keadaan tereksitasi kembali dari D atau C ke keadaan dasar A, mereka harus terlebih dahulu melewati B, melepaskan panas. Elektron-elektron tersebut kembali dari B ke A, disertai dengan pendaran, memancarkan fluoresensi merah. Dalam proses ini, elektron menyerap energi cahaya, menyebabkan ruby menyerap spektrum tampak D violet (400nm) dan C kuning-hijau (555nm) (Gambar 3-22), membentuk pita serapan.

Ketika cahaya putih melewati batu rubi, foton dalam spektrum dari ungu ke kuning-hijau diserap, sementara hampir semua cahaya merah dan sebagian cahaya biru melewatinya, memberikan warna merah tua dengan sedikit warna ungu, yang dikenal sebagai merah darah merpati.
Rubi menunjukkan penyerapan tingkat B yang singkat, yang dimanifestasikan sebagai fluoresensi merah. Penyerapan tingkat B yang menghasilkan fluoresensi merah ini membuat warna batu rubi menjadi lebih jelas; semakin tinggi kandungan ion kromium, semakin kuat fluoresensinya.
Ion besi dalam batu permata dapat menekan fluoresensi penyerapan tingkat B, yang menjelaskan fenomena batu rubi yang tampak lebih gelap ketika mengandung kotoran besi.
③ Cr3+ Mekanisme pewarnaan pada zamrud
Komponen kimia utama zamrud adalah Be3Al2Si6O18, Cr3+, yang menggantikan Al3+ dalam kisi zamrud, dan Cr3+ juga dikelilingi oleh oktahedron yang terdiri dari enam ion oksigen, di mana ion Cr3+Panjang ikatan -O juga sangat mirip dengan yang ada pada batu rubi. Namun, dibandingkan dengan rubi, zamrud memiliki dua ion lebih banyak, Be2+ dan Si4+. Dalam struktur zamrud, sifat ikatan kovalen antara oksida logam meningkat, sedangkan karakteristik ionik melemah.
Perubahan kecil seperti ikatan kimia menyebabkan sedikit penurunan Cr3+Level C dan energi level D, menghasilkan sedikit pergeseran pita serapan (Gambar 3-23), yang secara signifikan menghalangi transmisi cahaya biru-ungu (425nm) dan jingga-kuning (608nm) dalam spektrum, sekaligus meningkatkan transmisi cahaya biru-hijau, sehingga membentuk karakteristik warna hijau zamrud.

Penyerapan dioptase tingkat B nyaris tidak berubah. Apabila besi pengotor tidak memiliki efek “penghambatan” pada komponen zamrud, fluoresensi merah yang kuat membuat karakteristik hijau zamrud bersinar lebih cerah.
④ Cr3+ Mekanisme warna dalam alexandrite:
Warna alexandrite juga disebabkan oleh Cr3+ menggantikan Al3+ dalam koordinasi oktahedral yang terdistorsi. Karena komposisi kimia dari alexandrite adalah BeAL2O4, sifat ikatan kimia antara ion logam-oksigennya terletak di antara ruby dan zamrud. Oleh karena itu, pita serapannya juga terletak di antara pita serapan ruby dan zamrud, dengan probabilitas transmisi cahaya biru-ungu dan oranye-kuning kurang-lebih sama, sehingga mustahil untuk menentukan apakah cahaya merah atau biru-hijau yang dominan (Gambar 3-24).
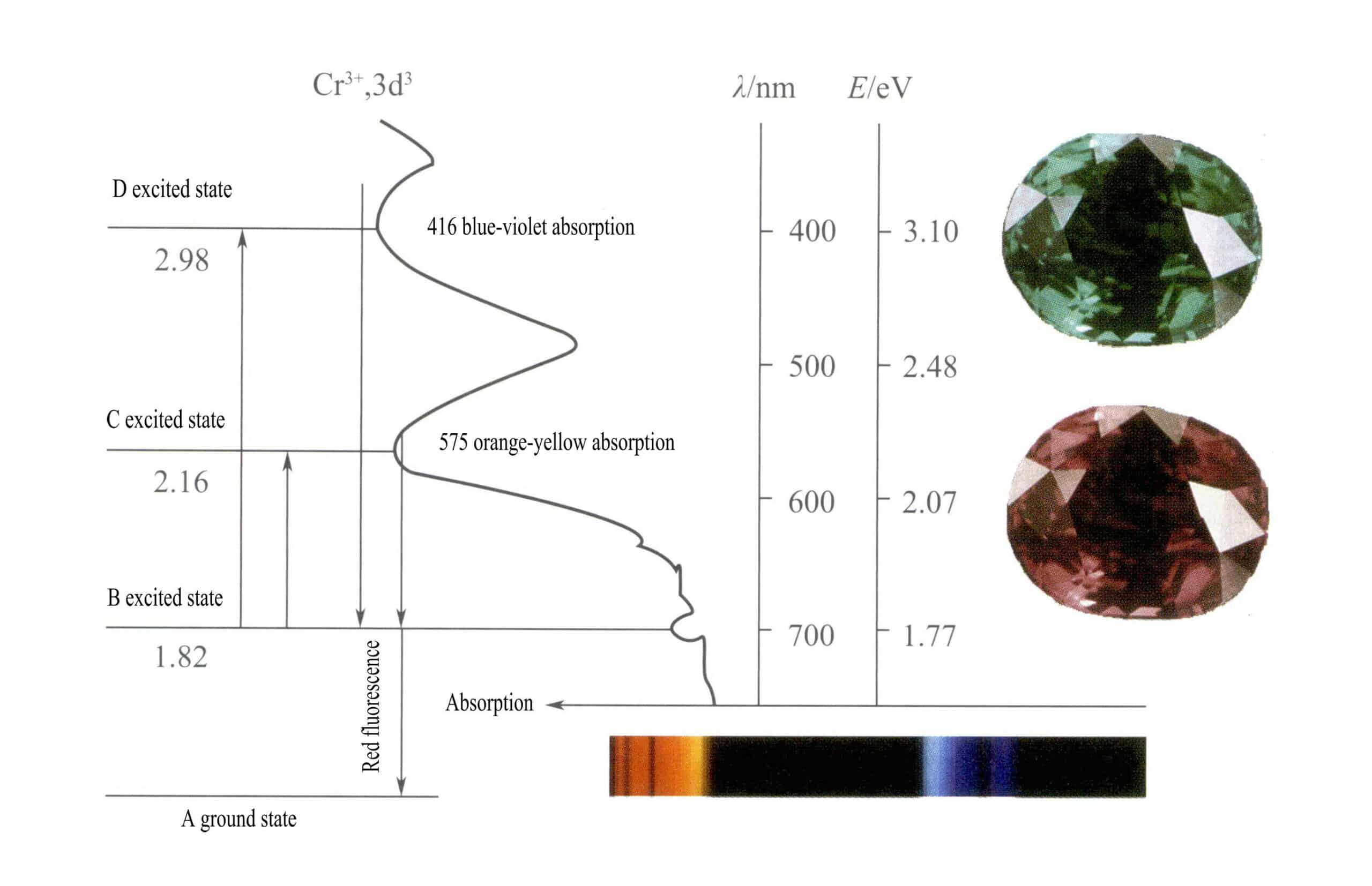
Oleh karena itu, warna alexandrite hanya dapat bergantung pada distribusi energi dan kisaran warna cahaya yang datang, sehingga menghasilkan “efek perubahan warna” alexandrite, yaitu, tampak hijau di siang hari dengan komponen cahaya biru yang tinggi, dan merah pada cahaya pijar dengan komponen cahaya merah yang tinggi. Oleh karena itu, alexandrite sering disebut sebagai “zamrud di siang hari dan ruby di malam hari.”
“Efek perubahan warna” muncul pada banyak jenis batu permata, seperti korundum yang berubah warna dan garnet yang berubah warna. Saat ini, korundum yang berubah warna yang disintesis secara artifisial diproduksi dengan menggunakan prinsip perubahan warna, menggunakan V3+ sebagai ion pewarna untuk sintesis.
3. Warna Mineral Batu Permata
Warna yang dihasilkan oleh komponen logam transisi dapat disimpulkan dari komposisi kimiawi mineral batu permata. Contohnya, pirus yang mengandung Cu2+ harus berwarna biru, sedangkan Cu+ tidak berwarna. Tabel 3-11 mencantumkan warna-warna yang dihasilkan oleh komponen logam transisi yang umum pada mineral batu permata alami.
Tabel 3-11 Warna yang Dihasilkan oleh Komponen Logam Transisi dalam Mineral Batu Permata Alami
| Elemen | Warna | Mineral Umum |
|---|---|---|
| Cerium (Ce) | Kuning | Paris |
| Kromium (Cr) | Merah, Hijau, Oranye, dll. | Crocoisite, Crocoisite Merah, Uvarovite |
| Kobalt (Co) | Biru | Spinel Sintetis |
| Tembaga (Cu) | Biru, Hijau | Azurite, chrysocolla, Turquoise malachite, Dioptase |
| Besi (Fe) | Merah, hijau, kuning | Almandine, olivin, goethite |
| Mangan (Mn) | Merah muda, oranye | Rhodonite, spessartine |
| Nikel (Ni) | Hijau | Bunsenite, Kalsedon |
Warna sebagian besar batu permata disebabkan oleh pengotor logam transisi yang dikandungnya. Sebagai contoh, batu rubi tampak merah karena adanya sejumlah kecil Cr3+. Berbagai faktor memengaruhi warna yang disebabkan oleh ion-ion pengotor dalam batu permata. Oleh karena itu, pengotor dapat menghasilkan warna yang berbeda pada batu permata yang berbeda. Sebagai contoh, Cr3+ tampak merah pada batu rubi dan hijau pada batu zamrud.
Pengotor yang sama belum tentu menyebabkan warna yang sama pada batu permata. Sebagai contoh, warna hijau pada sebagian besar zamrud disebabkan oleh Cr, sementara warna hijau pada beberapa zamrud sebagian atau seluruhnya disebabkan oleh vanadium (V).
Teori medan kristal tidak hanya dapat digunakan untuk menjelaskan warna batu permata yang dihasilkan oleh komponen logam transisi atau pengotor, tetapi juga warna yang dihasilkan oleh cacat struktural (pusat warna); proses spesifik pembentukan warna dapat dirujuk pada Bab 3.3 buku ini.
Ada juga kekurangan dalam penjelasan warna mineral batu permata oleh teori medan kristal, terutama tercermin dalam aspek-aspek berikut ini:
(1) Elektron-elektron ion pusat d tidak sepenuhnya terlokalisasi di orbital aslinya. Elektron-elektron tersebut juga dapat muncul di sekitar atom koordinasi, yang mengindikasikan adanya interaksi kovalen antara atom pusat dan ligan.
(2) Hanya mempertimbangkan interaksi ionik elektrostatik antara atom pusat dan ligan, sama sekali mengabaikan interaksi ikatan kovalen antara atom pusat dan ligan. Dalam penelitian fisik, hasil perhitungan kuantitatif sering kali berbeda secara signifikan dari situasi yang sebenarnya.
(3) Alasan warna mineral batu permata, selain interaksi antara ion pusat dan ligan, mungkin juga disebabkan oleh efek gabungan dari cacat struktural dan bidang kristal.
Bagian II Teori Orbital Molekul
Mulliken dan Hund pada awalnya mengusulkan teori orbital molekuler (teori MO). Melalui eksplorasi yang terus menerus dari banyak ilmuwan, teori ini telah berkembang menjadi teori yang matang. Orbital molekuler (MO) dapat diperoleh dengan kombinasi linier orbital atom, sebuah metode yang umum digunakan untuk membangun orbital molekuler. Dari n orbital atom, n orbital molekul dapat diperoleh, dan koefisien kombinasi linier dapat ditentukan dengan menggunakan metode variasi atau metode lainnya. Orbital molekul yang dibentuk oleh dua orbital atom, dengan tingkat energi lebih rendah dari orbital atom, disebut orbital ikatan; mereka yang memiliki tingkat energi lebih tinggi dari orbital atom disebut orbital antibonding; mereka yang memiliki tingkat energi yang mendekati orbital atom pada umumnya merupakan orbital non ikatan.
Teori orbital molekuler adalah teori yang digunakan untuk menjelaskan isu-isu seperti pembentukan, struktur, dan sifat molekul. Teori ini juga dapat menjelaskan beberapa penyebab warna batu permata, yang telah dikembangkan berdasarkan teori medan kristal dan teori orbital molekuler logam transisi. Orbital molekul adalah perluasan alami dari orbital atom. Dalam sebuah molekul, elektron tidak lagi menjadi milik atom tertentu, tetapi bergerak melintasi seluruh rentang molekul; oleh karena itu, pergerakan elektron dalam molekul digambarkan dengan menggunakan orbital molekul.
1. Konsep Dasar Teori Orbital Molekul
Teori orbital molekuler menyatakan bahwa setelah atom membentuk molekul, elektron tidak lagi berada di orbital atom asli seperti yang diusulkan oleh teori medan kristal, tetapi bergerak dalam orbital molekul tertentu. Orbital molekul menyusun molekul seperti halnya orbital atom menyusun atom. Elektron valensi tidak lagi dianggap terlokalisasi di dalam atom individu tetapi bergerak di seluruh molekul. Distribusi elektron dalam molekul dapat diperlakukan sesuai dengan prinsip-prinsip distribusi elektron dalam atom (prinsip energi minimum dan aturan Hund).
Kombinasi linier orbital atom dalam molekul membentuk orbital molekul. Jumlah orbital molekul sama dengan jumlah orbital atom sebelum kombinasi. Kombinasi orbital atom menjadi orbital molekul yang efektif harus mematuhi tiga prinsip berikut:
(1) Prinsip Pencocokan Simetri: Hanya orbital atom dengan simetri yang sama yang dapat membentuk orbital molekul.
(2) Prinsip Kedekatan Energi: Hanya orbital atom dengan energi yang sama yang dapat bergabung untuk membentuk orbital molekul yang efektif.
(3) Prinsip Tumpang Tindih Maksimum: Di bawah pencocokan simetri, semakin besar tumpang tindih orbital atom, semakin berkurang energi orbital molekul yang dihasilkan dan semakin stabil ikatan kimia yang dihasilkan.
Orbital molekul ψ adalah fungsi gelombang dari satu elektron. Hal ini dapat direpresentasikan sebagai kombinasi linear dari orbital atom, dengan masing-masing orbital yang sesuai dengan energi tertentu, yang merupakan jumlah energi kinetik dan potensial elektron yang bergerak di medan listrik molekuler. Dua orbital atom, a dan b, melalui kombinasi linier yang tumpang tindih, menghasilkan dua orbital molekul ψI dan ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Ketika orbital molekul dengan elektron terisi terlebih dahulu, orbital ikatan ψI diisi terlebih dahulu. Ketika elektron mengisi orbital molekul dengan energi yang sama, menurut aturan Hund, mereka juga harus menempati orbital molekul yang berbeda dengan arah putaran yang sama sebanyak mungkin.
Orbital molekul ψI yang diperoleh dengan menambahkan dua fungsi orbital atom (Persamaan 3-5) disebut orbital molekul ikatan. Orbital molekul ψII yang diperoleh dengan mengurangkan dua fungsi orbital atom (Persamaan 3-6) disebut orbital molekul antibonding. Energi orbital molekul ikatan lebih rendah daripada energi orbital molekul antibonding dan lebih rendah daripada energi dua orbital atom yang asli. Jadi, seperti halnya dalam kasus pengisian orbital atom, ketika mengisi orbital molekul, elektron pertama kali ditempatkan di orbital ikatan, dan orbital molekul dapat menampung dua elektron dengan putaran yang berlawanan. Ketika elektron mengisi orbital molekul dengan energi yang sama, menurut aturan Hund, mereka juga harus menempati orbital molekul yang berbeda dengan arah putaran yang sama sebanyak mungkin. Orbital molekul yang dibentuk oleh dua orbital atom ditunjukkan pada Gambar 3-25.

Orbital p dan orbital d juga dapat membentuk orbital molekul dengan tingkat energi yang berbeda; sebagai contoh, kombinasi orbital molekul diatomik dalam O2 molekul yang relatif kompleks.
Dalam eksperimen, sifat magnetik dari dua elektron tunggal ini diukur, memberikan dukungan yang kuat untuk teori orbital molekul. Tidak seperti molekul yang tersusun dari atom yang sama, molekul yang tersusun dari dua atau lebih atom yang berbeda memiliki tingkat energi orbital molekul yang lebih kompleks, tetapi prinsipnya sama.
2. Karakteristik Warna Transfer Muatan
Teori orbital molekul, di mana seluruh molekul berbagi elektron, juga dianggap sebagai transisi elektron dari satu orbital atom ke orbital atom lainnya, yang dikenal sebagai transfer muatan. Transfer muatan dapat terjadi pada interaksi logam-logam (M-M), non-logam-non-logam (L-L), dan non-logam-logam (L-M). Di antara mereka, L-L, M-L kedua jenis ikatan ini sering kali merupakan ikatan kovalen. O2 termasuk dalam transfer muatan L-L, yang merupakan ikatan kovalen.
(1) Transfer Muatan Logam-Logam (Transfer Muatan M - M)
Jenis transfer muatan ini umumnya terjadi di antara ion logam transisi yang umum. Sebagian besar penyebab warna pada batu permata berwarna dihasilkan oleh transfer muatan logam-logam. Transfer muatan M-M terutama mencakup jenis-jenis berikut ini: Fe2+ - Fe3+/ Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/ Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Transfer muatan antara logam dibagi menjadi dua jenis: transfer muatan antara atom homonuklear dan transfer muatan antara atom heteronuklear.
(1) Transfer muatan antara atom-atom isoelektronik
Transfer muatan antara atom isoelektronik terjadi antara dua atom dari unsur logam transisi yang sama dalam kondisi oksidasi yang berbeda. Sebagai contoh, Fe2+ dan Fe3+ mengalami transfer muatan dalam kondisi redoks yang berbeda, menyerap energi dan menghasilkan warna. Warna biru-ungu dari iolit dihasilkan oleh transfer muatan ion besi dalam kondisi oksidasi yang berbeda. Fe3+ dan Fe2+ masing-masing berada pada posisi tetrahedral dan oktahedral, dengan dua ligan yang dihubungkan oleh tepinya. Ketika cahaya tampak menyinari iolit, satu elektron d dari Fe2+ menyerap cahaya dengan energi tertentu dan bertransisi menjadi Fe3+, menyerap cahaya kuning pada 588nm dan menghasilkan warna biru-ungu. Aquamarine, turmalin hijau, dan lainnya juga dapat menunjukkan warna karena transfer muatan di antara ion-ion besi.
② Transfer muatan antara heteroatom
Safir biru paling sering menjadi contoh warna yang dihasilkan oleh transfer muatan antara dua jenis ion logam transisi. Polihedra koordinasi ion logam transisi dihubungkan oleh tepi atau permukaan, memfasilitasi transfer muatan antar logam.
Sebagai contoh, Pada safir, ketika ion besi dan ion titanium memasuki oktahedra yang terhubung, baik Fe dan Ti ada dalam dua kondisi oksidasi:
Fe2+ + Ti4+ low energy (3-7)
Fe3+ + Ti3+ high energy (3-8)
Transitioning from equation (3-7) to equation (3-8) requires absorbing a certain amount of light energy, resulting in a broad absorption band that ranges from yellow to red. In contrast, most blue light passes through the gemstone, giving it a blue appearance.
Charge transfer between different valence states has a strong directionality, and gemstones that exhibit color due to this mechanism often display pleochroism. For example, aquamarine colored by Fe2+→ Fe3+ charge transfer shows color strictly along the optical axis direction. Figure 3-26 shows that aquamarine appears yellow in the b and c planes. At the same time, there is no such transfer along the a-axis direction, resulting in no light absorption and, therefore, no color along the a-axis direction.
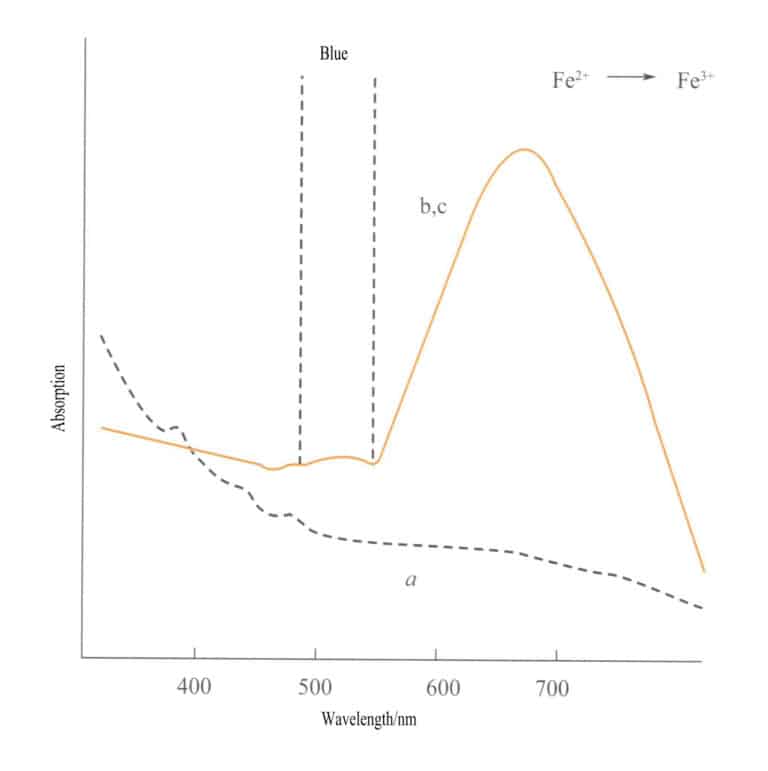
(2) Non-metal to metal (L-M) charge transfer
This type of L-M charge transfer often occurs between oxygen and metal ions, and some oxygen-containing gemstones are colored by non-metal to metal charge transfer, such as O2-→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
In the absorption spectrum of simple iron oxides (Figure 3-27), two weak absorption bands appear in the infrared region of ilmenite, hematite, and lepidocrocite ( d — d electronic transitions). A strong absorption band appears in the shortwave range, produced by O2-→ Fe3+ charge transfer, and this absorption band determines the characteristic colors of these compounds: reddish-brown, brown, and yellow-brown.
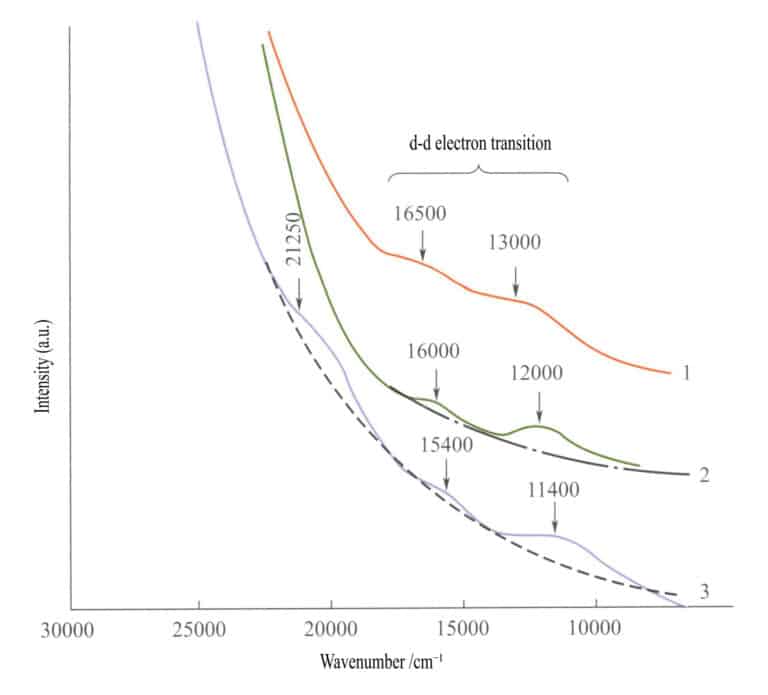
1 -Iilmenite; 2 – Hematite; 3 – Lepidocrocite
Yellow beryl gets its color from O2-→ Fe3+ charge transfer. In the structure of yellow beryl, O2-→ Fe3+ strong charge transfer absorption can extend from the ultraviolet end into the blue end of the visible spectrum, absorbing purple and blue, resulting in a yellow color.
Sapphire, which has a completely different coordination environment from beryl, can also produce the same spectral absorption bands as beryl, resulting in yellow, which is also a result of O2-→ Fe3+ charge transfer.
According to crystal field theory, some gemstone minerals do not contain unpaired electrons and cannot produce color. For example, the electronic layers of crocoite (PbCrO4), Pb2+, Cr6+, and O2- are full. Still, in the CrO42- atomic cluster are “molecular orbitals,” which correspond to the excited states during O2-→Cr6+ transfer, forming absorption bands and presenting orange.
L→M Charge transfer also includes the transfer of sulfur to metal, like in common pyrite; this optical phenomenon caused by the transfer is easier to understand when discussed using band theory.
(3) Non-metal to non-metal (L-L) charge transfer
Molecular orbital theory suggests that the deep blue color of lapis lazuli is due to the excitation energy levels of the S3- atomic group.
In graphite, the rings of six carbon atoms are arranged in layers. Along this layer, electrons can move to some extent freely, resulting in strong light absorption, anisotropy, and conductivity.
Some organic gemstones, such as amber and pearls, have electrons that move and excite through the atomic groups of organic pigments in shared molecular orbitals, causing the absorption of visible light and producing color. For example, the “honey yellow” of amber, the colors of coral, and some shells and colored pearls.
The color mechanisms of common gemstones are shown in Table 3-12.
Table 3-12 Classification of Color Mechanisms of Common Gemstones
| Metal - Metal Charge Transfer | Fe2+ - Fe3+ / Fe3+ - Fe2+ : iolite (blue), berthierite (blue), Magnetite (black), etc. |
| Fe2+ -Ti4+/ Fe3+ - Ti3+ : Kyanite (blue), Sapphire (blue) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Manganite (black), Bixbyite (black) | |
| Non-metal to metal charge transfer | O2- -Fe3+: Golden yellow beryl, golden yellow sapphire, ilmenite, hematite, lepidocrocite , etc. |
| O2- - Cr6+: Crocoite (orange) | |
| O2- -V5+:Vanadinite (orange) | |
| Sulfur to metal: pyrite, marcasite, etc. (see semiconductor with gap) | |
| Non-metal - non-metal charge transfer | S3-: Lapis lazuli (blue) |
| Π electronic: graphite (black) | |
| The colors of some organic gemstones such as amber and coral. |
Copywrite @ Sobling.Jewelry - Produsen perhiasan khusus, pabrik perhiasan OEM dan ODM
Section III Energy Band Theory
Energy band theory is a quantum mechanical model for studying gemstone materials, which is a further extension and expansion of molecular orbital theory. The study of energy band theory can better explain the color mechanism of some naturally colored gemstones.
1. Basic concepts of energy band theory
Energy band theory is an approximate theory used to study the laws of electron motion in solids. Solids are composed of atoms, which include atomic nuclei and outermost electrons, all of which are in a constant state of motion. Band theory posits that electrons in solids are not bound to a specific atom but are shared by the entire crystal and move within the periodic potential field of the three-dimensional space of the crystal. The range of electron motion is within the periodic potential field of the lattice, allowing the spatial distribution of electron orbits to exceed that of molecules, reaching a maximum. The energy levels of individual electrons are broadened into energy bands.
Band theory mainly discusses electron transitions between non-local states, where all valence electrons should belong to the entire solid lattice. According to band theory, solid materials can be divided into different energy bands based on whether the atomic orbitals are filled: a filled band is formed by the energy levels of atomic orbitals that are fully occupied by electrons, representing a low-energy band; an empty band is formed by energy levels that are not fully occupied by electrons, representing a high-energy band. The energy difference between these two types of bands is called the “band gap” (Figure 3-28).
When all energy bands of a material are filled, it is a non-conductor; when partially filled with electrons, it is a conductor. Lattice defects introduce additional energy levels in the crystal, allowing electrons to enter these energy levels, resulting in conditional conductivity.
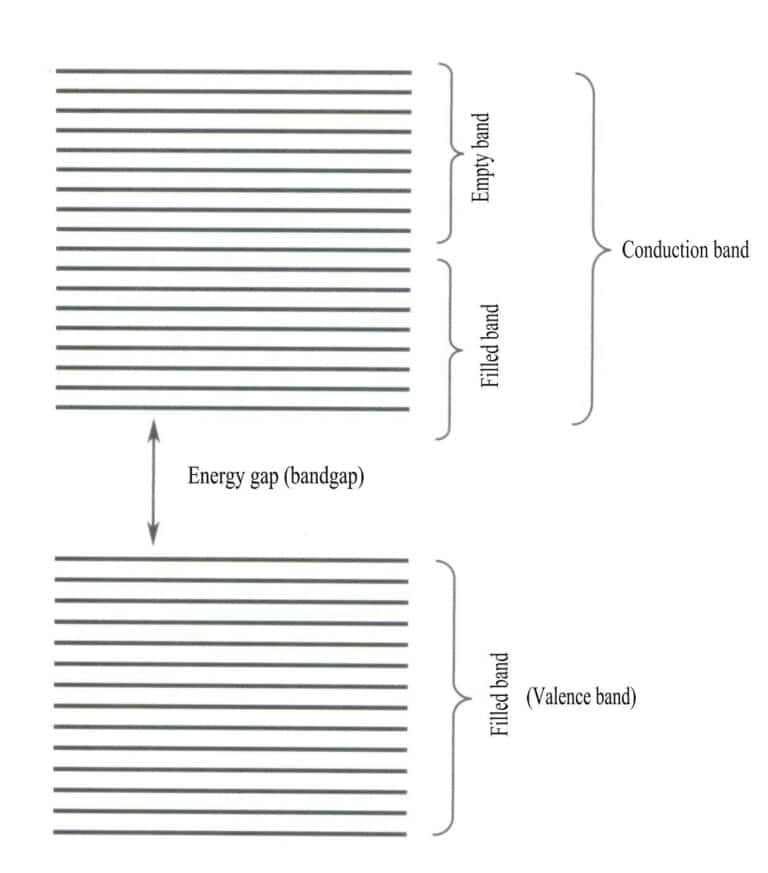
2. Characteristics of Band Gap Transitions
Some gemstone minerals contain elements from Group IV A of the periodic table, such as diamond and moissanite, which primarily bond covalently. There are also other minerals, such as Cadmium sulfide (CdS), whose colors can be explained by band theory.
Electrons absorb light energy and move between the valence and conduction bands, forming “internal band transitions.” The likelihood of transitions is closely related to the energy difference between the valence and conduction bands, known as the band gap energy (Eg) (Figure 3-29).

Figure 3-29 (a) is a typical semiconductor band diagram. Based on the size of the crystal’s band gap energy, it can be divided into three types: wide band gap, narrow band gap, and medium band gap. A wide band gap has a band gap energy greater than the energy of visible light; when the band gap energy exceeds the energy of visible light, visible light is not absorbed and passes through completely, making the mineral colorless. For example, the band gap energy of diamond Eg is about 5.5eV, making it colorless.
The bandgap energy of narrow bandgap materials is less than that of visible light, causing all visible light to be absorbed, resulting in dark gray-green or black colors. For example, the bandgap energy of galena is Eg less than 0.4eV, which appears to be lead gray. When this “narrow bandgap semiconductor” is in an appropriate geometric shape, it exhibits rectifying and amplifying properties.
Medium bandgap materials’ energy is exactly within the visible light range, and gem minerals display various colors. Their color sequence is shown in Figure 3-29 (c), ranging from red-yellow to green-blue to purple. For example, the bandgap energy (Eg) of Cadmium sulfide (CdS) is approximately 2.5eV, which absorbs blue and violet light, appearing yellow. The bandgap energy of cinnabar is about 2eV, allowing only red light to pass through, thus appearing red. The bandgap energy of orpiment is about 2.5eV, appearing yellow.
Another category of natural gem minerals explained by band theory is the color of wide bandgap materials containing impurities. For example, in the case of a diamond with impurities, the bandgap energy of the diamond is Eg approximately 5.5eV, and visible light is not absorbed when passing through the diamond; pure diamond is colorless, but the situation changes when it contains impurities.
(1) The color mechanism of yellow diamonds
Nitrogen atoms replace the positions of carbon atoms. Since nitrogen atoms have one more electron than carbon atoms, this extra electron forms an impurity energy level in the bandgap, known as the donor energy level, with nitrogen atoms acting as “donors.”
The existence of this impurity level reduces the energy of the band gap to 4eV[ [Figure 3-30 (a)]. It can be even lower, allowing it to absorb ultraviolet light and a bit of 3eV violet light, causing the diamond to appear yellow.
This effect is strong; having one nitrogen atom for every hundred thousand carbon atoms can make the diamond deep yellow. However, the band gap reduction is still insufficient to make the diamond conductive at room temperature.
(2) Mechanism of color in blue diamonds
Since boron has one less electron than carbon, it forms an “acceptor level” in the band gap of diamond. It does not have extra electrons, but it can accept electrons from the valence band of a diamond, creating holes in the valence band [Figure 3-30 (b)] and forming an impurity energy band about 0.4eV above the valence band known as the acceptor level.

The acceptor energy level is not simple; it is a complex structure of impurity energy bands that can produce blue. The acceptor energy level creates “holes” in the valence band, which allows this “hole” type II b blue diamond to conduct electricity.
One boron atom among every million carbon atoms can form blue. Due to the higher aluminum content in this blue diamond and because aluminum has one less outer layer electron than carbon, aluminum was previously thought to play the acceptor role. Still, current experiments have proven that it is boron, not aluminum.
Type II b conductive blue diamonds are naturally blue, and their conductivity is one of the differences from irradiated blue diamonds (color centers). This property is often used to distinguish between the two types of diamonds. However, yellow nitrogen donor diamonds do not conduct electricity, so this method cannot be used to differentiate them from irradiated yellow diamonds.
3. Gemstone minerals colored by band transitions
Energy band theory can explain part of the color formation of natural gemstones. Since the band gap energy is an inherent property of the crystal and does not change due to external conditions, the color of gemstones has good stability. The crystal’s conductivity can be determined based on whether the energy bands in the crystal are filled with electrons. Table 3-13 lists the types of gemstone colors that can be explained by band theory and their conductivity properties.
Table 3-13 Types of Gem Colors Explained by Band Theory and Their Conductivity
| Conductors (Metal Colors and Metallic Luster) | Elemen | Copper, Gold, Iron, Silver, Mercury, etc. |
| Paduan | Amalgam, Meteorite nickel iron | |
| Semikonduktor | Narrow Band Gap | Opaque gray to black: altaite, galena |
| Opaque metallic color: cobaltine, marcasite, pyrite, smaltite | ||
| Moderate band gap | Red: cinnabar, proustite, pyrargyrite | |
| Orange: Realgar | ||
| Yellow: Cadmium sulfide, realgar, sulfur | ||
| Wide bandgap | Colorless: diamond, sphalerite | |
| Impurity-containing wide bandgap semiconductors | Donor impurity: Nitrogen-doped diamond (yellow) | |
| Impurities in the host: Boron-containing diamond (blue) |
The color of gemstones caused by band transitions is related to the structure and bonding type at the time of gemstone formation. It has little relation to later impurities and crystal defects. The size of the band gap energy of gemstones is fixed. It does not change with the properties of the gemstone material, so conventional optimization methods generally cannot improve the color of gemstones.
Section IV Physical Optical Effects
Most natural gemstones can cause selective absorption of light, and different gemstones absorb visible light at different wavelengths, resulting in different colors. In addition to selective light absorption, the internal structure of gemstone crystals can also cause physical optical effects, leading to different colors in gemstones.
1. Gemstone minerals related to physical optical effects
The colors produced by physical optical effects are formed due to the dispersion, interference, diffraction, and other reasons of light caused by the crystal structure or composition and inclusions. This is merely an optical effect that can be explained by physical optical theory. Different gemstones can produce different colors under the same optical effects. In addition to the common trace elements that cause color, the reasons for colors produced by physical optical effects are mainly related to the gemstones’ internal structure and physical properties. The types of gemstone minerals that cause colors due to physical optical effects are listed in Table 3-14.
Table 3-14 Types of Gem Minerals Caused by Physical Optical Effects
| Fungsi | Optical Properties and Color | Gem Minerals |
|---|---|---|
| Dispersion Scattering | Shimmering | "Fire" in dispersion gemstones, such as diamonds, zircon, rutile, and strontium titanate |
| Biru | Moonstone, blue quartz, opal | |
| Ungu | Fluorite (scattering of microcrystals of calcium) | |
| Merah | Ruby glass, scattering of microcrystals of copper or gold | |
| Putih | Milky quartz | |
| Cat's eye effect | cat's eye aquamarine, cat's eye pyroxene, etc. | |
| Starlight effect | Various star effects of corundum and garnet | |
| Kilau | Luster of pearls, apophyllite, etc. | |
| Sparkle | Sparkle of aventurine, obsidian, etc. | |
| Interference Diffraction | The pure spectral colors of thin film | The rainbow of chalcopyrite, the discolored film in a iris quartz fissure |
| Interference effects | Color-changing of opal, the effect of labradorite | |
| Penyertaan | Biru | Dumortierite in quartz |
| Hijau | Green chalcedony and nickel veins in green chalcedony, fuchsite in star-quartz | |
| Oranye | Hydrated iron oxide in fire opal and flesh-colored chalcedony | |
| Merah | Hematite flakes in orthoclase |
2. Interference and Diffraction Effects
(1) Interference Effects
Interference phenomena occur when two beams of light propagate along the same optical path or in parallel directions. A common interference phenomenon in gemstones is iridescence. For example, in iridescent quartz, the interference colors depend on the thickness of the film, the refractive index of the film, and the nature of the incident light.
The interference colors of pearls are formed by the concentric layered alternating superposition of two substances with different refractive indices (aragonite and nacrum), where the incident light is reflected from the surfaces between the alternating layers, and the reflected light interferes with the incident light to produce beautiful interference colors.
(2) Diffraction Effects
Diffraction refers to the physical phenomenon where light waves deviate from their original straight-line propagation when encountering obstacles. In physics, light waves undergo varying degrees of bending and scattering when passing through obstacles such as slits, small holes, or disks. If an obstacle is placed between the light source and the observation screen, bright and dark regions will appear on the observation screen, and the boundaries of these regions are not sharp, forming a complex pattern of light and dark. This phenomenon is called diffraction. Such phenomena can occur whenever light waves encounter obstacles along their propagation path. The most important factor in producing diffraction is the presence of periodically spaced diffraction gratings in gemstone minerals.
① Opal Color Change
In opal, the water-containing silica spheres have equal diameters and are arranged in a regular alternating layered structure, forming periodically spaced diffraction gratings. When light enters the opal, diffraction occurs, changing color (Figures 3-31, 3-32). The types of colors and the degree of color change mainly depend on the interplanar spacing of the stacked silica spheres.
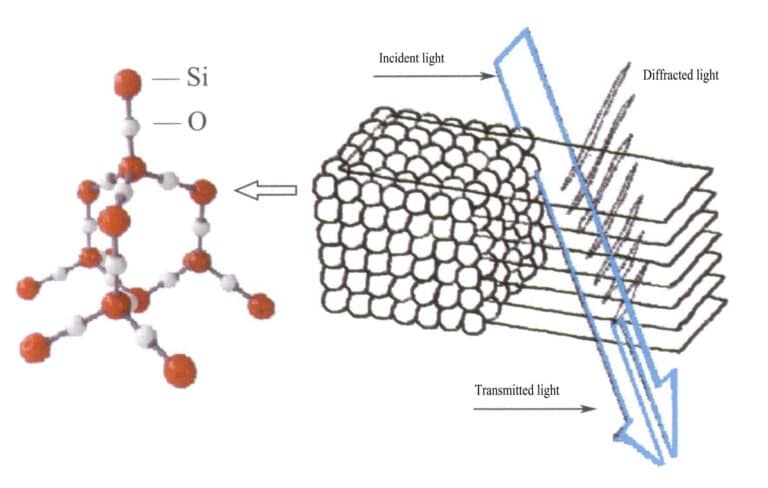

For example, opal with a face-centered cubic flat plate structure and a lattice spacing of 3×10-10m shows colors ranging from green to red; this type of opal with a lattice spacing of 2.5×10-10m shows colors ranging from blue to yellow.
② Labradorite Effect
Labradorite also exhibits effects similar to opal (Figure 3-33). Labradorite is also known as spectrolite because it can flash with the colorful light of the sun. Various types of labradorite from Finland can display a range of spectral colors, a phenomenon known as the “labradorite effect.” The color change effect in labradorite is due to small interlayer melts of plagioclase with different compositions. The slight differences in refractive index among the different feldspars cause interference and diffraction of light, resulting in luminescence and color change. The colors produced by this structure are related to the relative thickness of the layers and their refractive indices. Occasionally, andradite from Mexico also exhibits diffraction phenomena.

3. Scattering and Inclusions
(1) Hamburan
Scattering generally occurs when the internal structure of gem materials is irregular or when the size of the components exceeds the limits of diffraction conditions. The color effects produced by scattering are related to the particle size and shape of the gem material. When incident light interacts with irregularly arranged particles smaller than the wavelength of visible light, the transmitted high-energy light waves are stronger than the low-energy light waves, meaning that in most cases, only purple and blue can be seen. For example, the SiO2 small spheres in opal have diameters smaller than the wavelength of visible light, and when the size of the scattering particles is close to the wavelength of visible light, scattering colors can also occur.
For example, purple fluorite is caused by radioactive irradiation expelling fluorine atoms, resulting in calcium atoms that bond with fluorine atoms condensing into hexagonal plates of a size comparable to the wavelength of visible light. The interaction between the calcium plates and light waves produces scattering. It absorbs some light waves, creating a strong absorption peak in the green-to-red light region, allowing purple light to pass through and produce the purple color.
Since particles of the same size of metal elements can produce similar color effects, and different metal particles can produce different colors, some imitation gems are manufactured using this property.
For example, “ruby” glass is produced by adding copper or gold particles to glass, resulting in a red color similar to that of rubies. When the gem material contains inclusions, micro-cracks, or bubbles larger than the wavelength of visible light, the light waves interact with these scattering particles, causing the scattered light waves to recombine, producing a translucent milky light. For example, certain moonstone imitations.
The moonlight effect of moonstone is also produced by the scattering of light (Figure 3-34). Moonstone is an alkaline feldspar, a composite formed by alternating parallel layers of potassium-rich and sodium-rich feldspar. The interlayer thickness typically ranges from 50~1000nm, with thinner layers capable of producing scattering. The same scattering color can also occur in plagioclase, known as the “labradorite effect.”
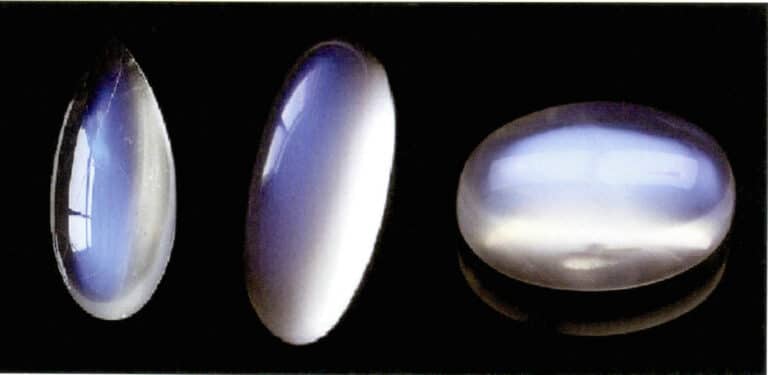
A specially oriented arrangement of scattering particles can produce characteristic optical effects. For example, when the scattering particles are in parallel fibrous form, they produce a cat’s eye or star effects, such as star sapphires and quartz cat’s eyes. When the scattering particles are large enough to be distinguished by the naked eye, they can produce a “goldstone effect,” such as sunstone (Figure 3-35) and goldstone glass.

(2) Inklusi
The color and optical phenomena produced by inclusions are a special type of scattering. Inclusions with color embedded in nearly colorless main crystals will present the color of the inclusions, such as nickel-bearing banded chalcedony and water-containing iron(II) oxide (FeO • H2O) flesh-colored chalcedony; the color of orthoclase from Madagascar and some cordierite is formed by slightly larger, yet still microscopic inclusions of hematite that create red hues; sub-microscopic inclusions of ferric hydroxide often color fire opal.
Diamonds often exhibit different colors due to the presence of numerous inclusions. The diamonds colored by inclusions can be black, orange-red, and brown-red. When a diamond contains countless dark opaque mineral inclusions, it appears black; when examined with strong transmitted light, many dark inclusions can be observed, and the diamond appears dark gray; another type is secondary inclusions that occur in the cracks of the diamond. When the cracks develop and are filled with these colored inclusions, the diamond appears brown-red or orange-red, which is also known as an “oxidized” diamond.
4. Dispersion
The phenomenon of decomposing white light into various spectral colors through an object is called dispersion. The dispersion of gemstones refers to the property of light dispersing into different wavelengths of spectral colors when passing through the inclined planes of transparent gemstones. Due to the different wavelengths of the monochromatic light that make up white light propagating at different speeds and refractive indices in different materials, white light can be decomposed into various spectral colors under certain conditions. The size of a gemstone’s dispersion value is determined by its physical properties; each gemstone has its inherent dispersion value, which does not change with the properties of the gemstone. The unique charm of diamonds is closely related to their high dispersion value (0.044).
Most diamond simulants have a higher dispersion value, such as zircon’s dispersion value of 0.039 and synthetic moissanite’s dispersion value of 0.104. The comparison of the dispersion values of diamonds and their common simulant gemstones is shown in Table 3-15.
Table 3-15 Comparison of the dispersion values of diamonds and their common simulant gemstones
| Nama Batu Permata | Nilai dispersi |
|---|---|
| Berlian | 0.044 |
| Zirkon | 0.039 |
| Korundum | 0.018 |
| Spinel | 0.020 |
| Topaz | 0.014 |
| Beryl | 0.014 |
| Kristal | 0.014 |
| Rutil sintetis | 0.280 |
| Synthetic strontium titanate | 0.190 |
| Synthetic moissanite | 0.104 |
Dispersion is commonly referred to as the “fire” of gemstones. For example, diamonds have a high dispersion value, and their fire is very pronounced, enhancing the already royal status of diamonds and showcasing their unique charm.
There are many types of colors produced by physical optical effects, all of which can be explained by physical optical theory. Except for dispersion, which is an inherent property of the gemstone itself, other phenomena are caused by structural changes after the formation of the gemstone and the differences in mechanical inclusions. Understanding the various causes of gemstone colors provides a theoretical basis for optimizing the treatment of natural and synthetic gemstones.