Comment prévenir le ternissement de l'argent et appliquer un plaquage argent chimique
Solutions d'argenture et d'anti-ternissement pour les bijoux
Introduction :
Cet article explique comment prévenir le ternissement de l'argent et des objets plaqués argent, un problème courant où les surfaces s'assombrissent en raison de réactions avec le soufre ou la lumière. Il détaille les différents traitements anti-ternissement, y compris les méthodes inorganiques comme l'électrolyse du chromate ou de l'étain, les trempages de composés organiques et les applications de tensioactifs. Le texte explique également ce qu'est l'argenture chimique, explorant à la fois l'argenture par déplacement pour des substrats tels que les circuits en cuivre et l'argenture par réduction utilisant des agents tels que le formaldéhyde ou l'hydrazine. Enfin, il explique pourquoi et comment analyser les composants clés des solutions d'argenture au cyanure, tels que les ions d'argent et le cyanure libre.

Table des matières
Section I Traitement préventif de la ternissure de l'argent
En raison de la forte réactivité de la surface de placage d'Ag, la surface argentée est susceptible de se décolorer au contact de milieux corrosifs (tels que H2S, SO2). La lumière transmet également un excès d'énergie à la surface de placage, favorisant l'ionisation de l'Ag et la réaction entre l'Ag et le milieu corrosif.
Le tableau 2-28 montre les effets de la longueur d'onde de la lumière et du temps d'exposition sur la décoloration de l'Ag. Le tableau 2-29 montre les effets du temps d'exposition sur la couleur et la composition chimique.
Tableau 2-28 Effet de la longueur d'onde de la lumière et du temps d'exposition sur le changement de couleur de l'Ag
| Ray | Temps d'exposition/h | ||||
|---|---|---|---|---|---|
| 6 | 12 | 18 | 24 | 48 | |
| 2527Å | Pas de changement de couleur | Taches jaunes | Brun jaunâtre | Brun-noir | Marron |
| 3650Å | Pas de changement de couleur | Pas de changement de couleur | Pas de changement de couleur | Jaune | - |
| Lumière du soleil | Pas de changement de couleur | Pas de changement de couleur | Pas de changement de couleur | Taches jaunes | - |
Tableau 2-29 Effet du temps d'exposition sur la couleur et la composition chimique de la surface argentée
| 2537Å Couleur d'exposition de la lumière/h | 6 | 12 | 18 | 24 | 48 |
|---|---|---|---|---|---|
| Couleur | Argent | Jaune | Brun jaunâtre | Noir brunâtre | Noir |
| Principale composition chimique | Ag(metal) | Ag2O+AgO | Ag2O+AgO | AgO+Ag (Superfine) | Ag(Superfine) |
Ces résultats montrent que les produits de décoloration sont des sulfures, des oxydes, des chlorures ou des particules d'argent. La couleur du placage d'argent après décoloration varie en fonction de la composition chimique. Ce type de changement de couleur n'affecte pas seulement l'aspect décoratif du placage d'argent, mais augmente également la résistance électrique du placage d'argent, ce qui est préjudiciable aux propriétés électriques du placage d'argent.
Ces mécanismes de décoloration de la couche de placage d'argent montrent qu'il suffit d'éviter tout contact entre la surface de placage et l'oxygène, la lumière et les milieux corrosifs pour empêcher la décoloration de la couche de placage d'argent. En même temps, la formation d'une substance dense (couche de film) sur la surface qui peut absorber les rayons ultraviolets devrait avoir un effet inhibiteur sur la décoloration de la couche de placage.
Parmi les méthodes traditionnelles de prévention de la décoloration des couches de placage d'Ag, on trouve les méthodes à base de composés inorganiques, les méthodes à base de composés organiques, les méthodes à base de tensioactifs et l'utilisation combinée de ces méthodes.
1. Méthode de traitement des composés inorganiques
Pour comparer les effets des différents traitements anti-ternissement, les pièces testées ont été plaquées avec 2~3μm Ag puis trempées dans une concentration de 0,2% de solution de polysulfure d'ammonium [(NH4)2SX] pendant une certaine période. L'inspection visuelle a été utilisée pour l'évaluation. Lorsque l'inspection visuelle était impossible, un luisanceur numérique a été utilisé pour mesurer la réflectance spéculaire, et la différence △ avant et après le trempage dans la solution de polysulfure d'ammonium a été calculée. Parallèlement, pour les tests d'exposition en intérieur, un luisancemètre a également été utilisé pour les mesures.
Des films métalliques ou des films d'oxyde métallique ayant la même tonalité que l'Ag, tels que In, Zn, Cd, Cr, Pd, Rh, Sn, Be, Al, Th et Zr, ont été testés en tant que traitement anti-ternissement pour l'Ag. Parmi eux, le traitement électrolytique du chromate a présenté la fonction anti-ternissement la plus remarquable et a été largement appliqué. Ensuite, le Rh et le Be font également partie des choix.
(1) Traitement des métaux précieux
L'électrodéposition des alliages de Rh et de Pd a été réalisée dans des conditions optimales, suivie de leurs changements de teinte et d'expériences de résistance à la décoloration. Les résultats sont présentés dans le tableau 2-30. La réflectance spéculaire du Rh est de 70%, tandis que celle de l'alliage (Pd80:Ni20) est d'environ 57%. Bien que les épaisseurs de placage diffèrent, il peut y avoir une certaine corrélation. L'épaisseur de placage du Rh est de 0,1μm, et l'épaisseur de placage du Pd-Ni est de 0,3μm. Lorsque l'épaisseur de placage d'autres métaux sur Ag augmente, la couleur argentée de la couche d'argent sous-jacente disparaît. Cependant, en comparant visuellement le ton, la luminosité et les valeurs relatives de la réflectance spéculaire, il a été constaté que lorsque la réflectance spéculaire est de 80%, la différence par rapport à la couleur argentée devient évidente, et 70% est sa limite. En deçà, la couleur argentée disparaît et se transforme en une couleur métallique différente. Par conséquent, du point de vue de la tonalité, une épaisseur de placage de Rh inférieure à 0,1μm est plus appropriée. Cependant, sa résistance à la décoloration est insuffisante, alors que la couche de placage de l'alliage Pd-Ni est plus épaisse et présente une bonne résistance à la décoloration. L'utilisation de métaux précieux entraîne une augmentation des coûts, mais ils offrent une bonne résistance à la drogue et à l'usure. Plus la résistance à la décoloration est bonne, plus la couleur originale de l'argent disparaît. Il est donc très difficile d'améliorer la résistance à la décoloration sans modifier le ton et la brillance de l'argenture.
(2) Traitement de l'étain et des alliages d'étain
Les alliages de Cu et de Sn sont appelés alliages miroir. Lorsque la teneur en Sn est supérieure à 60%, leur couleur est blanc argenté et la réflectance spéculaire est également élevée, avec une bonne résistance à la corrosion. C'est pourquoi ils ont été étudiés depuis l'Antiquité et utilisés comme surfaces de miroir dans les télescopes à réflexion. Lorsqu'ils sont utilisés comme revêtements anti-ternissement à base d'argent, ils résistent assez bien au ternissement pendant 5 à 6 heures. Cependant, la réflectance spéculaire chute à environ 65%, perdant clairement la couleur argentée. L'utilisation des alliages miroirs dépend du degré de teinte. Bien qu'ils soient moins chers que les métaux précieux, lorsque l'épaisseur du film atteint plusieurs milliers d'angströms, une différence de potentiel apparaît entre le métal précieux Ag et l'alliage Cu-Sn, ce qui peut entraîner des problèmes de résistance à la corrosion.
Outre le placage d'alliage de Sn, le métal Sn ou les composés Sn précipités par des traitements électrolytiques ou par trempage de 50~100Å peuvent également présenter une résistance au ternissement et une résistance améliorée aux intempéries. En tant que traitement contre le ternissement, il peut maintenir la stabilité de la résistance des contacts pendant une longue période.
Les résultats expérimentaux sont présentés dans le tableau 2-30. Par rapport aux solutions alcalines et acides, les pièces traitées avec des solutions acides présentent un précipité blanc brumeux et ne peuvent pas être utilisées à des fins décoratives. En revanche, les pièces traitées avec des solutions alcalines et des traitements électrolytiques ne présentent aucun problème à court terme.
Tableau 2-30 Résistance des composés inorganiques à la décoloration des surfaces plaquées argent
| Numéro de série | Composition de la solution | Conditions de traitement | Condition d'apparition de la couleur apparente | Note |
|---|---|---|---|---|
| 1 |
PNP (Nissin Kasei, Japon) Placage d'alliage Pd-Ni |
DK lA/dm2 Température ambiante 1min
|
Au-dessus de 6h | Perte de la couleur argentée, mauvaise CN- résistance |
| 2 |
Étain (Daiya Shokai) Placage en alliage Cu-Sn
|
3V 55℃ 40s
|
Au-dessus de 6h | Perte de la couleur argentée |
| 3 |
Na2Cu(CN)3 24g/L Na2SnO3 90g/L NaCN libre 16g/L NaOH
|
Dk 2A/dm2 60℃ 30s
|
Au-dessus de 6h | Perte de la couleur argentée, meilleure que la couleur argentée de 1 et 2. |
| 4 |
Na2SnO3 90g/L CH3COONa 0g/L,5g/L,10g/L
|
DK 0,5 A/dm2 Température ambiante 15〜90s
|
10 〜20s | Ajout de CH3COONa peut stabiliser la solution, et plus le temps d'électrolyse est long, plus elle est stable, mais elle perdra sa couleur argentée. |
| 5 |
SnCl2 20 g/L 0. 025NHCl 50mL/L
|
Température ambiante 1min
|
10 minutes | |
| 6 |
SnCl2 20 g/L 0,025NHCl 50mL/L
|
DK 0. 1 〜 2A/dm2 Température ambiante, 10s
|
10 minutes | Blanc |
|
Température ambiante ,1min, 10min |
Légèrement jauni | |||
| 7 | Fluoroborate d'étain 3% |
DK 0. 1 ~ 2 A/dm2 Température ambiante, 10s
|
- | Blanc |
| Température ambiante ,1min, 10min | 10 minutes | Légèrement jaune | ||
| 8 |
Sulfate stanneux 20g/L Acide iodique 30mL/L
|
DK 0. 1 〜 2 A/dm2 Température ambiante ,10s
|
- | Blanc |
| 9 |
Fluoroborate stanneux 20mL/L Acide fluorique 30mL/L Acide fluoroborique 20g/L
|
Température ambiante ,1min, 10min DK 0. 1 〜2 A/dm2 Température ambiante ,10s |
10 minutes - |
Légèrement jaunâtre Blanc
|
| Température ambiante, 1min, 10min | 10 minutes | Légèrement jaune | ||
| 10 |
BeSO4 , 4H2O 2g/L pH = 5. 7〜5. 8
|
DK 0. 007 A/dm2 Température ambiante 3〜10min
|
Supérieure à 1h | |
| 11 |
BeSO4 , 4H2O 2g/L pH = 5,8
|
1 〜2. 4V 20s~4min
|
20 minutes | |
| 12 | EverShine S(Tamura Chemical)) |
6.5V Température ambiante 90s
|
15 minutes | |
| 13 |
K2CrO4 15 g/L NaOH 30g/L
|
2〜6V Température ambiante 15〜120s
|
10 〜30s | Plus l'électrolyse est longue, mieux c'est |
| 14 |
K2CrO4 30 g/L NaOH 40g/L
|
DK 4A/dm2 Température ambiante 30〜40s
|
Brouillard blanc Pas de couleur argentée
|
|
| 15 |
K2CrO4 30 g/L NaOH 40g/L Chauffage 20h
|
Brouillard blanc Pas de couleur argentée
|
||
| 16 |
Al2(SO4)3 4g/L Oxalate d'ammonium 2g/L pH = 5,8
|
DK 0,06A/dm2 Température ambiante 30s〜1min
|
20 〜30s | Même temps qu'en l'absence de traitement |
| 17 | Carbonate de sodium | |||
| 18 |
Na2SnO3 8. 5g/L CH3COONa 5g/L (n° 4)
|
DK 0. 5A/dm2 15 〜30s Température ambiante
|
Au-dessus de 6h | |
|
K2CrO4 15 g/L KOH 30g/L (n° 13)
|
2〜3V 30s Température ambiante
|
|||
| 19 |
K2CrO4 15 g/L KOH 30g/L K2LE CO3 50 g/L
|
6V 15 〜60s
|
10 〜30min |
(3) Traitement du béryllium
L'application d'un film d'oxyde de béryllium sur l'or, le cuivre et le laiton en tant que traitement de changement de couleur permet d'obtenir de bons résultats. Le principe de cette méthode est le suivant : le point isoélectrique de l'hydroxyde de béryllium est de pH = 5,8, et la réaction électrolytique suivante peut se produire :
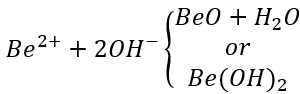
(4) Traitement de l'aluminium
Des rapports font état de la formation d'un film d'oxyde similaire à celui de Be ; des expériences supplémentaires n'ont montré aucune différence entre les échantillons traités et non traités, et aucun film d'oxyde n'a pu être formé.
(5) Traitement au chromate
L'argenture est la méthode la plus courante pour le traitement anti-ternissement du placage de laiton. Il existe deux méthodes de traitement du chromate : l'électrolyse cathodique et le trempage, mais la méthode de l'électrolyse cathodique est nettement supérieure.
Les additifs utilisés dans les électrolytes de chromate comprennent : K2LE CO3, Na2LE CO3KCN, NaS2O3KCNS, NaCl, KI, EDTA, etc. Parmi eux, le K2LE CO3 Les résultats expérimentaux ont montré qu'il peut également agir comme un sel conducteur, réduisant ainsi le temps de traitement de l'électrolyse par rapport au cas où il n'est pas ajouté. Les effets des autres additifs n'ont pas montré de différences significatives.
L'inconvénient du traitement par électrolyse au chromate est que le film résiste mal aux UV et qu'il brunit après une longue période d'inactivité.
2. Traitement avec des composés organiques et des agents tensioactifs
Tableau 2-31 Expérience d'anti-décoloration des composés organiques
| Catégorisation | Numéro de série | Composés organiques | Propriétés physiques | Solubilité | Conditions de traitement | Apparence | Hydrophobie | Effet anti-décoloration |
|---|---|---|---|---|---|---|---|---|
| Amine aliphatique | 1 |
Éthylamine (solution aqueuse 70%) CH3CH2NH2
|
Mw 45. 09 d15 0. 6892 Point de fusion 83.3℃ Point d'ébullition 16℃ |
Alcools (aqueux) Ether
|
0. 1mol/L (0. 65mL/L) 0. 01mol/L (6,5mL/L) Température ambiante,20min,60min |
pH 10〜11 Incolore Transparent O |
X | X |
| 2 |
Dodécylamine CH2(CH2)11NH2 |
Mw 18. 5 Point de fusion 25℃ Point d'ébullition 247℃ |
Acétone (Éthanol) |
0. 1mol/L (18,5g/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent Tache d'eau |
X | X | |
| 3 |
Tributylamine (CH3CH2CH2CH2)3N |
Mw 185 d 0. 7782 Point d'ébullition 216.5℃ |
(Éthanol) Ether
|
0. 1mol/L (24mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent O |
X | X | |
| Amines aromatiques | 4 | O-Toluidine |
Mw 107. 16 d20 0. 9989 Point d'ébullition 199. 7℃ |
Eau 1. 5(25) (Ethanol) Ether |
0. 1mol/L (24mL/L) Température ambiante, 20 minutes, 60 minutes |
Brun rougeâtre transparent O |
X | X |
| 5 | Diphénylamine |
Mw 169.23 d 1.159 Point d'ébullition 302℃ |
(Ethanol) 56 Ether |
0. 1mol/L (17g/L) Température ambiante, 20 minutes, 60 minutes |
Incolore transparent Tache d'eau |
X | X | |
| Diamines, polyamines | 6 | H2N(CH2)2NH2 |
Mw 45.09 d35 0.892 Point de fusion 8.5℃ Point d'ébullition 117℃ |
(water) Éthanol |
0,1mol/L (6. 7mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 10〜11 O |
X | X |
| Diamine, polyamine | 7 |
Diéthylènetriamine H2 N(CH2 )2 NH(CH2 )2 NH2 |
Mw 103 Point d'ébullition 208℃ |
(eau) Éthanol |
0. 1mol/L (10mL/L) Température ambiante, 20min, 60min |
Incolore Transparent pH 10〜11 O |
X | X |
| 8 |
Triéthylènetétramine H2 N(CH2 )2 NH(CH2 )2 NH2 (CH2 )2 NH2 |
Mw 146 Point de fusion 208℃ Point d'ébullition 174℃ |
(eau) |
0,1mol/L (15mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 10〜11 O |
X | X | |
| Alcools aminés | 9 |
Triéthylènetétramine H2N(CH2)2NH(CH2)2 NH(CH2)2NH2 |
Mw 189 | (eau) |
0. 1mol/L (19mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 10〜11 O |
X | X |
| 10 |
Éthanolamine HO(CH2)2NH2 |
Mw 61.09 d27 1.0111 Point d'ébullition 171℃ |
(eau) Éthanol |
0. 01mol/L (0,61mL/L) 0,1mol/L (6,1mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 9〜10 O |
X | X | |
| 11 |
Diéthanolamine (HOCH2CH2)2NH |
Mw 105.14 d20 1.0916 Point de fusion 28℃ Point d'ébullition 268℃ |
(eau) Éthanol |
0. 01mol/L (0.96mL/L) 0,1mol/L (9,6mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 9〜10 O |
O | X | |
| 12 |
Triéthanolamine (HOCH2CH2)3NH |
Mw 149.19 d20 1.124 Point de fusion 21.2℃ Point d'ébullition 227℃ |
(eau) Éthanol |
0. 01mol/L (1,3mL/L) 0,1mol/L (13mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 9〜10 O |
O | X | |
| 13 |
2N-Diéthylamine (CH2)2NCH2CH2OH |
Mw 93.1 Point d'ébullition 39.5℃ |
(eau) |
0. 1mol/L (0.89mL/L) 0. 01mol/L (8.9mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 9〜10 O |
O | X | |
| 14 | 2-Amino-2-ethyl-1,3-propanediol | Mw 105 | (eau) |
0,01mol/L (1,1g/L) 0. 1mol/L (11g/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 9〜10 O |
O | X | |
| Amide | 15 | Acétamide |
Mw 59.07 d 1.159 Point de fusion 52.62℃ Point d'ébullition 221℃
|
(eau) Éthanol |
0. 1mol/L(5.1mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent O |
△ | X |
| 16 | Acrylamide |
Mw 71.1 d 1.122 Point de fusion 85℃ |
(eau) Éthanol Ether Trichlorométhane
|
0. 1mol/L(7.1mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent O |
△ | X | |
| 17 | Benzylamine |
Mw 121.14 d 1.341 Point de fusion 128℃ Point d'ébullition 290℃ |
(eau) Éthanol
|
0. 1mol/L(12g/L) 30℃ Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent O |
O | X | |
| Oxime | 18 | Oxime de butanedione |
Mw116.12 Point de fusion 240℃ |
(Éthanol) Ether (Eau) |
0. 01mol/L (0,12g/L) 0. 001mol/L (1,2gmL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent O |
X | X |
| 19 | Oxime de benzohydrine |
Mw227 Point de fusion 154℃ |
(Éthanol) (ammoniac)
|
0,01mol/L (0,23g/L) 0. 001mol/L (2,3g/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent △ |
X | X | |
| Pyridine | 20 | Pyridine |
Mw 79.10 d20 0.977 Point d'ébullition 115.5℃ |
(eau) Éthanol |
0. 001mol/L (0,1mL/L) 0,1mol/L (8mL/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent O |
X | X |
| Quinoléine | 21 | Quinoléine |
Mw 127.16 d20 0.938 Point de fusion -15℃ Point d'ébullition 238℃ |
Eau chaude, acide dilué, éthanol, éther, disulfure de carbone (6mol/L HCl) 2~20mol/L |
0,1% (1g/L) 1% (10g/L) Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 2~4 O |
O | X |
| 22 | Carboxyquinoléine |
Mw 145 Point de fusion 75~76℃ |
Éthanol, acétone, trichlorométhane, benzène (6mol/L HCl) 2~20mol/L |
0,1% (1g/L) 1% (10g/L) Température ambiante, 20 minutes, 60 minutes |
Jaune Transparent pH 2~4 O |
X | X | |
| Quinoléine | 23 | Oxime de butanedione | Mw 256 |
Acide inorganique (6mol/L HCl) 40mol/L Éthanol |
0,1% (1g/L) 1% (10g/L) Température ambiante, 20 minutes, 60 minutes |
Jaune Transparent pH 10~11 O |
X | X |
| Composés diazoïques | 24 | p-Éthoxy-2,4-diaminoazobenzène | Mw 256 |
Acide inorganique (6mol/L HCl) 40mol/L Éthanol |
0,1% (1g/L) 1% (10g/L) Température ambiante, 20 minutes, 60 minutes |
Rouge Transparent O |
O | X |
| Acide hydroxycarboxylique | 25 | Acide tannique | Blanc jaunâtre, couleur claire, poudre |
(eau) Éthanol Acétone |
0.1% 0.1% 5% |
Incolore Transparent pH 6 Jaune transparent pH 4 Brun jaunâtre transparent pH 2 |
X | X |
| Thiourée | 26 | 1-Acétyl-2-thiourée |
Mw 118.16 Point de fusion 165℃ |
(eau) Alcool |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 7 O |
O | X |
| Thiourée | 27 | Aminothioureas |
Mw 95.6 Point de fusion 81~183℃ |
(6mol/L HCl) 50mL/L |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 1 O |
X | X |
| 28 | Dithizone | Mw 256 |
(Trichlorométhane) Tétrachlorure de carbone |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Tache d'eau bleue Devient jaune |
O | X | |
| Monosaccharide | 29 | Acide ascorbique (vitamine C) |
Mw 176 Point de fusion 190~192℃ |
(eau) |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 1 O |
X | X |
| Imidazoles | 30 | 1-Acétyl-2-thiourée |
Mw 155 Décomposition 287~288℃ |
Méthanol Eau 45mL
|
1g/L, 10g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 1 O |
X | X |
| 31 | 2-Heptadécylimidazole |
Méthanol 55mL Eau 45mL Dissolution Alcool, acide |
1g/L, 10g/L Température ambiante, 20 minutes, 60 minutes |
Suspension blanche Inégal Adhésion des Blancs |
O | O | ||
| Benzimidazoles | 32 | 2-mercaptopyridine |
Mw 150 Point de fusion 301~302℃ |
Méthanol 15mL Eau 45mL Eau chaude Éthanol NaOH |
1g/L, 10g/L Température ambiante, 60℃ 20min, 60min |
Incolore transparent O |
O | X |
| Triazoles | 33 | 3-Amino-1,2,3-triazole |
Mw 159 Point de fusion 159℃ |
(eau) Éthanol Trichlorométhane |
Température ambiante, 60℃ 1min, 10min, 60min |
O | - | X |
| Benzotriazole | 34 | Benzotriazole |
Mw 119.13 Point de fusion 99℃ |
Eau chaude Alcool |
12g/L, pH 6 60℃ 1min, 3min, 10min
|
Incolore Transparent O |
- | X |
| Triazine | 35 | Triéthylènediamine |
Mw 140 Sublimation au-dessus de 230°C |
(eau) Hydrater (CN2)2N Trichlorométhane Alcool |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 8 O |
X | X |
| Oxazole | 36 | 2-Oxobenzazole |
Mw 1151 Point de fusion 143.2℃ |
Ammoniac 6mol/L d'ammoniaque 200mL/L Acide acétique Ether |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 10 O |
O | X |
| (Oxo)zines | 37 | Morpholine |
Mw 87.12 d13 1.0007 Point d'ébullition 128℃ |
(eau) Alcool Ether |
10 g/L Température ambiante, 20 minutes, 60 minutes |
Incolore Transparent pH 9~10 O |
X | X |
| Thiazole | 38 | Ortanin |
Mw 264 Point de fusion 200~246℃ (Décomposition) Cristaux rouges en forme d'aiguilles
|
Acides forts Dense Trichlorométhane Ether Benzène (acétone)
|
1 g/L Température ambiante, 20 minutes, 60 minutes |
Rouge transparent (précipité rouge) Tache d'eau brune |
O | X |
| Benzothiazole | 39 | Benzothiazole |
Mw 135.39 d12 1.2349 Point d'ébullition 231℃ |
(Éthanol) Éther éthylique |
1 g/L Température ambiante, 3min, 60min |
Brun rougeâtre Transparent O |
△ | X |
| 40 | 2-Benzothiazole hydrophobe |
Mw 167 Point de fusion 177℃ |
Éthanol Éther éthylique Benzène Acide acétique Carbonate de potassium Hydroxyde de potassium Hydroxyde de sodium 2g/L |
1 g/L Température ambiante, 3min, 60min |
Blanc trouble pH 10 O |
X | O | |
| Naphtalènes | 41 | Agent d'épargne naphtalénique |
Mw 217 Point de fusion 109.5℃ |
Eau (20℃) 0,01g/L |
0,2g/L (précipitations) Température ambiante, 2min, 10min, 30min |
O | - | X |
| Isoacétone |
10 g/L Température ambiante, 10 minutes, 60 minutes |
Jaune transparent Tache d'eau
|
O | O | ||||
|
Isoacétone 50% Eau 50% |
5 g/L Température ambiante, 10 minutes, 60 minutes |
Jaune transparent Tache d'eau
|
O | O |
Tableau 2-32 Expérience des tensioactifs sur l'anti-décoloration
| Numéro de série | Nom (nom de l'entreprise) | Statut | Concentration | Conditions de traitement | Apparence | Hydrophobie | Effet d'inhibition | Remarques |
|---|---|---|---|---|---|---|---|---|
| 1 | Agent antirouille MC- 501 (Japan Lion Grease) |
Rouge clair transparent, d 1.06 pH 8. 0〜8. 5 |
2%,10% | Température ambiante 20min, 60min | O | O | Ag:x | |
| 2% | Température ambiante 15s, 10min | O | O | Cu:Tap immersion dans l'eau X, essai d'exposition △ | 15s de mieux | |||
| 2 | Enajiko-ru CNS (Japan Lion Grease) |
Amphotérique pH 8〜9 |
1% | Température ambiante 20min, 60 min (Ag)15s, 10min(Cu) | O | O | Ag:x Cu:Tap immersion dans l'eau X, test d'exposition: | 1% 15s bon |
|
15% Sulfonate de benzène sodique 15% (neutre)
|
Température ambiante 20min, 60min (Ag)15s, 10min(Cu) | Adhésion de précipités bruns et blancs | O | |||||
|
10% Pyrophosphate de potassium 5% (Alcaline) |
Température ambiante 20min, 60min (Ag) 15s, 10min(Cu) |
Turbidité blanche O |
O | |||||
| 3 | Ripa-ru OH- 104P (graisse de lion du Japon) | 0.1% | Température ambiante 20min, 60min |
Incolore et transparent O Blanc jaunâtre trouble O
|
O △
|
Ag:x | ||
| 1% | ||||||||
| 10% | ||||||||
| 4 | Dyuomin CD (Japan Lion Grease) | 0.1% | Température ambiante 20min, 60min |
Blanc nuageux O Traces de boue jaune O
|
O | Ag:x | ||
| 1% | ||||||||
| 10% | ||||||||
| 5 | Dyuomin CDA-50 (Lion Grease, Japon) | 0.1% | Température ambiante 20min, 60min |
Incolore et transparent O
|
△ O
|
Ag:x | Légère amélioration à 60 minutes | |
| 1% | ||||||||
| 10% |
Jaune turbide O |
|||||||
| 6 | FC-98 (Kanto Chemical, Japon) | Poudre blanche anionique contenant du fluor |
0.1% 1%
|
Température ambiante 20min, 60min |
Incolore et transparent pH 5~7 Marques tachetées
|
O | ×(Ag) | |
| 7 | FC-134 (Kanto Chemical, Japon) | Poudre brune de thé contenant des ions d'oxygène fluorés |
0.1% 1% (Éthanol) |
Température ambiante 20min, 60min 5min, 30s |
Jaune transparent, Jaune brun transparent pH 6 Marques tachetées
|
O | ○(Ag) | Les marques disparaissent lorsque la température est abaissée |
| 8 | Soft-data-jento W (graisse de lion du Japon) | Cationique Poudre blanche | 1% | Température ambiante 20min |
Blanc trouble pH 7 O
|
X | X |
OH RCH2CH(CH2)nSO3Na (MIX) α-Allylsulfonate
|
| 9 | Ripomin COH (Japan Lion Grease) | Liquide amphotère | 1% | Température ambiante 20min |
Blanc trouble pH 8 O
|
O | X | Imidazolyle |
| 10 | Perettex TR (Kao, Japon) |
Cationique Incolore transparent
|
1% | Température ambiante 20min |
Blanc trouble pH 10 O
|
O | X |
RODC-CH-SO3N4R-OOC-CH3 Dipropylsulfosuccinate de sodium
|
| 11 | Ema-ru 20C (Kao, Japon) |
Cationique Liquide jaune clair
|
1% | Température ambiante 20min |
Turbidité incolore pH 7 O
|
X | X |
R-O(CH2 OH)nSO3Na Acides alkylés polyoxyéthylénés
|
| 12 | Koutamin 24P (Kao, Japon) |
Anionique Solide blanc
|
1% |
Incolore et transparent pH 7 O
|
O | X | Triméthylamine | |
| 13 | Perettex # 1222 (Kao, Japon) | Non ionique | 1% | Température ambiante 20min |
Blanc nuageux O
|
O | X | |
| 14 | Perettex # 1265 (Kao, Japon) | Non ionique | 1% | Température ambiante 20min |
Incolore et transparent O
|
O | X | |
| 15 | Soft-kurin QA-1 (Miyoshi, Japon) |
Amphotérique Blanc solide
|
1% | Température ambiante 20min |
Turbidité incolore pH 7 O
|
O | X | Type de β-alanine |
| 16 | Soft-kurin MA-3-70 (Miyoshi, Japon) | Amphotérique | 1% | Température ambiante 20min |
Incolore et transparent pH 8 O
|
O | X | |
| 17 | Marusenokku AgT (Japon Ma-ruseru) | Agent anti-ternissement de l'argent |
3mL/L 30mL/L
|
Température ambiante 30s, 60min |
Blanc nuageux pH 8 Adhésion
|
O | △ | Se référer au manuel d'instructions |
| 18 | Dainshiruba-SS (Yamato Kasei, Japon) | Agent anti-ternissement de l'argent |
10% Isopropyl Cétone 50% Eau 10%
|
25~30℃ 4min, 20min, 60min
|
Incolore et transparent pH 8 O
|
O | X | Se référer au manuel d'instructions |
| 19 | T611 (Uemura Kogyo, Japon) | Agent anti-ternissement de l'argent |
Liquide 10% 90%
|
Température ambiante 30s, 2min, 10min, 60min | Taches transparentes incolores | O | O | Se référer au manuel d'instructions |
| 20 | Roukorinsu- eido (Aikorouko, Japon) | Agent anti-ternissement de l'argent | 1% | Température ambiante 31min, 5min, 30min |
Blanc nuageux pH 7 O
|
O | X | A utiliser dans les usines électroniques |
Parmi les composés organiques, ceux qui ont un effet anti-décoloration de l'Ag lorsqu'ils sont trempés dans une solution de polysulfure d'ammonium 0,2% sont le 2-17 alkanimidazole, le 2-mercaptobenzimidazole et les agents complexants.
Les composés organiques ayant ces effets anti-décoloration présentent les caractéristiques suivantes :
① Le traitement est effectué dans une région alcaline proche de pH 7.
② Contient des groupes hydrophobes (alkyle à longue chaîne, phényle).
③ Contient des groupes diméthylamine ou des groupes -SH ou contient des doubles liaisons.
④ Insoluble dans l'eau.
⑤ Incolore, proche du solide.
Toutefois, certains cas répondent aux conditions susmentionnées mais n'ont pas d'effets anti-décoloration, comme le 2-mercapto benzimidazole et le 2-thiazolyl benzimidazole.
La relation mutuelle entre les deux n'est pas encore très claire.
Les effets du FC-134 et du T611 ont été confirmés en ce qui concerne l'effet anti-décoloration des surfactants. Parallèlement, des expériences ont été menées sur l'effet combiné des composés organiques et des agents de surface (FC-134), et aucun effet significatif n'a été constaté (tableau 2-33). La résistance à la décoloration de la solution de polysulfure d'ammonium 0,2% ne dure qu'environ 10 minutes au maximum. Par ailleurs, la résistance aux solvants (diluants) est également relativement faible. Pour la résistance à la décoloration des objets décoratifs due à la présence de taches, si l'on considère l'ensemble de ces problèmes, la seule utilisation possible est le 2-mercapto benzimidazole avec le FC-134 (voir tableau 2-34).
Tableau 2-33 Effets combinés des composés organiques et des agents de surface sur l'anti-décoloration des couches d'argent plaqué
| Numéro de série | Composition | Conditions de traitement | Apparence | Hydrophobie | Propriété anti-modification de la couleur | Remarques |
|---|---|---|---|---|---|---|
| 1 |
2-Heptadécamidazolelg/L FC-134 1g/L EtOH : H2O = 1 :1 |
Température ambiante 1min, 60min |
Précipité blanc pH7 Adhésion | O |
O Moins efficace que lorsqu'il est utilisé seul
|
|
| 2 |
2-Mercaptobenzimidazole 1g/L FC-134 1g/L NaOH 2g/L
|
Température ambiante 1min, 60min |
O | X |
O Meilleur que lorsqu'il est utilisé seul |
Pouvoir moussant réduit, plus il est long, mieux c'est |
| 3 |
Mercaptone 5g/L FC-134 0. 5g/L Isoacétone:H2O = 1 :1 |
Température ambiante 1min, 60min |
O |
O Meilleur que lorsqu'il est utilisé seul
|
Pouvoir moussant réduit, plus il est long, mieux c'est |
Tableau 2-34 Effet des solvants sur le film anti-décoloration
| Composés organiques | Conditions de traitement | Solvant | Apparence | Effet anti-décoloration |
|---|---|---|---|---|
| 2-Heptadécamidazole |
1 g/L (C2H5OH : HO = 1 : 1) 20 minutes
|
Taches | O | |
|
Diluant (5 minutes)
|
Les taches disparaissent O
|
X | ||
|
Alcool (5 min)
|
Les taches disparaissent O
|
X | ||
| Pulvérisation grossière | Grattage |
O Seule la partie rayée est décolorée
|
||
| 2-Mercaptobenzimidazole |
10 g/L NaOH 2g/L Température ambiante 20 minutes
|
O | O | |
|
Plus mince (5 minutes)
|
O | X | ||
|
Alcool (5 minutes)
|
O | △ | ||
| Pulvérisation grossière | Grattage |
O Seule la partie rayée est décolorée
|
Les résultats expérimentaux ci-dessus sont résumés comme suit.
① Il est difficile de s'assurer que le ton et l'éclat uniques de l'argent ne sont pas endommagés lorsque d'autres métaux précieux sont appliqués sur l'argent dans le cadre d'un traitement anti-ternissement.
② En utilisant des méthodes à base de Sn ou d'alliage de Sn, lorsque l'épaisseur de Sn est de 50~10Å, l'effet anti-ternissement peut être atteint, mais l'effet de cette seule méthode est limité.
③ Les traitements avec Be et Al ont peu d'effet.
④ Les traitements classiques, comme les traitements au chromate, ont des effets relativement bons. Toutefois, leur principal inconvénient est que le film traité présente une faible résistance aux UV et peut brunir en cas de protection à long terme.
⑤ Parmi les composés organiques, ceux qui ont des propriétés anti-décoloration comprennent le 2-heptadécylimidazole, le 2-alkyl benzimidazole et les agents mercapto naphtalènes. Toutefois, d'autres composés organiques ayant la même structure n'ont pas nécessairement la même capacité anti-décoloration.
⑥ L'efficacité du FC-134 dans les surfactants vendus sur le marché a été confirmée.
3. Effet anti-décoloration du traitement combiné par électrolyse de l'étain et électrolyse de l'acide chromique
(1) Test de promotion de la décoloration et méthode de mesure de la décoloration
Les conditions de l'essai de promotion de la décoloration sont indiquées dans le tableau 2-35.
Tableau 2-35 Conditions de l'essai de promotion de la décoloration
| Solution |
Solution de sulfure d'ammonium (jaune) (Showa Chemical) (NH4)2Sx(2%) |
| Température | 20℃ |
| Temps de trempage | 2h |
△(%) = L1 - L2 (2-1)
Dans la formule,
L1- réflectance avant le test de changement de couleur, % ;
L2- réflectance avant le test de changement de couleur, %.
(2) Electrolyte d'étain
Des expériences sur les effets des conditions de traitement de l'électrolyte d'étain ont permis de déterminer que la concentration de stannate de sodium, le temps d'électrolyse, la densité de courant et la température de traitement pouvaient être ignorés en ce qui concerne leur impact sur les caractéristiques de résistance à la décoloration. En même temps, de l'acétate de sodium a été ajouté comme stabilisateur dans le placage alcalin de Sn. La composition et les conditions optimales pour l'électrolyse de l'étain sont indiquées dans le tableau 2-36.
Tableau 2-36 Composition et conditions optimales pour l'électrolyse du Sn
| Composition de la solution de placage |
NaSnO3 - 3H2O 8. 5g/L CH3COONa ・ 3H2O 5g/L |
| Conditions de traitement |
Densité de courant 0. 5A/dm2 Durée de l'électrolyse 15s (10〜30s) Température 20℃ (7〜30℃) Matériau de l'anode Plaque d'acier inoxydable |
(3) Relation entre l'émissivité et le temps d'électrolyse
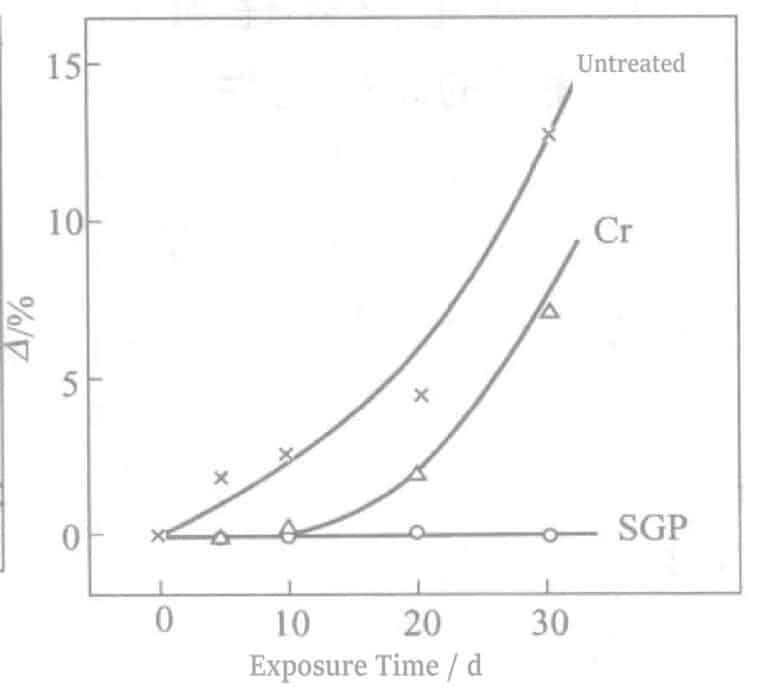
La relation entre la réflectivité et le temps d'électrolyse est illustrée dans la figure 2-8. Au fur et à mesure que le temps d'électrolyse augmente, la réflectivité diminue fortement, ce qui nuit à la teinte de l'Ag. Une durée d'électrolyse d'environ 90 secondes donne une couleur blanc étain, et à environ 180 secondes d'électrolyse, des stries brun clair apparaissent à la surface. Parallèlement, lorsque le temps d'électrolyse dépasse 60 secondes, les propriétés électriques se détériorent également. Les résultats expérimentaux obtenus selon l'équation (2-1) sont illustrés à la figure 2-9. Au fur et à mesure que le temps d'électrolyse augmente, la valeur △ diminue.
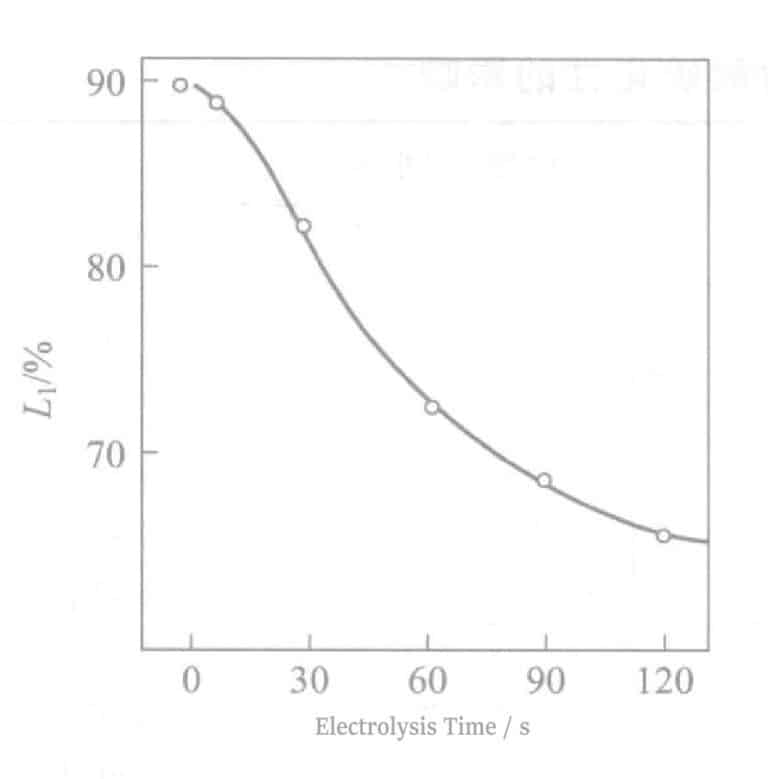
Figure 2-8 Relation entre la réflectivité et le temps d'électrolyse
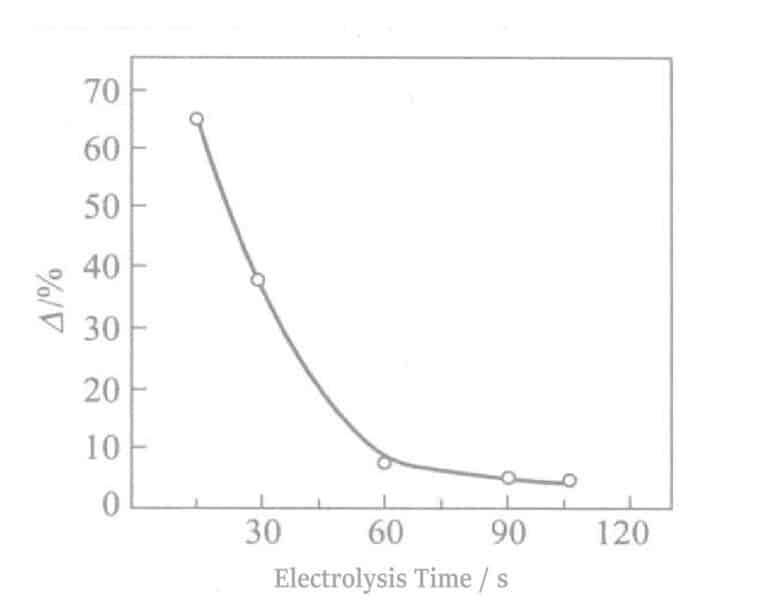
Figure 2-9 Temps d'électrolyse et résistance à la décoloration
(4) Épaisseur du film d'étain électrolytique et électrolyse
Compte tenu de l'efficacité du courant cathodique selon la loi de Faraday, la relation entre le temps d'électrolyse et l'épaisseur du film est illustrée à la figure 2-10. L'épaisseur de l'étain est d'environ quelques dizaines d'angströms.
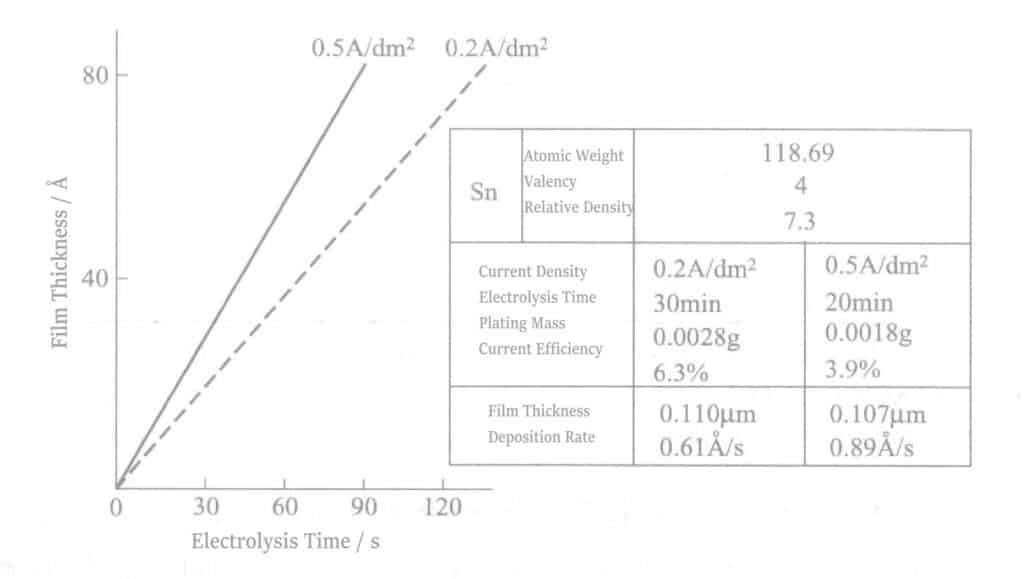
(5) L'influence des impuretés
Les effets des impuretés possibles (CN, Ag, Cu, Ni, etc.) qui peuvent être mélangées à l'électrolyte dans le tableau 2-36 sur l'apparence et la résistance au sulfure de la membrane électrolytique ont été confirmés par des expériences. Les résultats sont présentés dans le tableau 2-37.
Tableau 2-37 Effet des impuretés sur la résistance au soufre
| Impuretés | Concentration/×10-6 | Temps d'électrolyse /s | ||
|---|---|---|---|---|
| 30 | 60 | 120 | ||
| Aucun | 0 | O | O | △(blanc) |
| CN |
20 200 2000 20000 |
O O O △,white |
O △,white △,white △,white |
△,white △,white △,white △,white |
| Ag |
20 50 100 150 200 400 |
O O △ X X X |
O △,red X, rouge-noir X, rouge-noir X, rouge-noir X, noir |
△,red △, rouge-noir X, rouge-noir X, rouge-noir X, noir X, noir |
| Cu |
20 200 300 400 500 600 1000 |
O O O △,red △,red x,red x,red |
O O △,white △,red X,red X,red X,red |
△,white △,white △,red △,red X,red X,red X,red |
| Ni |
20 200 1000 |
O O O |
O O O |
O O O |
|
Note : 1. composés utilisés : CN-NaCN;Ag-KAg(CN)2;Cu-KCu(CN)2; Ni-Ni (CN)2 - 2KCN - 2H2O. 2. Degré de changement de couleur : ○ pas de changement d'aspect ; △ léger changement de couleur ; × changement de couleur.
|
||||
(6) Électrolyse du chromate
Outre le chromate, les sels inorganiques présents dans l'électrolyte, tels que (Na2LE CO2KCN, KI, Na2S2O3etc.), sont utilisées comme additifs. Ces solutions aqueuses sont depuis longtemps considérées comme des agents anti-ternissement pour l'argent. La composition de base de l'électrolyte est indiquée dans le tableau 2-38.
Tableau 2-38 Conditions du procédé d'électrolyse du chrome
| Composition de l'électrolyte |
K2 CrO4 15 g/L NaOH 30g/L |
| Utilisé après 30 heures de chauffage et de maturation | |
| Conditions de traitement |
Tension 6V (2 〜 6V) Durée de l'électrolyse 15s (60s) Température 20℃ Matériau de l'anode Plaque d'acier inoxydable |
(7) Relation entre la réflectivité et le temps d'électrolyse
La relation entre la réflectivité à une tension de 2~6V et le temps d'électrolyse est illustrée à la figure 2-11. Au fur et à mesure que la tension augmente, l'épaisseur du film de Cr augmente tandis que la réflectivité diminue. Contrairement au cas de l'électrolyte Sn, dans les mêmes conditions de tension, l'augmentation du temps d'électrolyse n'affecte pas la réflectivité.
7. Relation entre la réflectivité et le temps d'électrolyse
La relation entre la réflectivité à une tension de 2~6V et le temps d'électrolyse est illustrée à la figure 2-11. Au fur et à mesure que la tension augmente, l'épaisseur du film de Cr augmente tandis que la réflectivité diminue. Contrairement au cas de l'électrolyte Sn, dans les mêmes conditions de tension, l'augmentation du temps d'électrolyse n'affecte pas la réflectivité.
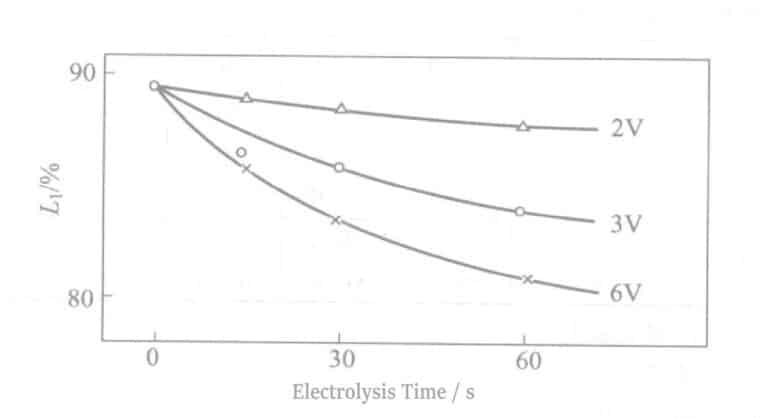
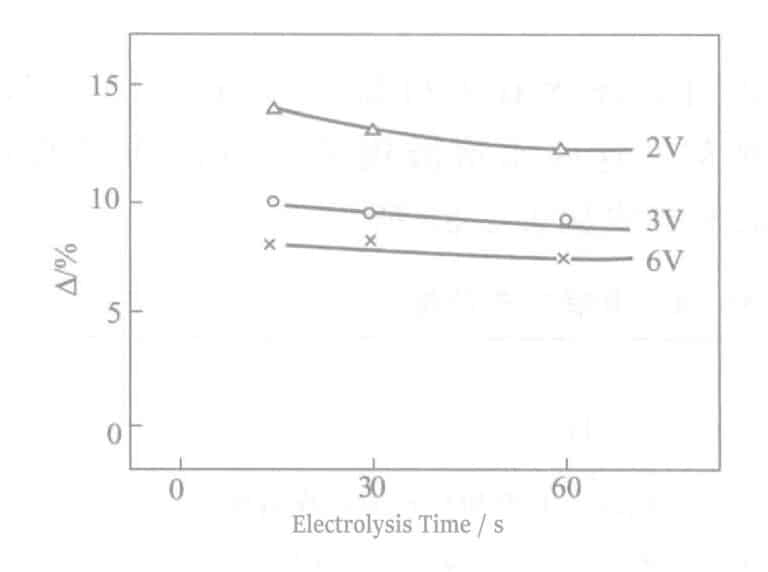
(8) Résistance aux sulfures
La comparaison △ des résultats dans les conditions de trempage dans 0,2% (NH4)2Sx La figure 2-12 présente les résultats de l'application d'une solution d'oxyde de chrome pendant 2 heures. Plus la tension est élevée, meilleure est la résistance au soufre, principalement en raison de l'épaississement du film d'oxyde de chrome. Si le temps d'électrolyse est prolongé sans amélioration, c'est qu'il y a trop de trous d'épingle dans le film électrolytique, ce qui entraîne une augmentation de l'acide chromique mélangé dans les trous d'épingle.
(9) Décoloration causée par la lumière ultraviolette
Les résultats de la décoloration et de la résistance au soufre des films électrodéposés au Cr causés par l'irradiation ultraviolette sont indiqués dans le tableau 2-39 (conditions d'électrodéposition du Cr : 6V, 30s). Après l'irradiation aux ultraviolets, le film de Cr électrodéposé est complètement endommagé, devenant rouge-violet et bleu-violet. Dans le même temps, la résistance au soufre diminue fortement, tombant au même niveau que sans traitement anti-décoloration. Il y a peu de différence entre les échantillons traités contre la décoloration et ceux exposés à la lumière du soleil en raison de la différence d'intensité des ultraviolets par rapport aux expériences générales d'irradiation aux ultraviolets.
Tableau 2-39 Changement de couleur causé par l'irradiation ultraviolette
| Numéro de série | Ultraviolet | L1/% | L2/% | L3/% | △1/% | △2/% | Remarques | |
|---|---|---|---|---|---|---|---|---|
| 1 | - | - | 86. 3 | - | 84. 8 | 0 | 1.5 | (Devient jaune) |
|
2 3 4 |
UV① |
0.5 1 3 |
86. 0 86. 2 86. 5 |
86. 0 83. 2 58〜65 |
67 53 - |
0 3 21〜28 |
19 33 - |
Bleu - Violet |
|
5 6 |
Lumière du soleil② |
3 6 |
86.6 86.4 |
86.6 86.4 |
85.6 85.5 |
0 0 |
0.8 0.9 |
(Devient jaune) - |
|
① Le brillancemètre photoélectrique utilise un tube à décharge d'hydrogène. ② Exposition à l'extérieur pendant la journée : L1 -- Réflexion avant irradiation ; L2 -- Réflexion après irradiation ; L3 -- Réflectance après trempage dans 0. 2% (NH4 )2 Sx pendant 30 minutes après l'irradiation. △1 =L1 - L2 △2 =L1 - L3
|
||||||||
Copywrite @ Sobling.Jewelry - Fabricant de bijoux sur mesure, usine de bijoux OEM et ODM
(10) L'impact des impuretés
Les résultats des tests sur les effets des impuretés dans la composition de base sont présentés dans le tableau 2-40.
Tableau 2-40 Effets des impuretés
| Impuretés | Concentration /×10-6 | Apparence |
|---|---|---|
| CN |
200 400 600 800 1000
|
O O O O O |
| Ag |
10 20 30 40 50 |
O O O X(noir) X(noir) |
| Sn |
200 400 600 800 1000
|
O O O O O |
(11) Sn Traitement électrolytique Plus Cr Résistance au soufre pendant le traitement électrolytique
Les méthodes présentées ci-dessus ont chacune des avantages et des inconvénients et ne peuvent être considérées comme des méthodes anti-décoloration complètes. Par conséquent, l'approche suivante est envisagée : effectuer immédiatement un traitement électrolytique de Sn après le placage d'Ag, suivi d'un traitement électrolytique de Cr.
Dans des conditions de courant constant ( DK = 0,5A/dm2 ), le temps d'électrolyse du Sn a été modifié et, au cours du traitement électrolytique ultérieur du Cr, sa tension et son temps d'électrolyse ont été modifiés. Les résultats sont présentés à la figure 2-13. La réduction de la réflectivité dans chaque condition est causée par des changements dans le temps d'électrolyse du Sn. Le temps d'électrolyse doit être maintenu dans les 30 secondes pour conserver la teinte argentée.
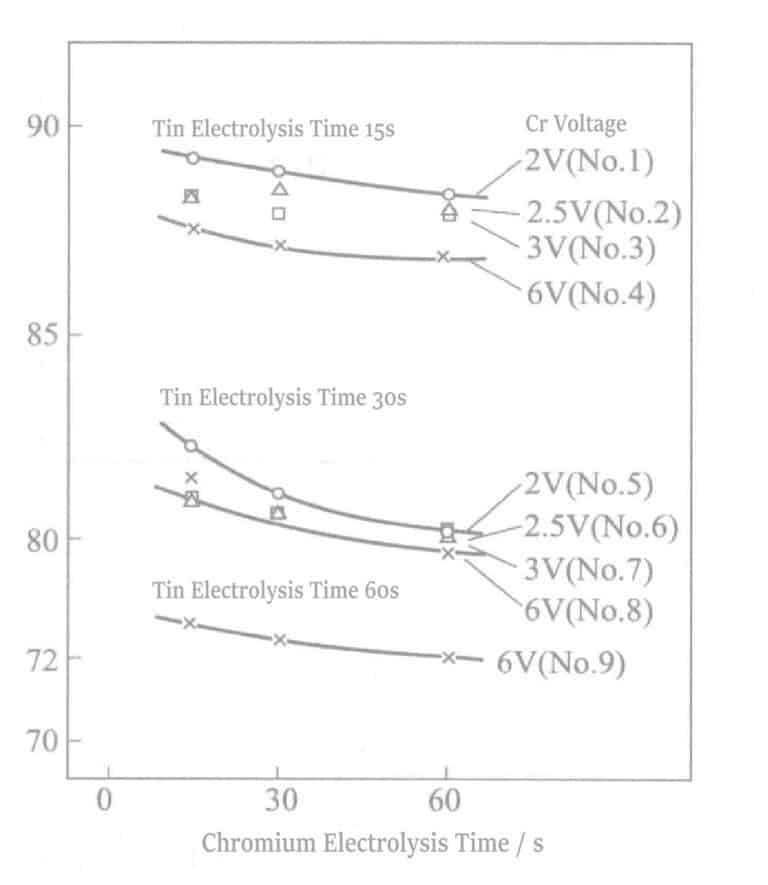
Dans le même état de temps de traitement par électrolyse Sn, l'allongement du temps d'électrolyse Cr fait apparaître la couleur du Cr sous-jacent Sn, ce qui donne un état blanc ou gris inégal. En même temps, lorsque l'électrolyse du Cr est à haute tension (6V), ce phénomène apparaît plus tôt ; à 6V, il peut être observé en 5 secondes, alors qu'à 2V, il peut durer plus de 60 secondes. L'allongement du temps d'électrolyse Sn montre la même tendance. Plus le temps d'électrolyse est long, plus le blanchiment est probable.
Ce phénomène apparaît lorsque la charge transmise pendant le traitement au Cr d'une certaine couche de Sn électrodéposée atteint une certaine valeur. La réaction d'oxydoréduction pendant l'électrodéposition de Cr joue un certain rôle sur la couche électrodéposée de Sn, provoquant des changements dans la morphologie de cristallisation de Sn ou des changements dans le contraste entre la couche électrodéposée de Sn et la couche électrodéposée de Cr.
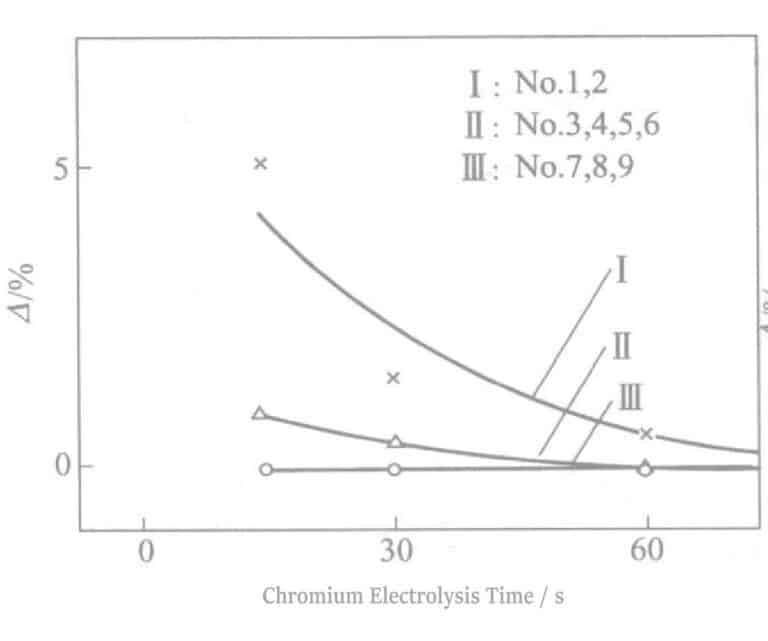
Si aucun changement de couleur ne se produit, cela est lié à l'allongement du temps d'électrolyse de Sn. Le temps d'électrolyse est de 15~30s+ le temps d'électrolyse supérieur à 30 secondes a une bonne résistance au soufre, mais il y aura des problèmes d'apparence. La combinaison de l'électrolyse Sn à 0,5A/dm2 pendant 15~30s, plus l'électrolyse du Cr à 2~3V pendant 30s était la condition optimale.
Les résultats de l'essai d'exposition à l'intérieur sont présentés dans la figure 2-15. Jaunissement après 1~2d pour les pièces non traitées et 7~10d pour le traitement électrolytique au Cr. En revanche, les pièces traitées par électrolyse Sn suivie d'une électrolyse Cr n'ont commencé à devenir partiellement grises qu'après 60~100 jours, ce qui montre une bonne efficacité. Le trempage a été effectué à l'aide d'une solution de 0,2% (NH4)2Sx équivalent à un mois d'essais d'exposition en intérieur. Le traitement par électrolyse du Sn suivi du traitement au Cr est abrégé en SGP (Silver Guard Process).
① Effet de divers sels d'étain sur la résistance au soufre
Les résultats des essais sur les effets de divers activateurs de surface à base de sels d'étain dans la méthode SGP sont présentés dans le tableau 2-41 et la figure 2-16.
Tableau 2-41 Comparaison des effets de divers sels d'étain
| Numéro de série | Composition et conditions de traitement | Sn Temps d'électrolyse /s | Cr Temps d'électrolyse/s | L1/% | △/% | Remarques |
|---|---|---|---|---|---|---|
| 1 |
SnCl2 4g/L HCl 0,025mol/L (immersion) |
13 30 60 |
15 |
90. 2 89. 8 89. 2 |
5. 4 4. 8 5. 8 |
Jaunissement Jaunissement Jaunissement |
| 2 |
Na2SnO3 -3H2O 8. 5g/L CH3COONa-3H2O 5g/L 3. 5V(0. 1A/dm2) |
15 30 60 |
15 |
89. 7 87. 3 85. 2 |
0. 7 0. 1 0
|
Jaunissement partiel - Couleur étain |
| 3 |
No. 2 plus Peretekkusu# 1232① 0. 1g/L 3. 5V (0. 15A/dm2) |
15 30 60 |
15 |
87. 4 85.0 76. 6
|
0 0. 1 0 |
- - Couleur étain |
| 4 |
K2SnO3-3H2O 8. 5g/L CH3COONa-3H2O 5g/L 3. 5V (0. 1A/dm2) |
15 30 60 |
15 |
89. 6 88. 9 85. 4 |
0. 9 0 0 |
Jaunissement partiel - Couleur étain |
|
① Peretekkusu# 1232 est un produit de Miyoshi Oil & Fat au Japon. Note : Cr électrolyte 3 V.
|
||||||
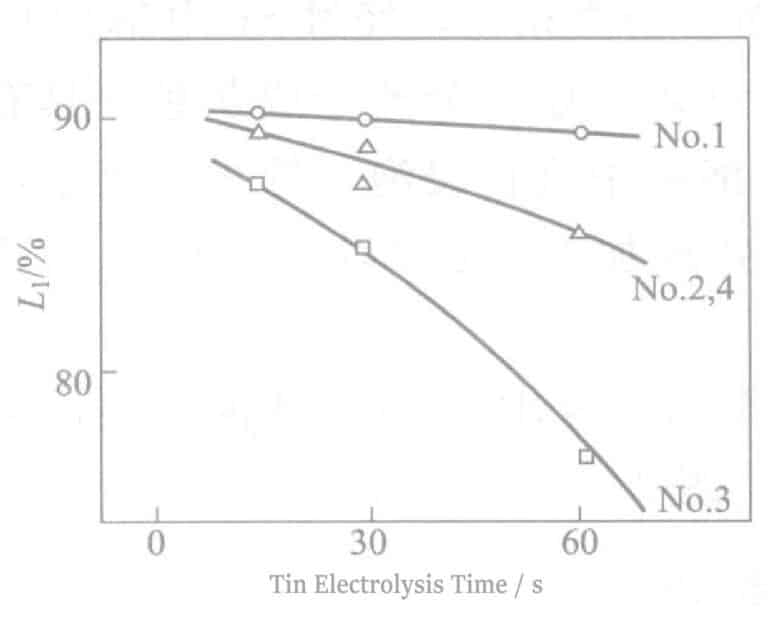
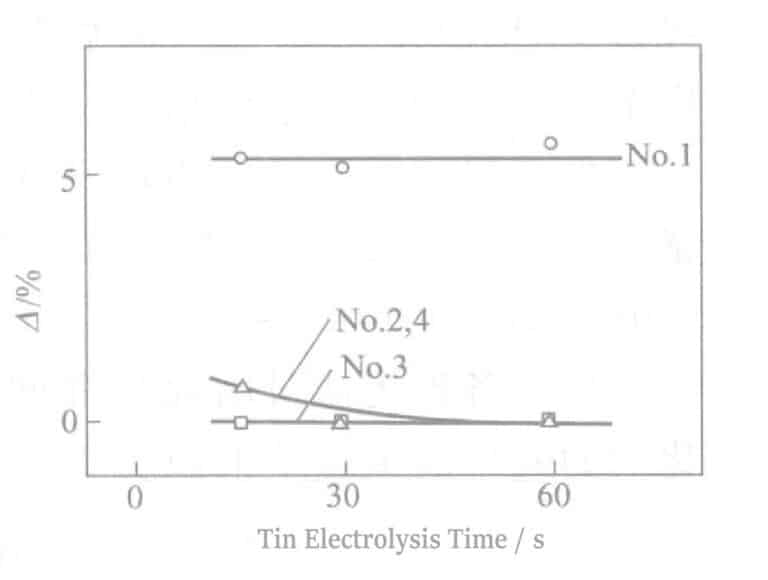
L'ajout d'un tensioactif non ionique (n° 3) à l'électrolyte de stannate de sodium améliore considérablement l'efficacité du courant, accélère la vitesse d'électrolyse (n° 2), réduit la réflectivité et améliore la résistance au soufre.
Bien que les résultats de l'électrolyte de stannate de potassium (n° 4) soient les mêmes que ceux de l'électrolyte de stannate de sodium, il existe certaines différences entre les effets des sels de sodium et des sels de potassium dans les solutions alcalines d'étamage.
② L'effet de l'électrolyte chromé sur la résistance au soufre a été principalement étudiée sous des aspects tels que la concentration de l'électrolyte, l'effet des tensioactifs et l'influence de la densité de courant sur l'aspect après traitement.
Tableau 2-42 Effet de la concentration sur la résistance au soufre
| Concentration /(g/L) | Temps d'électrolyse /s | Valeur du courant à tension constante (6V)/A | ||
|---|---|---|---|---|
| 5 | 15 | 30 | ||
|
K2CrO4 15 NaOH 30 |
X | X | X |
4. 0 (40A/dm2) |
|
K2CrO4 7.5 NaOH 15 |
O | X | X |
2.4 (24A/dm2) |
|
K2CrO4 1.5 NaOH 3.0 |
O | O | X |
0.6 (6A/dm2) |
|
Note : O indique qu'il n'y a pas de changement d'apparence ; × indique un changement d'apparence (blanchiment).
|
||||
- Effet de la concentration : La solution standard a été diluée à 1/2, 1/10, et le temps d'électrolyse à partir duquel une couleur d'étain apparaît pendant l'électrolyse à 6 V a été étudié. Les résultats sont présentés dans le tableau 2-42.
- Effet des agents de surface : Des solutions standard de tensioactif (Perettekusu#1265, un produit de Miyo-shi Oils and Fats Co., Ltd., Japon) ont été ajoutées au tensioactif ionique à des concentrations de 1/1 et 1/2, et le temps d'électrolyse a été étudié au moment où il a commencé à montrer une couleur d'étain. Les résultats sont présentés dans le tableau 2-43. Par rapport à l'absence d'ajout, l'effet était meilleur à une densité de courant élevée lorsque des agents tensioactifs étaient ajoutés. À faible densité de courant, il y avait peu de différence avec le cas sans ajout, mais le gaz entravait la progression de l'électrolyse. En présence de tensioactifs, leur concentration et la densité de courant affectaient le temps de démarrage du blanchiment, ce qui augmentait les difficultés de gestion. En même temps, des bulles ont été produites en raison de la grande quantité d'hydrogène générée. Il était plus facile de gérer sans ajout.
Tableau 2-43 Effets des agents de surface
| Concentration/(g/L) | Perettekusu# 1265/(mL/L) | Tension/V | DK/(A/dm2 | Temps d'électrolyse/s | ||
|---|---|---|---|---|---|---|
| 5 | 10 | 15 | ||||
|
K2CrO4 15 NaOH 30
|
0 |
6 5 6 3 |
40 29 19 7 |
X X X X |
X X X X |
X X X X |
| 0.01 |
6 5 6 3 |
40 29 19 7 |
O O O O |
X X O O |
X X X X |
|
| 0.1 |
6 5 6 3 |
40 29 19 7 |
O O O O |
O O O X |
X X X X |
|
| 1 | 6 | 40 | O | X | X | |
|
K2CrO4 7.5 NaOH 15
|
0 |
6 5 6 3 |
24 17 10 3 |
X X X O |
X X X O |
X X X X |
| 0.01 |
6 5 6 3 |
24 17 10 3 |
O O O O |
O O X X |
X X X X |
|
- Influence du courant : Densité Le moment où la couleur de l'étain apparaît pour la première fois à différentes densités de courant pendant l'électrolyse est indiqué dans la figure 2-18. Parallèlement, la courbe E-I est illustrée à la figure 2-19. La densité de courant est plus appropriée lorsque le temps d'électrolyse est de 0,5A/dm2 et de 30 secondes environ. Par ailleurs, le temps sans apparition de la couleur de l'étain est également affecté par la concentration de l'électrolyte, la densité de courant de l'anode, l'espacement des électrodes et d'autres facteurs. La gestion de la concentration se fait en calculant la taille du réservoir, et il est possible de dériver la puissance intrinsèque du réservoir qui n'apparaît pas en couleur d'étain à une certaine tension, pour faciliter la gestion.
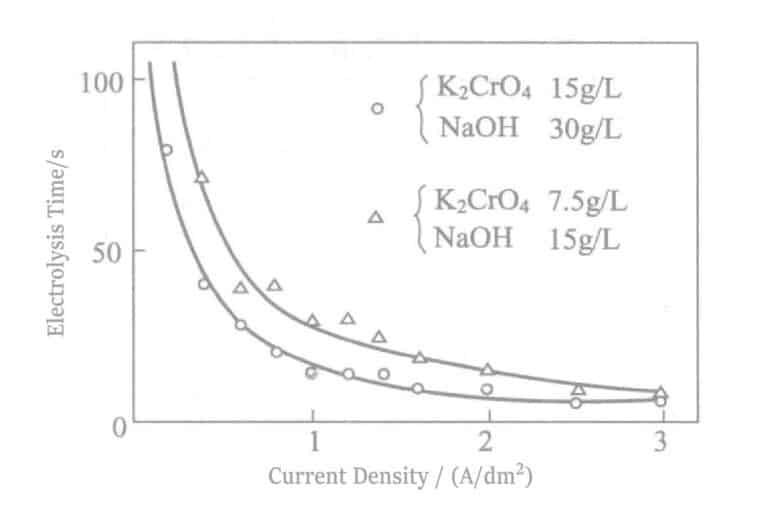
Figure 2-18 Relation entre la densité de courant et le temps d'électrolyse
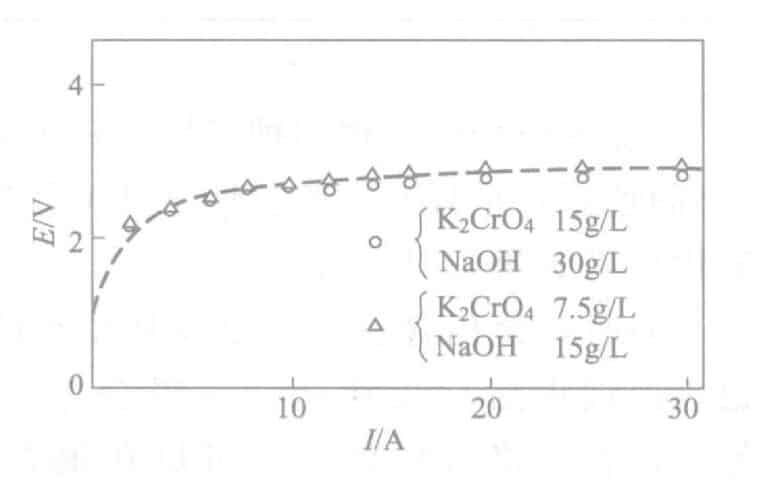
Figure 2-19 Courbe E-I de la solution d'électrolyte
Figure 2-20 Processus de traitement de l'électrolyte au chrome

Figure 2-21 Comparaison de la résistance au soufre de diverses méthodes de traitement
Par ailleurs, l'utilisation de détergents (surfactants) contenant de l'α-dicétone et ses sels pour laver ou tremper l'argent (ou les articles plaqués argent) et ses alliages (alliage d'étain, alliage de zinc, alliage d'indium, alliage de palladium, etc.) peut grandement inhiber la décoloration ou la corrosion de la surface.
La structure de base de son additif est illustrée à la figure 2-22.
Tableau 2-44 Exemples de formulation de tensioactifs Diketo pour la prévention du ternissement de l'argent
| Composition | N° 1 | N° 2 | N° 3 | N° 4 | N° 5 | N° 6 | N° 7 | N° 8 |
|---|---|---|---|---|---|---|---|---|
| Acide chlorovanillique | 10 | |||||||
| Polyoxyéthylène-éther d'alkyle | 0.5 | |||||||
| Dihydrogénophosphate de sodium | 5 | |||||||
| Polyéthylène glycol | 1 | |||||||
| Trétinoïne | 5 | |||||||
| Chlorure de pyrazole | 5 | |||||||
| Bicarbonate de sodium | 5 | |||||||
| Protéase | 1 | |||||||
| Iodure de potassium | 0.05 | |||||||
| Tétrahydroxy-1,4-benzoquinone | 0.5 | |||||||
| 2-Alkyl-N-carboxyméthyl-N-hydroxyméthylimidazoline | 10 | |||||||
| Thiourée | 0.5 | |||||||
| Glycérol | 1 | |||||||
| 3-éthyl-2-hydroxy-2-cyclopentane-1-carboxylate de sodium | 0.05 | |||||||
| Sulfonate d'alkyle de potassium | 5 | |||||||
| Sel d'isocyanuron | 5 | |||||||
| Amines N-acylées | 1 | |||||||
| 3-Hydroxy-2-methyl-4-pyrone | 20 | |||||||
| Acide citrique | 5 | |||||||
| Benzoate de sodium | 5 | |||||||
| Menthol | 0.1 | |||||||
| Acide rosmarinique de calcium | 2 | |||||||
| 3-Méthyl-1,2-Cyclopentanaminium | 20 | |||||||
| Huile de ricin polyoxyéthylénée | 5 | |||||||
| Glycosides stéroïdiens | 1 | |||||||
| 3-Hydroxy-1,2-diméthyl-4(1H)-pyridine | 6 | |||||||
| Mercaptoalanine | 2 | |||||||
| Glucoamylase | 5 | |||||||
| Sorbitol | 1 | |||||||
| 2,5-Dihydroxy-1,4-benzoquinone | 10 | |||||||
| Chlorure d'alkyl benzyl ammonium | 30 | |||||||
| Tartrate de potassium et de sodium | 5 | |||||||
| Papaïne | 1 |
Section II Argent chimique
L'argent ayant une faible résistivité et étant beaucoup moins cher que d'autres métaux précieux, l'argenture est largement utilisée dans le domaine de l'électronique.
En tant que métal précieux, l'argent a un potentiel d'oxydoréduction plus positif que les autres métaux, ce qui lui permet d'être déplacé et déposé sur des métaux tels que le cuivre, le fer et le zinc, formant ainsi une couche d'argent sur ces métaux. Il sera mentionné plus loin que ce type de réaction est utilisé sur les cartes de circuits imprimés pour remplacer le cuivre par de l'argent afin que le motif en cuivre soit recouvert d'une couche d'argent, augmentant ainsi la soudabilité et réduisant la résistance de contact. Cependant, ce dépôt par déplacement permet généralement d'obtenir une couche de placage relativement fine, d'environ 2μm ou moins. En revanche, la couche de placage obtenue par une réaction de réduction peut être un peu plus épaisse.
Dans l'application de l'argenture, la plus connue devrait être la réaction du miroir d'argent. Cette réaction a été mise au point par Drayton en 1830 et a été appliquée à l'industrie de fabrication des miroirs. En outre, l'argenture chimique (en particulier l'argenture par réduction) est largement utilisée dans l'électronique, ce qui élargit les applications industrielles de l'argenture. L'argenture chimique peut être appliquée non seulement aux métaux, mais aussi aux non-métaux.
1. Déplacement de l'argenture et ses applications
L'argenture par déplacement utilise la différence de potentiel entre le métal de base et l'argent.
Les motifs des conducteurs sur les cartes de circuits imprimés sont généralement en cuivre, mais pendant le stockage, avant le montage des composants, un film d'oxyde se forme sur la surface du cuivre. Ce film d'oxyde affecte la soudabilité du circuit imprimé. Des produits haut de gamme ou même des revêtements Ni/Au, Ni/Pd, Ni/Pa/Au sont généralement utilisés pour améliorer la capacité de brasage des circuits en cuivre, ce qui augmente naturellement le coût. Cependant, le placage Sn n'offre pas une résistance suffisante à la rouille. Le placage d'argent a un prix proche de celui du Sn et non seulement il empêche la rouille et convient au brasage, mais il peut également être utilisé pour les connexions de fils métalliques, ce qui signifie que l'argent peut être déplacé sur les circuits en cuivre. Cependant, l'épaisseur doit être augmentée pour compenser le placage d'argent directement sur le cuivre en raison d'un placage inégal. Le placage échoue alors au test du ruban, le placage s'écaillant facilement, en particulier après stockage. Toutefois, ce problème peut être résolu par une métallisation en deux étapes. La méthode consiste à déposer d'abord une couche de métal, plus chère que le cuivre, sur le cuivre, puis à déposer une couche d'argent. La première couche de métal peut être du Pd ou de l'Ag. L'épaisseur est si fine, de l'ordre du nanomètre (c'est-à-dire quelques nanomètres d'épaisseur), que la présence du placage n'est pas perceptible à l'œil nu. La réaction de déplacement est la suivante :
La solution de déplacement de l'argent doit également contenir un agent complexant pour le cuivre monovalent afin de stabiliser les ions de cuivre déplacés. Lorsque le premier revêtement est un déplacement d'argent, sa vitesse de déplacement doit être beaucoup plus lente que celle de la deuxième couche de placage d'argent, équivalente à moins de 15% de sa vitesse. Si elle est trop rapide, il est facile de provoquer une diminution de l'adhérence du revêtement, ce qui entraîne un décollement du revêtement pendant le test du ruban. Voici un exemple de placage d'argent.
Lorsque la première couche de placage est du Pd, la solution de placage de Pd est la suivante
PdSO4 50mg/L (comptabilisé en tant que Pd)
H2SO4 5%
Température Température ambiante
Temps Vers 30 ans
Tableau 2-45 Composition et procédé de placage d'argent par déplacement (première couche de placage)
| Conditions de composition et de procédé | Formulation et composants | Conditions de composition et de procédé | Formulation et composants |
|---|---|---|---|
| Méthanesulfonate d'argent (en tant qu'Ag) | 1 g/L | Lurotex A25 | 20mg/L |
| NaBr | 320g/L | pH | 5.5 |
| Acide diéthylènetriamine pentylènephosphonique | 30mL/L | Température | 50℃ |
| Polyéthylène glycol 400 | 80mL/L | L'heure | 5 min |
| 2,2'-Bipyridine | 90mg/L |
Après le placage, les pièces plaquées subissent un traitement thermique à 150℃ pendant 4 heures, suivi d'un test de mouillabilité, qui est qualifié.
Lorsque la première couche de placage est de l'Ag, la solution de placage et son processus sont indiqués dans le tableau 2-46.
Tableau 2-46 Composition et procédé d'argenture par déplacement (deuxième couche)
| Conditions de composition et de procédé | Formulation et composants | Conditions de composition et de procédé | Formulation et composants |
|---|---|---|---|
| Méthanesulfonate d'argent (en tant qu'Ag) | 1 g/L | Polyéthylène glycol 400 | 80mL/L |
| NaBr | 320g/L | 2,2'-Bipyridine | 90mg/L |
| Acide diéthylènetriamine pentylènephosphonique | 30mL/L | pH | 5.5 |
La solution de placage pour la première et la deuxième couche de placage peut avoir la même composition, mais la température et le temps d'immersion diffèrent. Les conditions pour la première couche de placage sont les suivantes : 25℃, 30s. Les conditions pour la deuxième couche de placage sont les suivantes : 50℃, 6min. Les couches de placage résultantes sont uniformes, brillantes comme de l'argent et ont une bonne soudabilité.
Hutchinson et al. ont proposé une méthode de solution de placage utilisant l'éther de polyéthylène glycol alkyle comme agent de blanchiment, l'éthylènediamine et l'acide 1-hydroxyéthylène-1,1-diphosphonique comme agents complexants du cuivre, et la couche de placage obtenue peut répondre aux conditions de brasage des cartes de circuits imprimés.
L'ITO (oxyde d'indium-étain transparent) est largement utilisé dans les écrans à cristaux liquides et à plasma. La taille des écrans à cristaux liquides et des écrans plasma ayant augmenté ces dernières années, la résistance de l'ITO lui-même est devenue relativement élevée. Pour résoudre ce problème, une couche d'argent moins conductrice peut être ajoutée à l'ITO. Cette opération ne peut pas être réalisée par électrodéposition d'argent directement, car il est difficile de déposer directement des métaux catalytiquement actifs sur l'ITO. Par conséquent, une couche d'étain est d'abord déposée sur l'ITO, suivie d'un dépôt de métal catalytiquement actif et, enfin, d'un dépôt d'argent. La composition de la solution de placage et les conditions de traitement pour le placage d'argent sur l'ITO sont indiquées dans le tableau 2-47.
Tableau 2-47 Composition de la solution de placage et conditions de traitement pour le placage d'argent sur ITO
| Liquide d'étain d'immersion |
SnCl2 HCl
|
70g/L 230mL/L |
| Fluide d'activation | AgNO3 | 10 g/L |
| Solution d'argenture |
AgNO3 NH4OH (NH4)2SO4 Co(SO4)2 Mg(OH)2 Épaisseur de l'argent Résistance spécifique Résistance spécifique (250℃, 30min après le traitement) |
0. 03〜0. 08mol/L 7〜10mol/L 0. 3〜0. 8mol/L 0. 1〜0. 2mol/L 0. 01〜0. 05mol/L 2900〜3200Å 3〜3. 5μΩ- cm 1. 6〜2. 5μΩ- cm |
2. Réduction de l'argenture et ses applications
La composition de la solution d'argenture par réduction est similaire à celle de l'argenture chimique générale, les principaux composants étant les suivants : sel d'Ag, agent complexant, agent réducteur, ajusteur de pH, stabilisateur, etc : Sel d'Ag, agent complexant, agent réducteur, ajusteur de pH, stabilisateur, etc. Les agents réducteurs de l'argent comprennent le glucose, la saccharine, le glyoxal, l'acide ascorbique, l'acide gluconique, le sorbitol, l'hydrazine, HCHO, KBH4, NaBH4DMAB et autres.
Les réactions de certains agents réducteurs d'argent représentatifs sont les suivantes.
(1) HCHO (en cas d'utilisation d'une solution d'ammoniac comme agent complexant)
2AgNO3 + 2NH4OH → Ag2O + 2NH4NON3 + H2O
Ag2O + 4NH4OH → 2[Ag(NH3)2OH + 3H2O
2[Ag(NH3)2OH + HCHO → 2Ag + 4NH3 + HCOOH + H2O
4AgNO3 + 4NH3 + C4H4O6NaK + H2O → 4Ag + 4NH4NON3 + C3H2O6NaK + CO2
4[Ag(NH3)2]NON3 + N2H4 → 4Ag + 4NH4NON3 + 4NH3 + N2
N2H4BH3 + 3Ag+ + 4OH– → 3Ag + N2H4 + B(OH)4–+ 3/2H2
Tableau 2-48 Formulations utilisant des solvants organiques pour l'argenture chimique
| Ingrédients et leurs conditions de traitement | N° 1 | N° 2 |
|---|---|---|
|
Sulfoxyde de diméthyle/mL Éthylène glycol/ml Éthanol/mL d-(+)Glucose/mL Triéthylamine/mL Température/°C Temps/min Matériaux de placage |
300 200 - - 15 70 20 Al2O3 poudre |
200 - 300 5g 2. 5mL/min 60 10 Tissu en nylon
|
Parmi eux, les diols et le glucose sont utilisés comme agents réducteurs. En même temps, comme le sulfoxyde de diméthyle a une légère capacité de réduction, la solution de placage ne nécessite pas de traitement de vieillissement. Les pièces plaquées qui en résultent ont un éclat métallique de type argenté.
Les composés organiques contenant deux groupes monothiol sont utilisés comme agents complexants, avec la formule structurelle suivante :
Dans la formule, R1 et R2 sont des groupes alkylènes contenant de 1 à 5 atomes de carbone ; R3 sont des groupes d'alkylène contenant de 2 à 8 atomes de carbone X et Y peuvent être des groupes carboxyle, acide sulfonique, amino, alkyle, etc.
Les agents réducteurs comprennent les aldéhydes, les hydrazines, les composés borohydriques, l'acide ascorbique, etc. Le tableau 2-49 présente des exemples d'utilisation de cette série.
Tableau 2-49 Conditions de traitement de la solution de placage par réduction de l'argent utilisant deux composés organiques monothiol comme agents complexants
| Composition et conditions de traitement | N° 1 | N° 2 | N° 3 |
|---|---|---|---|
|
Nitrate d'argent/(g/L) 1,2-Bis(2-carboxyéthylthio)éthane/(g/L) 1,4-bis(2-carboxyéthylthio)butane/(g/L) 1,2,2'-(Ethylthio)diéthyl mercaptan/(g/L) Hydrate d'hydrazine/(g/L) Formaline/(g/L) Hypophosphite de sodium/(g/L) pH (ajusté avec NaOH) Température/°C |
0. 17 10 - - 8 - - 10 35 |
0. 31 - 15 - - 4 - 11 50 |
0. 34 - - 20 - - 10 10. 5 50 |
Section III Analyse de la solution de cyanure pour l'argenture
1. Analyse de l'argent
Tableau 2-50 Méthode d'analyse des ions argent pour la solution d'argenture
| Séquence d'opérations | Notes et instructions |
|---|---|
|
(1) Prélever 5 ml de solution de placage dans un bécher de 300 ml, ajouter 20 ml d'acide sulfurique et 5 ml d'acide nitrique tout en observant. (2) Chauffer jusqu'à l'obtention d'une fumée blanche (3) Ajouter 100 ml d'eau et 3 ml de sulfate de fer ammoniacal 10%. (4) Titrer avec 0,1mol/L de thiocyanate de potassium. Formule de calcul : Ag(g/L) = mL × 2. 158× f AgCN(g/L) = Ag(g/L) ×1. 2402 Dans la formule, mL--0. Titre de 1mol/L de thiocyanate de potassium ; f--0. Coefficient de la solution de thiocyanate de potassium 1mol/L |
En raison de la production de cyanure d'hydrogène toxique, il est nécessaire d'opérer dans une zone de ventilation locale. Passage de la fumée brune à la fumée blanche Point final du titrage : couleur rouge clair 0. 1mol/L KCNS 1mL = 0,01079g Ag |
2. Méthodes d'analyse du cyanure libre
Tableau 2-51 Méthodes d'analyse du cyanure libre
| Séquence d'opérations | Notes et instructions |
|---|---|
|
(1) Prélever 5 ml de solution de placage dans un bécher de 300 ml, ajouter 50 ml d'eau. (2) Ajouter la solution d'iodure de potassium 10% 1~2mL (3) Titrer avec une solution de nitrate d'argent de 0,1mol/1. Formule de calcul. KCN libre (g/L) = mL×2,60×f NaCN libre (g/L) = mL×1,96× f Dans la formule, f - coefficient de la solution de nitrate d'argent 0,1mol/L |
Point final du titrage : couleur rouge clair 0. 1mol/L AgNO3 1mL = 0,0130g KCN = 0,0098g NaCN |













Une réponse
Precise & Excellent information