Γιατί οι πολύτιμοι λίθοι έχουν πολλαπλά χρώματα;
Εισαγωγή στη θεωρία του κρυσταλλικού πεδίου & στη θεωρία μοριακών τροχιακών & στη θεωρία ενεργειακών ζωνών
Τα χρώματα των πολύτιμων λίθων είναι πλούσια και ποικίλα, διαθέτοντας μια μοναδική γοητεία που οι άνθρωποι πάντα αγαπούσαν. Η ποιότητα των πολύτιμων λίθων εξαρτάται σε μεγάλο βαθμό από το χρώμα τους. Το χρώμα ενός πολύτιμου λίθου αποτελεί σημαντικό δείκτη στην αξιολόγηση των πολύτιμων λίθων και οι περισσότερες θεραπείες βελτιστοποίησης των πολύτιμων λίθων περιλαμβάνουν την αλλαγή ή τη βελτίωση του χρώματός τους. Ως εκ τούτου, η κατανόηση των αιτιών του χρωματισμού των πολύτιμων λίθων αποτελεί κρίσιμη προϋπόθεση για τη θεραπεία βελτιστοποίησης των πολύτιμων λίθων. Μόνο με την κατάκτηση του τρόπου με τον οποίο οι πολύτιμοι λίθοι αποκτούν το χρώμα τους μπορεί κανείς να καθορίσει αν ένας πολύτιμος λίθος μπορεί να βελτιστοποιηθεί, ποιο σχήμα βελτιστοποίησης πρέπει να υιοθετηθεί και ποιο πειραματικό σχέδιο πρέπει να καταρτιστεί. Υπάρχουν πέντε κοινές θεωρίες για τον χρωματισμό των πολύτιμων λίθων: η κλασική ορυκτολογική θεωρία, η θεωρία του κρυσταλλικού πεδίου, η θεωρία των μοριακών τροχιακών, η θεωρία των ενεργειακών ζωνών και τα φυσικά οπτικά φαινόμενα. Αυτές οι θεωρίες αποτελούν τις θεωρίες χρωματισμού των κοινών φυσικών πολύτιμων λίθων, και στη συνέχεια ακολουθεί μια σύντομη εισαγωγή σε αυτές τις πέντε θεωρίες χρωματισμού.
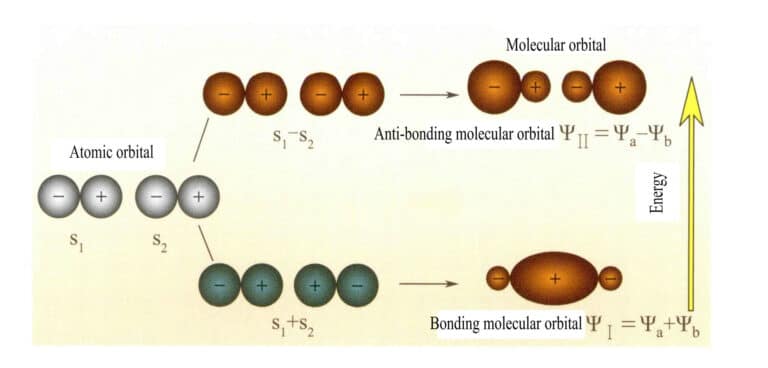
Μοριακά τροχιακά που σχηματίζονται από δύο ατομικά τροχιακά s
Πίνακας περιεχομένων
Ενότητα Ι Θεωρία κρυσταλλικών πεδίων
Τη δεκαετία του 1930 οι επιστήμονες πρότειναν τη θεωρία του κρυσταλλικού πεδίου για να εξηγήσουν τις ιδιότητες των κρυστάλλων. Η θεωρία του κρυσταλλικού πεδίου είναι μια θεωρία που μελετά τους χημικούς δεσμούς των μεταβατικών στοιχείων (σύμπλοκα). Εξηγεί τις φυσικές και χημικές ιδιότητες των στοιχείων μετάπτωσης και των λανθανιδίων συνδυάζοντας ορισμένες απόψεις της ηλεκτροστατικής θεωρίας, της κβαντομηχανικής και της θεωρίας ομάδων (η θεωρία που μελετά τη συμμετρία της ύλης), εστιάζοντας στην επίδραση των ligands στα τροχιακά d και f των κεντρικών ιόντων. Μέχρι τη δεκαετία του 1950, οι άνθρωποι εφάρμοσαν τη θεωρία του κρυσταλλικού πεδίου στα σύμπλοκα και πρότειναν τη θεωρία του πεδίου του ligand. Η θεωρία του πεδίου του ligand αποτελεί εξέλιξη της θεωρίας του κρυσταλλικού πεδίου- λαμβάνει υπόψη τόσο την επίδραση του ηλεκτρικού πεδίου του ligand στο κεντρικό ιόν όσο και την επίδραση πλήρωσης των ηλεκτρονίων του ligand στο κεντρικό ιόν, καθιστώντας την πιο ολοκληρωμένη από τη θεωρία του κρυσταλλικού πεδίου. Ωστόσο, δεν υπάρχει ουσιαστική διαφορά μεταξύ των δύο, και γενικά δεν διακρίνονται στη μελέτη των ανόργανων ορυκτών.
1. Βασικές έννοιες της θεωρίας του κρυσταλλικού πεδίου
Τα ιόντα των μετάλλων μετάπτωσης βρίσκονται στο κρυσταλλικό πεδίο των περιβαλλόντων ανιόντων ή διπολικών μορίων. Η θεωρία του κρυσταλλικού πεδίου είναι ένα ηλεκτροστατικό μοντέλο που θεωρεί τον κρύσταλλο ως μια ηλεκτροστατική αλληλεπίδραση μεταξύ θετικών και αρνητικών ιόντων, όπου το θετικά φορτισμένο κατιόν ονομάζεται κεντρικό ιόν και το αρνητικά φορτισμένο ανιόν ονομάζεται ligand.
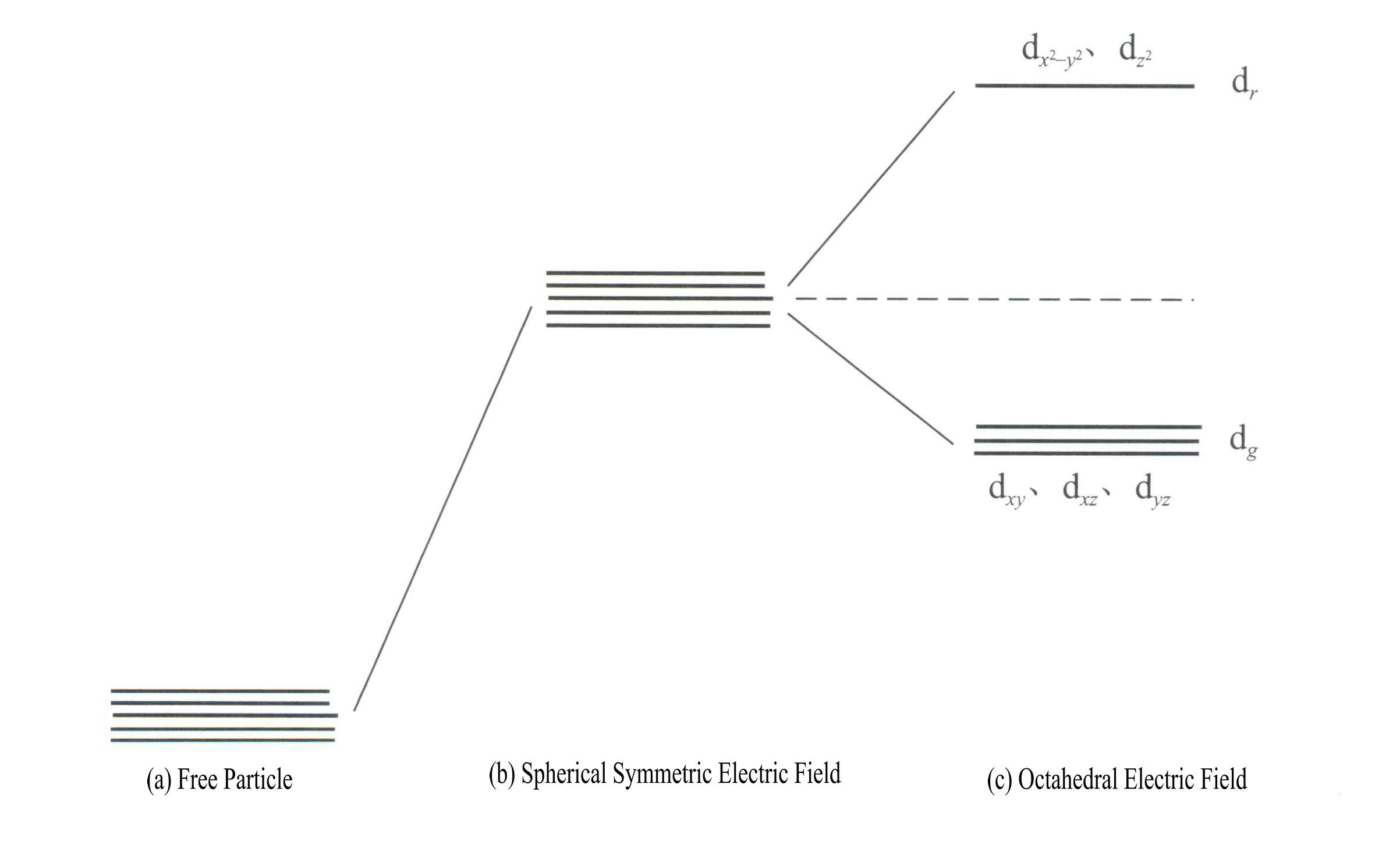
Η εφαρμογή της θεωρίας του κρυσταλλικού πεδίου για την εξήγηση του χρώματος των ορυκτών πολύτιμων λίθων αφορά κυρίως τα ηλεκτρόνια d ή την ενέργεια των ηλεκτρονίων f των ιόντων των μεταβατικών στοιχείων. Για παράδειγμα, τα τροχιακά d έχουν πέντε τύπους: dxy, dxz, dyz, d , και d . Αυτά τα πέντε d τροχιακά έχουν διαφορετικές χωρικές κατανομές στην κατάσταση του ελεύθερου ιόντος, αλλά έχουν την ίδια ενέργεια. Ωστόσο, υφίστανται σημαντικές αλλαγές υπό την επίδραση του πεδίου του ligand. Τα πέντε ενεργειακά εκφυλισμένα d τροχιακά του κεντρικού ατόμου διασπώνται υπό την επίδραση του αρνητικού ηλεκτρικού πεδίου που σχηματίζουν τα περιβάλλοντα ligands. Ορισμένα d τροχιακά έχουν αυξημένη ενέργεια, ενώ άλλα έχουν μειωμένη ενέργεια. Λόγω της διάσπασης των ενεργειακών επιπέδων των d τροχιακών, τα ηλεκτρόνια στα d τροχιακά του κεντρικού ατόμου θα αναδιαταχθούν, καταλαμβάνοντας κατά προτίμηση τα τροχιακά χαμηλότερης ενέργειας, μειώνοντας έτσι τη συνολική ενέργεια του συστήματος και καθιστώντας το σύμπλοκο πιο σταθερό.
Η ενέργεια των d τροχιακών είναι η ίδια όταν δεν υπάρχει ηλεκτρικό πεδίο [Σχήμα 3-19 (α)]- κάτω από ένα σφαιρικά συμμετρικό ηλεκτροστατικό πεδίο, τα d τροχιακά έχουν αυξημένη ενέργεια αλλά δεν διασπώνται [Σχήμα 3-19 (β)]- όταν το πεδίο του ligand είναι οκταεδρικό, διασπώνται σε dr και dg. Από αυτά, dr τα τροχιακά αποτελούνται από d και d , με υψηλότερη ενέργεια- τα χαμηλότερης ενέργειας dg τροχιακά αποτελούνται από dxy, dxz, dyz.
Τα ιόντα των μετάλλων μετάπτωσης βρίσκονται στο κρυσταλλικό πεδίο των περιβαλλόντων ανιόντων ή διπολικών μορίων. Η θεωρία του κρυσταλλικού πεδίου είναι ένα ηλεκτροστατικό μοντέλο που θεωρεί τον κρύσταλλο ως μια ηλεκτροστατική αλληλεπίδραση μεταξύ θετικών και αρνητικών ιόντων, όπου το θετικά φορτισμένο κατιόν ονομάζεται κεντρικό ιόν και το αρνητικά φορτισμένο ανιόν ονομάζεται ligand.
Η εφαρμογή της θεωρίας του κρυσταλλικού πεδίου για την εξήγηση του χρώματος των ορυκτών πολύτιμων λίθων αφορά κυρίως τα ηλεκτρόνια d ή την ενέργεια των ηλεκτρονίων f των ιόντων των μεταβατικών στοιχείων. Για παράδειγμα, τα τροχιακά d έχουν πέντε τύπους: dxy, dxz, dyz, d , και d . Αυτά τα πέντε d τροχιακά έχουν διαφορετικές χωρικές κατανομές στην κατάσταση του ελεύθερου ιόντος, αλλά έχουν την ίδια ενέργεια. Ωστόσο, υφίστανται σημαντικές αλλαγές υπό την επίδραση του πεδίου του ligand. Τα πέντε ενεργειακά εκφυλισμένα d τροχιακά του κεντρικού ατόμου διασπώνται υπό την επίδραση του αρνητικού ηλεκτρικού πεδίου που σχηματίζουν τα περιβάλλοντα ligands. Ορισμένα d τροχιακά έχουν αυξημένη ενέργεια, ενώ άλλα έχουν μειωμένη ενέργεια. Λόγω της διάσπασης των ενεργειακών επιπέδων των d τροχιακών, τα ηλεκτρόνια στα d τροχιακά του κεντρικού ατόμου θα αναδιαταχθούν, καταλαμβάνοντας κατά προτίμηση τα τροχιακά χαμηλότερης ενέργειας, μειώνοντας έτσι τη συνολική ενέργεια του συστήματος και καθιστώντας το σύμπλοκο πιο σταθερό.
Η ενέργεια των d τροχιακών είναι η ίδια όταν δεν υπάρχει ηλεκτρικό πεδίο [Σχήμα 3-19 (α)]- κάτω από ένα σφαιρικά συμμετρικό ηλεκτροστατικό πεδίο, τα d τροχιακά έχουν αυξημένη ενέργεια αλλά δεν διασπώνται [Σχήμα 3-19 (β)]- όταν το πεδίο του ligand είναι οκταεδρικό, διασπώνται σε dr και dg. Από αυτά, dr τροχιακά αποτελούνται από dx2– y2 και dz2
, με υψηλότερη ενέργεια- η χαμηλότερης ενέργειας dg τροχιακά αποτελούνται από dxy, dxz, dyz. [Εικόνα 3-19 (γ)]
Η διαφορά μεταξύ του υψηλότερου και του χαμηλότερου ενεργειακού επιπέδου μετά τη διάσπαση του τροχιακού d ονομάζεται ενέργεια διαχωρισμού △ . Οι ενέργειες διαχωρισμού που παράγονται από διαφορετικές διαμορφώσεις των πεδίων του ligand δεν είναι ίδιες (Σχήμα 3-20). Η ενεργειακή τους σειρά είναι η εξής:
Τετραγωνικό πεδίο > Οκταεδρικό πεδίο > Τετραεδρικό πεδίο

Ακόμη και για πεδία της ίδιας διαμόρφωσης, μπορεί επίσης να διαφέρουν λόγω των διαφορών στα ligands και τα κεντρικά ιόντα- όσο μεγαλύτερο είναι, τόσο πιο σταθερός είναι ο κρύσταλλος. Οι ακόλουθοι τρεις παράγοντες καθορίζουν κυρίως το μέγεθος της ενέργειας διαχωρισμού του κρυστάλλου:
(1) Κρύσταλλοι που σχηματίζονται από το ίδιο στοιχείο μετάπτωσης- όταν τα ligands είναι τα ίδια, όσο υψηλότερο είναι το φορτίο του κεντρικού ιόντος, τόσο μεγαλύτερη είναι η ενέργεια διαχωρισμού △ . Όσο υψηλότερο είναι το θετικό φορτίο του κεντρικού ιόντος, τόσο μεγαλύτερη είναι η έλξη προς τα ligands, με αποτέλεσμα μικρότερη απόσταση μεταξύ του κεντρικού ιόντος και του πυρήνα του ligand, και όσο μεγαλύτερη είναι η απωστική δύναμη του κρυσταλλικού πεδίου που δημιουργείται από τα ligands στα ηλεκτρόνια, τόσο μεγαλύτερη είναι η ενέργεια διαχωρισμού △ .
(2) Για κρυστάλλους που σχηματίζονται από διαφορετικά ιόντα με το ίδιο θετικό φορτίο και τα ίδια ligands, όσο μεγαλύτερη είναι η ακτίνα του κεντρικού ιόντος, τόσο πιο μακριά βρίσκονται τα τροχιακά d από τον πυρήνα και τόσο μεγαλύτερη είναι η ενέργεια διαχωρισμού △ .
(3) Για κρυστάλλους που σχηματίζονται από το ίδιο κεντρικό ιόν και διαφορετικά ligands, η ενέργεια διαχωρισμού ποικίλλει λόγω της διαφορετικής ισχύος του κρυσταλλικού πεδίου του ligand. Διαφορετικά ligands έχουν διαφορετικές εντάσεις πεδίου και η ενέργεια διαχωρισμού △ μεταβάλλεται ανάλογα με την ένταση του πεδίου του ligand.
Η ενέργεια διαχωρισμού χρησιμοποιείται για την ποιοτική εξήγηση της σταθερότητας των κρυστάλλων- δεν είναι απαραίτητο να ληφθεί η απόλυτη τιμή △ , καθώς αρκεί η γνώση των σχετικών τιμών του κρυστάλλου υπό διαφορετικές συνθήκες.
Με βάση τη σχετική ενέργεια των διαιρεμένων τροχιακών d, μπορεί να υπολογιστεί η συνολική ενέργεια των ιόντων μετάλλων μετάπτωσης στα τροχιακά d. Η ενέργεια αυτή είναι χαμηλότερη από ό,τι πριν από τη διάσπαση, παρέχοντας έτσι πρόσθετη ενέργεια στον κρύσταλλο, γνωστή ως ενέργεια σταθεροποίησης του κρυσταλλικού πεδίου, η οποία αντιπροσωπεύεται με το σύμβολο CFSE. Στον πίνακα 3-10 παρατίθενται οι ενέργειες σταθεροποίησης των ιόντων που περιέχουν dn ηλεκτρόνια υπό διαφορετικές συνθήκες.
Πίνακας 3-10 Ενέργειες σταθεροποίησης του κρυσταλλικού πεδίου υπό διαφορετικές συνδέσεις (Wu Ruihua, 1994)
| dn | Αδύναμο πεδίο | Ισχυρό πεδίο | ||||
|---|---|---|---|---|---|---|
| dn | Τετράγωνο | Κανονικό οκτάεδρο | Κανονικό Τετράεδρο | Τετράγωνο | Κανονικό οκτάεδρο | Κανονικό Τετράεδρο |
| d0 | 0 | 0 | 0 | 0 | 0 | 0 |
| d1 | 5.14 | 4 | 2.67 | 5.14 | 4 | 2.67 |
| d2 | 10.28 | 8 | 5.34 | 10.28 | 8 | 5.34 |
| d3 | 14.56 | 12 | 3.56 | 14.56 | 12 | 8.01 |
| d4 | 12.28 | 6 | 1.78 | 19.70 | 16 | 10.68 |
| d5 | 0 | 0 | 0 | 24.84 | 20 | 8.90 |
| d6 | 5.14 | 4 | 2.67 | 29.12 | 24 | 6.12 |
| d7 | 10.28 | 8 | 5.34 | 26.84 | 18 | 5.34 |
| d8 | 14.56 | 12 | 3.56 | 24.56 | 12 | 3.56 |
| d9 | 12.28 | 6 | 1.70 | 12.28 | 6 | 1.78 |
| d10 | 0 | 0 | 0 | 0 | 0 | 0 |
2. Χρωματικά χαρακτηριστικά ιόντων μετάλλων μετάπτωσης
Στους έγχρωμους πολύτιμους λίθους του, το χρώμα των περισσότερων πολύτιμων λίθων οφείλεται σε ιόντα μετάλλων μετάπτωσης και το χρώμα των πολύτιμων λίθων σχετίζεται με το αν τα χρωματικά ιόντα περιέχουν ασύζευκτα ηλεκτρόνια στα τροχιακά d ή f. Τα χρωματικά χαρακτηριστικά των ιόντων μετάλλων μετάπτωσης περιλαμβάνουν κυρίως τις ακόλουθες πτυχές:
(1) Ο χρωματισμός των ιόντων μετάλλων μετάπτωσης σχετίζεται με τις ηλεκτρονικές καταστάσεις του τροχιακού d ή του τροχιακού f. Όταν τα ηλεκτρόνια του τροχιακού d ή του τροχιακού f είναι γεμάτα ή κενά, ο πολύτιμος λίθος δεν παρουσιάζει χρώμα. Για παράδειγμα, το Cr6+, Ce4+, και Cu+.
(2) Διαφορετικά ιόντα χρωματισμού εμφανίζουν διαφορετικά χρώματα στο ίδιο υλικό πολύτιμων λίθων. Λόγω των διαφορετικών ενεργειών διαχωρισμού των διαφορετικών ιόντων χρωματισμού, μπορούν να παρουσιάζουν διαφορετικά χρώματα ακόμη και στο ίδιο υλικό. Για παράδειγμα, ο Fe2+ παράγει ένα ελαφρώς γκριζογάλαζο χρώμα στο σπινέλιο, ενώ το Cr3+ παράγει κόκκινο.
(3) Τα χρωματικά ιόντα του ίδιου στοιχείου σε διαφορετικές καταστάσεις σθένους παρουσιάζουν συχνά διαφορετικά χρώματα στο ίδιο υλικό πολύτιμων λίθων. Επειδή η ενέργεια που απαιτείται για τις μεταβάσεις δ-ηλεκτρονίων του κεντρικού ιόντος είναι διαφορετική, τα απορροφούμενα μήκη κύματος του φωτός είναι διαφορετικά, με αποτέλεσμα να εμφανίζονται διαφορετικά χρώματα. Για παράδειγμα, ένα κάστρο που περιέχει Mn2+ παρουσιάζει μια απαλή ροζ απόχρωση, ενώ ένα βηρύλλιο που περιέχει Mn2+ παρουσιάζει έντονο κόκκινο, γνωστό ως κόκκινο βηρύλλιο.
(4) Τα χρωματικά ιόντα του ίδιου στοιχείου στην ίδια κατάσταση σθένους παρουσιάζουν συχνά διαφορετικά χρώματα όταν βρίσκονται σε διαφορετικές διαμορφώσεις συνδέσμων. Για παράδειγμα, το Co2+ στην τετραεδρική διαμόρφωση του σπινέλιου παρουσιάζει ένα χαρακτηριστικό "μπλε του διαμαντιού" χρώμα, ενώ στην οκταεδρική διαμόρφωση του ασβεστίτη εμφανίζεται ροζ. Fe2+ στον οκταεδρικά συντονισμένο ολιβίνη εμφανίζει ένα χαρακτηριστικό λαδί πράσινο, ενώ στον παραμορφωμένο κυβικά συντονισμένο αλμανδίνη εμφανίζεται βαθύ κόκκινο.
(5) Ο ίδιος τύπος έγχρωμων ιόντων έχει την ίδια κατάσταση σθένους και την ίδια γεωμετρία συντονισμού, αλλά διαφορετικά γειτονικά άτομα συντονισμού παρουσιάζουν διαφορετικά χρώματα. Για παράδειγμα, στον τετραεδρικό συντονισμό του Co2+, σε σφαλερίτη, Co2+ συνδέεται με το θείο, δείχνοντας πράσινο, ενώ στο σπινέλιο, το Co2+ συνδέεται με το οξυγόνο και δείχνει μπλε.
(6) Ο ίδιος τύπος έγχρωμων ιόντων με την ίδια κατάσταση σθένους, τη γεωμετρία συντονισμού και τα γειτονικά άτομα παρουσιάζουν διαφορετικά χρώματα σε διαφορετικούς πολύτιμους λίθους. Η στρέβλωση της γεωμετρίας συντονισμού που προκαλείται από τις διαφορετικές χημικές συνθέσεις των πολύτιμων λίθων μεταβάλλει τη φύση των χημικών δεσμών μεταξύ του κεντρικού ιόντος και των συντονιστικών ligands, μεταβάλλοντας την ενέργεια μετάβασης των d ηλεκτρονίων. Για παράδειγμα, το Cr3+ εμφανίζεται κόκκινος στο ρουμπίνι, πράσινος στο σμαράγδι και παρουσιάζει ποικίλα χρώματα στον αλεξανδρίτη. Ο λόγος για αυτές τις αλλαγές στο Cr3+ σχετίζεται με τα χαρακτηριστικά του και τα παρακείμενα συντονιστικά ligands, με ανάλυση συγκεκριμένων χαρακτηριστικών ως εξής.
① Cr3+ Χαρακτηριστικά:
Cr3+ έχει δομή εξωτερικού ηλεκτρονιακού κελύφους 3s23p63d3, με 11 ηλεκτρόνια στο εξωτερικό κέλυφος, που ανήκουν σε μια ακανόνιστη δομή ηλεκτρονιακού κελύφους (8-18).
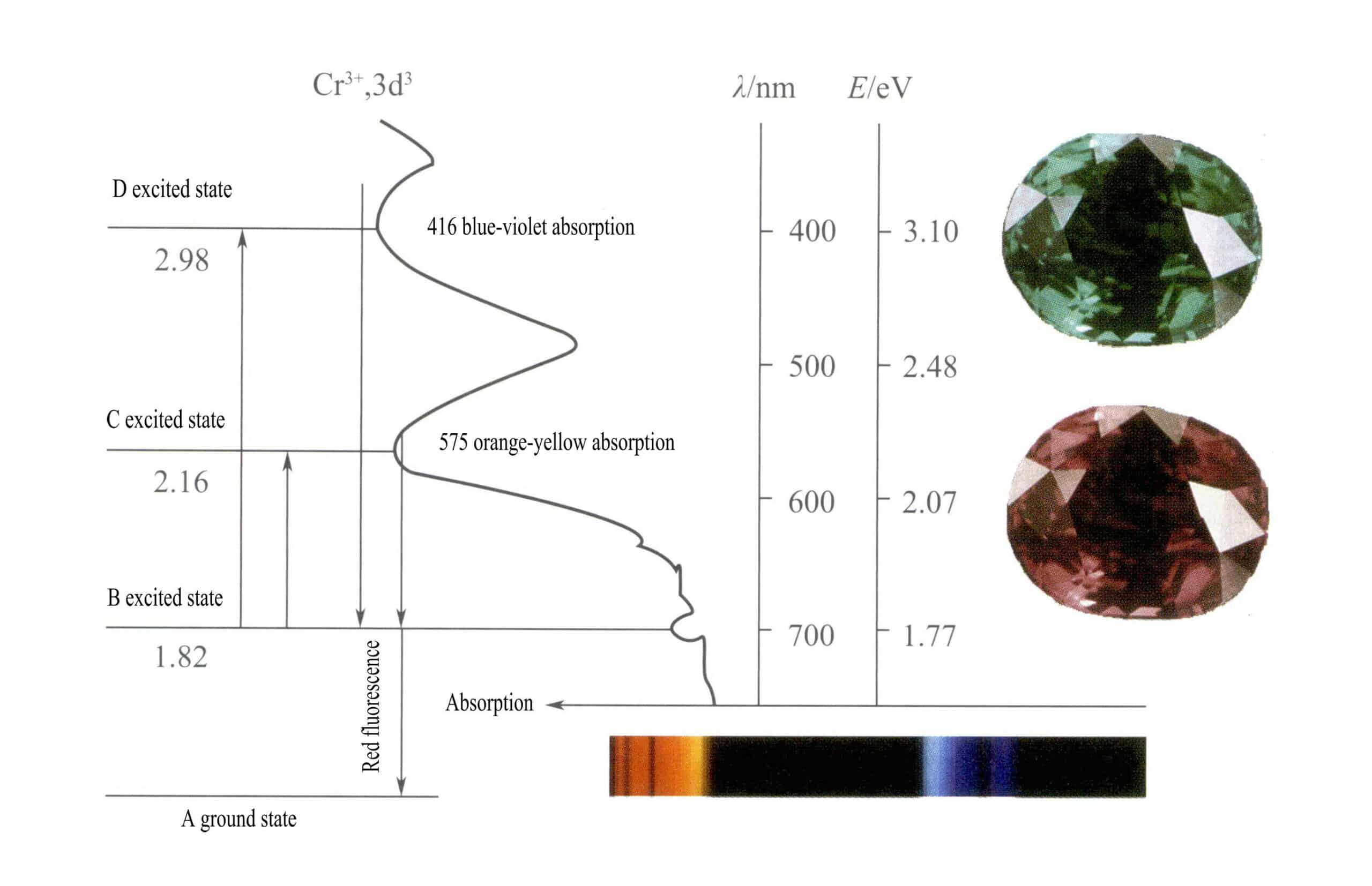
Αυτή η δομή έχει μικρότερη επίδραση θωράκισης στον πυρήνα από ό,τι η δομή του κελύφους των 8 ηλεκτρονίων, με αποτέλεσμα το Cr3+ που έχει υψηλότερο αποτελεσματικό θετικό φορτίο, ενώ η ιοντική ακτίνα του είναι επίσης μικρότερη, γεγονός που αποτελεί τα βασικά χαρακτηριστικά του Cr3+: ισχυρό θετικό ηλεκτρικό πεδίο και κενά d τροχιακά. Cr3+ μπορεί να παρέχει έξι κενά τροχιακά για να φιλοξενήσει έξι συντονιστικά ligands, με χωρική διαμόρφωση οκταεδρική, που ανήκουν στο d2sp3 υβριδισμός (Εικόνα 3-21).
Σύμφωνα με τη θεωρία του κρυσταλλικού πεδίου, σε ένα οκταεδρικό πεδίο, τα d τροχιακά του Cr3+ μπορεί να διασπαστεί σε χαμηλότερης ενέργειας dƐ τροχιά και υψηλότερης ενέργειας dr τροχιά. Δεδομένου ότι τα τρία ηλεκτρόνια d του Cr3+ είναι όλα στο dƐ τροχιακό και είναι όλα μονήρη ηλεκτρόνια, οι μεταπτώσεις d-d μπορούν να συμβούν κάτω από το ορατό φως, προκαλώντας πολύτιμους λίθους που περιέχουν Cr3+ να παρουσιάζουν χρώμα.
② Ο μηχανισμός χρωματισμού του Cr3+:
Στο ρουμπίνι Το κύριο χημικό συστατικό του ρουμπινιού είναι το Al2O3. Όταν ένα μικρό ποσοστό του Cr3+ αντικαθιστά τον Al3+, παράγει ένα έντονο κόκκινο χρώμα. Στη δομή του ρουμπινιού, λόγω της μεγαλύτερης ακτίνας του Cr3+ σε σύγκριση με την ακτίνα του Al3+, Cr3+ εισέρχεται στο πλέγμα του κορούνδιο, μειώνοντας τη συμμετρία γύρω από το οξείδιο του αργιλίου.
Τα d τροχιακά του Cr3+ διασπάται και όταν τα ηλεκτρόνια της διεγερμένης κατάστασης επιστρέφουν από το D ή το C στη βασική κατάσταση A, πρέπει πρώτα να περάσουν από το B, απελευθερώνοντας θερμότητα. Επιστρέφουν από το Β στο Α, συνοδευόμενα από φωταύγεια, εκπέμποντας κόκκινο φθορισμό. Κατά τη διαδικασία αυτή, τα ηλεκτρόνια απορροφούν φωτεινή ενέργεια, με αποτέλεσμα το ρουμπίνι να απορροφά το D ιώδες (400nm) και το C κίτρινο-πράσινο (555nm) ορατό φάσμα (Εικόνα 3-22), σχηματίζοντας μια ζώνη απορρόφησης.

Όταν το λευκό φως περνάει μέσα από ένα ρουμπίνι, τα φωτόνια του φάσματος από το μοβ έως το κιτρινοπράσινο απορροφώνται, ενώ σχεδόν όλο το κόκκινο φως και λίγο μπλε φως περνούν, δίνοντας στο ρουμπίνι ένα βαθύ κόκκινο χρώμα με μια υποψία μοβ, γνωστό ως κόκκινο του αίματος του περιστεριού.
Τα ρουμπίνια παρουσιάζουν μια σύντομη απορρόφηση επιπέδου Β, που εκδηλώνεται ως κόκκινος φθορισμός. Αυτή η απορρόφηση του επιπέδου Β που προκαλεί τον κόκκινο φθορισμό κάνει το χρώμα του ρουμπινιού πιο ζωντανό- όσο υψηλότερη είναι η περιεκτικότητα σε ιόντα χρωμίου, τόσο ισχυρότερος είναι ο φθορισμός.
Τα ιόντα σιδήρου στον πολύτιμο λίθο μπορούν να καταστείλουν τον φθορισμό της απορρόφησης του επιπέδου Β, εξηγώντας το φαινόμενο τα ρουμπίνια να εμφανίζονται πιο σκούρα όταν περιέχουν προσμίξεις σιδήρου.
③ Cr3+ Ο μηχανισμός χρωματισμού στα σμαράγδια
Το κύριο χημικό συστατικό του σμαραγδιού είναι το Be3Al2Si6O18, Cr3+, το οποίο αντικαθιστά το Al3+ στο σμαραγδένιο πλέγμα και Cr3+ περιβάλλεται επίσης από ένα οκτάεδρο αποτελούμενο από έξι ιόντα οξυγόνου, όπου το Cr3+Το μήκος του δεσμού -Ο είναι επίσης αρκετά παρόμοιο με εκείνο των ρουμπινιών. Ωστόσο, σε σύγκριση με τα ρουμπίνια, τα σμαράγδια έχουν δύο περισσότερα ιόντα, Be2+ και Si4+. Στη δομή των σμαραγδιών, ο ομοιοπολικός δεσμός μεταξύ των οξειδίων των μετάλλων αυξάνεται, ενώ τα ιοντικά χαρακτηριστικά εξασθενούν.
Μικρές αλλαγές, όπως οι χημικοί δεσμοί, οδηγούν σε ελαφρά μείωση του Cr3+ενέργειας των επιπέδων C και D, με αποτέλεσμα την ελαφρά μετατόπιση της ζώνης απορρόφησης (Σχήμα 3-23), εμποδίζοντας σημαντικά τη μετάδοση του μπλε-μωβ (425nm) και του πορτοκαλοκίτρινου (608nm) φωτός στο φάσμα, ενώ αυξάνει τη μετάδοση του μπλε-πράσινου φωτός, σχηματίζοντας έτσι το χαρακτηριστικό σμαραγδένιο πράσινο.

Η απορρόφηση του επιπέδου Β της διοπτρίας είναι σχεδόν αμετάβλητη. Όταν η πρόσμειξη σιδήρου δεν έχει "ανασταλτική" επίδραση στο σμαραγδένιο συστατικό, ο ισχυρός κόκκινος φθορισμός κάνει το χαρακτηριστικό σμαραγδένιο πράσινο να λάμπει ακόμη πιο έντονα.
④ Cr3+ Ο μηχανισμός χρώματος στον αλεξανδρίτη:
Το χρώμα του αλεξανδρίτη οφείλεται επίσης στο Cr3+ αντικαθιστώντας τον Al3+ σε παραμορφωμένο οκταεδρικό συντονισμό. Λόγω της χημικής σύνθεσης του αλεξανδρίτη που είναι BeAL2O4, η φύση των χημικών δεσμών μεταξύ των ιόντων μετάλλου-οξυγόνου βρίσκεται μεταξύ εκείνων του ρουμπινιού και του σμαραγδιού. Ως εκ τούτου, οι ζώνες απορρόφησής του βρίσκονται επίσης μεταξύ εκείνων του ρουμπινιού και του σμαραγδιού, με τις πιθανότητες μετάδοσης του μπλε-βιολετί και του πορτοκαλο-κίτρινου φωτός να είναι περίπου ίσες, καθιστώντας αδύνατο να προσδιοριστεί αν κυριαρχεί το κόκκινο ή το μπλε-πράσινο φως (Εικόνα 3-24).
Επομένως, το χρώμα του αλεξανδρίτη μπορεί να εξαρτάται μόνο από την ενεργειακή κατανομή και το χρωματικό εύρος του προσπίπτοντος φωτός, με αποτέλεσμα το "φαινόμενο αλλαγής χρώματος" του αλεξανδρίτη, δηλαδή να εμφανίζεται πράσινος στο φως της ημέρας με υψηλή συνιστώσα μπλε φωτός και κόκκινος στο φως πυρακτώσεως με υψηλή συνιστώσα κόκκινου φωτός. Ως εκ τούτου, ο αλεξανδρίτης αποκαλείται συχνά "το σμαράγδι της ημέρας και το ρουμπίνι της νύχτας".
Το "φαινόμενο της αλλαγής χρώματος" εμφανίζεται σε πολλούς τύπους πολύτιμων λίθων, όπως το κορούνδιο που αλλάζει χρώμα και ο γρανάτης που αλλάζει χρώμα. Επί του παρόντος, το τεχνητά συντιθέμενο κορούνδιο που αλλάζει χρώμα παράγεται χρησιμοποιώντας την αρχή της αλλαγής χρώματος, χρησιμοποιώντας V3+ ως ιόν χρωματισμού για τη σύνθεση.
3. Χρώματα των ορυκτών πολύτιμων λίθων
Τα χρώματα που παράγονται από τα συστατικά των μεταβατικών μετάλλων μπορούν να συναχθούν από τη χημική σύνθεση των ορυκτών των πολύτιμων λίθων. Για παράδειγμα, το τυρκουάζ που περιέχει Cu2+ πρέπει να είναι μπλε, ενώ ο Cu+ είναι άχρωμο. Ο Πίνακας 3-11 παραθέτει τα χρώματα που παράγονται από κοινά συστατικά μετάλλων μετάπτωσης σε φυσικά ορυκτά πολύτιμων λίθων.
Πίνακας 3-11 Χρώματα που παράγονται από συστατικά μετάλλων μετάπτωσης σε φυσικά ορυκτά πολύτιμων λίθων
| Στοιχείο | Χρώμα | Κοινά ορυκτά |
|---|---|---|
| Κέριο (Ce) | Κίτρινο | Parisite |
| Χρώμιο (Cr) | Κόκκινο, πράσινο, πορτοκαλί, κ.λπ. | Κροκοϊσίτης, Κόκκινος Κροκοϊσίτης, Ουβαροβίτης |
| Κοβάλτιο (Co) | Μπλε | Συνθετικό σπινέλιο |
| Χαλκός (Cu) | Μπλε, Πράσινο | Αζουρίτης, χρυσοκόλλα , τυρκουάζ μαλαχίτης, διοπτάση |
| Σίδηρος (Fe) | Κόκκινο, πράσινο, κίτρινο | Αλμανδίνης, ολιβίνης, γκαιτίτης |
| Μαγγάνιο (Mn) | Ροζ, πορτοκαλί | Ροδονίτης, σπεσσαρτίνη |
| Νικέλιο (Ni) | Πράσινο | Bunsenite, Χαλκηδόνος |
Το χρώμα των περισσότερων πολύτιμων λίθων οφείλεται στις προσμίξεις μεταβατικών μετάλλων που περιέχουν. Για παράδειγμα, τα ρουμπίνια εμφανίζονται κόκκινα λόγω των ιχνοστοιχείων Cr3+. Διάφοροι παράγοντες επηρεάζουν το χρώμα που προκαλείται από ιόντα ακαθαρσιών στον πολύτιμο λίθο. Ως εκ τούτου, οι προσμίξεις μπορεί να παράγουν διαφορετικά χρώματα σε διαφορετικούς πολύτιμους λίθους. Για παράδειγμα, το Cr3+ εμφανίζεται κόκκινο στα ρουμπίνια και πράσινο στα σμαράγδια.
Οι ίδιες ακαθαρσίες δεν είναι απαραίτητο να προκαλούν το ίδιο χρώμα ενός πολύτιμου λίθου. Για παράδειγμα, το πράσινο χρώμα των περισσότερων σμαραγδιών οφείλεται στο Cr, ενώ το πράσινο χρώμα ορισμένων σμαραγδιών οφείλεται εν μέρει ή εξ ολοκλήρου στο βανάδιο (V).
Η θεωρία του κρυσταλλικού πεδίου μπορεί να χρησιμοποιηθεί όχι μόνο για να εξηγήσει τα χρώματα των πολύτιμων λίθων που παράγονται από συστατικά μετάλλων μετάπτωσης ή προσμίξεις, αλλά και τα χρώματα που παράγονται από δομικές ατέλειες (κέντρα χρώματος)- η συγκεκριμένη διαδικασία παραγωγής χρώματος μπορεί να αναφερθεί στο κεφάλαιο 3.3 του παρόντος βιβλίου.
Υπάρχουν επίσης ελλείψεις στην εξήγηση των χρωμάτων των ορυκτών πολύτιμων λίθων με τη θεωρία του κρυσταλλικού πεδίου, οι οποίες αντικατοπτρίζονται κυρίως στις ακόλουθες πτυχές:
(1) Τα ηλεκτρόνια του κεντρικού ιόντος d δεν είναι πλήρως εντοπισμένα στα αρχικά τροχιακά τους. Μπορούν επίσης να εμφανιστούν γύρω από τα συντονιστικά άτομα, υποδεικνύοντας ομοιοπολική αλληλεπίδραση μεταξύ του κεντρικού ατόμου και των ligands.
(2) Λαμβάνει υπόψη μόνο την ηλεκτροστατική ιοντική αλληλεπίδραση μεταξύ του κεντρικού ατόμου και των ligands, αγνοώντας πλήρως την αλληλεπίδραση ομοιοπολικού δεσμού μεταξύ του κεντρικού ατόμου και των ligands. Στη φυσική έρευνα, τα αποτελέσματα των ποσοτικών υπολογισμών συχνά διαφέρουν σημαντικά από τις πραγματικές καταστάσεις.
(3) Οι λόγοι για το χρώμα των ορυκτών πολύτιμων λίθων, εκτός από την αλληλεπίδραση μεταξύ του κεντρικού ιόντος και των ligands, μπορεί επίσης να οφείλονται στις συνδυασμένες επιδράσεις των δομικών ατελειών και του κρυσταλλικού πεδίου.
Ενότητα II Θεωρία μοριακών τροχιακών
Οι Mulliken και Hund πρότειναν αρχικά τη θεωρία των μοριακών τροχιακών (θεωρία MO). Μέσα από τη συνεχή διερεύνηση πολλών επιστημόνων, εξελίχθηκε σε μια ώριμη θεωρία. Τα μοριακά τροχιακά (ΜΟ) μπορούν να προκύψουν από γραμμικούς συνδυασμούς ατομικών τροχιακών, μια ευρέως χρησιμοποιούμενη μέθοδος για την κατασκευή μοριακών τροχιακών. Από n ατομικά τροχιακά μπορούν να προκύψουν n μοριακά τροχιακά και οι συντελεστές γραμμικού συνδυασμού μπορούν να προσδιοριστούν με τη μέθοδο της μεταβολής ή άλλες μεθόδους. Τα μοριακά τροχιακά που σχηματίζονται από δύο ατομικά τροχιακά, με ενεργειακές στάθμες χαμηλότερες από εκείνες των ατομικών τροχιακών, ονομάζονται δεσμικά τροχιακά- εκείνα με ενεργειακές στάθμες υψηλότερες από τα ατομικά τροχιακά ονομάζονται αντιδεσμικά τροχιακά- εκείνα με ενεργειακές στάθμες κοντά στα ατομικά τροχιακά είναι γενικά μη δεσμικά τροχιακά.
Η θεωρία των μοριακών τροχιακών είναι μια θεωρία που χρησιμοποιείται για την εξήγηση ζητημάτων όπως ο σχηματισμός, η δομή και οι ιδιότητες των μορίων. Μπορεί επίσης να εξηγήσει ορισμένες από τις αιτίες των χρωμάτων των πολύτιμων λίθων, οι οποίες έχουν αναπτυχθεί με βάση τη θεωρία του κρυσταλλικού πεδίου και τη θεωρία μοριακών τροχιακών μετάλλων μετάπτωσης. Τα μοριακά τροχιακά είναι μια φυσική επέκταση των ατομικών τροχιακών. Σε ένα μόριο, τα ηλεκτρόνια δεν ανήκουν πλέον σε ένα συγκεκριμένο άτομο αλλά κινούνται σε ολόκληρο το μοριακό εύρος- επομένως, η κίνηση των ηλεκτρονίων σε ένα μόριο περιγράφεται με τη χρήση μοριακών τροχιακών.
1. Βασικές έννοιες της θεωρίας μοριακών τροχιακών
Η θεωρία των μοριακών τροχιακών υποστηρίζει ότι, αφού τα άτομα σχηματίσουν ένα μόριο, τα ηλεκτρόνια δεν ανήκουν πλέον στα αρχικά ατομικά τροχιακά, όπως προτείνεται από τη θεωρία του κρυσταλλικού πεδίου, αλλά κινούνται εντός ορισμένων μοριακών τροχιακών. Τα μοριακά τροχιακά συνθέτουν ένα μόριο όπως ακριβώς τα ατομικά τροχιακά συνθέτουν ένα άτομο. Τα ηλεκτρόνια σθένους δεν θεωρούνται πλέον εντοπισμένα μέσα σε μεμονωμένα άτομα αλλά κινούνται σε ολόκληρο το μόριο. Η κατανομή των ηλεκτρονίων στο μόριο μπορεί να αντιμετωπιστεί σύμφωνα με τις αρχές της κατανομής των ηλεκτρονίων στα άτομα (αρχή της ελάχιστης ενέργειας και κανόνας του Hund).
Ο γραμμικός συνδυασμός των ατομικών τροχιακών σε ένα μόριο σχηματίζει μοριακά τροχιακά. Ο αριθμός των μοριακών τροχιακών ισούται με τον αριθμό των ατομικών τροχιακών πριν από τον συνδυασμό. Ο συνδυασμός των ατομικών τροχιακών σε αποτελεσματικά μοριακά τροχιακά πρέπει να τηρεί τις ακόλουθες τρεις αρχές:
(1) Αρχή αντιστοίχισης συμμετρίας: Μόνο ατομικά τροχιακά με την ίδια συμμετρία μπορούν να σχηματίσουν μοριακά τροχιακά.
(2) Αρχή της ενεργειακής εγγύτητας: Μόνο ατομικά τροχιακά με παρόμοιες ενέργειες μπορούν να συνδυαστούν για να σχηματίσουν αποτελεσματικά μοριακά τροχιακά.
(3) Αρχή της μέγιστης επικάλυψης: Υπό την αντιστοίχιση συμμετρίας, όσο μεγαλύτερη είναι η επικάλυψη των ατομικών τροχιακών, τόσο περισσότερο μειώνεται η ενέργεια των μοριακών τροχιακών που προκύπτουν και τόσο πιο σταθερός είναι ο χημικός δεσμός που προκύπτει.
Το μοριακό τροχιακό ψ είναι η κυματοσυνάρτηση ενός μεμονωμένου ηλεκτρονίου. Μπορεί να αναπαρασταθεί ως γραμμικός συνδυασμός ατομικών τροχιακών, με κάθε τροχιακό να αντιστοιχεί σε μια συγκεκριμένη ενέργεια, η οποία είναι το άθροισμα της κινητικής και της δυναμικής ενέργειας του ηλεκτρονίου που κινείται στο μοριακό ηλεκτρικό πεδίο. Δύο ατομικά τροχιακά, α και β, μέσω επικαλυπτόμενων γραμμικών συνδυασμών, παράγουν δύο μοριακά τροχιακά ψI και ψII :
ψI=ψa + ψb (3-5)
ψII = ψa - ψb (3-6)
Όταν τα μοριακά τροχιακά με ηλεκτρόνια γεμίζουν πρώτα, τα τροχιακά δεσμού ψI γεμίζουν πρώτα. Όταν τα ηλεκτρόνια γεμίζουν μοριακά τροχιακά ίσης ενέργειας, σύμφωνα με τον κανόνα του Hund, θα πρέπει επίσης να καταλαμβάνουν όσο το δυνατόν περισσότερο διαφορετικά μοριακά τροχιακά με την ίδια διεύθυνση σπιν.
Τα μοριακά τροχιακά ψI που προκύπτουν από την πρόσθεση δύο συναρτήσεων ατομικών τροχιακών (Εξίσωση 3-5) ονομάζονται μοριακά τροχιακά δεσμού. Τα μοριακά τροχιακά ψII που προκύπτουν από την αφαίρεση δύο συναρτήσεων ατομικών τροχιακών (Εξίσωση 3-6) ονομάζονται αντιδεσμικά μοριακά τροχιακά. Η ενέργεια των δεσμικών μοριακών τροχιακών είναι χαμηλότερη από εκείνη των αντιδεσμικών μοριακών τροχιακών και χαμηλότερη από τις ενέργειες των δύο αρχικών ατομικών τροχιακών. Έτσι, όπως ακριβώς στην περίπτωση της πλήρωσης ατομικών τροχιακών, έτσι και κατά την πλήρωση μοριακών τροχιακών, τα ηλεκτρόνια τοποθετούνται πρώτα σε δεσμικά τροχιακά και ένα μοριακό τροχιακό μπορεί να φιλοξενήσει δύο ηλεκτρόνια με αντίθετα σπιν. Όταν τα ηλεκτρόνια γεμίζουν μοριακά τροχιακά ίσης ενέργειας, σύμφωνα με τον κανόνα του Hund, θα πρέπει επίσης να καταλαμβάνουν κατά το δυνατόν διαφορετικά μοριακά τροχιακά με την ίδια κατεύθυνση σπιν. Τα μοριακά τροχιακά που σχηματίζονται από δύο s ατομικά τροχιακά φαίνονται στο Σχήμα 3-25.

Τα τροχιακά p και τα τροχιακά d μπορούν επίσης να σχηματίσουν μοριακά τροχιακά διαφορετικών ενεργειακών επιπέδων- για παράδειγμα, ο συνδυασμός των διατομικών μοριακών τροχιακών στο Ο2 μορίων είναι σχετικά πολύπλοκη.
Σε πειράματα μετρήθηκαν οι μαγνητικές ιδιότητες αυτών των δύο μεμονωμένων ηλεκτρονίων, παρέχοντας ισχυρή υποστήριξη στη θεωρία των μοριακών τροχιακών. Σε αντίθεση με τα μόρια που αποτελούνται από τα ίδια άτομα, εκείνα που αποτελούνται από δύο ή περισσότερα διαφορετικά άτομα έχουν πιο πολύπλοκα ενεργειακά επίπεδα μοριακών τροχιακών, αλλά η αρχή είναι η ίδια.
2. Χαρακτηριστικά χρωματισμού μεταφοράς φορτίου
Αυτή η θεωρία των μοριακών τροχιακών, όπου ολόκληρο το μόριο μοιράζεται ηλεκτρόνια, θεωρείται επίσης ως η μετάβαση ηλεκτρονίων από ένα ατομικό τροχιακό σε ένα άλλο, γνωστή ως μεταφορά φορτίου. Η μεταφορά φορτίου μπορεί να συμβεί στις αλληλεπιδράσεις μέταλλο-μέταλλο (Μ-Μ), μη μέταλλο-μη μέταλλο (Λ-Λ) και μη μέταλλο-μέταλλο (Λ-Μ). Μεταξύ αυτών, οι L-L, M-L αυτοί οι δύο τύποι δεσμών είναι συχνά κυρίως ομοιοπολικοί δεσμοί. O2 ανήκει στη μεταφορά φορτίου L-L, η οποία είναι ομοιοπολικός δεσμός.
(1) Μεταφορά φορτίου μετάλλου-μετάλλου ( Μεταφορά φορτίου Μ - Μ)
Αυτός ο τύπος μεταφοράς φορτίου συμβαίνει γενικά μεταξύ κοινών ιόντων μετάλλων μετάπτωσης. Τα περισσότερα από τα αίτια του χρωματισμού των έγχρωμων πολύτιμων λίθων παράγονται από τη μεταφορά φορτίου μετάλλου-μετάλλου. Η μεταφορά φορτίου Μ-Μ περιλαμβάνει κυρίως τους ακόλουθους τύπους: Fe2+ - Fe3+/Fe3+ - Fe2+; Ti3+ - Ti4+ / Ti4+- T3+ ;Fe2+ - T4+/Fe3+ - T3+; Mn2+ - Mn4+/Mn3+ - Mn3+ . Η μεταφορά φορτίου μεταξύ μετάλλων χωρίζεται σε δύο τύπους: μεταφορά φορτίου μεταξύ ομοπυρηνικών ατόμων και μεταφορά φορτίου μεταξύ ετεροπυρηνικών ατόμων.
① Μεταφορά φορτίου μεταξύ ισοηλεκτρονικών ατόμων
Η μεταφορά φορτίου μεταξύ ισοηλεκτρονικών ατόμων πραγματοποιείται μεταξύ δύο ατόμων του ίδιου μεταβατικού μεταλλικού στοιχείου σε διαφορετικές καταστάσεις οξείδωσης. Για παράδειγμα, ο Fe2+ και Fe3+ υφίστανται μεταφορά φορτίου υπό διαφορετικές οξειδοαναγωγικές συνθήκες, απορροφώντας ενέργεια και παράγοντας χρώμα. Το μπλε-μωβ χρώμα του ιόλιθου παράγεται από τη μεταφορά φορτίου ιόντων σιδήρου σε διαφορετικές καταστάσεις οξείδωσης. Fe3+ και Fe2+ βρίσκονται σε τετραεδρική και οκταεδρική θέση, αντίστοιχα, με δύο ligands συνδεδεμένα με ακμές. Όταν το ορατό φως ακτινοβολεί στον ιόλιθο, ένα ηλεκτρόνιο d του Fe2+ απορροφά φως ορισμένης ενέργειας και μεταπίπτει σε Fe3+, απορροφώντας κίτρινο φως στα 588 nm και παράγοντας ένα μπλε-μωβ χρώμα. Ο ακουαμαρίνος, ο πράσινος τουρμαλίνης και άλλοι μπορούν επίσης να παρουσιάσουν χρώμα που οφείλεται στη μεταφορά φορτίου μεταξύ ιόντων σιδήρου.
② Μεταφορά φορτίου μεταξύ ετεροατόμων
Τα μπλε ζαφείρια αποτελούν το πιο χαρακτηριστικό παράδειγμα του χρώματος που παράγεται από τη μεταφορά φορτίου μεταξύ δύο τύπων ιόντων μετάλλων μετάπτωσης. Τα πολύεδρα συντονισμού των ιόντων μετάλλων μετάπτωσης συνδέονται με ακμές ή επιφάνειες, διευκολύνοντας τη μεταφορά φορτίου μεταξύ των μετάλλων.
Για παράδειγμα, στα ζαφείρια, όταν τα ιόντα σιδήρου και τα ιόντα τιτανίου εισέρχονται στα συνδεδεμένα οκτάεδρα, τόσο ο Fe όσο και το Ti βρίσκονται σε δύο οξειδωτικές καταστάσεις:
Fe2+ + Ti4+ χαμηλή ενέργεια (3-7)
Fe3+ + Ti3+ υψηλή ενέργεια (3-8)
Η μετάβαση από την εξίσωση (3-7) στην εξίσωση (3-8) απαιτεί την απορρόφηση ορισμένης ποσότητας φωτεινής ενέργειας, με αποτέλεσμα μια ευρεία ζώνη απορρόφησης που κυμαίνεται από το κίτρινο έως το κόκκινο. Αντίθετα, το μεγαλύτερο μέρος του μπλε φωτός διέρχεται από τον πολύτιμο λίθο, δίνοντάς του μπλε εμφάνιση.
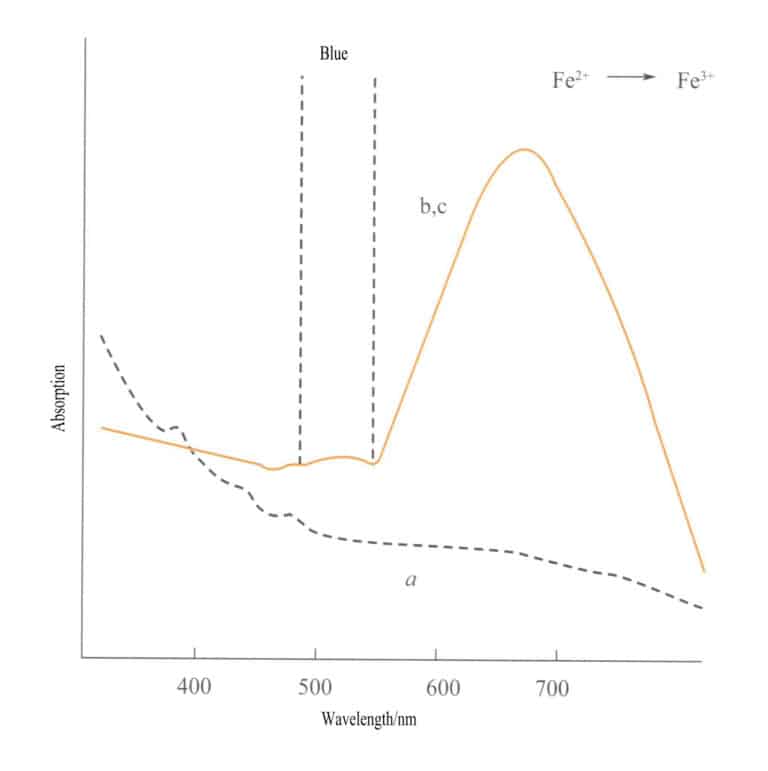
Η μεταφορά φορτίου μεταξύ διαφορετικών καταστάσεων σθένους έχει ισχυρή κατευθυντικότητα και οι πολύτιμοι λίθοι που παρουσιάζουν χρώμα λόγω αυτού του μηχανισμού συχνά εμφανίζουν πλειοχρωισμό. Για παράδειγμα, η ακουαμαρίνη που χρωματίζεται από Fe2+→ Fe3+ η μεταφορά φορτίου εμφανίζει χρώμα αυστηρά κατά μήκος της διεύθυνσης του οπτικού άξονα. Το σχήμα 3-26 δείχνει ότι το aquamarine εμφανίζεται κίτρινο στα επίπεδα b και c. Ταυτόχρονα, δεν υπάρχει τέτοια μεταφορά κατά μήκος της διεύθυνσης του άξονα α, με αποτέλεσμα να μην υπάρχει απορρόφηση φωτός και, επομένως, να μην υπάρχει χρώμα κατά μήκος της διεύθυνσης του άξονα α.
(2) Μεταφορά φορτίου από μη μέταλλο σε μέταλλο (L-M)
Αυτός ο τύπος μεταφοράς φορτίου L-M συμβαίνει συχνά μεταξύ οξυγόνου και μεταλλικών ιόντων και ορισμένοι πολύτιμοι λίθοι που περιέχουν οξυγόνο χρωματίζονται από τη μεταφορά φορτίου από μη μέταλλο σε μέταλλο, όπως το O2–→ Fe3+, O2- →Cr6+, O2-→Mn6+, O →V5+.
Στο φάσμα απορρόφησης των απλών οξειδίων του σιδήρου (Σχήμα 3-27), εμφανίζονται δύο ασθενείς ζώνες απορρόφησης στην υπέρυθρη περιοχή του ιλμενίτη, του αιματίτη και του λεπιδοκροκίτη ( ηλεκτρονικές μεταβάσεις d - d). Μια ισχυρή ζώνη απορρόφησης εμφανίζεται στην περιοχή βραχέων κυμάτων, που παράγεται από το O2-→Fe3+ μεταφορά φορτίου, και αυτή η ζώνη απορρόφησης καθορίζει τα χαρακτηριστικά χρώματα αυτών των ενώσεων: κοκκινωπό-καφέ, καφέ και κίτρινο-καφέ.
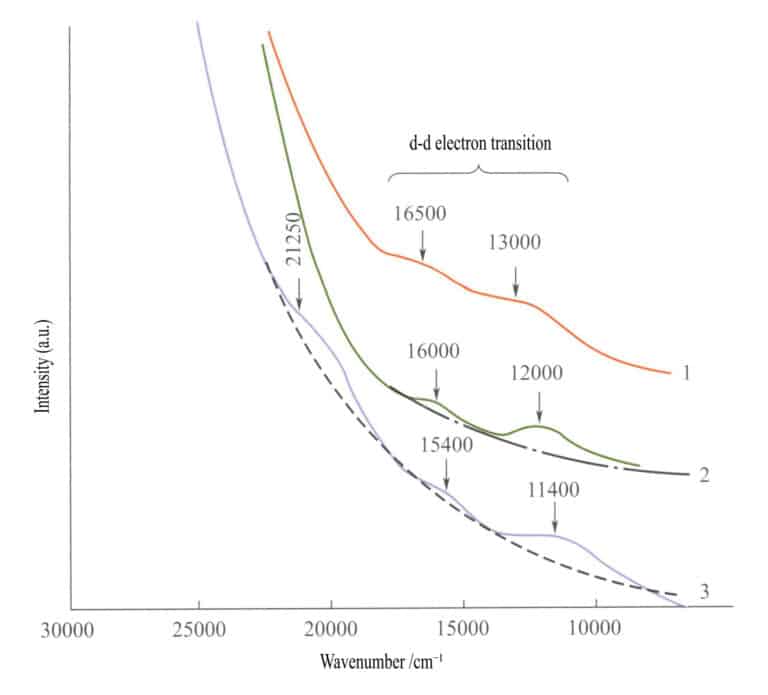
1 -Ιιλμενίτης- 2 - Αιματίτης- 3 - Λεπιδοκροκίτης
Το κίτρινο βηρύλλιο παίρνει το χρώμα του από το Ο2–→ Fe3+ μεταφορά φορτίου. Στη δομή του κίτρινου βηρυλίου, το O2–→ Fe3+ η ισχυρή απορρόφηση μεταφοράς φορτίου μπορεί να επεκταθεί από το υπεριώδες άκρο στο μπλε άκρο του ορατού φάσματος, απορροφώντας μοβ και μπλε, με αποτέλεσμα ένα κίτρινο χρώμα.
Το ζαφείρι, το οποίο έχει ένα εντελώς διαφορετικό περιβάλλον συντονισμού από το βηρύλλιο, μπορεί επίσης να παράγει τις ίδιες φασματικές ζώνες απορρόφησης με το βηρύλλιο, με αποτέλεσμα το κίτρινο χρώμα, το οποίο είναι επίσης αποτέλεσμα του O2–→ Fe3+ μεταφορά φορτίου.
Σύμφωνα με τη θεωρία του κρυσταλλικού πεδίου, ορισμένα ορυκτά πολύτιμων λίθων δεν περιέχουν ασύζευκτα ηλεκτρόνια και δεν μπορούν να παράγουν χρώμα. Για παράδειγμα, τα ηλεκτρονικά στρώματα του κροκόλιθου (PbCrO4), Pb2+, Cr6+, και O2– είναι πλήρεις. Ακόμα, στο CrO42- είναι "μοριακά τροχιακά", τα οποία αντιστοιχούν στις διεγερμένες καταστάσεις κατά τη διάρκεια του O2-→Cr6+ μεταφορά, σχηματίζοντας ζώνες απορρόφησης και παρουσιάζοντας πορτοκαλί χρώμα.
L→M Η μεταφορά φορτίου περιλαμβάνει επίσης τη μεταφορά θείου σε μέταλλο, όπως στον κοινό πυρίτη- αυτό το οπτικό φαινόμενο που προκαλείται από τη μεταφορά είναι ευκολότερο να κατανοηθεί όταν συζητείται με τη χρήση της θεωρίας ζωνών.
(3) Μεταφορά φορτίου από μη μέταλλο σε μη μέταλλο (L-L)
Η θεωρία των μοριακών τροχιακών υποδηλώνει ότι το βαθύ μπλε χρώμα του λάπις λάζουλι οφείλεται στις ενεργειακές στάθμες διέγερσης του S3- ατομική ομάδα.
Στον γραφίτη, οι δακτύλιοι των έξι ατόμων άνθρακα είναι τοποθετημένοι σε στρώματα. Κατά μήκος αυτού του στρώματος, τα ηλεκτρόνια μπορούν να κινούνται σε κάποιο βαθμό ελεύθερα, με αποτέλεσμα την ισχυρή απορρόφηση του φωτός, την ανισοτροπία και την αγωγιμότητα.
Ορισμένοι οργανικοί πολύτιμοι λίθοι, όπως το κεχριμπάρι και τα μαργαριτάρια, έχουν ηλεκτρόνια που κινούνται και διεγείρονται μέσω των ατομικών ομάδων των οργανικών χρωστικών σε κοινά μοριακά τροχιακά, προκαλώντας την απορρόφηση του ορατού φωτός και παράγοντας χρώμα. Για παράδειγμα, το "κίτρινο του μελιού" του κεχριμπαριού, τα χρώματα του κοραλλιού και ορισμένα κοχύλια και χρωματιστά μαργαριτάρια.
Οι χρωματικοί μηχανισμοί των κοινών πολύτιμων λίθων παρουσιάζονται στον Πίνακα 3-12.
Πίνακας 3-12 Ταξινόμηση των μηχανισμών χρώματος κοινών πολύτιμων λίθων
| Μεταφορά φορτίου μέταλλο - μέταλλο | Fe2+ - Fe3+ /Fe3+ - Fe2+ : ιολίτης (μπλε), βερτιερίτης (μπλε), μαγνητίτης (μαύρος), κ.λπ. |
| Fe2+ -Ti4+/Fe3+ - Ti3+ : Κυανίτης (μπλε), Ζαφείρι (μπλε) | |
| Mn2+-Mn4+/Mn3+-Mn3+: Μαγγανίτης (μαύρος), Μπιξμπιίτης (μαύρος) | |
| Μεταφορά φορτίου από μη μέταλλο σε μέταλλο | O2- -Fe3+: Χρυσοκίτρινο βηρύλλιο, χρυσοκίτρινο ζαφείρι, ιλμενίτης, αιματίτης, λεπιδοκροκίτης κ.λπ. |
| O2- - Cr6+: Κροκόλιθος (πορτοκαλί) | |
| O2- -V5+:Βαναδινίτης (πορτοκαλί) | |
| Θείο σε μέταλλο: πυρίτης, μαρκασίτης κ.λπ. (βλέπε ημιαγωγός με διάκενο) | |
| Μη μεταλλική - μη μεταλλική μεταφορά φορτίου | S3-: Lapis lazuli (μπλε) |
| Π ηλεκτρονικό: γραφίτης (μαύρο) | |
| Τα χρώματα ορισμένων οργανικών πολύτιμων λίθων, όπως το κεχριμπάρι και το κοράλλι. |
Copywrite @ Sobling.Jewelry - Κατασκευαστής προσαρμοσμένων κοσμημάτων, εργοστάσιο κοσμημάτων OEM και ODM
Ενότητα III Θεωρία ενεργειακών ζωνών
Η θεωρία των ενεργειακών ζωνών είναι ένα κβαντομηχανικό μοντέλο για τη μελέτη των πολύτιμων υλικών, το οποίο αποτελεί περαιτέρω επέκταση και διεύρυνση της θεωρίας των μοριακών τροχιακών. Η μελέτη της θεωρίας των ενεργειακών ζωνών μπορεί να εξηγήσει καλύτερα τον μηχανισμό χρώματος ορισμένων φυσικά χρωματισμένων πολύτιμων λίθων.
1. Βασικές έννοιες της θεωρίας ενεργειακών ζωνών
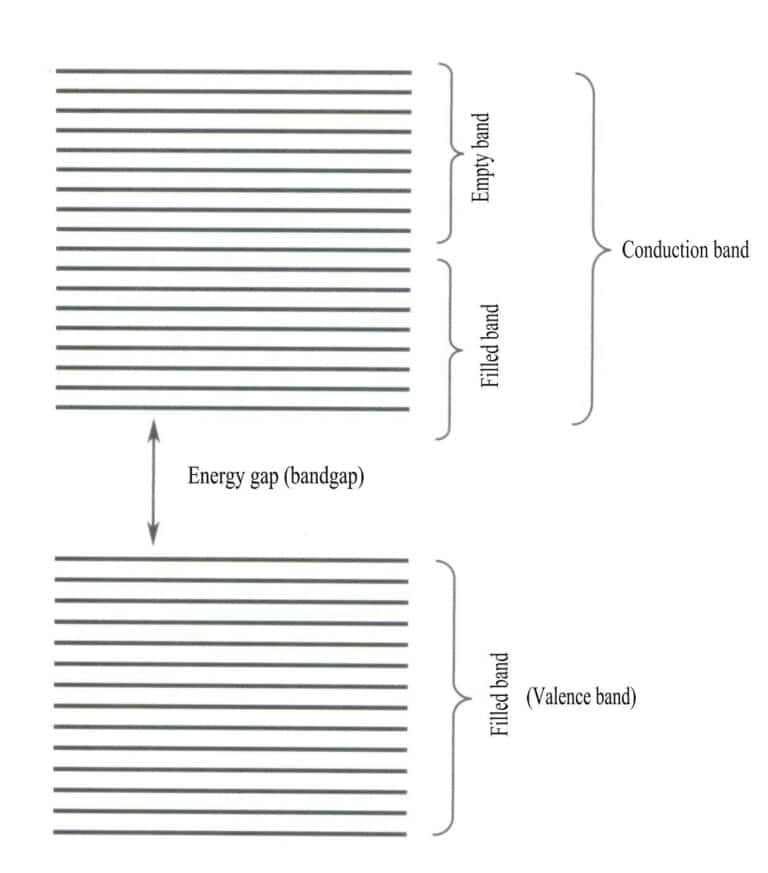
Η θεωρία των ενεργειακών ζωνών είναι μια προσεγγιστική θεωρία που χρησιμοποιείται για τη μελέτη των νόμων της κίνησης των ηλεκτρονίων στα στερεά. Τα στερεά αποτελούνται από άτομα, τα οποία περιλαμβάνουν τους ατομικούς πυρήνες και τα εξωτερικά ηλεκτρόνια, τα οποία βρίσκονται σε μια συνεχή κατάσταση κίνησης. Η θεωρία των ζωνών υποστηρίζει ότι τα ηλεκτρόνια στα στερεά δεν είναι δεσμευμένα σε ένα συγκεκριμένο άτομο, αλλά μοιράζονται σε ολόκληρο τον κρύσταλλο και κινούνται εντός του περιοδικού πεδίου δυναμικού του τρισδιάστατου χώρου του κρυστάλλου. Το εύρος της κίνησης των ηλεκτρονίων βρίσκεται εντός του περιοδικού δυναμικού πεδίου του πλέγματος, επιτρέποντας στη χωρική κατανομή των τροχιών των ηλεκτρονίων να υπερβαίνει εκείνη των μορίων, φτάνοντας σε ένα μέγιστο. Οι ενεργειακές στάθμες των μεμονωμένων ηλεκτρονίων διευρύνονται σε ενεργειακές ζώνες.
Η θεωρία ζωνών εξετάζει κυρίως τις μεταβάσεις ηλεκτρονίων μεταξύ μη τοπικών καταστάσεων, όπου όλα τα ηλεκτρόνια σθένους πρέπει να ανήκουν σε ολόκληρο το στερεό πλέγμα. Σύμφωνα με τη θεωρία ζωνών, τα στερεά υλικά μπορούν να χωριστούν σε διαφορετικές ενεργειακές ζώνες ανάλογα με το αν τα ατομικά τροχιακά είναι γεμάτα: μια γεμάτη ζώνη σχηματίζεται από τις ενεργειακές στάθμες των ατομικών τροχιακών που είναι πλήρως κατειλημμένες από ηλεκτρόνια, αντιπροσωπεύοντας μια ζώνη χαμηλής ενέργειας- μια κενή ζώνη σχηματίζεται από ενεργειακές στάθμες που δεν είναι πλήρως κατειλημμένες από ηλεκτρόνια, αντιπροσωπεύοντας μια ζώνη υψηλής ενέργειας. Η ενεργειακή διαφορά μεταξύ αυτών των δύο τύπων ζωνών ονομάζεται "χάσμα ζώνης" (Σχήμα 3-28).
Όταν όλες οι ενεργειακές ζώνες ενός υλικού είναι γεμάτες, είναι μη αγωγός- όταν είναι μερικώς γεμάτες με ηλεκτρόνια, είναι αγωγός. Οι ατέλειες πλέγματος εισάγουν πρόσθετες ενεργειακές στάθμες στον κρύσταλλο, επιτρέποντας στα ηλεκτρόνια να εισέλθουν σε αυτές τις ενεργειακές στάθμες, με αποτέλεσμα την υπό όρους αγωγιμότητα.
2. Χαρακτηριστικά των μεταβάσεων χάσματος ζώνης
Ορισμένα ορυκτά πολύτιμων λίθων περιέχουν στοιχεία από την ομάδα IV A του περιοδικού πίνακα, όπως το διαμάντι και ο μοισσανίτης, τα οποία συνδέονται κυρίως ομοιοπολικά. Υπάρχουν επίσης άλλα ορυκτά, όπως το θειούχο κάδμιο (CdS), τα χρώματα των οποίων μπορούν να εξηγηθούν με τη θεωρία των ζωνών.
Τα ηλεκτρόνια απορροφούν φωτεινή ενέργεια και μετακινούνται μεταξύ της ζώνης σθένους και της ζώνης αγωγιμότητας, σχηματίζοντας "εσωτερικές μεταβάσεις ζώνης". Η πιθανότητα των μεταβάσεων σχετίζεται στενά με την ενεργειακή διαφορά μεταξύ των ζωνών σθένους και αγωγιμότητας, γνωστή ως ενέργεια χάσματος ζώνης (Eg) (Σχήμα 3-29).

Το Σχήμα 3-29 (α) είναι ένα τυπικό διάγραμμα ζώνης ημιαγωγού. Με βάση το μέγεθος της ενέργειας του χάσματος ζώνης του κρυστάλλου, μπορεί να χωριστεί σε τρεις τύπους: ευρύ χάσμα ζώνης, στενό χάσμα ζώνης και μεσαίο χάσμα ζώνης. Ένα ευρύ χάσμα ζώνης έχει ενέργεια χάσματος ζώνης μεγαλύτερη από την ενέργεια του ορατού φωτός- όταν η ενέργεια χάσματος ζώνης υπερβαίνει την ενέργεια του ορατού φωτός, το ορατό φως δεν απορροφάται και διέρχεται πλήρως, καθιστώντας το ορυκτό άχρωμο. Για παράδειγμα, η ενέργεια χάσματος ζώνης του διαμαντιού Eg είναι περίπου 5,5eV, καθιστώντας το άχρωμο.
Η ενέργεια του χάσματος ζώνης των υλικών με στενό χάσμα ζώνης είναι μικρότερη από εκείνη του ορατού φωτός, με αποτέλεσμα να απορροφάται όλο το ορατό φως και να δημιουργούνται σκούρα γκρι-πράσινα ή μαύρα χρώματα. Για παράδειγμα, η ενέργεια του χάσματος ζώνης του γαληνίτη είναι Eg λιγότερο από 0,4eV, που φαίνεται να είναι γκρι μολύβδου. Όταν αυτός ο "ημιαγωγός στενού χάσματος ζώνης" βρίσκεται σε κατάλληλο γεωμετρικό σχήμα, παρουσιάζει ανορθωτικές και ενισχυτικές ιδιότητες.
Η ενέργεια των υλικών με μεσαίο χάσμα ζώνης βρίσκεται ακριβώς μέσα στην περιοχή του ορατού φωτός και τα πολύτιμα ορυκτά εμφανίζουν διάφορα χρώματα. Η χρωματική τους ακολουθία παρουσιάζεται στην Εικόνα 3-29 (γ), που κυμαίνεται από το κόκκινο-κίτρινο στο πράσινο-μπλε και στο μοβ. Για παράδειγμα, η ενέργεια του χάσματος ζώνης (Eg) του θειούχου καδμίου (CdS) είναι περίπου 2,5eV, το οποίο απορροφά το μπλε και το ιώδες φως και εμφανίζεται κίτρινο. Η ενέργεια του χάσματος ζώνης του κιννάβαρι είναι περίπου 2eV, επιτρέποντας τη διέλευση μόνο του κόκκινου φωτός, με αποτέλεσμα να εμφανίζεται κόκκινο. Η ενέργεια του χάσματος ζώνης του ορπιμέντου είναι περίπου 2,5eV, εμφανιζόμενο κίτρινο.
Μια άλλη κατηγορία φυσικών ορυκτών πολύτιμων λίθων που εξηγείται από τη θεωρία ζωνών είναι το χρώμα των υλικών με ευρύ χάσμα ζώνης που περιέχουν προσμίξεις. Για παράδειγμα, στην περίπτωση ενός διαμαντιού με προσμίξεις, η ενέργεια του χάσματος ζώνης του διαμαντιού είναι π.χ. περίπου 5,5eV και το ορατό φως δεν απορροφάται όταν διέρχεται από το διαμάντι- το καθαρό διαμάντι είναι άχρωμο, αλλά η κατάσταση αλλάζει όταν περιέχει προσμίξεις.
(1) Ο χρωματικός μηχανισμός των κίτρινων διαμαντιών
Τα άτομα αζώτου αντικαθιστούν τις θέσεις των ατόμων άνθρακα. Δεδομένου ότι τα άτομα αζώτου διαθέτουν ένα ηλεκτρόνιο περισσότερο από τα άτομα άνθρακα, αυτό το επιπλέον ηλεκτρόνιο σχηματίζει μια ενεργειακή στάθμη πρόσμιξης στο χάσμα ζώνης, γνωστή ως ενεργειακή στάθμη δότη, με τα άτομα αζώτου να ενεργούν ως "δότες".
Η ύπαρξη αυτού του επιπέδου πρόσμιξης μειώνει την ενέργεια του χάσματος ζώνης στα 4eV[ [Σχήμα 3-30 (α)]. Μπορεί να είναι ακόμη χαμηλότερη, επιτρέποντας την απορρόφηση υπεριώδους φωτός και λίγο ιώδους φωτός 3eV, με αποτέλεσμα το διαμάντι να εμφανίζεται κίτρινο.
Το φαινόμενο αυτό είναι ισχυρό- η ύπαρξη ενός ατόμου αζώτου για κάθε εκατό χιλιάδες άτομα άνθρακα μπορεί να κάνει το διαμάντι βαθύ κίτρινο. Ωστόσο, η μείωση του χάσματος ζώνης εξακολουθεί να είναι ανεπαρκής για να καταστήσει το διαμάντι αγώγιμο σε θερμοκρασία δωματίου.
(2) Μηχανισμός του χρώματος στα μπλε διαμάντια
Δεδομένου ότι το βόριο έχει ένα ηλεκτρόνιο λιγότερο από τον άνθρακα, σχηματίζει ένα "επίπεδο αποδέκτη" στο χάσμα ζώνης του διαμαντιού. Δεν έχει επιπλέον ηλεκτρόνια, αλλά μπορεί να δεχτεί ηλεκτρόνια από τη ζώνη σθένους ενός διαμαντιού, δημιουργώντας οπές στη ζώνη σθένους [Σχήμα 3-30 (β)] και σχηματίζοντας μια ενεργειακή ζώνη πρόσμιξης περίπου 0,4eV πάνω από τη ζώνη σθένους, γνωστή ως στάθμη αποδέκτη.

Το ενεργειακό επίπεδο του αποδέκτη δεν είναι απλό- είναι μια πολύπλοκη δομή ενεργειακών ζωνών πρόσμιξης που μπορεί να παράγει μπλε χρώμα. Το ενεργειακό επίπεδο του αποδέκτη δημιουργεί "τρύπες" στη ζώνη σθένους, γεγονός που επιτρέπει σε αυτό το "τρύπιο" μπλε διαμάντι τύπου II b να άγει τον ηλεκτρισμό.
Ένα άτομο βορίου σε κάθε εκατομμύριο άτομα άνθρακα μπορεί να σχηματίσει μπλε χρώμα. Λόγω της υψηλότερης περιεκτικότητας σε αλουμίνιο σε αυτό το μπλε διαμάντι και επειδή το αλουμίνιο έχει ένα ηλεκτρόνιο λιγότερου εξωτερικού στρώματος από τον άνθρακα, το αλουμίνιο θεωρούνταν προηγουμένως ότι παίζει το ρόλο του αποδέκτη. Παρόλα αυτά, τα τρέχοντα πειράματα έχουν αποδείξει ότι πρόκειται για το βόριο και όχι για το αλουμίνιο.
Τα αγώγιμα μπλε διαμάντια τύπου ΙΙ β είναι φυσικά μπλε και η αγωγιμότητά τους είναι μία από τις διαφορές τους από τα ακτινοβολημένα μπλε διαμάντια (κέντρα χρώματος). Αυτή η ιδιότητα χρησιμοποιείται συχνά για τη διάκριση μεταξύ των δύο τύπων διαμαντιών. Ωστόσο, τα κίτρινα διαμάντια με αζωτοδότη δεν αγωγιμοποιούνται, οπότε η μέθοδος αυτή δεν μπορεί να χρησιμοποιηθεί για τη διαφοροποίησή τους από τα ακτινοβολημένα κίτρινα διαμάντια.
3. Ορυκτά πολύτιμων λίθων χρωματισμένα από μεταβάσεις ζωνών
Η θεωρία των ενεργειακών ζωνών μπορεί να εξηγήσει μέρος του σχηματισμού του χρώματος των φυσικών πολύτιμων λίθων. Δεδομένου ότι η ενέργεια του χάσματος ζώνης είναι μια εγγενής ιδιότητα του κρυστάλλου και δεν μεταβάλλεται λόγω εξωτερικών συνθηκών, το χρώμα των πολύτιμων λίθων έχει καλή σταθερότητα. Η αγωγιμότητα του κρυστάλλου μπορεί να προσδιοριστεί με βάση το αν οι ενεργειακές ζώνες του κρυστάλλου είναι γεμάτες με ηλεκτρόνια. Στον πίνακα 3-13 παρατίθενται οι τύποι χρωμάτων πολύτιμων λίθων που μπορούν να εξηγηθούν με τη θεωρία ζωνών και οι ιδιότητες αγωγιμότητάς τους.
Πίνακας 3-13 Τύποι χρωμάτων πολύτιμων λίθων που εξηγούνται από τη θεωρία ζωνών και την αγωγιμότητά τους
| Αγωγοί (μεταλλικά χρώματα και μεταλλική λάμψη) | Στοιχείο | Χαλκός, χρυσός, σίδηρος, ασήμι, υδράργυρος κ.λπ. |
| Κράμα | Αμάλγαμα, Μετεωρίτης νικέλιο σίδηρος | |
| Ημιαγωγός | Στενό χάσμα ζώνης | Αδιαφανές γκρι έως μαύρο: αλταΐτης, γαληνίτης |
| Αδιαφανές μεταλλικό χρώμα: κοβαλτίνη, μαρκασίτης, πυρίτης, σμαλτίτης | ||
| Μέτριο χάσμα ζώνης | Κόκκινο: κιννάβαρι, προουστίτης, πυραργυρίτης | |
| Πορτοκαλί: Realgar | ||
| Κίτρινο: θειούχο κάδμιο, ρεαλγκάρ, θείο | ||
| Ευρύ χάσμα ζώνης | Άχρωμο: διαμάντι, σφαλερίτης | |
| Ημιαγωγοί με ευρύ χάσμα ζώνης που περιέχουν προσμίξεις | Καθαρή ουσία δότη: διαμάντι (κίτρινο) | |
| Προσμίξεις στον ξενιστή: Διαμάντι που περιέχει βόριο (μπλε) |
Το χρώμα των πολύτιμων λίθων που προκαλείται από τις μεταβάσεις ζωνών σχετίζεται με τη δομή και τον τύπο του δεσμού κατά τη στιγμή του σχηματισμού των πολύτιμων λίθων. Έχει ελάχιστη σχέση με μεταγενέστερες προσμίξεις και κρυσταλλικά ελαττώματα. Το μέγεθος της ενέργειας του χάσματος ζώνης των πολύτιμων λίθων είναι σταθερό. Δεν αλλάζει με τις ιδιότητες του υλικού των πολύτιμων λίθων, επομένως οι συμβατικές μέθοδοι βελτιστοποίησης δεν μπορούν γενικά να βελτιώσουν το χρώμα των πολύτιμων λίθων.
Τμήμα IV Φυσικές οπτικές επιδράσεις
Οι περισσότεροι φυσικοί πολύτιμοι λίθοι μπορούν να προκαλέσουν επιλεκτική απορρόφηση του φωτός και οι διαφορετικοί πολύτιμοι λίθοι απορροφούν το ορατό φως σε διαφορετικά μήκη κύματος, με αποτέλεσμα να έχουν διαφορετικά χρώματα. Εκτός από την επιλεκτική απορρόφηση του φωτός, η εσωτερική δομή των κρυστάλλων των πολύτιμων λίθων μπορεί επίσης να προκαλέσει φυσικά οπτικά φαινόμενα, οδηγώντας σε διαφορετικά χρώματα στους πολύτιμους λίθους.
1. Ορυκτά πολύτιμων λίθων που σχετίζονται με φυσικά οπτικά φαινόμενα
Τα χρώματα που παράγονται από φυσικά οπτικά φαινόμενα σχηματίζονται λόγω της διασποράς, της παρεμβολής, της περίθλασης και άλλων λόγων του φωτός που προκαλούνται από τη δομή ή τη σύνθεση του κρυστάλλου και τα εγκλείσματα. Πρόκειται απλώς για ένα οπτικό φαινόμενο που μπορεί να εξηγηθεί από τη φυσική οπτική θεωρία. Διαφορετικοί πολύτιμοι λίθοι μπορούν να παράγουν διαφορετικά χρώματα κάτω από τα ίδια οπτικά φαινόμενα. Εκτός από τα κοινά ιχνοστοιχεία που προκαλούν το χρώμα, οι λόγοι των χρωμάτων που παράγονται από φυσικά οπτικά φαινόμενα σχετίζονται κυρίως με την εσωτερική δομή και τις φυσικές ιδιότητες των πολύτιμων λίθων. Οι τύποι ορυκτών πολύτιμων λίθων που προκαλούν χρώματα λόγω φυσικών οπτικών φαινομένων παρατίθενται στον πίνακα 3-14.
Πίνακας 3-14 Τύποι πολύτιμων ορυκτών που προκαλούνται από φυσικές οπτικές επιδράσεις
| Λειτουργία | Οπτικές ιδιότητες και χρώμα | Ορυκτά πολύτιμων λίθων |
|---|---|---|
| Διασπορά Σκέδαση | Λαμπερό | "Φωτιά" σε πολύτιμους λίθους διασποράς, όπως τα διαμάντια, το ζιρκόνιο, το ρουτίλιο και το τιτανικό στρόντιο |
| Μπλε | Φεγγαρόπετρα, μπλε χαλαζίας, οπάλιο | |
| Μωβ | Φθορίτης (σκέδαση μικροκρυστάλλων ασβεστίου) | |
| Κόκκινο | Γυαλί ρουμπινί, διασπορά μικροκρυστάλλων χαλκού ή χρυσού | |
| Λευκό | Γαλακτώδης χαλαζίας | |
| Επίδραση ματιών γάτας | Ακουαμαρίνιο μάτι της γάτας, πυροξένιο μάτι της γάτας, κ.λπ. | |
| Επίδραση Starlight | Διάφορα αστρικά φαινόμενα του κορούνδιο και του γρανάτη | |
| Λάμψη | Λάμψη μαργαριταριών, αποφυλλίτη κ.λπ. | |
| Λάμψη | Λάμψη αβεντουρίνης, οψιδιανού κ.λπ. | |
| Περίθλαση παρεμβολής | Τα καθαρά φασματικά χρώματα του λεπτού φιλμ | Το ουράνιο τόξο του χαλκοπυρίτη, το αποχρωματισμένο φιλμ σε μια σχισμή ιριδίζοντος χαλαζία |
| Επιπτώσεις παρεμβολής | Χρωματική αλλαγή του οπάλου, το αποτέλεσμα του λαμπραντορίτη | |
| Ένταξη | Μπλε | Dumortierite σε χαλαζία |
| Πράσινο | Πράσινος χαλκηδόνιος και φλέβες νικελίου σε πράσινο χαλκηδόνιο, φουχσίτης σε αστρο-χαλαζία | |
| Πορτοκαλί | Υδρογονωμένο οξείδιο του σιδήρου σε όπαλ φωτιάς και σαρκώδες χαλκηδόνιο | |
| Κόκκινο | Νιφάδες αιματίτη σε ορθόκλαστο |
2. Φαινόμενα παρεμβολής και περίθλασης
(1) Αποτελέσματα παρεμβολής
Τα φαινόμενα παρεμβολής εμφανίζονται όταν δύο δέσμες φωτός διαδίδονται κατά μήκος της ίδιας οπτικής διαδρομής ή σε παράλληλες κατευθύνσεις. Ένα συνηθισμένο φαινόμενο παρεμβολής στους πολύτιμους λίθους είναι ο ιριδισμός. Για παράδειγμα, στον ιριδίζοντα χαλαζία, τα χρώματα της παρεμβολής εξαρτώνται από το πάχος του υμενίου, τον δείκτη διάθλασης του υμενίου και τη φύση του προσπίπτοντος φωτός.
Τα χρώματα παρεμβολής των μαργαριταριών σχηματίζονται από την εναλλασσόμενη επικάλυψη ομόκεντρων στρωμάτων δύο ουσιών με διαφορετικούς δείκτες διάθλασης (αραγωνίτης και νάκρουμ), όπου το προσπίπτον φως ανακλάται από τις επιφάνειες μεταξύ των εναλλασσόμενων στρωμάτων και το ανακλώμενο φως παρεμβάλλεται με το προσπίπτον φως, παράγοντας όμορφα χρώματα παρεμβολής.
(2) Φαινόμενα περίθλασης
Η περίθλαση αναφέρεται στο φυσικό φαινόμενο κατά το οποίο τα φωτεινά κύματα αποκλίνουν από την αρχική ευθύγραμμη διάδοσή τους όταν συναντούν εμπόδια. Στη φυσική, τα φωτεινά κύματα υφίστανται ποικίλους βαθμούς κάμψης και σκέδασης όταν περνούν μέσα από εμπόδια όπως σχισμές, μικρές οπές ή δίσκους. Εάν ένα εμπόδιο τοποθετηθεί μεταξύ της φωτεινής πηγής και της οθόνης παρατήρησης, στην οθόνη παρατήρησης θα εμφανιστούν φωτεινές και σκοτεινές περιοχές και τα όρια αυτών των περιοχών δεν είναι ευκρινή, σχηματίζοντας ένα σύνθετο μοτίβο φωτός και σκότους. Το φαινόμενο αυτό ονομάζεται περίθλαση. Τέτοια φαινόμενα μπορούν να εμφανιστούν κάθε φορά που τα φωτεινά κύματα συναντούν εμπόδια κατά μήκος της διαδρομής διάδοσής τους. Ο σημαντικότερος παράγοντας για την παραγωγή περίθλασης είναι η παρουσία περιοδικά διατεταγμένων πλεγμάτων περίθλασης στα ορυκτά πολύτιμων λίθων.
① Αλλαγή χρώματος Opal
Στο οπάλιο, τα σφαιρίδια πυριτίας που περιέχουν νερό έχουν ίσες διαμέτρους και είναι τοποθετημένα σε μια κανονική εναλλασσόμενη στρωματοποιημένη δομή, σχηματίζοντας περιοδικά διατεταγμένα πλέγματα περίθλασης. Όταν το φως εισέρχεται στο οπάλιο, παρατηρείται διάθλαση, η οποία αλλάζει χρώμα (εικόνες 3-31, 3-32). Οι τύποι των χρωμάτων και ο βαθμός αλλαγής του χρώματος εξαρτώνται κυρίως από την απόσταση μεταξύ των επιπέδων των στοιβαγμένων σφαιρών πυριτίας.
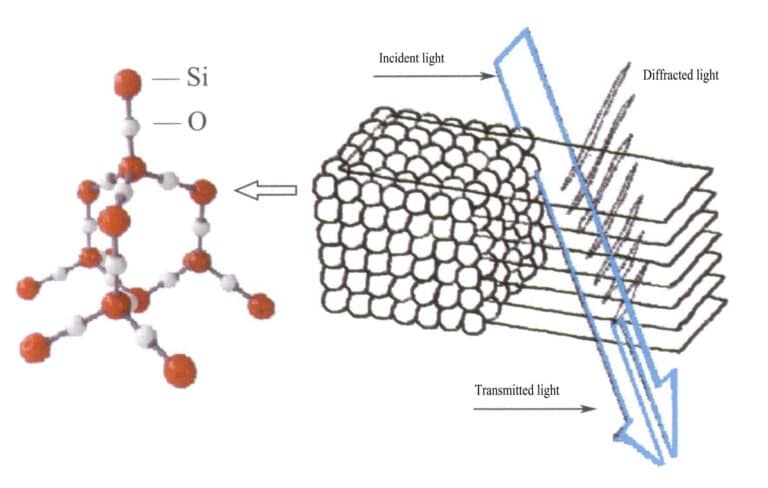

Για παράδειγμα, το οπάλιο με δομή επίπεδης κυβικής πλάκας με πρόσωπο-κεντρικό και απόσταση πλέγματος 3×10-10m εμφανίζει χρώματα που κυμαίνονται από πράσινο έως κόκκινο- αυτός ο τύπος οπάλου με απόσταση πλέγματος 2,5×10-10m εμφανίζει χρώματα που κυμαίνονται από μπλε έως κίτρινο.
② Επίδραση λαμπραντορίτη
Ο λαμπραντορίτης παρουσιάζει επίσης φαινόμενα παρόμοια με το οπάλιο (Εικόνα 3-33). Ο λαμπραντορίτης είναι επίσης γνωστός ως φασματολίτης επειδή μπορεί να αναβοσβήνει με το πολύχρωμο φως του ήλιου. Διάφοροι τύποι λαμπραντορίτη από τη Φινλανδία μπορούν να εμφανίσουν μια σειρά φασματικών χρωμάτων, ένα φαινόμενο γνωστό ως "φαινόμενο λαμπραντορίτη". Το φαινόμενο της αλλαγής χρώματος στον λαμπραντορίτη οφείλεται σε μικρές διαστρωματικές τήξεις πλαγιόκλαδου με διαφορετικές συνθέσεις. Οι μικρές διαφορές στον δείκτη διάθλασης μεταξύ των διαφορετικών άστρωτων προκαλούν παρεμβολή και διάθλαση του φωτός, με αποτέλεσμα τον φωτισμό και την αλλαγή χρώματος. Τα χρώματα που παράγονται από αυτή τη δομή σχετίζονται με το σχετικό πάχος των στρωμάτων και τους δείκτες διάθλασής τους. Περιστασιακά, ο ανδραδίτης από το Μεξικό παρουσιάζει επίσης φαινόμενα περίθλασης.

3. Σκέδαση και εγκλείσματα
(1) Διασπορά
Η σκέδαση εμφανίζεται γενικά όταν η εσωτερική δομή των πολύτιμων λίθων είναι ακανόνιστη ή όταν το μέγεθος των συστατικών υπερβαίνει τα όρια των συνθηκών περίθλασης. Τα χρωματικά αποτελέσματα που παράγονται από τη σκέδαση σχετίζονται με το μέγεθος και το σχήμα των σωματιδίων του υλικού του πολύτιμου λίθου. Όταν το προσπίπτον φως αλληλεπιδρά με ακανόνιστα διατεταγμένα σωματίδια μικρότερα από το μήκος κύματος του ορατού φωτός, τα μεταδιδόμενα φωτεινά κύματα υψηλής ενέργειας είναι ισχυρότερα από τα φωτεινά κύματα χαμηλής ενέργειας, πράγμα που σημαίνει ότι στις περισσότερες περιπτώσεις, μόνο το μωβ και το μπλε μπορούν να φανούν. Για παράδειγμα, το SiO2 τα μικρά σφαιρίδια στο οπάλιο έχουν διάμετρο μικρότερη από το μήκος κύματος του ορατού φωτός και όταν το μέγεθος των σωματιδίων σκέδασης είναι κοντά στο μήκος κύματος του ορατού φωτός, μπορεί επίσης να εμφανιστούν χρώματα σκέδασης.
Για παράδειγμα, ο πορφυρός φθορίτης προκαλείται από ραδιενεργό ακτινοβολία που αποβάλλει άτομα φθορίου, με αποτέλεσμα τα άτομα ασβεστίου που συνδέονται με άτομα φθορίου να συμπυκνώνονται σε εξαγωνικές πλάκες μεγέθους συγκρίσιμου με το μήκος κύματος του ορατού φωτός. Η αλληλεπίδραση μεταξύ των πλακών ασβεστίου και των φωτεινών κυμάτων προκαλεί σκέδαση. Απορροφά ορισμένα φωτεινά κύματα, δημιουργώντας μια ισχυρή κορυφή απορρόφησης στην περιοχή του πράσινου έως κόκκινου φωτός, επιτρέποντας στο μοβ φως να περάσει και να παράγει το μοβ χρώμα.
Δεδομένου ότι τα σωματίδια του ίδιου μεγέθους των μεταλλικών στοιχείων μπορούν να παράγουν παρόμοια χρωματικά αποτελέσματα και τα διαφορετικά μεταλλικά σωματίδια μπορούν να παράγουν διαφορετικά χρώματα, κατασκευάζονται μερικοί απομιμήσεις πολύτιμων λίθων χρησιμοποιώντας αυτή την ιδιότητα.
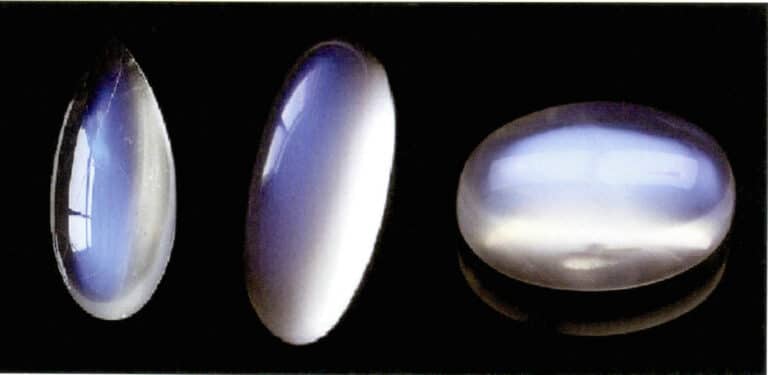
Για παράδειγμα, το γυαλί "ρουμπίνι" παράγεται με την προσθήκη σωματιδίων χαλκού ή χρυσού στο γυαλί, με αποτέλεσμα ένα κόκκινο χρώμα παρόμοιο με αυτό των ρουμπινιών. Όταν το υλικό του πολύτιμου λίθου περιέχει εγκλείσματα, μικρορωγμές ή φυσαλίδες μεγαλύτερες από το μήκος κύματος του ορατού φωτός, τα φωτεινά κύματα αλληλεπιδρούν με αυτά τα σκεδαζόμενα σωματίδια, προκαλώντας την επανασύνδεση των σκεδαζόμενων φωτεινών κυμάτων, παράγοντας ένα ημιδιαφανές γαλακτώδες φως. Για παράδειγμα, ορισμένες απομιμήσεις φεγγαρόπετρας.
Το φαινόμενο του σεληνόφωτος του φεγγαρόπετρας παράγεται επίσης από τη σκέδαση του φωτός (Εικόνα 3-34). Ο φεγγαρόπετρας είναι ένας αλκαλικός αστρίτης, ένα σύνθετο υλικό που σχηματίζεται από εναλλασσόμενα παράλληλα στρώματα πλούσιων σε κάλιο και πλούσιων σε νάτριο αστρίων. Το πάχος μεταξύ των στρωμάτων κυμαίνεται συνήθως από 50~1000nm, με λεπτότερα στρώματα ικανά να παράγουν σκέδαση. Το ίδιο χρώμα σκέδασης μπορεί να εμφανιστεί και στο πλαγιόκλαστο, γνωστό ως "φαινόμενο λαμπραντορίτη".
Μια ειδικά προσανατολισμένη διάταξη σωματιδίων σκέδασης μπορεί να παράγει χαρακτηριστικά οπτικά αποτελέσματα. Για παράδειγμα, όταν τα σωματίδια σκέδασης βρίσκονται σε παράλληλη ινώδη μορφή, παράγουν ένα μάτι γάτας ή ένα αστέρι, όπως τα ζαφείρια αστέρων και τα μάτια γάτας από χαλαζία. Όταν τα σωματίδια σκέδασης είναι αρκετά μεγάλα ώστε να διακρίνονται με γυμνό μάτι, μπορούν να παράγουν ένα "φαινόμενο χρυσόστομου", όπως ο ηλιόστομος (Εικόνα 3-35) και το γυαλί χρυσόστομου.

(2) Συμπεριλήψεις
Τα χρωματικά και οπτικά φαινόμενα που παράγονται από τα εγκλείσματα είναι ένας ειδικός τύπος σκέδασης. Τα εγκλείσματα με χρώμα ενσωματωμένα σε σχεδόν άχρωμους κύριους κρυστάλλους θα παρουσιάσουν το χρώμα των εγκλεισμάτων, όπως ο νικελιούχος ταινιωτός χαλκηδόνας και το οξείδιο του σιδήρου(ΙΙ) που περιέχει νερό (FeO - H2O) σαρκώδους χρώματος χαλκηδόνιο- το χρώμα του ορθόκλαδου από τη Μαδαγασκάρη και μερικών κορδιεριτών σχηματίζεται από ελαφρώς μεγαλύτερα, αλλά ακόμη μικροσκοπικά εγκλείσματα αιματίτη που δημιουργούν κόκκινες αποχρώσεις- υπομικροσκοπικά εγκλείσματα υδροξειδίου του σιδήρου συχνά χρωματίζουν το όπαλ φωτιάς.
Τα διαμάντια παρουσιάζουν συχνά διαφορετικά χρώματα λόγω της παρουσίας πολυάριθμων εγκλεισμάτων. Τα διαμάντια που χρωματίζονται από εγκλείσματα μπορεί να είναι μαύρα, πορτοκαλοκόκκινα και καφεκόκκινα. Όταν ένα διαμάντι περιέχει αμέτρητα σκούρα αδιαφανή ορυκτά εγκλείσματα, εμφανίζεται μαύρο- όταν εξετάζεται με ισχυρό διαπερατό φως, παρατηρούνται πολλά σκούρα εγκλείσματα και το διαμάντι εμφανίζεται σκούρο γκρι- ένας άλλος τύπος είναι τα δευτερογενή εγκλείσματα που εμφανίζονται στις ρωγμές του διαμαντιού. Όταν οι ρωγμές αναπτύσσονται και γεμίζουν με αυτά τα έγχρωμα εγκλείσματα, το διαμάντι εμφανίζεται καφεκόκκινο ή πορτοκαλοκόκκινο, το οποίο είναι επίσης γνωστό ως "οξειδωμένο" διαμάντι.
4. Διασπορά
Το φαινόμενο της διάσπασης του λευκού φωτός σε διάφορα φασματικά χρώματα μέσω ενός αντικειμένου ονομάζεται διασπορά. Η διασπορά των πολύτιμων λίθων αναφέρεται στην ιδιότητα του φωτός να διασπάται σε διαφορετικά μήκη κύματος των φασματικών χρωμάτων όταν διέρχεται μέσα από τα κεκλιμένα επίπεδα των διαφανών πολύτιμων λίθων. Λόγω των διαφορετικών μηκών κύματος του μονοχρωματικού φωτός που συνθέτουν το λευκό φως που διαδίδεται με διαφορετικές ταχύτητες και δείκτες διάθλασης σε διαφορετικά υλικά, το λευκό φως μπορεί να διασπαστεί σε διάφορα φασματικά χρώματα υπό ορισμένες συνθήκες. Το μέγεθος της τιμής διασποράς ενός πολύτιμου λίθου καθορίζεται από τις φυσικές του ιδιότητες- κάθε πολύτιμος λίθος έχει την εγγενή του τιμή διασποράς, η οποία δεν μεταβάλλεται με τις ιδιότητες του πολύτιμου λίθου. Η μοναδική γοητεία των διαμαντιών συνδέεται στενά με την υψηλή τιμή διασποράς τους (0,044).
Τα περισσότερα προσομοιωτικά διαμαντιών έχουν υψηλότερη τιμή διασποράς, όπως η τιμή διασποράς του ζιρκονίου 0,039 και η τιμή διασποράς του συνθετικού μοισσανίτη 0,104. Η σύγκριση των τιμών διασποράς των διαμαντιών και των κοινών προσομοιωτών τους παρουσιάζεται στον πίνακα 3-15.
Πίνακας 3-15 Σύγκριση των τιμών διασποράς των διαμαντιών και των κοινών προσομοιωτών τους πολύτιμων λίθων
| Όνομα πολύτιμου λίθου | Τιμή διασποράς |
|---|---|
| Διαμάντι | 0.044 |
| Ζιρκόνιο | 0.039 |
| Κορούνδιο | 0.018 |
| Spinel | 0.020 |
| Topaz | 0.014 |
| Beryl | 0.014 |
| Κρύσταλλο | 0.014 |
| Συνθετικό ρουτίλιο | 0.280 |
| Συνθετικό τιτανικό στρόντιο | 0.190 |
| Συνθετικός μοισσανίτης | 0.104 |
Η διασπορά αναφέρεται συνήθως ως η "φωτιά" των πολύτιμων λίθων. Για παράδειγμα, τα διαμάντια έχουν υψηλή τιμή διασποράς και η φωτιά τους είναι πολύ έντονη, ενισχύοντας την ήδη βασιλική ιδιότητα των διαμαντιών και αναδεικνύοντας τη μοναδική γοητεία τους.
Υπάρχουν πολλοί τύποι χρωμάτων που παράγονται από φυσικά οπτικά φαινόμενα, τα οποία μπορούν να εξηγηθούν από τη φυσική οπτική θεωρία. Εκτός από τη διασπορά, η οποία είναι εγγενής ιδιότητα του ίδιου του πολύτιμου λίθου, άλλα φαινόμενα προκαλούνται από δομικές αλλαγές μετά το σχηματισμό του πολύτιμου λίθου και τις διαφορές στα μηχανικά εγκλείσματα. Η κατανόηση των διαφόρων αιτιών των χρωμάτων των πολύτιμων λίθων παρέχει μια θεωρητική βάση για τη βελτιστοποίηση της επεξεργασίας φυσικών και συνθετικών πολύτιμων λίθων.